La cellula batterica
Giovanni Di Bonaventura, Ph.D.
CI «Microbiologia e Microbiologia Clinica»
CdS Medicina e Chirurgia
Università “G. d’Annunzio”, Chieti-Pescara
AA 2015-2016
Batteri
Dimensioni cellulari
I batteri presentano elevata variabilità nelle dimensioni:
Dimensioni medie Procarioti: 0.5 - 2.0 µm
Mycoplasma pneumoniae (0.2 µm)
Thiomargarita namibiensis (750 µm)
Dimensioni medie Eucarioti: 2 - 200 µm
Emazia: 7.5 μm
Rapporto superficie/volume
batteri = 12 μm2 / 4 μm3 = 3:1
cellula eucariotica = 1.5:1
Il metabolismo e, quindi, la crescita batterica sono
funzione inversa delle dimensioni:
tasso metabolico = 1/k x (d)2
Le ridotte dimensioni della cellula batterica consentono una
penetrazione più efficiente dei nutrienti che raggiungono
velocemente ogni parte del batterio. Gli Eucarioti, di contro,
necessitano, a tal fine, di strutture ed organelli.
Batteri
Principali morfologie cellulari
I batteri presentano elevata variabilità anche nella
forma ed organizzazione:
Forme (morfologie) cellulari caratteristiche:
– sferica: cocchi (Staphylococcus spp., Streptococcus
spp., Neisseriaceae)
– cilindrica: bacilli (Escherichia coli, Pseudomonas
aeruginosa)
• corta e rigonfia: coccobacilli (Corynebacterium)
• curva: vibrioni (Vibrio cholerae)
• spirale: spirilli (Spirillum)
– a molla: spirochete (Borrelia, Treponema)
– filamentosa: (Streptomyces)
– variabile: pleomorfi (Bacteroides, Corynebacterium)
Batteri
Organizzazione cellulare
L’organizzazione cellulare dipende dalla modalità di divisione
e dai rapporti che le cellule mantengono a seguito di divisione:
– cocchi:
• singoli
• diplococchi: in coppia (Neisseriaceae)
• catene (Streptococcus)
• tetradi (gruppi di 4 cellule)
• sarcina (forma cubica, formata da 8-64 cellule)
• ammassi: (clusters) irregolari (Staphylococcus)
– bacilli:
• catene (streptobacilli) (Bacillus anthracis)
• palizzata (Corynebacterium)
Cellula batterica
Struttura
La struttura cellulare dei batteri è quella tipica dei Procarioti.
La cellula batterica comprende tipicamente:
Componenti fondamentali: necessari per la sopravvivenza e la riproduzione
cellulare (parete cellulare, membrana cellulare, ribosomi, inclusioni, nucleoide,
matrice citoplasmatica, spore)
Componenti accessori: non sempre presenti in quanto svolgono funzioni
accessorie (non vitali); possono essere determinanti di virulenza (flagelli, pili,
capsula, glicocalice, plasmidi)
Cellula batterica
Composta da proteine (60%), lipidi (40%), carboidrati
Struttura sottile (spessore 8 nm) che separa il citoplasma dall’ambiente
Barriera altamente selettiva (concentra i nutrienti al suo interno ed
espelle all’esterno le sostanze di rifiuto)
Struttura trilaminare organizzata a “mosaico fluido”,
–
–
–
–
doppio strato fosfolipidico con una componente proteica associata od
integrata (transmembrana)
i fosfolipidi contengono regioni idrofiliche (glicerofosfato) ed idrofobiche (acidi
grassi) mediante le quali si auto-assemblano
le proteine sono associate alla membrana od integrate in essa
flessibile (viscosità ~ olio leggero), per movimento dei fosfolipidi
Rispetto alla membrana eucariotica, quella procariotica:
–
–
–
Struttura
Membrana Citoplasmatica
non contiene steroli (es. colesterolo), presenti solo nei Micoplasmi e nei batteri
metanotrofi; sostituiti da opanoidi aventi stessa funzione di stabilizzazione e
compattamento
è più ricca in proteine
proteine non glicosilate
- senza utilizzo di energia (trasporto PASSIVO, secondo gradiente
di concentrazione):
• diffusione semplice (osmosi)
• diffusione facilitata (mediata da specifici canali o proteine carrier)
- con utilizzo di energia (trasporto ATTIVO, contro gradiente di
concentrazione):
• mediato da proteine carriers
• traslocazione di gruppo
Sito di ancoraggio per proteine coinvolte nel
trasporto, nella chemotassi ed in reazioni
bioenergetiche
Funzioni
Membrana Citoplasmatica
Barriera di permeabilità, regola il trasporto di nutrienti/prodotti metabolici:
Sito di conservazione dell’energia: produzione
ed utilizzo di forza motrice protonica, durante la
respirazione (fosforilazione ossidativa)
Interviene nella divisione cellulare,
segregando i due cromosomi (mesosomi)
Sede di proteine coinvolte nella sintesi del
petidoglicano e nella trasduzione (all’interno della
cellula) del segnale (ambientale)
Trasporto passivo
Membrana Citoplasmatica
Non richiede utilizzo di energia in quanto la sostanza si muove secondo
gradiente di concentrazione (high-to-low).
La diffusione semplice riguarda piccoli composti idrofobici (glicerolo), gas (O2),
oppure solo H2O (osmosi).
La diffusione facilitata utilizza un canale (aspecifico) od un carrier (specifico) di
natura proteica.
La parete cellulare dei microrganismi aiuta a preservare l’integrità cellulare
opponendosi alle variazioni della pressione osmotica:
Osmosi
Trasporto Passivo
Quando differenti concentrazioni di soluto sono
separate da una membrana semi-permeabilie,
H2O si sposta per raggiungere una condizione
isotonica ([soluto]extra = [soluto]intra).
cellula in soluzioni ipertoniche
([soluto]extra > [soluto]intra):
contrazione della membrana per
fuoriuscita di H2O dalla cellula
cellula in soluzioni ipotoniche
([soluto]extra < [soluto]intra):
membrana turgida per l’ingresso
di H2O nella cellula.
a) Mediato da “carriers”
Trasporto Attivo
Il trasporto è mediato da proteine trasportatrici
(carriers) ed avviene contro gradiente
elettrochimico richiedendo, quindi, utilizzo di
energia (ATP)
Trasporto “uniport”: 1 sostanza viene
trasportata in un’unica direzione
Trasporto “antiport”: 2 sostanze (una
generalmente H+) sono co-trasportate in
direzioni opposte
Trasporto “symport”: 2 sostanze sono cotrasportate nella stessa direzione
b) Traslocazione di gruppo
Trasporto Attivo
La molecola trasportata viene modificata chimicamente.
Esempio: sistema P-transferasico in E. coli (24 proteine)
utilizzo dell‘energia derivante dal fosfoenol-piruvato
almeno 4 proteine necessarie al trasporto di un carboidrato
(enzima I aspecifico, enzima II specifico)
fosforilazione a cascata
Sistema ABC (ATP-Binding Cassette), composto da 3 proteine:
proteina periplasmatica
proteina trans-membrana
ATP-asi
proteina periplasmatica mobile nel periplasma e dotata di elevata affinità (fino
a 10-6 M) per il substrato
c) ABC transporter
Trasporto Attivo
oltre 200 tipologie di sistemi ABC; specificità per composti organici
(aminoacidi, carboidrati) ed inorganici (solfati, fosfati)
presente non soltanto nei Gram- ma anche nei Gram+ (PBP ancorato alla
membrana citoplasmatica)
energizzato da idrolisi ATP
Appaiono come strutture (lamellari, tubulari) concentriche in prossimità del
nucleoìde, delle estremità cellulari o della zona di formazione del setto.
Mesosoma
Membrana Citoplasmatica
Il mesosoma è una invaginazione della membrana citoplasmatica di
notevoli dimensioni, di forma irregolare. Presenza di diversi e voluminosi
mesosomi, soprattutto nei batteri Gram+.
Svolge importanti funzioni:
durante la divisione cellulare, fornisce
attacco al DNA facilitando la separazione
dei due cromosomi e la produzione del
setto trasverso (mesosomi settali)
contengono gran parte dei citocromi e
degli enzimi respiratori (mesosomi
respiratori)
contengono enzimi coinvolti nella sintesi
dei componenti di parete (mesosomi
biosintetici)
Strutture citoplasmatiche
Citoplasma
gel colloidale (80% H2O, 20% sali-proteine)
H2O (80% peso totale cellulare), solvente per composti organi/inorganici
e componenti funzionali citoplasmatiche
proteine, zuccheri, lipidi, sali (Na, Ca, Mg, Fe, fosfati, solfati, ecc.)
Cromosoma
localizzato in un’area chiamata “nucleoìde”, non è delimitato da
membrane (assenza di nucleo)
DNA bicatenario, circolare (lineare in Streptomyces, Borrelia)
singolo (aploidia più efficiente vs diploidia: crescita più veloce; le
mutazioni permettono un adattamento più veloce all’ambiente)
lunghezza rilevante (1-1.4 mm), superavvolto, non associato ad istoni
Plasmidi
DNA circolare extra-cromosomico (piccole dimensioni)
singoli o presenti in più copie
non essenziali per la crescita ed il metabolismo batterico
codificano per fattori di virulenza (es. antibiotico-resistenza)
Ribosomi
60% RNA-ribosomale, 40% proteine
differiscono da quelli eucariotici per numero (10.000/cellula) e
dimensioni (subunità 50S: 34 proteine, RNA 5S e 23S; subunità 30S: 21
proteine, RNA 16S)
Assenza di compartimenti intracellulari separati da membrane
nucleo (trascrizione e traduzione accoppiate), mitocondri, complesso di
Golgi, reticolo endoplasmatico
plasmide
Strutture citoplasmatiche
Inclusioni e granuli
Corpi intracellulari con funzione di “riserva” energetica
La cellula batterica può, infatti, utilizzarli nei casi di carenza, od
assenza, di fonti energetiche ambientali
Variabili in dimensioni, numero e contenuto
Tipologie:
- glicogeno
- poli-β-idrossibutirrato (Bacteria, Archaea)
- vescicole gassose per il galleggiamento (Cyanobacterium)
- granuli di zolfo e fosfato (granuli metacromatici in
Corynebacterium diphtheriae)
- magnetosomi (Fe3O4; magnetotassi)
Cellula Procariotica
(1 di 4)
Struttura del peptidoglicano
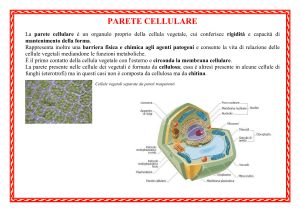
Parete cellulare
La parete cellulare è presente in gran parte dei Procarioti, dove circonda la
membrana citoplasmatica.
eccezioni: Archea (generalmente assente; alcune specie
presentano uno pseudoglicano), Micobatteri (peptidoglicano a
struttura caratteristica), Micoplasmi (privi di parete)
Presente anche negli Eucarioti (es. miceti) ma con struttura più semplice.
E’ formata da strati sovrapposti di peptidoglicano (mureina).
Il peptidoglicano è una struttura rigida a forma di rete, in cui catene
polisaccaridiche lineari sono unite tra loro mediante legami crociati di
natura peptidica.
(2 di 4)
Struttura del peptidoglicano
Parete cellulare
La caratteristica unità di ripetizione (glican tetrapeptide) del
peptidoglicano consta di:
catena polisaccaridica: formata da unità disaccaridiche ripetute (in
alternanza) di N-acetilglucosamina (NAG) e acido N-acetilmuramico
(NAM), legate tra loro da un legame β(1,4) glicosidico.
peptide: tetrapeptide di sintesi enzimatica, legato a NAM e formato da Ded L-aminoacidi (uniti mediante legami peptidici):
- L-alanina --- acido D-glutamico --- L-lisina --- D-alanina
- la sequenza aminoacidica è specie-specifica, sebbene presenti
sempre in posizione 3 un aminoacido bibasico: L-lisina (Gram +),
oppure acido meso-diaminopimelico (Gram-).
(3 di 4)
Struttura del peptidoglicano
Parete cellulare
Nella struttura di base del peptidoglicano, le catene individuali di
peptidoglicano sono adiacenti e tenute insieme, a livello dei tetrapeptidi, da
legami crociati peptidici.
Il legame crociato peptidico interessa il diamminoacido in posizione 3 e
D-alanina in posizione 4; può essere:
indiretto, mediante ponte pentaglicinico (Gram+)
diretto, mediante legame peptidico tra acido meso-diaminopimelico
e D-alanina (Gram-)
Elevata variabilità nella composizione dei
legami crociati tetrapeptidici: noti più di
100 tipi di peptidoglicano.
(4 di 4)
Struttura del peptidoglicano
Parete cellulare
NUMERO DI LEGAMI CROCIATI (cross bridges)
Oltre che a livello strutturale, la parete dei Gram+ differisce da quella dei
Gram- anche per il numero dei legami crociati presenti:
nei Gram+: tutti i residui di NAM sono legati ad un tetrapeptide;
nei Gram-: i legami sono meno frequenti; maglie più larghe e, quindi,
minore rigidità parietale.
conferisce rigidità alla cellula:
- impedisce la lisi od il collasso della cellula, in risposta a variazioni
della pressione osmotica (pressione interna: 5-20 atm !)
- protegge la cellula da insulti meccanici
- determina la forma dei batteri
contribuisce al determinismo della patogenicità batterica:
- protegge la cellula da sostanze tossiche (es. detergenti, antibiotici,
disinfettanti)
- ha attività pirogena (aumento temperatura dell’ospite)
- può interferire con la fagocitosi
- è mitogeno per i linfociti
Funzioni
Parete cellulare
La parete cellulare è indispensabile per la cellula batterica perchè:
è sensibile al lisozima (presente nel lacrime, muco, saliva; prodotto anche
dai batteri) che attacca lo scheletro glicanico a livello del legame β(1-4)
glicosidico
lisandosi (es. in presenza di penicillina), genera cellule osmoticamente
sensibili che non lisano soltanto in ambiente isotonico:
- protoplasto (Gram+), cellula priva di residui di parete cellulare
- sferoplasto (Gram-), cellula dotata di frammenti di parete cellulare
- forme L (Lister Institute, dove furono osservate per la prima volta):
sferoplasto/protoplasto in grado di crescere; reversibili (allontanamento
dell’induttore) od irreversibili; responsabili della cronicizzazione
dell’infezione (antibiotico-R, immuno-elusione)
è riconosciuta come target da alcuni antibiotici (β-lattamici)
può essere riconosciuta dal sistema immune (immunogenicità)
Funzioni
Parete cellulare
Tuttavia, la parete cellulare può rappresentare anche un vulnus per la
cellula batterica, in quanto:
Protoplasto
Sferoplasto
B. subtilis: fase L
Gram-positivi
Parete cellulare
Formata da peptidoglicano multistratificato e ispessito
150-500 Å; fino a 40 strati concentrici; 40-80% peso secco
Acidi teicoici (dal greco τεικος= muro):
polimeri di poliol- (glicerolo, ribitolo) fosfati
solubili in H2O
legati covalentemente al peptidoglicano
determinano la carica netta di superficie;
legano Ca2+ e Mg2+, portandoli nella cellula
funzione di adesine (per batteriofagi)
immunogeni (principali antigeni di superficie: sierotipo)
Acidi lipoteicoici:
acidi teicoici contenenti un acido grasso
ancorati (mediante l’acido grasso) alla membrana citoplasmatica
nell’uomo possono svolgere attività endotossica
funzione di adesine (associati a proteina M)
immunogeni (determinanti sierotipo batterico)
Carboidrati:
carboidrato C (criterio classificativo negli streptococchi)
Proteine:
proteina M (S. pyogenes: antifagocitaria, adesività a mucose)
proteina A (S. aureus: lega Fc anticorpale inibendo la formazione
dell’immuncomplesso e la attivazione del Complemento)
Struttura altamente polare
si oppone al passaggio di molecole idrofobiche (es. sali biliari, tox per
la cellula)
consente il passaggio di composti idrofili (carboidrati, aminoacidi)
lega alte quantità di cationi (Na+, Mg+):
Struttura rigida
consente la sopravvivenza in ambiente isotonico, opponendosi alla lisi
cellulare osmotica
Gram-positivi
Parete cellulare
garantisce la giusta osmolarità per la funzionalità enzimatica (sintesi
peptidoglicano) di membrana
conferisce maggiore resistenza, vs Gram-, ad elevate concentrazioni
saline (alofilia)
Parete cellulare
Gram-positivi
Gram-negativi: parete e membrana esterna
Parete cellulare
Parete cellulare:
strutturalmente e chimicamente più complessa vs Gram+, è formata da un
sottile (20-30 Å; 2-3 strati concentrici; 5% peso secco) strato di peptidoglicano
assenza di acidi teicoici e lipoteicoici
Membrana esterna:
si trova esternamente alla parete cellulare
legata al peptidoglicano mediante la frazione proteica di lipoproteine
struttura bilaminare e asimmetrica: strato esterno formato da
lipopolisaccaride (LPS), molecola anfipatica
si oppone al passaggio di molecole
idrofobiche (catene laterali idrofiliche LPS), ma
anche di grosse molecole idrofiliche (doppio
strato fosfolipidico).
attraversata da proteine adibite al trasporto di
molecole idrofiliche (porine)
protegge la cellula da alcuni antibiotici
presenta adesine per batteriofagi
Gram-negativi: porine
Parete cellulare
Le porine sono organizzate in omotrimeri a formare canali (pori) che
permettono il passaggio di sostanze idrofiliche attraverso la membrana
esterna:
Porine aspecifiche (molecole con PM < 600 Da)
- OmpF, OmpC: diffusione di ioni ed altre piccole molecole idrofile
- PhoE: indotta da “phosphate starvation”, consente il passaggio di
molecole idrofile cariche negativamente
Porine specifiche (molecole più grandi)
- Btu: vitamina B12
- LamB: indotta da maltosio ed altre maltodestrine nel mezzo
- FhuA: uptake del ferro
Ruolo nella antibiotico-resistenza:
la sostituzione di aminoacidi neutri con altri carichi che si proiettano
all’interno del poro perturba il normale passaggio degli antibiotici
in presenza di antibiotico, viene diminuita/eliminata l’espressione delle
porine implicate nel suo uptake cellulare
Funzione recettoriale per:
fagi, batteriocine, componenti del Complemento, anticorpi
Determinanti di patogenicità, in quanto promuovono:
l’adesione alle cellule dell’ospite
l’invasività delle cellule dell’ospite
l’attività citotossica
Gram-negativi: lipopolisaccaride (LPS)
Parete cellulare
Il lipopolisaccaride (LPS o endotossina) è il fattore di virulenza che caratterizza l’azione
patogena dei Gram-.
Formato da 3 componenti:
Lipide A (gruppo-specifico): glicosfosfolipide; frazione endotossica ancorata alla
membrana esterna tramite acidi grassi; con i suoi gruppi P laterali unisce LPS adiacenti;
altamente conservato nei Gram Core (specie-specifico): polisaccaride ramificato (9-12 zuccheri, tra cui i peculiari acido
cheto-deossi-octonico ed un eptoso)
Antigene O (tipo-specifico): polisaccaride lineare (50-100 unità ripetute, 4-7
zuccheri/unità); determina il sierotipo (2.000 in Salmonella, 150 in E. coli)
Gram-negativi: effetti biologici del LPS
Parete cellulare
LPS rappresenta una importante struttura di superficie che consente la
interazione dell'agente patogeno con il suo ospite. Infatti, LPS:
media la adesione agli epiteli (colonizzazione);
interferisce con la fagocitosi;
è sede di determinanti antigenici (immunogeno);
se liberato in un ospite sensibile, dà luogo a numerosi effetti tossici
(ENDOTOSSINA BATTERICA)
EFFETTI BIOLOGICI DELL'ENDOTOSSINA
1) Effetto pirogeno (capacità di indurre febbre anche a basse dosi)
2) Attiva vari tipi cellulari con produzione di interleuchine/chemochine:
- macrofagi (aumento della fagocitosi e capacità battericida,
produzione di monochine attive su vari altri tipi cellulari e tessuti)
- linfociti B (proliferazione e differenziazione in plasmacellule)
- cellule endoteliali
- piastrine
- granulociti
3) Induce infiammazione
4) Induce vasodilatazione con conseguente ipotensione e shock
5) Attiva il Complemento
6) Stimola la coagulazione del sangue (CID, coagulazione intravasale
disseminata)
Gram-negativi: effetti biologici di LPS
Parete cellulare
RUOLO DELL'ENDOTOSSINA NELLO SHOCK ENDOTOSSICO
Shock endotossico: grave quadro clinico che può accompagnare le setticemie da
batteri Gram-; caratterizzato da febbre, ipotensione, acidosi, insufficienza renale e
respiratoria e, nelle fasi finali, da coagulazione intravasale disseminata (reazione
di Schwartzman; CID/DIC) ed insufficienza d’organo.
Frequenza: 1% dei pazienti ospedalizzati sviluppa sepsi; 20-30% nei reparti di
terapia intensiva.
Esito fatale: 40-60% dei pazienti, nonostante la terapia antibiotica.
Gram-negativi: spazio periplasmico
Parete cellulare
Lo spazio periplasmatico è la zona compresa tra:
membrana citoplasmatica e peptidoglicano (Gram+)
membrana citoplasmatica e membrana esterna (Gram-)
Contiene il periplasma, di consistenza gelatinosa, che occupa circa il
20-40% del volume totale cellulare.
Nello spazio periplasmico si trovano:
proteine per il trasporto di zuccheri,
aminoacidi, fosfato, vitamine.
enzimi (Gram-)* per l’acquisizione di nutrienti,
la degradazione di grosse molecole o DNA
fagico (proteasi, lipasi, nucleasi), il trasporto
elettronico, la sintesi del peptidoglicano, la
inattivazione di antibiotici (es. β-lattamasi vs
antibiotici β-lattamici).
oligosaccaridi di membrana
Lo spazio periplasmico aumenta di volume in
caso di ridotta osmolarità ambientale.
* nei Gram+, gli esoenzimi sono analoghi funzionali degli enzimi periplasmatici; tuttavia,
la incapacità di poterli concentrare nello spazio periplasmatico richiede la sintesi di
elevate concentrazioni e, quindi, di un aumentato «costo energetico».
Parete cellulare
Gram-negativi
Parete cellulare
Gram+ vs Gram-
Parete cellulare
Gram+ vs Gram-
Casi particolari
Parete cellulare
In alcuni casi particolari, la parete cellulare è assente oppure ha una
composizione/struttura peculiari:
Micoplasmi: non presentano parete cellulare; presenza di steroli nella
membrana citoplasmatica.
Micobatteri: dotati di parete cellulare a struttura complessa (simile a
quella dei Gram+) in cui il peptidoglicano è legato covalentemente ad
un polimero di arabinogalattano e circondato da uno strato di lipidi
complessati con le cere formate dagli acidi grassi a lunga catena
(acidi micolici) dotate di potente azione adiuvante la patogenicità.
Lipidi con acidi micolici sono presenti anche nei corinebatteri ed in
Nocardia.
Micoplasmi
Micobatteri. Parete cellulare.
Cellula batterica
Strutture esterne
Strutture esterne: glicocalice
Cellula batterica
Glicocalice: rivestimento esterno cellulare di Gram+ (S. pneumoniae, S. mutans,
B. anthracis) e Gram- (N. meningitidis, P. aeruginosa, H. influenzae);
generalmente formato da polisaccaridi etero/omo-polimerici, ad eccezione di
B. anthracis (composizione proteica: poli-D-glutamato)
Tipologia:
- capsula: altamente organizzata, fortemente adesa
- strato mucoso (slime): diffuso (uniforme), scarsamente adeso, lasso
Sintesi regolata da fattori:
- genetici (geni codificanti la capsula), ambientali (chimico-fisici)
Funzioni. Non indispensabilie per la crescita ma per la sopravvivenza
all’interno dell’ospite:
- protezione da disidratazione e perdita di nutrienti
- limita l’ingresso di molecole idrofobiche tossiche (antibiotici, disinfettanti,
detergenti) (P. aeruginosa in FC)
- protezione vs risposta immune (es. fagocitosi in S. pneumoniae)
- adesione ai tessuti e materiali inerti (S. mutans su smalto dentale;
Staphylococcus spp., P. aeruginosa su protesi), formazione di biofilm
Biofilm: dinamica di formazione
Strutture esterne: glicocalice
Cellula batterica
Glicocalice: colorazione
con inchiostro di china
Strutture esterne: glicocalice
Cellula batterica
Nei pazienti affetti da Fibrosi Cistica (FC), le infezioni polmonari rappresentano
la principale causa di mortalità.
Pseudomonas aeruginosa può essere isolato dal polmone FC in due fenotipi:
“mucoide” oppure “non mucoide”.
Il fenotipo «mucoide» presenta una spiccata propensione ad aderire all’epitelio
formando biofilm, comunità sessili in grado di esibire una resistenza ai comuni
antibiotici e disinfettanti, fino a 1000 volte maggiore vs controparte planctonica
Il fenotipo «non mucoide» invece è proprio di batteri “nudi”, acapsulati, che
vivono in forma individuale, e che come tali sono più facilmente aggredibili dalla
terapia.
Diagnosticare la presenza del fenotipo mucoide fornisce un’informazione
importante perché fortemente predittiva di una infiammazione-infezione cronica
polmonare. Infatti, è noto che l’infezione causata da un ceppo “non mucoide” può
essere eliminato facilmente dai polmoni dei bambini con FC, per lo meno per un certo
periodo di tempo. Al contrario, è molto più difficile eradicare l’infezione «mucoide».
Strutture esterne: flagelli
Cellula batterica
Alcune specie batteriche sono dotate di motilità attiva grazie alla presenza di uno
o più flagelli.
Il flagello risulta composto da tre parti:
filamento: struttura elicoidale che protrude dal soma cellulare; formato da
monomeri di flagellina (antigene H; ted. hauch, pellicola), proteina la cui
composizione aminoacidica è specie-specifica
uncino: membrana (guaina) ricurva
corpo basale: àncora il flagello alla cellula e fornisce energia per il suo
movimento. Composto da anelli proteici (almeno 15 proteine):
- Gram-: 4 anelli: L (LPS), P (parietale), S (al di sopra della membrana
cellulare), M (in corrispondenza della membrana cellulare)
- Gram+: anello P ed M
Strutture esterne: flagelli
Cellula batterica
La sintesi del flagello è regolata da circa 20 geni. I monomeri proteici
(flagellina) vengono secreti all’esterno della cellula, quindi si autoassemblano in presenza di un “nucleatore (sali, proteine).
Composizione e struttura:
proteica
struttura a singolo filamento (vs flagello eucariotico: “9 + 2” coppie)
Il numero e l’organizzazione dei flagelli sono variabili:
monotrìco: singolo, ad un’estremità (P. aeruginosa, V. cholerae)
lofotrìco: ciuffo di flagelli, ad una estremità (H. pylori)
amfitrìco: un flagello ad ogni estremità
peritrìco: flagelli disposti attorno alla cellula (P. mirabilis, E. coli)
a) peritrìco; b) monotrìco; c) lofotrìco; d) amfitrìco
Strutture esterne: flagelli
Cellula batterica
Movimento
Il movimento viene energizzato da idrolisi ATP (anaerobi) o da potenziale
di membrana durante fosforilazione ossidativa (aerobi)
Il flagello guida il batterio in una direzione (movimento direzionale), in
risposta ad uno stimolo esterno:
- stimolo chimico: chemotassi (positiva o negativa)
- stimolo luminoso: fototassi
Il segnale attiva un movimento rotatorio di 360° in senso antiorario (run,
in avanti con direzione) od orario (tumble, rotolamento per interruzione
del run)
In presenza di un gradiente “attraente” (positivo), il numero dei tumbles si
riduce favorendo runs più lunghe
Strutture esterne: flagelli
Cellula batterica
Rilevanza clinica
Il flagello è un fattore di virulenza poichè consente al batterio:
motilità autonoma, generalmente in un mezzo liquido:
migrazione di E. coli da intestino alle vie urinarie
penetrazione del film mucoso gastrico da parte di H. pylori
migrazione verso il circolo ematico
invasione cellulare (E. coli, S. typhimurium)
adesione a superfici abiotiche/biotiche
adesione intercellulare (clusters batterici intra- od inter-specifici)
Tuttavia, il flagello è immunogeno e,
quindi, viene frequentemente utilizzato
dal sistema immune dell’ospite per
individuare il batterio
Haiko & Westerlund-Wikström, Biology, 2013
Strutture esterne: flagelli
Cellula batterica
Esistono 3 principali tipologie di motilità:
Swimming:
flagellare, consente il movimento in un mezzo liquido
Twitching
composito (flagelli + pili tipo IV), consente un movimento per
“strisciamento” su superfici (mucose, abiotiche)
Swarming
flagellare, viene indotta dal contatto con superfici aventi una
appropriata viscosità e composizione
caratterizzata dal differenziamento di cellule vegetative in cellule
swarm, lunghe ed iperflagellate
Strutture esterne: fimbrie o pili
Cellula batterica
Fimbria (lat., fimbriae: frangie), pilo (lat., pilus: pelo):
più corti (0.2-2 um), sottili e numerosi vs flagella, sono disposti uniformemente
formati da polimeri di pilina (1-2 tipi, specie-specifiche)
Funzioni:
adesione intercellulare od a superfici [abiotiche (protesiche) e biotiche
(glicoproteine di membrane)] tramite adesine site alla estremità terminale (E. coli,
N. gonorrhoeae).
in E. coli: curli (formati da monomeri di curlina), essenziali per formazione biofilm
in azione combinata con i flagelli, consentono alla cellula di “strisciare” su superfici
solide (twitching)
pili sessuali (pili F): mediano il trasferimento intercellulare di materiale genetico
durante la coniugazione
Strutture esterne: filamenti assiali
Cellula batterica
Filamento assiale:
struttura periplasmica, formata da flagelli intracellulari, localizzati tra la
parete cellulare e membrana esterna delle Spirochete (dal greco speira:
spirale)
contraendosi, impartisce alla cellula un movimento alternato di torsione e
flessione
Treponema pallidum (spirocheta),
agente eziologico della sifilide
Endospore
Cellula batterica
Endospora:
forma di resistenza che prende
origine dall acellula vegetative
qualora le condizione ambientali
siano non ottimali per la
moltiplicazione cellulare.
assicura la protezione e la
dispersione della specie
implicazioni cliniche, tecniche,
sociali e terapeutiche
NOTE
Questo materiale non può essere distribuito, modificato o pubblicato né in forma
cartacea, né su un sito, né utilizzato per motivi pubblici o commerciali.
E’ possibile utilizzare il materiale solo per motivi personali e non commerciali,
purché ogni copia di questo materiale preservi tutti i diritti di copyright e di
proprietà intellettuale, sempre dopo richiesta rivolta al Prof. Di Bonaventura.