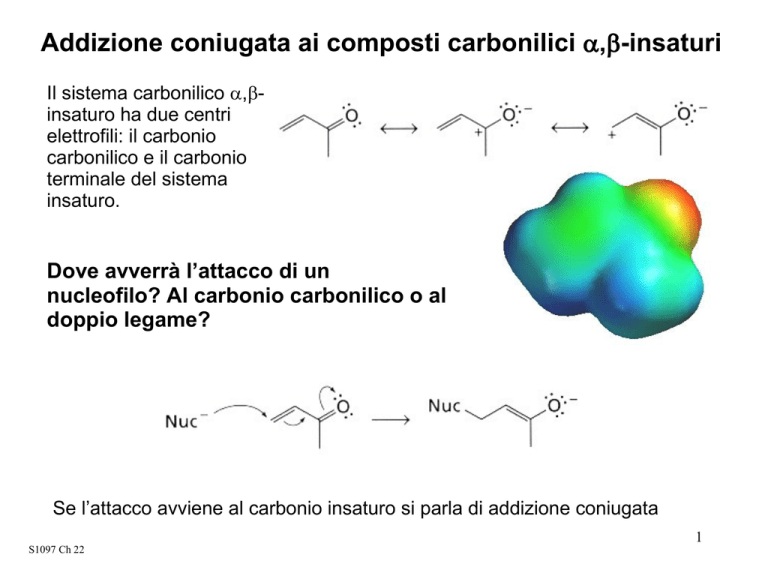
Addizione coniugata ai composti carbonilici α,β-insaturi
Il sistema carbonilico α,βinsaturo ha due centri
elettrofili: il carbonio
carbonilico e il carbonio
terminale del sistema
insaturo.
Dove avverrà l’attacco di un
nucleofilo? Al carbonio carbonilico o al
doppio legame?
Se l’attacco avviene al carbonio insaturo si parla di addizione coniugata
S1097 Ch 22
1
Addizione 1,2 vs. addizione 1,4
A causa della tautomerizzazione del prodotto (da enolo a composto
carbonilico) il prodotto finale corrisponde formalmente all’addizione di
HX al doppio legame
S1097-8
2
Sintesi di sistemi carbonilici α,β-insaturi
Reazioni di eliminazione
La strategia dipende dalla posizione relativa del gruppo
uscente rispetto al carbonile
S1098
3
Eliminazione del gruppo in α al carbonile
Si genera un carbanione in α al carbonile inserendo un gruppo
fenilseleniuro o fenilsolfuro.
Dopo ossidazione questi gruppi eliminano PhSeOH o PhSOH per semplice
riscaldamento
S1099
4
Eliminazione del gruppo in β al carbonile
Condensazione aldolica
Riduzione di un β-cheto estere
S1099
5
Eliminazione del gruppo in β al carbonile:
Reazione di Mannich
Mediante reazione di Mannich si ottiene un chetone che possiede
un gruppo uscente in β al carbonile.
La reazione avviene per reazione di uno ione imminio (elettrofilo)
e un composto carbonilico (nucleofilo)
(CH3)2N=CH2+ IS1101
(sale di Eschenmoser)
6
Reazione di Mannich
Gli ioni imminio possono essere generati in situ mediante reazione di
un’ammina secondaria (dimetilammina) e un composto carbonilico
(formaldeide), oppure utilizzati preformati
Poichè non vi sono protoni in β, in condizioni debolmente acide si ha
eliminazione di acqua e formazione del sale di dialchilimminio.
S1100
7
Reazione di Mannich
Lo ione imminio ha un carbonio
elettrofilo in grado di reagire con
un nucleofilo, nel caso specifico
un enolo. Si ottiene la forma
protonata di un β-dimetilammino
chetone (base di Mannich)
S1101
8
Reazione di Mannich
Una volta formata, una base di Mannich (o il suo acido coniugato) è in
grado di eliminare l’ammina per semplice riscaldamento, fornendo il
sistema insaturo
S1102
9
Reazione di Mannich
Se sono necessarie condizioni di reazione più blande, la base di Mannich può
essere metilata con CH3I. Si ottiene un miglior gruppo uscente (NMe3) che
elimina per trattamento basico (eliminazione di Hoffman, E1cb).
S1102
10
Reazione di Mannich
La reazione di Mannich avviene anche con i fenoli
S1102
11
Addizione coniugata di acqua
Meccanismo in condizioni basiche
S1103
12
Addizione coniugata di acqua
La reazione può anche avvenire in ambiente acido.
La protonazione del carbonile genera un centro elettrofilo sia
su C-2 che su C-4
S1104
13
Addizione coniugata di acqua
Se l’acqua reagisce al C-2 si ottiene la forma idrata
Questi derivati sono instabili; eliminano acqua rigenerando il
prodotto di partenza
S1104
14
Addizione coniugata di acqua
Se l’acqua reagisce al C-4 si ottiene l’enolo che, dopo tautomeria,
genera l’idrossichetone
S1104-5
15
Esercizio: l’acqua può anche dare addizione 1,4 a un enolo derivato da un
dichetone. Questa reazione acido-catalizzata fornisce l’idrolisi dell’enol etere.
Proporre un meccanismo.
O
OH
OH
OH
H3O+
H2O
OH
OH2+
OCH3
OCH3
H
O
OH
OH
OCH3
OCH3
+ CH3OH
OH+
S1105
O
O
16
Addizione coniugata di HCN
In ambiente acido:
Si ottiene un β-chetonitrile
S1108
17
Addizione coniugata di HCN
In ambiente basico, le aldeidi α,β-insature forniscono addizione 1,2
(analogamente ai derivati carbonilici) mentre per i chetoni prevale il
meccanismo 1,4.
Il diverso meccanismo può essere imputato al diverso ingombro
sterico del carbonile.
S1108
18
Addizione coniugata di HCN
L’addizione di HCN seguita da idrolisi o riduzione permette di
ottenere acidi o ammine.
S1109
19
Addizione coniugata di ammine
La reazione non è altro che la reazione di Mannich inversa
S1109
20
Esercizio: come preparereste i seguenti composti a partire dal cicloesanone?
O
O
1. LDA
2. PhSeCl
O-
O
OH
O
NHMe2+
NMe2
H
H
Me2NH
O
NMe2
O
H
OH
LiAlH4
HCN
CN
O
CH2NH2
O
CH2NMe2
CH2O/Me2NHCl
[Me2N=CH2+]
S1109
21
Addizione coniugata di alcoli e tioli
Queste reazioni possono avvenire sia con catalisi acida che basica.
La catalisi basica generalmente fornisce rese più elevate.
S1110
22
Addizione coniugata di tioli: detossificazione
Questa reazione, di limitata importanza in chimica
organica, riveste un ruolo importante nella detossificazione
degli stupefacenti
glutatione
L’addizione coniugata di un nucleofilo
(glutatione) a derivati della morfina
(morfina-6-deidrogenasi) ne aumenta la
solubilità in acqua, favorendone
l’eliminazione
S1114-5
23
Addizione coniugata di idroperossidi
Nel caso dell’addizione dell’anione
idroperossido, non si ha formazione
del prodotto di addizione 1,2.
Al contrario, l’enolato reagisce come nucleofilo nei confronti dell’ossigeno
perossidico, eliminando un ione idrossido e formando un epossido
S1110
24
Addizione coniugata di idroperossidi
Questa reazione è molto diversa
dall’ossidazione di un alchene con un
peracido
Un doppio legame isolato è abbastanza elettron-ricco da reagire con un
peracido, mentre un doppio legame coniugato è elettron-povero e
reagisce con un ossidante nucleofilo (HOO-)
S1111
25
Esercizio: come preparereste i seguenti epossidi a partire da qualsiasi
reagente contenente 7 atomi di carbonio?
H2O2/OHCHO
CHO
CH2OH
O
RCO3H
O
O
CHO
S1111
O
CH2OH
26
Addizione coniugata ai fenoli
I fenoli danno addizioni coniugate tramite i corrispondenti chinoni:
Gli idrossibenzeni vengono facilmente ossidati ai corrispondenti chinoni
(cicloesadiendioni)
S1111-2
27
Addizione coniugata ai chinoni
Un chinone possiede due sistemi α,β-insaturi, ciascuno dei quali può subire
addizione coniugata con un nucleofilo
L’intermedio che si ottiene tautomerizza fornendo nuovamente il sistema
aromatico a 6 elettroni π.
S1112
28
Addizione coniugata alle basi di Mannich. 1
Questa reazione di transamminazione di una base di Mannich appare come
una reazione di sostituzione. In realtà la base di Mannich perde
dimetilammina generando una specie chinoide, un chinone metide
S1112-3
29
Addizione coniugata alle basi di Mannich. 2
Il chinone metide subisce addizione coniugata da parte dell’ammina,
portando al fenolo sostituito:
L’attacco nucleofilo avviene preferenzialmente al doppio legame esociclico,
perché questo ripristina l’aromaticità del sistema
S1113
30
La reazione di Michael
Addizione di un enolato di un derivato metilenico attivato ad un sistema α,βconiugato (accettore di Michael). Tali trasformazioni possono avvenire in
presenza di quantità catalitiche di OH- o RO-. Il prodotto è un composto 1,5dicarbonilico.
Donatore di Michael
S1116
Accettore di Michael
31
Esempi di reazioni di Michael
S1116-7
32
Trasformazioni degli addotti di Michael
Un addotto di Michael può essere trasformato mediante rimozione di
un gruppo attivante (decarbossilazione)
S1121
33
La reazione di Michael
Se la reazione è sotto controllo termodinamico, avviene più facilmente se l’enolato
deriva da composti con protoni relativamente acidi (pKa < 14).
Se la reazione è invece sotto controllo cinetico, molti tipo di ioni enolato possono
reagire con gli accettori di Michael.
S1117-8
34
La reazione di Michael
Questa procedura viene spesso utilizzata fornendo i prodotti in rese elevate
S1118
35
La reazione di Michael con enolati non stabilizzati
L’utilizzo di un enolato non stabilizzato può avere un vantaggio rispetto a quella
normale. L’intermedio ionico può essere alchilato, anziché protonato, portando a
un prodotto doppiamente sostituito.
Addizione-alchilazione tandem
S1118-9
36
Addizione-alchilazione tandem
La stessa reazione, se eseguita sul chetone saturo, produrrebbe due
enolati e quindi una miscela di prodotti:
S1119
37
Polimerizzazioni anioniche: reazioni di Michael
multiple e sequenziali
Poichè l’addizione di un carbanione a un sistema α,β-insaturo genera un
altro carbanione, in condizioni adatte questo può provocare una
polimerizzazione. Questo processo viene denominato polimerizzazione
anionica e avviene con una serie di accettori di Michael
L’iniziatore di una polimerizzazione anionica è un nucleofilo in grado
di generare un enolato da un accettore di Michael
S1119
38
Polimerizzazione anionica del metile
cianoacrilato
E’ sufficiente uno ione ossidrile. Se
non sono presenti altri elettrofili,
l’enolato reagisce con un’altra
molecola di accettore di Michael
Questa polimerizzazione è alla base degli adesivi cianoacrilici
Perchè la colla non deve toccare la pelle durante l’uso?
S1120
39
Esercizio. Come preparereste i seguenti prodotti ?
O-
O
O
COOEt
O
CH3
CH3Br
CH3
-HC
CN
CN
CN
COOEt
COOEt
EtO-
H2C
PhCH2Br
COOEt
H
COOEt
PhH2C
C
CN
COOEt
EtO-
PhH2C
CN
O
COOEt
-C
C
CN
S1119
PhH2C
CN
H2C
CH
C
CN
O
Ph
40
Ph
Esercizio. Quale è il prodotto atteso dalle seguenti sequenze di reazioni?
EtOOC
-
COOEt
COOEt
- CO2
CH(COOEt)2
COOH
COOEt
CN
-
S1121
COOH
CN
CH2NH2
CH2COOt-Bu
CH2CH2OH
CH2COOt-Bu
41
L’anellazione di Robinson: sintesi di cicloesenoni
(reazione di Michael + condensazione aldolica)
L’addizione a formare
il ciclo a 4 è sfavorita
S1121-2
42
Anellazione di Robinson: meccanismo
Isomerizzazione
Condensazione
aldolica
Disidratazione
(E1cb)
S1122-3
43
Addizione coniugata di carbanioni non stabilizzati
Addizione di reagenti di Grignard a composti carbonilici alcol
Addizione di reagenti di Grignard agli enoni miscela di prodotti da
addizione 1,2 (alcol) e 1,4 (chetone)
Scarsa selettività
Addizione di RLi ad accettori di Michael addizione 1,2
S1123
44
Addizione coniugata di carbanioni non stabilizzati:
organocuprati
Con i litio cuprati (reagenti di Gilman) si ottiene quasi esclusivamente
addizione 1,4
Reagenti di Gilman: [R2Cu(I)]- Li+
2 RLi + CuI R2CuLi + LiI
L’aggiunta di sali di Cu(I) porta a favorire l’addizione 1,4 anche con i
reagenti di Grignard
S1124
45
Addizione coniugata di carbanioni non stabilizzati:
organocuprati
Anche altri cuprati reagiscono bene con gli accettori di Michael, portando
preferenzialmente all’addotto 1,4. Reagiscono bene alchil, vinil e aril ciano
cuprati
S1124
46
Addizione coniugata di organocuprati agli esteri
Gli esteri α,β-insaturi reagiscono con selettività inferiori, tranne quando
viene utilizzato un alchil cuprato-boro trifluoruro
S1124
47
Esercizio: Come preparereste questi composti utilizzando un reagente
organometallico e un derivato organico con fino a 7 atomi di carbonio?
(CH2=CH)2CuLi
O
O
OO-
O
O
+
O-
O
OO
O
O
-O
S1125
48
Esercizio: Come preparereste questi composti utilizzando un reagente
organometallico e un derivato organico con fino a 7 atomi di carbonio?
Cu.BF3
COOEt
COOEt
2
S1125
49
Varianti degli organocuprati
50
Addizione coniugata 1,4 dei cuprati di
Gilman
Possibili meccanismi di
reazione:
•Polare (2e) [CuI → CuIII]
•Single-electron transfer
(1e + 1e) [CuI → CuII]
Scarsa “atom economy”
Formazione di un enolato
Addizione-alchilazione tandem
51
Addizioni-alchilazioni tandem via organocuprati
Il meccanismo di addizione di un organocuprato a un accettore di Michael
prevede la generazione di uno ione enolato.
In presenza di un agente alchilante, l’enolato viene alchilato dalla stessa parte
dove è avvenuta l’addizione coniugata → alchilazione alle posizioni α e β
Formazione dell’addotto trans
S1125
52
Addizioni-alchilazioni tandem
Le condizioni di reazione determinano la formazione preferenziale del
diastereoisomero trans o cis
Ponendo i prodotti in ambiente basico si può favorire la formazione del derivato
trans, più stabile, attraverso la formazione dell’enolato.
S1126
53
Addizioni-alchilazioni tandem: utilizzo di altri elettrofili
S1126
54
Addizioni-alchilazioni tandem: fenilselenazione
doppia alchilazione alle posizioni α e α'
S1127
55
Esercizio. Come preparereste i seguenti prodotti dal cicloesenone e qualsiasi
altro composto organico o organometallico con fino a 6 atomi di carbonio?
O
O
1. Et2CuLi
2. MeI
S1127
56
Esercizio. Come preparereste i seguenti prodotti dal cicloesenone e qualsiasi
altro composto organico o organometallico con fino a 6 atomi di carbonio?
O
O
O
O
SePh
H2O2
1. Et2CuLi
Me2CuLi
Me
2. PhSeCl
Et
Et
Et
1. Me2CuLi
2. MeCHO
O
OH
O
Me
Me
Et
S1127
57
Et
Addizione coniugata di idruro
L’addizione di ioni idruro è simile all’addizione di un reagente
organometallico. Anche in questo caso si ha competizione tra addizione
1,2 e 1,4.
Se l’addizione 1,4 avviene prima, spesso si ha anche ulteriore riduzione
della funzione carbonilica ad alcol.
S1133
58
Riduzione degli enoni per idrogenazione
Per molti substrati si può ridurre il doppio legame semplicemente
mediante riduzione catalitica. Questo metodo però non è compatibile
con la presenza di altri doppi o tripli legami nella molecola.
S1135
59
Addizione coniugata di idruro: NaBH4 e LiAlH4
NaBH4 e LiAlH4 reagiscono preferenzialmente con la funzione
carbonilica
S1133
60
Addizione coniugata di idruro: NaBH4/CeCl3
In presenza di CeCl3 si
forma esclusivamente
l’alcol allilico:
Probabilmente a causa della coordinazione del
cerio alla funzione carbonilica
S1133-4
61
Addizione coniugata di idruro con [(Ph3P)CuH]6
Per promuovere l’addizione coniugata ad un enone spesso si aggiunge un
sale di rame all’idruro. Un reagente particolarmente utile è un idruro di rame
esamerico [(Ph3P)CuH]6 che si utilizza in presenza di tracce d’acqua.
S1134
62
Addizione coniugata di idruro agli esteri
Per ridurre un estere insaturo si utilizza AlH3 o DIBAL [(iPrO)2AlH]. Si
ottiene anche in questo caso l’alcol allilico
S1134
63
Esercizio: come preparereste i seguenti composti partendo dal cicloesenone?
O
O
O
1.
CuLi
OH
SePh
2
H2O2
NaBH4/CeCl3
2. PhSeCl
O
SePh
1. Me2CuLi
O
O
O
1. LDA
2. n-BuBr
Bu
Bu
SePh
H2O2
2. PhSeCl
OH
Bu
NaBH4/CeCl3
S1135
64
Addizione coniugata di idruro con Li/NH3 liq
Addizione di un elettrone derivante da un metallo disciolto in NH3 liquida
L’enone addiziona un elettrone
producendo un radicale anione
Il trasferimento di un secondo
elettrone, seguito da due
protonazioni, fornisce il chetone
Come sorgente di protoni si
utilizza un alcol (NH3 è un
acido troppo debole)
S1135
65
Addizione coniugata di idruro con Li/NH3 liq:
alchilazione
Se nella riduzione si aggiunge un solo equivalente di H+ si ottiene un enolato.
In presenza di elettrofili si può avere alchilazione.
Questo è uno dei migliori metodi per
generare un enolato con completo
controllo della regiochimica, a
differenza della deprotonazione di
un chetone non simmetrico
S1137
66
Esercizio: quale è il prodotto principale atteso dalle seguenti reazioni?
O
O
Br
S1137
67
Riepilogo
Sintesi di composti carbonilici α,β-insaturi: eliminazione
del gruppo in α al carbonile via PhSCl o PhSeCl
O
O
LDA
H2O2
PhSeCl
SePh
O
O
heat; - PhSeOH
SePh
O
68
Riepilogo
Sintesi di composti carbonilici α,β-insaturi: eliminazione
da un aldolo o riduzione di un β-chetoestere
69
Riepilogo
O
O
Addizioni coniugate
O
OR,SR
O
O
ROH, RSH
H2O2/OH-
H 2O
O
OH
O
RNH2
HCN
O
CH2NH2
NHR
CN
O
70
COOH
Riepilogo
Addizioni coniugate ai fenoli via chinoni
O
O
OH
OH
Cl
[O]
OH
HCl
O
H
O
Cl
taut.
OH
71
Riepilogo
Sintesi di composti carbonilici α,β-insaturi: eliminazione
da un prodotto della reazione di Mannich
O
KH
Me2N=CH2+
O
O
heat
- Me2NH
CH2NMe2
72
Riepilogo
Addizioni coniugate alle basi di Mannich via chinone metide
(transamminazione apparente)
OH
OH
H
N
NMe2
O
N
O
N
73
Riepilogo
Reazione di Michael
Addizione coniugata con metilene reattivo composto 1,5dicarbonilico
Normalmente con basi tipo NaOEt
O
COOEt
NaOEt/EtOH
H
O
EtOOC
C
H
COOEt
EtOOC
O
C
O-
O
- CO2
O
COOEt
CH3Br
HOOC
O
CH3
CH3
-HC
COOEt
COOEt
COOEt
COOEt
COOH
COOEt
74
Riepilogo
Anellazione di Robinson
NaOEt/EtOH
O
O
O
4. Cond. aldolica
1. Formazione enolato
O
O
OH
2. Reaz. Michael
5. Disidratazione
O
O
O
3. Isomerizzazione
O
O
75
Riepilogo
Addizione di organocuprati
OH
O
Grignard e organolitio
danno miscele di prodotti
1,2 e 1,4
O
R
RMgBr
R
OH
R
RLi
O
O
OEt
R2Cu.BF3
OEt
O
R
R2CuLi
R
76
Riepilogo
Addizione coniugata di organocuprati: addizione-alchilazione tandem
O
O
SePh
H2O2
R
1. R2CuLi
O
R
2. PhSeCl
O
O
O
R'
R'
1. R2CuLi
1. R2CuLi
2. R'COCl
2. R'Br
R
R
1. R2CuLi
2. R'CHO
O
OH
R'
R
77
Riepilogo
Addizione coniugata di idruro
O
O
OH
OH
H-
Miscela di prodotti
o NaBH4
O
H2
Incompatibile con altri doppi legami
OH
NaBH4/CeCl3
Solo alcol allilico
COOEt
DIBAL
CH2OH
O
(Ph3PCuH)6
Solo chetone saturo
78
Riepilogo
Addizione coniugata di idruro con Li/NH3
Si forma l’enolato che può essere alchilato con ottima regioselettività
O-
O
O
R'X
Li/NH3 liq.
R
R
R'
R
79
Addenda
80
Sintesi di sistemi carbonilici α,β-insaturi
Reazione di Horner-Emmons (modificazione della reazione di Wittig)
S904, S1098
81
Ilidi di fosforo con un carbonile in β
A causa della presenza del gruppo carbonilico, queste ilidi sono meno
reattive nei confronti di gruppi carbonilici per dare l’alchene
corrispondente
I corrispondenti reagenti che hanno un
fosfonato anziché una fosfina forniscono
un’ilide con una maggior carica negativa
sul carbonio, anche se la presenza del
carbonile continua a stabilizzare la specie
S903 Ch 18
82
Reazione di Arbuzov
I fosfonato carbanioni si preparano per reazione di fosfiti con alogenuri
alchilici reattivi
Una base quale un alcolato riesce a deprotonare il fosfonato (i gruppi MeO
rendono i protoni molto più acidi) generando l’ilide.
S903 Ch 18
83
Riepilogo
Sintesi di composti carbonilici α,β-insaturi: reazione di
Horner-Emmons via reazione di Arbuzov
O
O
MeO
P
O
CH
C
CH3
O
OMe
Reaz. Horner-Emmons
EtONa/EtOH
O
O
Br
CH2
C
CH3
+ P(OMe)3
MeO
P
O
CH2
C
CH3
OMe
Reaz. Arbuzov
84
Addizione coniugata di idruro con Li/NH3 liq:
stereochimica
La stereochimica del prodotto dipende dalla struttura dell’intermedio che si
ottiene prima della protonazione
Se si genera un singolo stereocentro partendo da un derivato achirale si ottiene
un racemo. Se il reagente è chirale, la stereochimica dei prodotti dipende
fortemente dalle condizioni di reazione utilizzate.
S1135
85