I Vertebrati ectotermi
del Parco Regionale del Matese, 2002
A cura di Odierna G. e Guarino F.M., pp. 127-137
Localizzazione di aree biosintetiche
per vasotocina e mesotocina nell’encefalo di Rettili
mediante ibridazione in situ
DI MONTEFIANO ROSITA, ESPOSITO ROSSELLA, MONTI MARIA GAIA,
ROMANO MAURIZIO, ROSANOVA PATRIZIA, LIMATOLA ERMELINDA
Dipartimento di Biologia Evolutiva e Comparata
Università degli Studi di Napoli Federico II
Abstract
The hypothalamic areas transcribing mRNA for mesotocin (MT) and vasotocin (AVT)
with their neurophisins (np) in some reptiles (Podarcis sicula, Podarcis muralis e Anguis
fragilis) were localized by in situ hybridation. The probes for MT-np and AVT-np, recently
cloned in P. sicula, hybridise also in the other two species of reptiles. The results show
that in the hypothalamus of these reptiles, the neurons of supraoptical nuclei (SONs), of
the paraventricular nuclei (PVNs) and of the interconnecting nuclei (INs) transcribe
mRNA for MT-np and AVT-n; therefore they suggest that these molecules represent
neurohypofiseal hormones in the lizard P. muralis and in the slow-worm Anguis fragilis
too. Furthermore mRNAs for MT-np and AVT-np were detected in extra hypothalamic
areas and in the forebrain.
Introduzione
I peptidi neuroipofisari o neuroormoni sono nonapeptidi distinti in basici e
neutri. Gli ormoni basici, a funzione essenzialmente vasopressoria, presentano in
posizione 8 un aminoacido basico; gli ormoni neutri, a funzione essenzialmente
ossitocica presentano un aminoacido neutro nella stessa posizione (Gorbmann,
1983; Acher, 1996). In tutte le classi di vertebrati sono state identificate almeno
due molecole ormonali, di cui una basica ed una neutra (Acher, 1985; Acher &
Chauvet, 1988; Smeets & Gonzales, 2001). Nei mammiferi tranne alcune eccezioni, i due principi sono rappresentati dalla vasopressina (AVP) e dall’ossitocina
(OXY), con funzioni vasopressorie e ossitociche ben distinte. Nei vertebrati non
mammiferi il principale neuropeptide basico con funzioni sia vasopressorie che
ossitociche è la vasotocina (AVT), trovato in tutti gli uccelli, Rettili, Anfibi e Pesci
studiati. In questi vertebrati è di solito presente anche un peptide neutro diverso
dall’ossitocina. La mesotocina (MT) è il principio neutro negli uccelli, Rettili e
Anfibi studiati, mentre nei pesci si trova sostanzialmente l’isotocina (IT). Una
128
DI MONTEFIANO ET AL
delle ipotesi più accreditate sull’evoluzione molecolare di questi ormoni propone
l’arginina-vasotocina (AVT) come molecola ancestrale dalla quale si sarebbero differenziati i diversi principi sia ossitocici che vasopressori (Acher, 1993; Acher &
Chauvet, 1995).
Come nei mammiferi, gli ormoni neuroipofisari mesotocina (MT) e vasotocina
(AVT) dei vertebrati non mammiferi sono prodotti da neuroni ipotalamici e trasportati mediante fibre nervose alla neuroipofisi che li riversa nel circolo ematico.
A questi neurormoni sono stati attribuiti diverse funzioni: contrazione delle vie
genitali (MT), effetto antidiuretico a livello dei sistemi barriera e contrazione dei
muscoli della parete dei vasi sanguigni (effetto vasopressorio) (AVT). Nei Rettili i
neuroni secernenti sono essenzialmente raggruppati in precise aree ipotalamiche e
costituiscono il nucleo sopraottico (SON) e il nucleo paraventricolare (PVN)
(Bargman & Sharrer, 1961; Acher et al., 1969; Turner & Bagnara, 1974). Il SON
è costituito da neuroni magnocellulari che bordano dorsalmente il tratto ottico in
direzione rostro-caudale; il PVN è formato da un esteso gruppo di neuroni disposti ai lati del 3° ventricolo. Tra il SON e il PVN sono di solito presenti neuroni di
interconnessione (IN). Il pattern di distribuzione encefalica dei neuropeptidi
ipofisari è stato studiato in varie specie di cheloni, ofidi e sauri mediante tecniche
di immunoistochimica anche utilizzando anticorpi non omologhi. Neuroni e fibre immunoreattive per MT e AVT sono state riscontrate nei classici nuclei
secernenti (SON e PVN) dell’ipotalamo e, in alcune specie, anche in aree
extraipotalamiche (positive solo alla AVT) quali il nucleo del letto della stria terminale (bNst), in Gekko gekko, la fascia laterale telencefalica (LFB) in, Mauremys
caspica, Natrix maura e Anolis carolinensis, la corteccia telencefalica (LC) e il
tubercolo olfattorio, in Natrix e Mauremis, (Fernandez-Llebrez et al., 1988; Propper
& Dixon, 1997). Nella lucertola Podarcis sicula, indagini immunocitochimiche
hanno evidenziato, una produzione stagionale di un principio ossitocico anche da
parte dell’organo Subcommissurale (OSC) (Limatola et al., 1997).
Recentemente in Podarcis sicula, per la prima volta nei Rettili, sono stati amplificati e clonati i cDNA della mesotocina-neurofisina (MT-np) (≅550bp) e vasotocinaneurofisina (AVT-np) (≅620/630bp). Le sequenze sono state utilizzate per la costruzione di due sonde ad RNA e marcate con digossigenina (Di Montefiano et
al., 2001). Tali sonde, capaci di ibridare in maniera specifica con mRNA per MTnp e AVT-np, sono state costruite su una delle regioni del gene ormone-neurofisina
maggiormente variabile tra i vertebrati già studiati: Mammiferi (Ruppert et al.,
1984; Rehbein et al., 1986) Anfibi (Nojiri et al., 1987) Uccelli (Barth et al.,
1997). Gli studi finora effettuati sui Rettili hanno verificato la presenza dei principi ossitocici e vasopressori ma non la specifica capacità biosintetica dei nuclei
encefalici per i neuroormoni (Bons & Perezi, 1981; Fasolo & Gaudino, 1982;
Neurosecrezione in Rettili
129
Fernandez-Llebrez et al., 1988; Propper & Dixon, 1997).
Scopo di tale studio è stato quello di verificare mediante ibridazione in situ (ISH)
se le sonde per MT-np e AVT-np ottenute in Podarcis sicula ibridano anche in altre
specie di Rettili (Anguis fragilis e Podarcis muralis) che vivono in un’area montana
del Matese e di effettuare uno studio comparativo sulla distribuzione
neuroanatomica di regioni neurosecernenti MT-np e AVT-np in queste specie e
sulla stessa Podarcis sicula.
Materiali e metodi
Esemplari adulti di Podarcis sicula, Anguis fragilis, Podarcis muralis di entrambi i sessi, sono stati catturati nel bosco misto presso il “parco Capuano”
di Civitella Licinia, in località Fonte Greca-Gallo da Aprile a Ottobre 2000.
Gli animali sono stati mantenuti in stabulario per non più di tre giorni in
condizioni di temperatura e umidità controllati, nutriti ad libitum con larve
di Tenebrio molitor L. e poi sacrificati per decapitazione previa anestesia. Gli
encefali sono stati rapidamente rimossi dalla scatola cranica e fissati chimicamente o congelati.
Il congelamento è stato ottenuto per immersione in isopentano raffreddato a 20°C e gli encefali sono conservati a -80°C fino al sezionamento con il criostato
(Jung frigocut 2800 N Leika). Per l’ibridazione in situ sono state utilizzate
criosezioni seriate trasverse o sagittali di circa 12 µm di spessore. Prima
dell’ibridazione le sezioni sono state fissate per 30' in paraformaldeide (PFA) 3%
in PBS 1X. L’ibridazione in situ è stata effettuata con le sonde antisenso (as) MTnp-as e AVT-np-as di P. sicula su sezioni gemelle, campionate in modo da coprire
l’area che va dal telencefalo al mesencefalo (Di Montefiano et al., 2001). Tutte le
soluzioni sono preparate con H2O/DEPC (dietilpirocarbonato 0,01%) sterile. Le
sonde MT-np e AVT-np sono state utilizzate ad una concentrazione di 1:100 nel
buffer di ibridazione (50% formammide, 10X Denhardt’s solution, 10%
dexstransulphate, 0.3M NaCl, 0.01M EDTA, 500 µg/ml Herring sperm DNAss,
0.1M DTT, 100µg/ml polyA, 500 µg/ml tRNA). La reazione è stata rivelata con
anti-Dig (Roche) e BCIP/NBT (Roche). Alcuni encefali dopo il prelievo sono
stati fissati in formaldeide 3.7% in PBS disidratati in alcool ed inclusi in paraffina.
Sezioni trasverse di 7µ di spessore sono state sparaffinate e pretrattate con proteinase
K (10µg/ml, Roche) prima dell’incubazione con il buffer di ibridazione in situ
come le criosezioni sopra descritte.
Sezioni gemelle di quelle usate per l’ibridazione, sono state poste su vetrini separati, sono state incubate con le sonde senso RNA-MTss e RNA-AVTss, processate
allo stesso modo delle altre sezioni e utilizzate come controlli.
Le osservazioni sono state effettuate al microscopio ottico Nikon microphot FXA.
130
DI MONTEFIANO ET AL
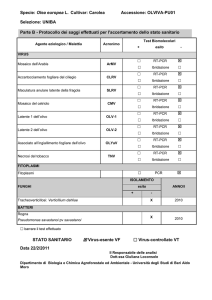
Figura 1: Podarcis sicula a: schema rappresentativo di una sezione sagittale dell’encefalo; iii: terzo
ventricolo; EM: eminenza mediana; OC: chiasma ottico; PVN: nucleo paraventricolare; SON: nucleo
sopraottico. b: criosezione sagittale ibridazione in situ con sonda AVT-np nel nucleo sopraottico
(SON)(200x); c: criosezione sagittale ibridazione in situ con sonda MT-np nel nucleo paraventricolare
(PVN)(200x).
Figura 2: Podarcis sicula: ibridazione in situ con sonda AVT-np su sezioni traverse in paraffina a livello
del telencefalo. a: nella parte rostrale appaiono positive la corteccia mediale nella sua parte ventrale
(CM) e la placca superficiale della cresta dorsale del ventricolo (SP)(150x). b: a livello del pallio mediale
appaiono positive la corteccia mediale (CM) e la parte più rostrale del nucleo sferico (NS)(150x); c:
nella parte più caudale del telencefalo il nucleo sferico (NS) ibrida fortemente. (150x)
Risultati
Le osservazioni effettuate mostrano che nelle sezioni in paraffina la struttura
istologica risulta meglio conservata rispetto alle criosezioni e che il segnale di
ibridazione è stato rivelato con una buona risoluzione in entrambi i casi. I risultati
dell’ibridazione in situ sia su criosezioni che su sezioni in paraffina trasverse e
sagittali, mostrano che nell’ipotalamo di P. sicula i neuroni positivi per MT-np e
AVT-np sono localizzati nel SON, nel PVN e nei nuclei di interconnessione (IN)
distribuiti tra il SON ed il PVN nell’area ipotalamica (Fig. 1, 3). In regioni
Neurosecrezione in Rettili
131
extraipotalamiche inoltre risultano positive le cellule accessorie della fascia
telencefalica laterale (ACLFB) e alcune aree del telencefalo; in senso cranio-caudale,
risulta ibridata la corteccia mediale (CM) nella sua parte ventrale, la placca superficiale della cresta dorsale del ventricolo (SP) e, caudalmente, il nucleo sferico
(NS) (Fig. 2).
I risultati mostrano inoltre che le sonde di P. sicula ibridano in situ in Anguis
fragilis e in P. muralis ma con minore intensità. In particolare in P. muralis entrambe le sonde per MT-np e per AVT-np ibridano con i neuroni del SON e del PVN
nell’ipotalamo e della ACLFB in aree extraipotalamiche (Fig. 3). In Anguis fragilis
Figura 3: Podarcis sicula e podarcis muralis. a: schema rappresentativo di sezione traversa del diencefalo
delle due specie: LFB: fascia laterale telencefalica; pvn: nucleo paraventricolare; SON: nucleo sopraottico.
b,c,d: ibridazione in situ su criosezioni, con sonda MT-np. In p. Sicula (b)(100x); risultano positivi il
nucleo paraventricolare (PVN), i nuclei di interconnessione (IN), il nucleo sopraottico (SON) e le
cellule accessorie della fascia laterale telencefalica (ACLFB). Notare la diversa intensità della reazione
dei SONS in P. sicula (c)(180x); e in P. muralis (d)(180x).
132
DI MONTEFIANO ET AL
(orbettino) è stata evidenziata, dopo tempi più lunghi di rivelazione, una positività
netta nel SON, nel PVN e nei IN per entrambe le sonde (Fig. 4).
Tutte le sezioni di controllo trattate con le sonde senso MT-ss e AVT-ss risultano
negative.
La terminologia dei nuclei è secondo: Beccari, 1943; Norcthcutt, 1978; Butler,
1978; Stoll & Vorn, 1985; Thepen et al., 1987; Fernandez-Llebrez et al., 1988;
Propper et al., 1992; Moore et al., 1998.
Figura 4: Anguis fragilis. a: rappresentazione sintetica di sezioni trasverse di diencefalo: nucleo
paraventricolare (PVN), nucleo sopraottico (SON); nucleo di interconnessione (IN). b: ibridazione in
situ su criosezioni con sonda MT-np: sono evidenti neuroni positivi nel nucleo sopraottico (80x).
Discussione
I neuroormoni nei vertebrati studiati vengono trascritti insieme alle loro proteine carrier denominate neurofisine. Il prodotto della trascrizione è un mRNA che
contiene la sequenza di un peptide segnale, del neurormone e della rispettiva
neurofisina. La struttura della famiglia di geni che codificano per i neurormoni è
molto conservata ed è costituita da tre esoni A, B e C in cui il peptide segnale,
l’ormone e una parte della neurofisina sono contenuti nel primo esone A; nell’esone
B si trova la parte più conservata delle neurofisine di tutti i vertebrati, nell’esone C
si trova la regione più variabile di esse. La regione terminale del DNA della
neurofisina, nel principio vasopressorio, è costituita da una sequenza che codifica
per una regione glicopeptidica (Ivell, 1987; Nojiri et al., 1987; Barth et al., 1997).
Nei Rettili, le informazioni sugli ormoni neuroipofisari rimangono finora incomplete. Lo studio del cDNA di AVT-np e MT-np in Podarcis (Di Montefiano et al.,
2001) e i risultati qui esposti sono i primi studi di tipo biomolecolare nei Rettili.
Neurosecrezione in Rettili
133
In particolare viene ora evidenziato che le sonde di P. sicula ibridano sicuramente
con gli mRNA nell’ipotalamo di P. muralis e di Anguis fragilis e che la AVT e la
MT rappresentano gli ormoni neuroipofisari anche in queste due specie. Poiché le
sonde utilizzate sono state costruite sulle sequenze delle neurofisine di AVT ed
MT in P. sicula (Di Montefiano et al., 2001) i risultati dell’ibridazione suggeriscono che anche nella lucertola di muro e nell’orbettino le neurofisine sono
cotrascritte con i rispettivi ormoni così come è stato dimostrato negli Anfibi (Conway
& Gainer, 1987; Nojiri et al., 1987; Gonzalez & Smeets, 1992) negli Uccelli
(Berk et al., 1982; Blasher, 1983; Tennyson et al., 1985; Barth et al., 1997) e nei
Mammiferi (Swaab et al., 1975a; De Vries et al., 1985; Ulfig et al., 1990).
In Anguis fragilis, l’ibridazione ha evidenziato sempre un segnale più debole rispetto alla P. sicula. Anche se le aree biosintetiche di P. muralis risultano sovrapponibili
a quelle di P. sicula, il segnale è comunque meno intenso e resta tale anche se si
allungano i tempi di rivelazione. Si potrebbe pertanto ipotizzare un non completo
appaiamento a livello delle neurofisine in specie differenti da P. sicula. Le sonde
utilizzate sono state infatti costruite in P. sicula sulla parte maggiormente variabile
delle sequenze delle neurofisine per AVT-np e per MT-np (Di Montefiano et al.,
2001) note nei vertebrati studiati.
La presenza in P. sicula di aree positive alla sonda di mRNA per AVT-np a livello
telencefalico dimostra che in queste aree viene sintetizzata AVT; precedenti studi
hanno evidenziato la presenza di AVT immunoreattiva nella corteccia telencefalica
di alcuni Rettili (Fernandez-Llebrez et al., 1988; Propper et al., 1997), anche se il
suo significato funzionale in aree extraipotalamiche resta tuttavia da chiarire.
La somministrazione di AVT in altri vertebrati non mammiferi può modificare
una varietà di atteggiamenti sociali e riproduttivi che includono negli Anfibi, l’attività locomotoria, la recettività delle femmine di rana, i richiami canori (Boyd,
1992; Boyd et al., 1992; Boyd, 1994; Propper & Dixon, 1997; Tito et al., 1999)
ed il rilascio delle uova (Moore et al., 1992; Moore et al., 2000); negli Uccelli, i
comportamenti sessuali (Kihlstrom & Danninge, 1972), il canto (Voorhuis et al.,
1991; Goodson, 1998; Goodson & Adkins-Regan, 1999) e la deposizione delle
uova (Nakada et al., 1994). Di recente nel maschio di tritone (Tarica granulosa),
la presenza di neuroni immunoreattivi all’AVT in regioni extraipotalamiche (nucleo del letto della stria terminale, amigdala dorso laterale) è stata correlata con i
rituali di corteggiamento (Moore et al., 2000).
Sulla base di queste indicazioni, la presenza in Podarcis sicula di AVT in aree
telencefaliche potrebbe anche essere correlata al ciclo riproduttivo annuale.
Ringraziamenti
Lavoro finanziato dalla Regione Campania. Esemplari catturati con autorizzazio-
134
DI MONTEFIANO ET AL
ne del 1/06/2000 n. SCN/2D/2000/9213 del Ministero dell’Ambiente.
Riassunto
Sono stati mappati mediante ibridazione in situ (ISH) le aree ipotalamiche nelle quali
vengono trascritti mRNA per mesotocina (MT) e vasotocina (AVT) con le rispettive
neurofisine (np) in alcuni Rettili (Podarcis sicula, Podarcis muralis e Anguis fragilis). Le
sonde per MT-np e AVT-np, già ottenute in P. sicula, hanno ibridato anche nelle altre due
specie. I risultati dimostrano che nell’ipotalamo di questi Rettili i neuroni del nucleo
sopraottico (SON), e del nucleo paraventricolare (PVN) e quelli dei nuclei d’interconnessione
(IN) trascrivono mRNA per MT-np e per AVT-np suggerendo che queste molecole rappresentano gli ormoni neuroipofisari anche nella lucertola P. muralis e nell’orbettino Anguis
fragilis. Gli mRNAs per la MT-np e per la AVT-np vengono inoltre evidenziati anche in aree
extra ipotalamiche diencefaliche e nel telencefalo.
Bibliografia
Acher R., 1985 - Byosinthesis, processing and evolution of neurohypophisial hormone
precursor. In:Kobayashi H., Bern H.A.; Urano A. Neurosecretion and biology of
neuropeptides. Japan Scientific. Societies Press Tokyo; Springer, Berlin, Haeidberg,
New York.
Acher R., 1993 - Neurohypophisyal peptides system: processing machinary, hydrohosmotic
regulation, adaption and evolution. Regul. Pept., 45: 1-13.
Acher R., 1996 - Molecular evolution of fish neurohypophysial hormone: neutral and
selective evolutionary mechanism. Gen. Comp. Endocrinol., review, 102: 157-152.
Acher R., Chauvet J., Chauvet M. T., 1969 - The neurohypophysial hormones of reptiles:
comparation of the viper, cobra and elaphe active principles. Gen. Comp. Endocrinol.,
13: 357-360
Acher R., Chauvet J., 1988 - Structure, processing and devolution of the neurohypophysial
hormone-neurophysin precursor. Biochimie., 70: 1197-1207.
Acher R., Chauvet J., 1995 - The neurphypophysial endocrine regulatory cascade:
precursors, mediators, receptors. Front. Neuroendocrinol., 16: 237-298.
Bargman N., Sharrer E., 1961 - The site of origin of the hormones of the posterior
pituitary. Ann. Sci., 39: 255-260.
Barth S. W., Barhgate R. A. D., Mess A., Parry L. J., Ivell R., Grossman R., 1997 Mesotocin gene expression in the diencephalon of domestic fowl: cloning and
sequencing of the MT cDNA and distribution of MT gene expressing neurons in the
chiken hypothalamus. J. Endocrinol., 9: 777-787.
Beccari N., 1943 - Neurologia comparata. Sansoni, Firenze XXI
Berk M. L., Reavest A., Hayward J. N., Finkelstein J. A., 1982 - The localization of
vasotocin and neurophysin neurons in the diencephalon of the pigeon Columba livia.
J. Neurol., 204: 392-406.
Blahser S., 1983 - Topography ontogeny and functional aspects of immunoreactive
neuropeptide system in the domestic fowl. In Mikami S., Houma K., Wada M.
Avian endocrinology: Environmental and ecological prospectives. Japan Scientific
Societies press, Tokyo, pp. 11-24.
Bons N., Perezi N., 1981 - Characterization immunocytochimique des systèmes
Neurosecrezione in Rettili
135
neurosecreteurs à mèsotocine et à vasotocine dans l’encephale de quelques lacertides.
C R Acad. Sci., III: 645-648.
Boyd S. K., 1992 - Sexual difference in hormonal control of a release cells in bullfrog.
Horm. Behav., 26: 522-535.
Boyd S. K., 1994 - Development of vasotocin pathways in the bullfrog brain. Cell. Tiss.
Res., 276: 593-602.
Boyd S. K., Tyler C. J., Devries G. J., 1992 - Sexual dimorphism in the vasotocin system
of the bullfrog (Rana catabesiana). J. Comp. Neurol., 325: 313-325.
Butler A. B., 1978 – Forebrain connections in lizards and the evolution of sensory system.
In: Behavior and Neurology of lizards. Greenberg N., MacLean P., NIMH, Rockville,
Maryland, pp. 65-78.
Conway K.M., Gainer H., 1987 - Immunocytochemical study of vasotocin, mesotocin
and neurophisins in the Xenopus hypothalamo-neurohypophisial system. J. Comp.
Neurol., 264: 494-508.
De Vries G. J., Buijs R. M., van Leeuwen F. W., Caffe A. R., Swaab D. F., 1985 – The
vasopressinergic innervation of the brain in normal and castrated rats. J. Comp.
Neurol., 233: 236-254.
Di Montefiano R., Spiess A., Romano M., Limatola E., Ivell R., 2001 - Colning of
mesotocin (MT) and vasotocin (AVT) cDNA from the oviparous reptile Podarcis
sicula perspective in Comparative Endocrinology: Unity and Diversity. Editors: Goos
H. J. Th., Rastogi R. K., Vaudry H., Pierantoni R.. Monduzzi, Bologna, pp. 547554.
Fasolo A., Gaudino G., 1982 - Immunohystochemical localization of somatostatin-like.
Immunoreactivity in the hypothalamus of the lizard, Lacerta sicula. Gen. Comp.
Endocrinol. 48: 205-212.
Fernandez-Llebrez P., Perez J., Nadales A. E., Fuentes M., Grondona J. M., Mancera M.,
Rodriguez E. M., 1988 - Immunocytochemical study of the hypothalamic
magnocellular neurosecretory nuclei of the snake Natrix maura and turtle Mauremys
caspita. Cell. Tiss. Res., 53: 435-445.
Gonzalez A., Smeets W. J. A., 1992 – Comparative analysis of the vasotocinergic and
mesotocinergic cells and fibers in the brain of two amphibians, the anuran Rana
vidibunda and the urodele Pleurodeles waltlii. J. Comp. Neurol., 315: 53-73.
Goodson J. L., 1998 – Territorial aggression and dawn song are modulated by septal
vasotocin and vasoactive intestinal polypeptide in male field sparrows (Spizella pusilla).
Horm. Behav., 34: 67-77.
Goodson J. L., Adkins-Regan E., 1999 – Effect of intraseptal vasotocin and vasoactive
polypeptide infusion on courtship song and aggression in the zebra finch (Taeniopygia
guttata). J. Neuroendocrinol., 11: 19-25.
Gorbmann A., Dickhoff W. W., Vignas R., Clark N. B., Ralph C. L., 1983 - Comparative endocrinology. Interscience Publication. Wiley, New York.
Ivell R., 1987 - Vasopressinergic and ossitocinergic cells: models in neuropeptide gene
expression. Elli Horwood LTD; England VCH, Weinheim, Federal Republic of
Germany.
Kihlstrom J. E., Danninge I., 1972 - Neurohyipophysial hormones and sexsual behavior
in males of the domestic fowl (Gallus domesticus L.) and the pigeon (Columia livia
Gmel.). Gen. Comp. Endocrinol., 18: 115-120.
136
DI MONTEFIANO ET AL
Limatola D’uva E., Monti M.G., Di Montefiano R., 1997 - Production of an oxytocin
like substance by the subcommissural organ (SCO), related to the reproductive
cycle in oviparous and viviparous reptiles. J. Neuroendocrinol., 9: 655-662.
Moore F. L., Lowry C. A., 1998 – Comparative neuroanatomy of vasotocin and
vasopressin in amphibians and other vertebrates. Comp. Biochem. Physiol. C
Pharmacol Toxicol Endocrinol. review, 119: 251-260.
Moore F. L., Wood R. E., Wood S. K., 1992 - Sex steroids and vasotocin interact in a
female amphibian (Taricha granulosa) to elicit female-like egg-laying behavior or
male-like courtship. Horm. Behav., 26: 156-166.
Moore F. L., Richardson C., Lowry C. A., 2000 – Sexual dimorphism in numbers of
vasotocin-immunoreactive neurons in brain areas associated with reproductive
behavior in the roughskin newt. Gen. Comp. Endocrinol., 117: 281-298.
Nakada T., Soh T., Shiota T., Tanaka K., 1994 – Studies on the role of arginine vasotocine
in relation to ovoposition in laying hens. Jnp. Poult. Sci., 31:358-362.
Nojiri H., Ishida I., Miyhashita E., Stetro M., Urano A., Deguchi T., 1987 – Cloning
and sequence analysis of cDNA for neurohypophisial hormones vasotocin and
mesotocin for the hypothalamus of toad Bufo bufo. Proc. Nat. Acad. Sci., 84:30433046.
Nortchutt R. G., 1978 – Forebrain and midbrain organization in lizard its phylogenetic
significance. Greenberg N., MacLean P., eds, NIMH, Rockville, Maryland, 11-64.
Propper P., Dixon T. B., 1997 – Differential effects of arginine vasotocin and gonadotropinreleasing hormone on sexual behaviors in an anuran amphibian. Horm. Behav., 32:
99-104.
Propper P., Jones R. E., Lopez K. H., 1992 - Distribution of arginin vasotocin in the
brain of the lizard Anolis carolinensis. Cell Tiss. Res., 267:391-398.
Rehbein M., Hillers M., Mohr E., Ivell R., Morley S., Schmle H., Richter D., 1986 –
The neurohypophysial hormones vasopressin and oxytocin: Precursor structure,
synthesis and regulation. Biol. Chem. Hoppe Seylers, 367: 695-704.
Ruppert S., Scherer G., Schutz G., 1984 – Recent gene conversion involving bovine
vasopressin and oxytocin precursor genes suggested by nucleotide sequence. Nature.,
308 (5959): 554-557.
Smeets W. J., Gonzalez A., 2001 - Vasotocin and Mesotocin in the brains of amphibians:
State of the art. Microsc. Res., 54(3): 125-136.
Stool C. J., Voorn P., 1985 - The distribution of hypothalamic and extrahypothalamic
vasotocinergic cells and fibres in the brain of a lizard, Gekko gecko; presence of a sex
difference. J. Comp. Neurol., 239: 193-204.
Swaab D. F., Nijveldt F., Pool C. W., 1975 - Distribution of oxytocin and vasopressin in
the rat supraoptic and paraventricular nucleus. J. Endocrinol., 67: 461-462.
Tennyson V. M., Hou-Yu A., Nilaver G., Zimmerman E. A., 1985 - Immunocytochemical
studies of vasotocin and mesotocin in the hypothalamo-hypophysial sistem of the
chicken. Cell. Tiss. Res., 239: 279-291
Thepen T., Voorn P., Stool C. J., Sluiter A. A., Pool C. W., Lohamann A. H. N., 1987 Mesotocin and vasotocin in the brain of Gekko gecko. Cell Tiss. Res., 250: 649-656.
Tito M. B., Hoover M. A., Mingo A. M., Boyd S. K., 1999 - Vasotocin maintains multiple call types in the grey treefrog Hyla versicolor. Horm. Behav., 36: 166-175.
Neurosecrezione in Rettili
137
Turner C. D., Bagnara J. T., 1974 - Endocrinologia generale. Zanichelli, Bologna
Ulfig N.E., Braak T. G. Ohm, Pool C. W., 1990 - Vasopressinergic neurons in the
magnocellular nuclei of the human basal forebrain. Brain. Res., 530: 176-180.
Voorhuis T. A. M., deKloet E. R., deWied D., 1991 – Effect of a vasotocin analog on
singing behaviour in the canary. Hormon. Behav., 25: 549-559.