A
Lezioni di immunoallergologia
III Edizione
a cura di
Giampiero Patriarca
Con la collaborazione di
Domenico Schiavino, Eleonora Nucera, Alessandro Buonomo
Copyright © MMXIII
ARACNE editrice S.r.l.
www.aracneeditrice.it
[email protected]
via Raffaele Garofalo, /A–B
Roma
()
----
I diritti di traduzione, di memorizzazione elettronica,
di riproduzione e di adattamento anche parziale,
con qualsiasi mezzo, sono riservati per tutti i Paesi.
Non sono assolutamente consentite le fotocopie
senza il permesso scritto dell’Editore.
III edizione: maggio
Indice
Presentazione della III edizione
Giampiero Patriarca
I. Il sistema immunitario: fisiopatologia e clinica
Amira Colagiovanni, Vito Sabato, Domenico Schiavino
II. Le immunodeficienze
Franco Pandolfi, Amira Colagiovanni
III. I principali test diagnostici in allergologia
Arianna Aruanno, Vito Sabato
IV. Le allergopatie respiratorie
Angela Rizzi, Eleonora Nucera
V. La dermatite atopica
Alessandro Buonomo, Lucilla Pascolini
VI. L’anafilassi
Valentina Pecora, Carla Lombardo
VII. Le reazioni da ipersensibilità agli alimenti: l’allergia e le
“intolleranze” alimentari
Eleonora Nucera, Alessandro Buonomo, Amira Colagiovanni, Domenico Schiavino
VIII. L’allergia al lattice della gomma
Eleonora Nucera, Valentina Pecora
IX. L’allergia al veleno di Imenotteri
Alessandro Buonomo, Carla Lombardo
Indice
X. Le reazioni da ipersensibilità ai farmaci
Alessandro Buonomo, Tiziana De Pasquale, Domenico Schiavino
XI. Le dermatiti da contatto e l’allergia sistemica al nichel
Tiziana De Pasquale, Emanuela Pollastrini
XII. La sindrome orticaria–angioedema
Amira Colagiovanni, Angela Rizzi, Eleonora Nucera
Bibliografia
Appendice
Lezioni di immunoallergologia
ISBN 978-88-548-5916-6
DOI 10.4399/97888548591661
pag. 7–7 (maggio 2013)
Presentazione della III edizione
G P
Questa terza edizione del volume Lezioni di Immunoallergologia
segue di quasi anni la precedente. Un nuovo capitolo, riguardante
le immunodeficienze è stato aggiunto. Nel capitolo riguardante le
reazioni da ipersensibilità agli alimenti è stato aggiunto un paragrafo
sull’Anisakis che è un allergene emergente dell’area mediterranea.
Nei vari capitoli, sono state aggiunte le più recenti acquisizioni
fisiopatologiche, diagnostiche e terapeutiche che riguardano tutti i
campi dell’allergologia e la bibliografia è stata aggiornata.
Voglio ringraziare i coautori di questo testo, il prof. Domenico
Schiavino, la dr.ssa Eleonora Nucera e il dott. Alessandro Buonomo,
che lavorano con me da molti anni (in particolare il dott. Buonomo si
è occupato della revisione finale del testo) e il prof. Franco Pandolfi, la
dr.ssa Valentina Pecora, la dr.ssa Amira Colagiovanni, la dr.ssa Arianna
Aruanno, la dr.ssa Angela Rizzi, la dr.ssa Lucilla Pascolini e la dr.ssa
Tiziana De Pasquale che si sono occupati della revisione dei capitoli
del testo.
Giampiero Patriarca
Già Direttore Servizio Allergologia del Policlinico “A. Gemelli”
Scuola di Specializzazione in Allergologia e Immunologia Clinica
Università Cattolica del Sacro Cuore di Roma
Lezioni di immunoallergologia
ISBN 978-88-548-5916-6
DOI 10.4399/97888548591662
pag. 9–43 (maggio 2013)
I. Il sistema immunitario: fisiopatologia e clinica
A C, V S, D S
. Introduzione
Il Sistema Immunitario (S.I.) è un complesso di cellule e molecole
specializzate nella distinzione del self dal non self e nell’eliminazione di
quest’ultimo. Un tale tipo di sistema è essenziale per la sopravvivenza
di ogni organismo vivente. Nell’uomo un S.I. ben funzionante consente di proteggersi dagli insulti degli agenti esterni (microrganismi
o tossine) e degli agenti interni (cellule tumorali, fenomeni autoimmuni). Un alterato funzionamento del S.I. può portare a molteplici
patologie, dalla rinite allergica all’artrite reumatoide, dai deficit immunitari alle malattie neoplastiche. Le strutture del S.I. possono essere
classificate in due categorie:
— immunità innata (o naturale o aspecifica): si attiva immediatamente dopo l’invasione da parte del patogeno.
— immunità adattativa (o specifica): è una risposta che si instaura
nell’arco di giorni o di settimane a seguito del contatto con un
patogeno specifico.
I due sistemi (tab. ) spesso cooperano: l’immunità innata rappresenta la prima linea di difesa, l’immunità adattativa diventa preminente
entro alcuni giorni a seguito dell’espansione di cloni B e T specifici. Inoltre le cellule antigene–specifiche potenziano la loro azione
reclutando cellule effettrici dell’immunità innata.
In definitiva, quindi, anche se la risposta immune innata e quella
adattativa sono assai differenti in termini di meccanismi effettori la
loro sinergia è fondamentale per un sistema immune pienamente
efficiente.
Amira Colagiovanni, Vito Sabato, Domenico Schiavino
Tabella . Principali caratteristiche dell’immunità innata e adattativa
Caratteristiche
Specificità
Recettori
Immunità Innata
Non Specifica
Codificati da geni della linea
germinale; diversificazione limitata
(es. Toll–like receptors)
Distribuzione dei Recettori
Memoria
Componenti
Barriere chimiche e fisiche
Non clonale
Assente
Immunità Adattativa
Specifica
Codificati da geni dalla linea
somatica; il riarrangiamento di
questi geni è alla base dell’elevata
diversificazione (es. T cell
receptor)
Clonale
Presente
Cute, epiteli delle mucose,
sostanze antimicrobiche
Complemento
Fagociti e natural killer
Linfociti intra–epiteliali, anticorpi
secreti a livello degli epiteli
Anticorpi
Linfociti
Proteine Ematiche
Cellule
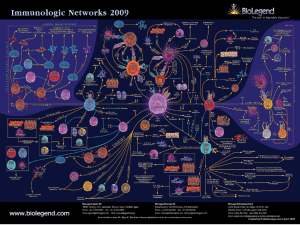
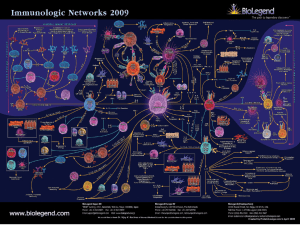
Figura . L’anatomia del sistema immunitario
I. Il sistema immunitario: fisiopatologia e clinica
. Organi del sistema immunitario
.. Organi linfatici primari
Sono: il timo e la borsa di Fabrizio per gli uccelli; il timo, il midollo
osseo e il fegato fetale per i mammiferi.
a) Il timo
È un organo bilobato localizzato nella regione anteriore del mediastino. Ciascun lobo è costituito da lobuli nei quali si riconoscono una
regione corticale e una midollare.
Le cellule contenute nel timo sono soprattutto linfociti (timociti),
altre cellule di derivazione midollare (macrofagi e cellule dendritiche)
e cellule epiteliali (corpuscoli di Hassal).
Nel timo si compie il processo di ontogenesi dei linfociti T; i linfociti immaturi che arrivano nella zona sottocapsulare dal midollo osseo
vanno incontro a un processo di maturazione/selezione al termine
del quale divengono immunocompetenti e vengono reimmessi in
circolo per andare a colonizzare gli organi linfoidi secondari.
Il timo, inoltre, regola le funzioni immunitarie con la secrezione di
numerose sostanze (gli ormoni timici) che modulano la crescita e le
funzioni delle varie cellule immunocompetenti.
Il timo nei mammiferi va incontro, a partire dalla pubertà, ad un
processo di progressiva involuzione. Il processo investe dapprima
la zona corticale e prevede la progressiva sostituzione con tessuto
adiposo.
b) Il midollo osseo
Il midollo osseo (e il fegato nella vita fetale) costituisce l’equivalente
della borsa di Fabrizio per gli uccelli.
Essi sono la sorgente di cellule staminali pluripotenti che poi si
differenziano in linfociti, granulociti, eritrociti e megacariociti, che
hanno diverse caratteristiche funzionali. Un alterato funzionamento di queste linee cellulari porta a gravi malattie (deficit immunitari,
leucemie, linfomi).
Amira Colagiovanni, Vito Sabato, Domenico Schiavino
.. Organi linfatici secondari
Gli organi linfatici secondari dei mammiferi sono: linfonodi, milza
e tessuto linfatico delle mucose e della cute. Essi sono connessi contemporaneamente al circolo sanguigno e linfatico; attraverso questi
vasi (sanguigni e linfatici) i linfociti circolano continuamente, rispondono agli stimoli antigenici e trasferiscono la specifica informazione
derivante da questa esposizione all’antigene in tutto il sistema linfatico.
a) Linfonodi
Costituiscono gli organi periferici del S.I. deputati alla localizzazione di una infezione e alla prevenzione di una sua diffusione. I linfonodi
hanno una struttura fatta da cellule reticolari e fibre e in essi sono
rilevabili una regione corticale e una midollare. I linfociti T (Timo–
equivalenti) si ritrovano nella midollare e nelle aree paracorticali. Nei
linfonodi (a livello dei follicoli primari) si ritrovano anche macrofagi e
cellule dendritiche che funzionano come cellule presentanti l’antigene
(APC).
b) Milza
La milza è un organo dotato di grande flusso ematico ( ml/min),
che ritorna in massima parte nel circolo generale, dopo aver dato la
possibilità alle strutture immunitarie spleniche (linfociti, monociti,
macrofagi) di valutare e controllare ripetutamente il contenuto antigenico del torrente circolatorio. Inoltre i macrofagi splenici catturano ed
eliminano gli eritrociti senescenti.
.. Altri tessuti linfatici
a) MALT (Mucose–Associated Lymphoid Tissue)
È formato da aggregati di linfociti, macrofagi e altre cellule accessorie, localizzate al di sotto dell’epitelio delle mucose e da alcuni linfociti
presenti anche in sede intraepiteliale. È distribuito a livello gastrointestinale, uro–genitale, del tratto respiratorio, occhio, etc. Della sua
I. Il sistema immunitario: fisiopatologia e clinica
componente gastrointestinale (GALT = Gut–Associated Lymphoid Tissue) fanno parte le placche di Peyer della lamina propria dell’intestino
tenue e l’appendice.
b) Sistema immune cutaneo
È costituito da linfociti intraepidermici e da cellule simili alle cellule
dendritiche dei linfonodi (cellule di Langherans.)
c) Tessuti linfoidi ectopici
Possono originare ex novo in sedi coinvolte in marcata e persistente
risposta immunitaria (per es. i follicoli linfatici sinoviali in corso di
artrite reumatoide).
. Cellule del sistema immunitario
.. I linfociti
I linfociti sono le uniche cellule dotate di specifici recettori per gli
antigeni e sono le cellule chiave della risposta immunitaria adattativa.
Nonostante siano morfologicamente indistinguibili al microscopio
ottico, nell’ambito dei linfociti è possibile individuare diverse popolazioni con specifiche funzioni e fenotipo. Le cellule sono quindi distinte
in base a proteine di superficie che possono essere identificate con un
pannello di anticorpi monoclonali; queste molecole sono definite CD
(cluster of differentiation) e identificate da un numero arabo. Ad oggi
ne sono state descritte .
Le tre linee cellulari distinguibili nell’ambito dei linfociti sono:
— Linfociti T
— Linfociti B
— Natural Killer
Le molecole di superficie che più caratterizzano la linea T cellulare sono: CD, CD (marker linkage specifico), CD (T helper, TH),
Amira Colagiovanni, Vito Sabato, Domenico Schiavino
CD (T citotossici o CTL); da ricordare inoltre il CD (implicato nella trasduzione del segnale da interazione cellula–cellula), il CD (il
marker più precoce delle cellule T), il CD (implicato nel segnale
costimolatorio), il CD (o CTLA– coinvolto in segnali inibitori). I
linfociti T CD+ sono definiti T helper in quanto “aiutano” i linfociti
B a produrre anticorpi e i fagociti nella distruzione dei microrganismi; i linfociti T CD+ sono detti citotossici in quanto lisano cellule
infettate da microrganismi. Le cellule T CD+ immesse in circolo,
dopo aver completato il ciclo di maturazione nel timo, vanno incontro
ad una serie di stimolazioni antigeniche il cui risultato è quello di far
acquisire alla cellula TH (o null o vergine) un fenotipo di tipo TH o
TH. Dopo il contatto con l’antigene il linfocita vergine interagisce
con altre cellule del sistema immune (macrofagi, mastociti, cellule
NK): il tipo di contatto e di risposta all’antigene sono influenzati dalle
caratteristiche genetiche dell’ospite e da una serie di fattori non noti.
La processazione dell’antigene da parte di queste cellule dell’immunità innata (e successivamente delle APC, fra cui soprattutto le cellule
dendritiche) determina la produzione di una serie di citochine il cui
equilibrio è fondamentale per lo sviluppo della risposta immunitaria
nei confronti di quello specifico antigene. La modalità di presentazione dell’antigene e il pattern citochinico “polarizzano” il TH verso il
fenotipo TH o il TH (Fig. ).
L’acquisizione del fenotipo TH e del fenotipo TH è indotta dalla
presenza dell’IL– e dell’IL– nel sito di presentazione dell’antigene; è
un processo stepwise (per gradi) determinato da attivazione di particolari segnali cellulari, divisioni cellulari e modulazione della cromatina
il cui risultato finale è una memoria epigenetica per la produzione di
citochine. Per la differenziazione in senso TH è fondamentale la stimolazione dell’IL– attraverso STAT– e, nelle fasi precoci, dell’IL–
attraverso STAT–. Queste pathway attivano il fattore di trascrizione
TH regulator–T–box il quale non solo promuove la produzione di
citochine pro–TH (IFN–γ , IL–,TNF-β), ma blocca anche la differenziazione in senso TH. L’IL– invece attraverso la stimolazione del
GATA– stimola la produzione di citochine pro–TH (IL–,,,,,,
), inibendo allo stesso tempo la differenziazione in senso TH. Negli
ultimi anni, inoltre, è stato definito un subset di cellule T, le cellule T
regolatorie (o Treg), implicato nella regolazione della risposta immunitaria nei confronti di antigeni self e non self (vedi “La regolazione
I. Il sistema immunitario: fisiopatologia e clinica
Figura . Polarizzazione TH/TH
della risposta immune”). I linfociti B, invece, sono definiti da CD e
CD (marcatori pan–B cellulari), CD, CD e CD (detto anche
antigene CALLA: common acute lymphoblastic leukemia associated antigen).
Esiste, inoltre, una subpopolazione CD+ ossia linfociti B che compaiono nel fegato e nella milza fetali intorno alla a–a settimana e
si localizzano ai margini dei centri germinativi dei follicoli secondari;
queste cellule sono capaci di produrre spontaneamente autoanticorpi
(soprattutto fattore reumatoide e antiDNA a singola elica). L’% dei
linfociti circolanti sono T, il –% sono B; i linfociti TCD sono in
rapporto : con i CD. Le cellule NK sono un subset di linfociti identificati dal CD e dal CD. Questi fanno parte della cosiddetta immunità
innata e esercitano un ruolo di immunosorveglianza nei confronti di siti
esprimenti target non self complessati con l’MHC di classe I (es. cellule
infettate da virus, cellule neoplastiche, cellule trapiantate). Le cellule NK
esprimono il recettore per la IL–,esercitano un’attività citolitica nonristretta dai meccanismi di riconoscimento associativo (MHC di classe
I o II + antigene, vedi pagina ) tipico dei linfociti T. Le cellule NK
possono svolgere anche un’attività regolatoria dal momento che, dopo
attivazione, secernono numerose citochine quali TNF–α, GM–CSF e
Amira Colagiovanni, Vito Sabato, Domenico Schiavino
IFN–γ .
.. I fagociti
Sono cellule ematiche che maturano nel midollo osseo, circolano nel
sangue per brevi periodi (giorni) ed entrano negli spazi tissutali per
diapedesi attraverso le pareti capillari in risposta a fattori chemiotattici
rilasciati dall’infiammazione.
a) Macrofagi: giocano un ruolo fondamentale nella risposta immune. Derivano dai monociti circolanti, circolano per pochi
giorni nel sangue, che lasciano per divenire macrofagi tissutali
attivati. Funzioni fondamentali:
I Chemiotassi (richiamo di cellule)
II Fagocitosi (digestione dell’antigene)
III Processazione dell’antigene e presentazione ai linfociti perché si possa iniziare una risposta immune linfocitaria (APC).
Essi non sono però antigene specifici
IV Secrezione di enzimi, proteine plasmatiche, metaboliti attivi dell’ossigeno, citochine (es. IL–)
b) Neutrofili: originano dal midollo osseo, circolano nel sangue
e nei tessuti; la loro funzione primaria è la fagocitosi e la
distruzione di agenti estranei
c) Eosinofili: sono spesso presenti nei siti di immunoflogosi, ma
la loro attività fagocitaria è inferiore a quella dei neutrofili. Hanno un ruolo nella immunità anti–parassitaria e nelle malattie
allergiche. Gli eosinofili attivati rilasciano diverse sostanze, fra
cui la cosiddetta proteina cationica degli eosinofili (ECP) che
può essere dosata nel siero dei pazienti come indice di attività
di flogosi allergica (soprattutto nelle allergie respiratorie), MBP
(proteina basica maggiore), etc.
d) Basofili e Mastociti: sono espressioni diverse di cellule con analoga finalità: sintesi, trasporto e liberazione dei mediatori chimici
della flogosi allergica (istamina, leucotrieni, fattore chemiottattico degli eosinofili o ECF, fattore di attivazione delle piastrine
o PAF). I basofili sono presenti in circolo, i mastociti risiedono
nei tessuti (mucose e parenchimi).
I. Il sistema immunitario: fisiopatologia e clinica
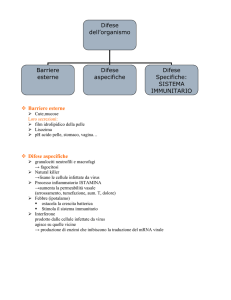
. L’immunità innata
Viene così definita in quanto si avvale di meccanismi altamente conservati nella scala evolutiva e che non sono influenzati da precedenti
contatti con microrganismi.
Il primo sistema di difesa è rappresentato dalla barriera cutanea,
dalle secrezioni mucose, dagli epiteli ciliati, dal succo gastrico e dall’antagonismo della flora microbica commensale. In caso di superamento
di queste barriere i microrganismi sono attaccati da fattori solubili (es.
lisozima) e dai fagociti.
I principali fagociti sono rappresentati dai polimorfonucelati neutrofili e dai macrofagi; attraverso i cosiddetti pattern recognition receptors,
PRRs, (es. i toll–like receptors) essi riconoscono i cosiddetti pathogen
associated molecular patterns, PAMPs, posti sulla superficie del microbo.
Una volta adesi sulla superficie del fagocita i microrganismi attivano
specifici segnali intracellulari e sono trasportati all’interno della cellula
ove sono fusi con i granuli lisosomiali. Ciò determina l’attivazione
di una serie di sistemi microbicidi ossigeno–dipendenti (es. mieloperossidasi, ossido nitrico) e ossigeno–indipendenti (es. lattoferrina,
defensine, proteine cationiche, lisozima, etc.). Inoltre, l’adesione del
microrganismo ai PRRs sulle cellule dendritiche dà inizio alla risposta
immune adattativa.
Importante nell’espletamento della risposta immune innata (ma
anche di quella adattativa) è quel complesso di proteine circolanti e
associato alle membrane che prende nome di complemento. Si tratta
di proteine normalmente presenti nel siero in forma inattiva le quali
esplicano la loro azione biologica attraverso un’attivazione enzimatica
sequenziale.
Alcune proteine (inibitore della Cq esterasi o C–INH, Cb inattivatore, fattore H, etc.) sono normalmente presenti per bloccare
un’attivazione aspecifica del complemento. L’attivazione del complemento può seguire la via “classica”, la via “alternativa” e la via
“lectinica”. La via “classica” è parte integrante della risposta immune
adattativa e si innesca dopo che un anticorpo (IgM, IgG e IgG) si è
legato alla superficie microbica.
La via “alternativa” e la via “lectinica” rientrano nell’ambito dell’immunità innata e si innescano rispettivamente in seguito al contatto
diretto con la superficie microbica (che non contiene gli elementi re-
Amira Colagiovanni, Vito Sabato, Domenico Schiavino
golatori inibenti presenti nell’ospite) o mediato dalle IgA e in seguito
al legame della lectina legante il mannosio con i residui di mannosio delle glicoproteine di superficie dei microbi. Tra gli elementi
complementari è importante ricordare:
— C: è la componente centrale del complemento su cui convergono tutte le vie di attivazione; il frammento Cb interviene
nell’opsonizzazione e nella fagocitosi ed è in grado di promuovere il clivaggio delle proteine poste a valle. Nella pratica clinica,
nel sospetto di patologia da attivazione del complemento, si
richiede il dosaggio delle frazioni C e C del complemento.
— Ca, Ca, Ca: sono i frammenti proteolitici che stimolano la
flogosi (aumentano la permeabilità vascolare, favoriscono la chemiotassi dei leucociti, inducono il rilascio di altri mediatori della
flogosi). Questi fattori sono definiti anche “anafilotossine” in
quanto sono in grado di indurre direttamente la degranulazione
dei mastociti e dei basofili.
— C–C: costituisce il cosiddetto complesso di attacco alla membrana (MAC) ed è implicato nella lisi dei microrganismi.
— C–INH: proteina regolatrice che inibisce l’attivazione del complemento nelle fasi precoci. Un suo deficit quantitativo/qualitativo,
ereditario o acquisito è causa di angioedemi ricorrenti; la forma
più nota è l’edema angioneurotico ereditario di Quincke ed
è dovuta al deficit quantitativo, geneticamente trasmesso, del
C–INH.
Altro importante meccanismo effettore dell’immunità innata è il cosiddetto killing extracellulare. Le cellule infettate da virus sono aggredite
dai NK attraverso il sistema delle perforine e del FAS–FAS ligando (FAS:
apoptosis stimulating fragment). Quest’ultima pathway innesca una serie
di segnali intracellulari che portano alla cosiddetta morte cellulare programmata o apoptosi. L’“apoptosi” è un fenomeno di morte cellulare
programmata il cui fine è l’eliminazione di cellule non desiderate dell’organismo e si verifica: ) durante l’embriogenesi, ) come meccanismo di
mantenimento di popolazioni cellulari all’interno di un tessuto, ) come
meccanismo di difesa nelle reazioni immunitarie, ) dopo danno cellulare, ) durante l’invecchiamento. Nel controllo della risposta immunitaria
l’apoptosi è responsabile di una serie di eventi tra cui:
I. Il sistema immunitario: fisiopatologia e clinica
— morte dei neutrofili durante la risposta infiammatoria acuta
— morte cellulare indotta dai linfociti T citotossici
— morte dei linfociti in seguito a deplezione di citochine ed
eliminazione di cloni autoreattivi
L’attivazione degli eosinofili da parte del Cb adeso alla superficie
dei parassiti è responsabile della loro uccisione.
. L’immunità adattativa
Le caratteristiche peculiari della risposta immune adattativa sono:
— specificità: capacità di riconoscere e rispondere a diversi tipi di
microrganismi;
— memoria: dopo il primo contatto con l’antigene (risposta primaria) si generano cellule a lunga emivita che permangono in
uno stato di quiete fino a quando non si realizza un successivo
contatto con l’antigene (risposta secondaria); in tal caso queste
cellule acquisiscono rapidamente funzioni effettrici;
— specializzazione: capacità di riconoscere strutture specifiche di
specifici microrganismi;
— non autoreattività contro il self : meccanismi regolatori impediscono alle cellule del sistema immune di attaccare l’ospite.
L’immunità adattativa si compone di due compartimenti (tab.):
immunità umorale e immunità cellulo–mediata.
Tabella . Principali caratteristiche dell’immunità adattativa (umorale e cellulare)
Immunità umorale
Immunità cellulo–mediata
Mediata da anticorpi
Cellule responsabili: linfociti B
Possibilità di trasferimento sierico
Prima difesa contro le infezioni batteriche
Mediata da cellule
Cellule responsabili: linfociti T, monociti, macrofagi
Impossibilità di trasferimento sierico
Responsabile delle difese contro virus, miceti,
organismi intra–cellulari, antigeni tumorali, rigetto dei
trapianti
Amira Colagiovanni, Vito Sabato, Domenico Schiavino
. Le fasi della risposta immunitaria adattativa
La risposta immune è il risultato di una serie di eventi sequenziali che
possono essere così schematizzati:
fase di riconoscimento e presentazione dell’antigene: le APC presentano l’antigene ai linfociti antigene–specifici naive;
fase di attivazione: richiede almeno due segnali. Il primo è fornito
dal legame del recettore specifico per l’antigene (TCR: T–cell
receptor), il secondo (“costimolazione”) è fornito dal microbo
stesso o da fattori dell’immunità innata attivatasi in seguito all’invasione del microrganismo. Durante la fase di attivazione i
linfociti che hanno riconosciuto l’antigene vanno incontro ad
una rapida divisione cellulare (espansione clonale) e acquistano
la capacità di eliminare l’antigene (cellule effettrici);
fase effettrice: i linfociti B si differenziano in cellule effettrici
capaci di produrre anticorpi (plasmacellule), mentre i linfociti
T acquisiscono la capacità di killing nei confronti delle cellule
infettate. Le cellule effettrici e i loro secreti eliminano l’antigene,
spesso in coordinazione con i meccanismi effettori della risposta
immune innata;
fase di declino (omeostasi): debellata l’infezione viene a mancare lo
stimolo in grado di attivare i linfociti. Ne deriva che la maggior
parte delle cellule stimolate dalla presenza dell’antigene vanno
incontro a fenomeni di apoptosi e successiva rimozione dei
corpi apoptotici da parte dei fagociti;
fase della memoria: le cellule che sopravvivono sono i cosiddetti
linfociti della memoria e sono capaci di rimanere quiescenti
per mesi o anni e di rispondere rapidamente ad una successiva
invasione da parte di un microrganismo.
Ruolo cruciale nella presentazione dell’antigene è rivestito dalle
molecole del complesso maggiore di istocompatiblità (MHC o HLA:
human leukocyte antigen): esse segnalano la presenza di un non self e
contemporaneamente rappresentano un segnale di riconoscimento
per le cellule che devono cooperare. I linfociti T, infatti, non sono in
grado di riconoscere gli antigeni se non processati e complessati con
le molecole MHC. I geni che codificano per le proteine del complesso