METABOLISMI
TESSUTO-SPECIFICI
Ogni tessuto ha una sua funzione specifica che riflette la sua funzione
specifica che si riflette nella sua anatomia e nella sua attività metabolica.
mantenimento potenziale
di membrana, invio segnali ad altri organi
ruolo centrale nel metabolismo
sintesi, raccolta e
molbilizzazione dei trigliceridi
Intestino tenue:
assorbimento dei nutrienti
Sistema linfatico:
trasporto dei lipidi
dall’intestino al fegato
T. Adiposo
lavoro meccanico mediante utilizzazione di ATP
Riepilogo delle principali vie metaboliche
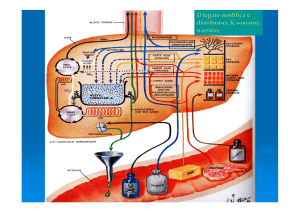
FEGATO
Funzioni metaboliche del fegato
1.
Metabolismo dei carboidrati
2.
Metabolismo dei lipidi
3.
Metabolismo delle proteine
4.
Metabolismo eme
5.
Deposito Fe
6.
Fattori coagulazione
7.
Detossificazione
8.
Deposito vitamina
Fegato
•
•
•
•
Organo altruista
Centralità funzionale
Grande flessibilità metabolica
Modulazione dell’espressione degli enzimi
avviene a una velocità 5-10 superiore a
quella degli altri tessuti
• La vena porta è la via di trasporto che
collega gli organi della digestione con il
fegato
Vie metaboliche che utilizzano glucosio nel fegato
Il fegato tampona i livelli di glucosio nel
sangue
• Assume e rilascia glucosio in risposta agli
ormoni e alla concentrazione di glucosio
• Glucosio è intrappolato nel fegato come G-6-P
dalla glucochinasi
– Glucochinasi ha un’alta Km (∼ 5 mM: bassa affinità) per il
glucosio e non è inibita da G6P.Attività aumenta con la
concentrazione del glucosio.
– Esochinasi in molte cellule hanno un’alta affinità per il
glucosio (Km ~ 0.1 mM:alta affinità) e sono inibite da
G6P
• Ad alta [glucosio], il fegato assume glucosio a
una velocità più o meno proporzionale alla sua
concentrazione
Metabolismo degli amino acidi nel fegato
Metabolismo dei lipidi nel fegato
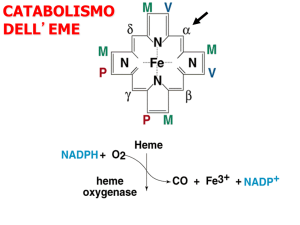
Catabolismo dell’eme
•
L’eme viene trasformato in bilirubina.
•
Il 75% della bilirubina deriva dall’emoglobina degli eritrociti vecchi che
vengono fagocitati dai macrofagi della milza, del fegato e del midollo
osseo.
•
1.2 108 eritrociti /ora distrutti (6g di emoglobina /die)
•
Concentrazione plasmatica di bilirubina: 1 mg/dl
•
Se la concentrazione di bilirubina supera 3 mg/dl si ha l’ittero
(riconoscibile dalla colorazione gialla della pelle)
La bilirubina è il prodotto del metabolismo dell’eme, il gruppo prostetico
dell’emoglobina.
È un pigmento giallo-verde che dà il colore alla bile stessa.
Prende origine dalla distruzione dei globuli rossi ad opera dei macrofagi: il gruppo
dell’eme viene aperto:
•
Il ferro viene catturato dalla transferrina
•
La catena lineare di 4 anelli pirrolici viene metabolizzata a
1.
Biliverdina
2.
Bilirubina
La bilirubina, nel giro di poche ore, viene quindi catturata dal fegato dove viene
coniugata, essenzialmente con acido glucuronico: la bilirubina glucuronide viene escreta
nella bile
Catabolismo dell’eme
Eme
Fe (pool)
emoglobina
urine
biliverdina
rene
Feci
sangue bilirubina (insol)
Bilirubina/albumina
stercobilina(colorato
fegato
intestino
Bilirubina/ac. glucuronico
Canalicolo biliare
stercobilinogeno
(incolore
Ittero
•
L’ittero è inequivocabilmente evidente su base clinica quando la
concentrazione plasmatica di bilirubina è supera la soglia di 3 mg/dl
•
Classificazione:
• Pre-epatico: eccessiva produzione di bilirubina conseguente a
episodi emolitici
• Intra-epatico: riflette una disfunzione epatica generalizzata
• Post-epatico: provocata dalla ostruzione delle vie biliari
Pre-epatico
cause: emolisi
Intra-epatico
cause: infezione
epatiti
sostanze chimiche
alcol
difetti genetici
metabolismo bilirubina
sindrome di Gilbert
sindrone di Grigler
sindrome di Dubin-J
sindrome di Rotor
proteine specifiche
morbo di Wilson
neonatale
fisiologico
autoimmune
epatite cronica
Post-epatico
cause: dotti biliari intraepatici
dotti biliari extraepatci
(molto comune)
comune)
(1/20)
(raro)
(raro)
(raro)
(1/200.000)
(molto comune)
farmaci
(molto comune)
cirrosi
calcolosi cistifellea (comune)
• I difetti genetici sono associati ad anomalie nella
coniugazione o nella secrezione delle bilirubina.
• Sindrome di Gilbert (5% delle popolazione) consiste in un
modesto aumento della bilirubina non coniugata a causa di
una diminuita attività della UDP-glucuronil trasferasi
• Sindrome di Crigler-Najjar è causata dall’assenza completa
o dalla marcata diminuzione delle capacità di coniugazione
delle bilirubina (può essere fatale)
• Ittero neonatale (comune nei neonati) dovuto alla
immaturità del sistema enzimatico responsabile della
coniugazione della bilirubina. La bilirubina non coniugata è
tossica per il cervello e provoca uno stato patologico
(kernittero). Fototerapia con UV per ossidare la bilirubina
Azione detossificante del fegato:
metabolismo dell’Etanolo
• E’ un alcol a elevato contenuto energetico (7kcal/g),
intermedio fra quello dei glucidi e dei lipidi,
• Non viene accumulato, viene subito eliminato attraverso
le urine, l’aria e metabolizzato
• 80% del metabolismo avviene nel fegato (2 mmoli di
alcol/g di tessuto/ min) e in minor misura nella mucosa
gastrica, polmoni e rene
• Viene assorbito dal cavo orale, stomaco e intestino
tenue per semplice diffusione
• La velocità di assorbimento è proporzionale alla quantità
ingerita
• Alcol deidrogenasi: dimero di 4 distinte catene polipeptidiche,
ognua delle quali ha 4 atomi di Zn :2 per legare etanolo e NAD e 2 per
stabilizzare la struttura terziaria)
– Alcol + NAD+
Diverse forme di acetaldeide deidrogenasi.
matrice mitocondri (Km<1mM)
membrana mitocndri (Km 2mM)
citoplasma Km elevata
NADH + H+ + acetaldeide
Concentrazione elevata
di etanolo
Nel fegato sono presenti altri due enzimi in grado di trasformare
l’etanolo in acetaldeide che sono attivi solo ad elevata concentrazione di alcool:
-catalasi, che utilizzando H2O2 ha anche un ruolo detossificante
Etanolo + H2O2
acetaldeide + 2acqua
alcool idrossilasi a funzione mista (MEOS:sistema microsomiale ossidante etanolo), che
utilizza O2 e NADPH e costituisce il sistema microsomiale ossidante
dell’etanolo:
etanolo + NADPH + H+ + O2
acetaldeide + NADP+ + H2O
Meos è un sistema specifico che catalizza anche la detossificazione di
molti farmaci e composti tossici ed inducibile dell’etanolo stesso
Cambiamenti metabolici durante l’ossidazione dell’etanolo
1-Aumento del rapporto NADH/NAD+ (spostamento del
potenziale redox verso uno stato più ridotto, condizione che
determina variazioni nel rapporto di substrati NAD dipendenti)
2-Aumento della sintesi di acidi grassi e trigliceridi
3-blocco della gluconeogenesi
4-inattivazione della glutammico deidrogenasi
5- formazione di radicali liberi dell’ossigeno e il radicale idrossietilico,
responsabili entrambi dell’aumento dei processi di perossidazione
lipidica e di una riduzione delle difese antiossidanti del fegato
Riduzione difese antiossidanti
del fegato
Azione Detossificante del fegato:
Metabolismo degli xenobiotici
• Il fegato presiede alla rimozione di svariate sostanze
"non nutritive" presenti nell’organismo riducendone o
annullandone l’eventuale tossicità.
• Le reazioni di biotrasformazione di farmaci, ormoni
steroidei, steroidi endogeni e sostanze tossiche,
comprendono processi
– di detossicazione esplicati mediante idrossilazioni,
ossidazioni, riduzioni
– coniugazioni che avvengono principalmente nei
microsomi del fegato.
Reazione della fase I: IDROSSILAZIONE
SH + O2 + NADPH + H+
S-OH + H2O NADP+
Serie successiva di reazioni red-ox:
SOH
NADPH+H+
NADP+
Flavoproteina
ossidata
Flavoproteina
ridotta
NHP-Fe2+
P450-Fe3+
NHP-Fe3+
P450-Fe2+
SH
Il 50% dei farmaci viene metabolizzato con il sistema P450
H2O
O2
Protezione da danno ossidativo
• Nella cellula si formano radicali liberi provenienti da
parziale riduzione dell’O2 molto reattivi e tossici per lipidi,
acidi nucleici, proteine
• Mitocondri sono molto esposti a questo danno
• In condizioni normali se ne formano pochi e sono
rapidamente rimossi
• In particolari condizioni si formano molti radicali liberi con
uno o più elettroni spaiati e molto reattivi
– radicale superossido molto reattivo e non tossico poiché
rimosso dalla SOD (superossido dismutasi)
– da questo radicale si formano altri specie reattivi e tossici, come
l’ossigeno singoletto, molto reattivo e tossico
Rimozione di acqua ossigenata
Nell’uomo, esistono 15 o più isoenzimi CYP450,
che differiscono, parzialmente, per specificità,
induttori, inibitori.
CYP450 NOMENCLATURE
Based upon Nelson et al. DNA & Cell Biology 12:1-51, 1993.
CYP3A4
CYP – abbreviation for cytochrome P450
3 – designates family (> 40% sequence identity)
A – designates sub-family (> 55% sequence identity)
4 – designates specific gene/enzyme
CYP – designates mRNA or protein
CYP – designates gene
CYP1A1 – gene that codes for cytochrome P450 1A1
CYP1A1 – mRNA or protein product of CYP1A1 gene
19
• Ciascun isoenzima è caratterizzato dai
substrati metabolizzati, dagli induttori ed
inibitori.
• Tuttavia, data la scarsa specificità delle varie
isoforme, spesso 2 o più isoforme partecipino
al metabolismo di un singolo xenobiotico.
• Le varie isoforme possono catalizzare
reazioni diverse sullo stesso substrato.
• In molti casi predomina il metabolismo
operato da un’isoforma. Il contributo delle
varie isoforme dipende dai valori di Km e
Vmax.
Variabilità del CYP450
• Fattori genetici (variabilità interindividuale)
• Se il metabolismo di un farmaco è regolato
principalmente da un solo gene (un solo enzima o
isoenzima), si possono avere tre casi generali:
• 1. Il gene è presente in una sola forma, espressa in
modo simile in tutti gli individui;
• 2. Il gene è presente, nella popolazione, in due o più
forme (alleli), i cui prodotti hanno attività enzimatica
nettamente diversa;
• 3. Il gene è presente in una sola forma ma mutazioni
dei geni regolatori causano una marcata riduzione
dell’espressione genica.
• Nel caso 1), la variabilità è determinata da
fattori non genetici e la distribuzione della
capacità metabolizzante nella popolazione
sarà normale (gaussiana).
• Nei casi 2) e 3) si osserva una distribuzione
non normale; sono presenti due (o più)
popolazioni .
• Sono quindi presenti almeno due fenotipi. In
questo caso si ha polimorfismo genetico
•
•
•
•
•
•
Reazioni di coniugazione (fase II):
glucuronidazione
solfatazione
acetilazione
metilazione
coniugazione con glutatione
(formazione di acidi mercapturici)
• coniugazione con aminoacidi (glicina,
taurina, acido glutammico)
Le reazioni di coniugazione consistono nella
combinazione di sostanze non fisiologiche o
xenobiotiche con gruppi polari per formare un
coniugato inattivo più facilmente eliminabile dal rene.
Le principali reazioni di questo tipo sono:
1-fenoli, alcooli, acidi carbossilici, amine e tioli con acido glucuronico
con formazione di glucuronidi
2-la coniugazione di fenoli, alcooli, amine con
solfati per dare origine a formazione di solfati
assai solubili in acqua
PAPS: fosfoadenosina-5’-fosfosolfato
PAP: fosfoadenosina-5’-fosfato
APS:adenosina-5’-fosfosolfato
3) l’acetilazione di amino composti catalizzata
dall’acetiltransferasi;
4) la metilazione di alcuni fenoli, catecolamine e
di acido nicotinico a spese della metionina;
5) l’attacco di glicina ad acidi aromatici quali
l'acido benzoico o l'acido salicilico con formazione
di un’amide sostituita
6) l’attacco di glutatione a composti alogenati e
a nitrocomposti come il 2-4 dinitro-1-clorobenzene per
formare un coniugato attraverso il legame con l’atomo
di zolfo del residuo di cisteina
Glutathione è un
tripeptide formato da
glutamateo, cisteina, e
glicina
Reazione del glutatione con un elettrofilo
Alcuni parametri utili per testare la funzionalità epatica
AST ( o GOT): aspartico amino trasnferasi
ALT (o GPT): alanina amino transferasi:
AST è libero nella frazione mitocondriale; ALT è libero nel
citosol degli epatociti.Solo AST si trova anche nel cuore,
Muscolo scheletrico, rene…ALT è abbondante nel fegato
(specifico:utile nelle apatopatie)
ALP:fosfatasi alcalina
Presente in molti organi. I levelli aumentano nelle epatopatie
PT: tempo di protrombina
Importante per valutare il la funzionalità epatica (produzione
Dei fattori II, VII, IX, X da parte del fegato)
GGT: gamma-glutamil-transferasi
Glicoproteina legata alla mebrana plasmatica. Il suo livello
Aumenta negli alcolisti per elevata produzione da parte
delfegato
DANNO EPATO CELLULARE
ACUTO
CRONICO
Albumina
normale o diminuita
normale o fortemente diminuita
Bilirubina
normale o fortemente aumentata normale o aumentata
Transaminasi fortemente aumentata
aumentata
ALP
normale
normale
GGT
leggermente aumentata
leggermente aumentata
Ig
leggermente aumentata
normale
PT
normale
leggermente aumentata
COLESTASI
normale
aumentata
leggermente aumentata
fortemente aumentata
fortemente aumentata
normale
leggermente aumentata
Tessuto adiposo
Il tessuto adiposo: un deposito di materiale energetico
In un individuo di 70 kg la quantità di grasso accumulata è di
circa 15kg (21% del peso), in gran parte sotto forma di Trigliceridi
Distinguiamo:
tessuto adiposo bianco
tessuto adiposo bruno
Differenze
Funzione
Risp. Freddo
Distribuzione
Vascolarizzazione
Gocce lipidiche
Mitocondri
Meta. Ac. Grassi
UCP
T.A. bianco
riserve energetiche
lieve
estesa
scarsa
uniloculari
scarsi
rilasci acidi grassi
assente
T.A. bruno
termogenesi
intensa
limitata
estesa
multiloculari
numerosi
oss. in situ
presente
Adipociti umani
Composizione biochimica dell’adipocita
Oltre ai lipidi, il t.a. contiene 10% di acqua, 2% collagene, o.1% di glicogeno
Gli acidi grassi utilizzati per la sintesi dei Trigliceridi provengono dai
chilomicroni (intestino) e dalle VLDL (fegato)
L’idrolisi dei Tg avviene ad opera di una Lipoproteina Lipasi (fatt. chiarificante)
L’attività della lipoproteina lipasi dipende dallo stato nutrizionale e metabolico
dell’organismo e, in particolare, dall’azione ormonale di glucagone e insulina
Condizioni post-prandiali: attività LPL aumenta (azione dell’insulina)
Condizioni di digiuno: attività LPL diminuisce (azione glucagone)
Km LPL del tessuto adiposo è 10 volte> Km tessuto cardiaco
Punti chiave:
La produzione di gliceloro 3-fosfato controlla l’esterificazione
La lipolisi è controllata dalla lipasi ormono-sensibile
L’aumento del metabolismo del glucosio diminuisce il rilascio di acidi grassi liberi
Metabolismo del tessuto adiposo
Glucosio-6-P
Tessuto adiposo (non ha
la glicerolo chinasi)
Acetil-CoA
β-ox
lipogenesi
Ciclo pentosi
Glicerolo-3-P
Acil.CoA
esterificazione
Ciclo continuo
Idrolisiesterificazione
FFA
(Pool2)
Lipasi ormono-sensibile
TG
glicerolo
FFA (Pool1)
esterificazione<lipolisi
+
LPL
FFA
glucosio
+
insulina
glicerolo
TG
Chilomicroni, VLDL
plasma
Fegato, reni
Regolazione della lipolisi
5’AMP
insulina
+
-
fosfodiesterasi
Caffeina
teofillina
Lipasi
ormono-sensibile
(inattiva)
Proteina
Chinasi
cAMP-dip
cAMP
Adenilato ciclasi
+
ATP
insulina
-
-
Glucagone
Adrenalina, ACTH,
TSH
fosfatasi
P
Lipasi
ormono-sensibile
(attiva)
TG
insulina
+
DG
+ FFA
DG lipasi
MG + FFA
MG lipasi
FFA + glicerolo
• Il tessuto adiposo bruno promuove la
termogenesi, quando è richiesta pa produzione
di calore
• Molto attivo in alcune specie durante il risveglio
dal letargo, animali esposti al freddo, nei neonati
• Molto probabilmente reposnabile della
termogenesi indotta dalla dieta
• Ridotta negli obesi
• Disaccoppiamento dell’ossidazione e della
fosforilazione ossidativa
• Importante la proteina UCP (uncoupling protein;
termogenina)
• L’ossidazione produce essenzialmente calore
Cervello
• I neuroni utilizzano solo glucosio come nutriente
• Dipende in gran parte dal glucosio che arriva col
sangue
• Metabolismo respiratorio molto attivo
• Non utilizzano direttamente acidi grassi come
nutrienti
• Utilizza corpi chetonici nel digiuno prolungato
• Utilizza la maggior parte della sua energia sotto
forma di ATP per il trasporto attivo di ioni Na e K
al fine di mantenere il potenziale elettrico delle
membrane neuronali
Fonti energetiche nel cervello in base
allo stato nutrizionale
Soggetto a riposo
Soggetto sveglio da 48h
Metabolismo del glucosio nel cervello
Sangue
• Trasporta metaboliti, ossigeno, ormoni
• Metà del volume è occupato da
– Eritrociti
– Leucociti
– Piastrine
La concentrazione del glucosio nel sangue
è sottoposta a stretto controllo
• Sistemi ormonali di controllo
Effetti della bassa concentrazione del sangue
REGOLAZIONE
ORMONALE DEL
METABOLISMO
ENERGETICO
M aturazione di insulina
+ peptide C
I nsulina
• Cellule β delle isole di Langerhans
• Polipeptide con 2 catene legate da ponti S-S
• Fortemente conservata (si può usare sull’uomo insulina
bovina e suina)
Ribosomi
Pre-pro-insulina
Pro-insulina
Pro-insulina
Reticolo
endoplasmico
Insulina + C
Insulina + C
Apparato di Golgi
Circolazione
Secrezione norm ale di insulina
•
•
•
•
Semivita plasmatica di insulina: 3-5 minuti
Semivita plasmatica di pro-insulina: molto maggi ore
Pro-insulina dà reazioni crociate con insulina
Livello di peptide C discrimina insulina eso- ed endogena
Ribosomi
Pre-pro-insulina
Pro-insulina
Pro-insulina
5%
Reticolo
endoplasmico
Insulina + C
Insulina + C
95%
Apparato di Golgi
Circolazione
Risposta delle cellule β alle modificazioni di concentrazione di glucosio
Granuli di insulina
Glucosio: ALTA
Glucosio: BASSA
K+
Canali K
ATP-dip.
G-6-P
K+
+
ATP
ADP
depolarizzazione
ATP
ADP
Ca
++
++
+
Ca++
polarizzazione
70mV
Canale Ca
Meccanismo di secrezione dell’insulina dalle cellule β del pancreas
K+
depolarizzazione
Ca++
diazossido
sulfonilurea
+
Somatostatina
Ca antagonisti
KIR
SUR
K
++
Ca
+
GK
glucosio
ATP/ADP
G-6-P
Ins
+
NADP
Glu
NADPH
αKG + NH4 +
GDH
Insulina
+
leucina
GK: sensore del glucosio
Ins.
Ins.
Membrana cellulare
Y
Y
PY
YP autofosforilazione
IRS: Insulin Receptor Substrate
Segnali intracellulari
-metabolici
-DNA (trascrizione. Proliferazione…..)
Effetti cellulari
Effetti metabolici
PDE3b=fosfodiesterasi 3b
PI3K=fosfoinositolo 3 chinasi
PP1=proteina fosfatasi
GSK3= glicerolo sintasi chinas
i
glucosio
glucosio
Glicogeno sint.
+
glicogeno
glicolisi
piruvato
+
c. Acetil CoA
krebs
+
Glicogeno sint.
Glicerolo-3.P
+
+
TG
+
Ac.grassi
c. Acetil CoA
krebs
lipogenesi
+
+
Lipopr.
lipasi
lipogenesi
+
Acidi grassi
TG
MUSCOLO
+
piruvato
lipogenesi
c. Acetil CoA
krebs
+
Sint.prot.
glicerolo
Glut 4
K+
glicolisi
piruvato
Sint.prot.
FEGATO
+
glicogeno
glucosio
K+
+
VLDL
glicerolo
aa.
aa.
Glut 4
Glut 2
+
TESSUTO ADIPOSO
Acidi
grassi
TG
Effetti metabolici
dell’insulina
Effetti metabolici
del Glucagone
glucosio
Sintesi glicogeno
glicogeno
glicogenolisi
+
-
glicerolo
gluconeogenesi
glicolisi
alanina
+
lattato
piruvato
c.
krebs
Acetil CoA
chetogenesi
Ossidaz.
+
lipogenesi
+
Corpi chetonici
Acidi grassi
Glucagone
adrenalina
P
Inibitore-1
cAMP
Inibitore-1-P
Fosforilasi
Chinasi b
Glicogeno
Sintetasi b
Inibizione
delle
fosfatasi
P
P
P
Proteina
Chinasi
cAMP dip.
Proteina
fosfatasi
Proteina
fosfatasi
Fosforilasi
Chinasi a
Glicogeno
Sintetasi a
P
glicogeno
UDP-glc
Ciclo
del
glicogeno
Fosforilasi
a
Fosforilasi
b
P
P
Glucosio-1-P
Controllo della glicogenolisi e glicogenosintesi
Proteina
fosfatasi
Glucagone
recettore
Regolazione da parte
del fruttosio-2,6-difosfato
Proteine G
Adenilato c.
ATP
cAMP
Attivazione della proteina chinasi A
Fosforilazione del complesso fosfofruttochinasi-2/
Fruttosio-2,6difosfatasi
Attivazione della fruttosio-2,6dPasi
inattivazione della PFK-2
Diminuzione di F-2,6.dP
Attivazione della
F-1,6 dPasi
Aumento della gluconeogenesi
Inibizione PFK-1
Diminuzione della glicolisi
Inibita dalla
fosforilazione
cAMP dipend.
epatocita
c.K
citrato
citrato
Attivata dalla
Acetil-CoA
defosfor.
insul. dip.
Acetil-CoA
carbossilasi
c.chet.
Acetil.CoA
Malonil.CoA
palimitato
Corpi
chetonici
Acil-CoA
stearato
oleato
Acil-CoA
Acido grasso
TG
VLDL
Lipoproteina
lipasi
Acidi grassi
liberi
Lipasi
Or. sen
Attivata dalla fosforilazione
cAMP-dipendente
TG
adipocita