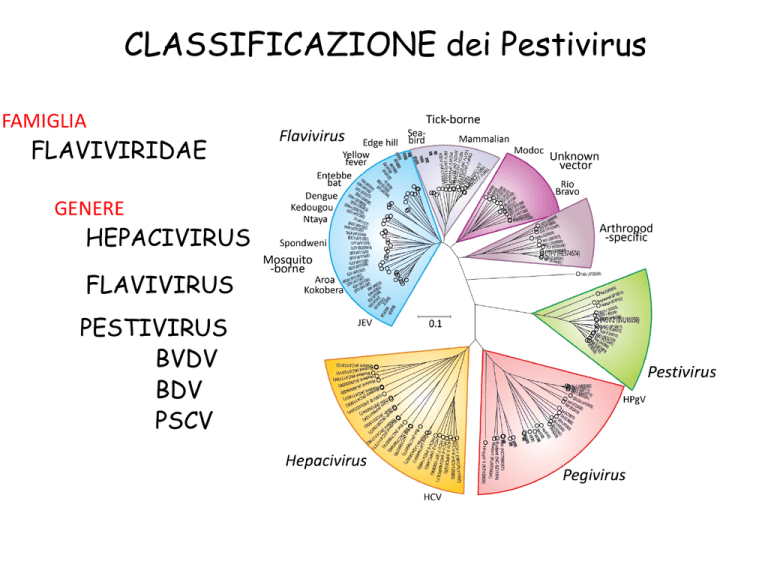
CLASSIFICAZIONE dei Pestivirus
FAMIGLIA
FLAVIVIRIDAE
GENERE
HEPACIVIRUS
FLAVIVIRUS
PESTIVIRUS
BVDV
BDV
PSCV
I pestivirus
• Virus RNA di piccole dimensioni (40-60 nm) provvisto di involucro
esterno (envelope) e appartenente alla famiglia Flaviviridae, genere
Pestivirus. Costituito da una sola molecola di RNA monocatenario
• Ha 4 proteine strutturali
• glicoproteina dell’envelope gp53
• glicoproteina dell’envelope gp48
• glicoproteina dell’envelope gp25
• proteina del nucleocapside p14
• 9 proteine non strutturali
E1-E2 dimer
Erns protein
Capsid protein
Genomic RNA
•NPRO = autoproteinasi
•C = proteina principale del nucleocapside
•Erns/E1/E2 = glicoproteine
•Restanti proteine = componenti
enzimatici o strutturali
•NS3 = proteina legante l’RNA
•NS5B = RNA polimerasi RNA
dipendente
Genere Pestivirus:
COMPRENDE TRE VIRUS ANTIGENICAMENTE
CORRELATI FRA LORO:
• PSCV
• BVDV
• BDV
• NON OSPITE SPECIFICI
CLASSIFICAZIONE DEI PESTIVIRUS
•
LA PRIMA CLASSIFICAZIONE DEI PESTIVIRUS SI BASAVA
SULLA SPECIE OSPITE
•
LA SCOPERTA CHE NON SONO OSPITE SPECIFICI FA SI CHE PER
LA CLASSIFICAZIONE SI UTILIZZINO METODI CHE
EVIDENZIANO LE LORO CARATTERISTICHE ANTIGENICHE E
GENETICHE E PATON ET AL .(1995) LI CLASSIFICANO IN 4
GRUPPI UTILIZZANDO MAbs (76)
•
I° GRUPPO PESTIVIRUS SUINI – PSC
•
II° GRUPPO BVDV BOVINI E ISOLATI DA SUINI E OVINI
•
III° GRUPPO ISOLATI DI BDV E ISOLATI DA SUINI
CLUSTER DI CEPPI FRA BVDV E BDV
IV° VIRUS ATIPICI ISOLATI DA BOVINI, OVINI E SUINI
•
CLASSIFICAZIONE DEI PESTIVIRUS
•
Gli ultimi lavori propongono una classificazione in 9 specie sulla base della
similarità genetica utilizzando varie porzioni del genoma quali la 5’utr, la E2
e la Npro
•
Specie 1 include ceppi per lo più di origine bovina (BVDV1);
•
Specie 2 comprende il virus della peste suina classica (PSCV);
•
Specie 3 include isolati da ovini e suini con caratteristiche di “veri” virus
border disease (BDV);
•
Specie 4 comprende isolati sia bovini che ovini (BVDV2 )
•
5 nuove specie comprendenti isolati da:
antilope pronghorn
Giraffa
bufalo brasiliano e siero fetale bovino (BVDV3)
Bungowannah (Australia)
Tunisian sheep virus (TSH - isolati Tunisia)
Peste suina classica
• Peste Suina Classica (PSC), malattia inserita nel listone O.I.E., ha
notevolissima importanza economica soprattutto nei paesi in cui la
suinicultura rappresenta una parte consistente della loro
zooeconomia.
• Secondo l’OIE e la letteratura scientifica, tutti i continenti sono o
sono stati interessati dalla presenza della malattia ad eccezione
dell’Oceania.
• Negli Stati membri dell’UE ad elevata produzione suinicola i danni
economici prodotti dalla PSC nel precedente decennio, assommano
ad oltre 6 milioni di Euro. I Paesi maggiormente colpiti sono stati
l’Olanda, la Germania, la Spagna, il Belgio e l’Italia. In Olanda si sono
registrate perdite per circa 2 milioni di Euro.
• I danni provocati dalla malattia sono relativi all’abbattimento di
suini per motivi di profilassi sanitaria o per misure di prevenzione e
a fattori di mancata produzione zootecnica.
• L'esigenza di combattere quanto più efficacemente possibile la
malattia, ha portato ad includere nella normativa allestita dalla
Unione Europea, anche misure di controllo nel caso in cui l'infezione
si propagasse alle popolazioni di suidi selvatici rappresentate dai
cinghiali.
DISTRIBUZIONE DELLA PSC NEL MONDO
GENNAIO – GIUGNO 2016
Maggio 2016: Italia ufficialmente indenne da peste
suina classica (PSC)
• L’Organizzazione Mondiale per la Salute Animale (OIE) ha
riconosciuto all’Italia lo stato sanitario di Paese indenne per la
Peste Suina Classica (PSC). La risoluzione è stata votata a Parigi
dai 180 Capi Servizi Veterinari nel corso della 84° Assemblea
Generale dell’OIE, Parigi 22-27 maggio 2016.
• Un traguardo importante per la tutela della salute e del
benessere del patrimonio zootecnico nazionale, frutto
dell’impegno per il controllo e l’eradicazione della malattia da
parte della veterinaria pubblica italiana e, al tempo stesso,
un’opportunità in più per le imprese nazionali impegnate
nell’export di prodotti alimentari di origine suina.
Resistenza
• Molto stabile nell'ambiente (si sono avuti un elevato numero di
focolai a modalità di trasmissione indiretta dell'infezione).
• Gli enzimi proteolitici, al contrario di quanto avviene per altri virus
privi di envelope (ad esempio l'afta), hanno nei suoi confronti solo
un moderato effetto inattivante
• Sensibile ai solventi lipidici ed ai tensioattivi, è stabile a valori di
pH tra 5 e 10, è rapidamente inattivato a pH 3.
• E' relativamente stabile al calore, a 37°C può resistere 18 giorni in
presenza di siero. A 4°C nella carne può resistere fino a 33 giorni;
a -20°C fino a 9 mesi.
• In condizioni di essiccamento può resistere nelle secrezioni oculari
fino a 15 giorni, nel sangue 20 giorni, nelle feci ed urine 6 giorni.
• Indagini sperimentali hanno consentito di rinvenire virus attivo nei
prosciutti fino a 188 giorni di stagionatura, nella carne affumicata
fino a 90 giorni e nei salumi fino a 60 giorni.
Caratteristiche della PSC
• Malattia altamente contagiosa, in condizioni naturali infetta suino
domestico e selvatico e il cinghiale.
• E’ caratterizzata da forme acute, croniche e atipiche (prenatale).
• L'evoluzione della PSC è condizionata essenzialmente da tre fattori:
– il grado di patogenicità del virus in causa,
– le condizioni immunologiche del soggetto colpito,
– il periodo pre o post-natale di contrazione dell'infezione.
• Le forme croniche sono sostenute da stipiti a bassa virulenza, possono
passare inosservate negli animali adulti ma provocano gravi danni a
carico dei feti e dei giovani suini.
• Le forme atipiche sono difficili da riconoscere, possono essere
facilmente confuse con infezioni sostenute da altri virus (Parvovirus
suino, PRRS, SMEDI, malattia di Aujeskzy).
• L'infezione si trasmette per contatto diretto ed indiretto. I suini
infetti eliminano virus attraverso tutti i loro secreti ed escreti. La più
importante sorgente di virus è rappresentata dall'animale infetto in
forma acuta, cronica o persistente.
• I suini normalmente si infettano per via oro-nasale.
Modalità di diffusione
•
•
•
•
•
La modalità più frequente di diffusione della PSC è rappresentata da suini
provenienti da allevamenti infetti e l'impiego di mezzi di trasporto
contaminati
Un ruolo importante per la diffusione del virus viene svolto dalle scrofe
gravide infette con stipiti a bassa patogenicità
L'introduzione di stipiti a bassa patogenicità negli allevamenti può
rimanere inosservata per settimane o mesi ed il numero di animali infetti
può risultare anche modesto.
I cinghiali rivestono un ruolo importante come sorgente di virus, a motivo
della elevata diffusione della carne e dei prodotti derivati sul mercato
nazionale ed estero. In alcuni paesi dell'UE, la presenza della PSC nei
cinghiali costituisce un pesante ostacolo alla eradicazione della malattia.
La possibilità di ricorrere ad un'analisi comparativa del genoma degli
stipiti del virus della PSC responsabili di diversi episodi di malattia,
consente di stabilire eventuali correlazioni epidemiologiche tra focolai
insorti in diverse regioni o Paesi.
Ospiti naturali della
malattia sono il suino
domestico e selvatico e
il cinghiale
In condizioni
sperimentali anche il
coniglio
Sintomatologia della PSC
Il periodo di incubazione va da 3 a 14 giorni;
FORMA ACUTA: febbre elevata che persiste a lungo, depressione
ed anoressia. I soggetti ammalati tendono ad aggrupparsi. Possono
presentare congiuntivite, scolo nasale, costipazione seguita da
diarrea, vomito e cianosi
Sintomo costante è rappresentato da atassia e successivamente
paresi del treno posteriore; il decorso clinico va in genere dai 6 ai 16
giorni e la mortalità raggiunge il 90-100%.
FORMA SUBACUTA:
i sintomi diminuiscono di
intensità e gli animali in
genere, vengono a morte
dopo 3-4 settimane.
Il tasso di mortalità è
molto variabile.
PSC: decorso acuto
I poco vitali possono
sopravvivere fino a 5-6 mesi e
mostrano viremia persistente.
Talvolta, in queste forme di
infezione, l'unica manifestazione
apprezzabile è un evidente
ritardo nella crescita .
Nelle forme di infezione
intrauterina, che si verificano
nell'ultimo mese di gravidanza, con
stipiti a bassa patogenicità, possiamo
avere la nascita di suinetti nati sani,
di altri poco vitali o affetti da
tremori. in caso di morte precoce in
utero, i feti vanno incontro a
mummificazione. I suinetti nati morti
presentano spesso edemi, deformità
della testa, ascite, emorragie a carico
di vari organi e necrosi epatica.
PSC: esiti dell'infezione prenatale
Reazione anticorpale a seguito di infezione "in utero“
PSC: Decorso cronico
SOSPETTO DI FOCOLAIO
QUADRO CLINICO ED ANATOMO-PATOLOGICO
•
•
•
•
•
•
•
•
•
Febbre con incremento di morbilità e mortalità
Febbre con sindrome emorragica
Febbre con sintomatologia nervosa
Febbre di origine ignota con resistenza ai trattamenti
terapeutici
Aborti e problemi di fertilità negli ultimi 3 mesi
Tremore congenito nei suinetti
Presenza di soggetti sottopeso ("scarti")
Petecchie ed emorragie ai linfonodi, reni, milza (infarti),
vescica e laringe
Bottoni ulcerosi nell'ileo in corrispondenza della valvola ileocecale.
Emorragie a "carta geografica"
Lesioni vaiolo- like
Emorragie nelle tonsille linfonodi sottomandibolari e polmone
Emorragie ai linfonodi meseraici ed al rene, milza , bottoni pestosi a livello della valvola
ileo cecale (forma cronica)
La PSC è inclusa tra le malattie
dell'O.I.E. che in grado di generare
gravi emergenze sanitarie.
Ad ogni caso sospetto di malattia
devono seguire
•una approfondita indagine
epidemiologica, ed
•accertamenti di laboratorio per
escludere o confermare la presenza del
virus PSC sia nelle popolazioni di suini
domestici che selvatici.
La denuncia di focolaio di PSC comporta
l'applicazione di precise misure di
polizia veterinaria previste da
regolamenti specifici emanati sia a
livello comunitario che nazionale.
Direttiva 2001/89/CE del 23/10/2001
recepita con il
Decreto 55 del 20/02/2004
Controllo della PSC
Esistono essenzialmente due strategie per combattere la PSC:
•la vaccinazione di massa,
•l'eradicazione senza alcun intervento vaccinale.
L'impiego di vaccini convenzionali impedisce la differenziazione tra
animali vaccinati e soggetti infetti con virus di campo. Inoltre il virus di
campo può diffondersi in modo inapparente all'interno delle popolazioni
suine.
Per tali ragioni e alla luce delle restrizioni sanitarie imposte dalla
globalizzazione del commercio di animali e prodotti derivati, l'UE ha
fatto divieto di ricorrere alla vaccinazione per combattere la PSC fin
dagli anni '80.
Permessa la vaccinazione con vaccini deleti in caso di focolai in zone ad
alta vocazione suinicola.
Gli animali vaccinati con il deleto possono distinguersi dagli altri grazie
all’utilizzo di test DIVA
Nell'UE le misure di eradicazione si basano su:
•Stamping out degli allevamenti infetti e, possibilmente,
di quelli vicini o che hanno avuto contatti sospetti con
l'allevamento sede di focolaio;
•Accurate indagini epidemiologiche;
•Indagini cliniche e di laboratorio;
•Restrizioni di movimentazione per animali vivi, carni o
altri materiali in grado di trasmettere il virus della PSC
nelle aree dove è presente la malattia
•Restrizioni per quelle aziende che si trovino al di fuori
di queste aree ma che hanno avuto contatti a rischio con
gli allevamenti infetti.
La PSC si combatte attraverso:
•L’ eliminazione dell'agente causale dal territorio
(eradicazione)
•La protezione della popolazione suina da eventuali
reintroduzioni (prevenzione)
•Accreditamento degli allevamenti e dei servizi deputati al
controllo di questi (servizi veterinari e laboratori)
• I piani di monitoraggio: unico strumento per la verifica dello
stato immunitario delle popolazioni suine e dei cinghiali.
Tali piani sono particolarmente importanti per il cinghiale
poiché i selvatici non sono sottoposti a frequenti controlli a
differenza di quanto accade per il suino domestico
PSC: Diagnosi di laboratorio
• Le prove eseguite in laboratorio per la diagnosi diretta
consentono, di evidenziare gli antigeni virali negli organi e nei
tessuti – mediante prove di immunofluorescenza diretta (IFD),
PCR - o l'agente virale attraverso isolamento su colture cellulari
• Nel caso di infezioni croniche o atipiche, le prove sopradescritte
potrebbero risultare difficoltose.
• In tali circostanze e qualora la popolazione suina non fosse
sottoposta a vaccinazione, la ricerca di anticorpi dal siero può
costituire un valido ausilio diagnostico.
• Tale ricerca viene correntemente effettuata con il metodo
immunoenzimatico (ELISA) e confermata attraverso la
sieroneutralizzazione (SN), che permette la differenziazione
degli anticorpi nei confronti del virus della PSC da quelli verso gli
altri pestivirus dei ruminanti.
PSC: Diagnosi di laboratorio
Suini
Organi
Sangue Edta / Siero
Prodotti
Prove da effettuare
con tutti i materiali
IFD
Elisa Ac
SN
Altri Pestivirus
PCR
• Nella nostra territorio si verificano annualmente casi di
mortalità neonatale, natimortalità e/o nascita di agnelli
poco vitali ad eziologia sconosciuta con conseguenti perdite
economiche elevate.
• Il virus Border Disease, è responsabile di una sindrome
congenita degli ovini e dei caprini caratterizzata da aborti
e nascita di agnelli con anomalie del vello, disturbi nervosi
di varia entità, ipomielinogenesi, malformazioni
scheletriche e scarsa vitalità. L’elevato indice di mortalità
degli agnelli nelle prime settimane di vita, le perdite dovute
ad aborti e infertilità nonché lo scarso sviluppo dei nati vivi
giustificano l’importanza della malattia.
• La possibilità che la border disease possa essere tra gli
agenti eziologici interessati e non investigati per mancanza
di una diagnosi appropriata, ci ha spinto a ricercare i
pestivirus come responsabili di aborti negli ovi caprini
Attività di ricerca su Pestivirus presso IZS
1 – Miglioramento diagnosi sierologica:
comparazione fra kit diagnostici del
commercio. I risultati sono stati confrontati
con la sieroneutralizzazione, test gold
standard
2 – Isolamento su colture cellulari
3 – Tipizzazione dei ceppi circolanti ed analisi
filogenetica
BVDV
BDV
Elisa IZS
Brescia
Pestivirus
Positivo
3
3
33
1
3
1
Negativo
94
94
64
96
94
96
Totale
97
97
97
97
97
97
Specificità
100%
98%
68%
Sensibilità
100%
100%
100%
Risultati
Elisa Pourquier
Elisa PSC
Idexx
SN BVD
SN BD
La sensibilità e la specificità dei kit è stata calcolata assumendo la SN come gold
standard.
Per stabilire se vi fosse reattività crociata contro il virus PSC, è stata eseguita
la elisa PSC, al posto della SN, a causa della insufficiente quantità di siero.
La positività in SN è stata attribuita al virus a titolo superiore
Un solo siero è risultato positivo all’elisa PSC ma anche alla SNBVD e SNBD con
titolo 1/10 (risultati non conclusivi)
Nessuno dei kit testati è in grado di distinguere fra BDV e BVDV, ma il risultato
non sorprende perché spesso anche in sieroneutralizzazione non si ottengono
risultati conclusivi.
Isolamento su colture cellulari
• Si attua su cc di MDBK (linea cellulare di rene bovino) e su
cc primarie
• E’ processo lungo, almeno tre passaggi ciechi prima di
dichiarare un campione negativo
• Difficile lettura perché del BVDV e BD esistono ceppi
citopatogeni e non citopatogeni che vengono evidenziati
solo con IFD
• Complicata dalla presenza in commercio di sieri fetali
bovini utilizzati per la crescita celle colture, contaminati
da BVDV, nonostante fossero certificati BVDV free.
• Oggi il SFB viene sottoposto RT-PCR che escludano anche
la sola presenza dell’acido nucleico del BVDV
• Dal siero SFVB contaminato sono stati isolati nuovi stipiti
di bvdv tipo3
Tipizzazione dei ceppi circolanti tramite sequenziamento
regione 5’UTR
Organizzazione genomica dei Pestivirus: regione 5’UTR target della PCR
Analisi filogenetica
• Permette di classificare i virus (organismi in
generale) e di effettuare analisi di
epidemiologia molecolare e collegare stipiti
virali da specie o aree geografiche diverse.
• L’utilizzo di software specifici permette
l’allineamento delle sequenze e la costruzione
di alberi filogenetici mediante diversi modelli
matematici.
Classificazione dei pestivirus
Liu et al., 2009 – Bauermann et al., 2013
BVDV1: 11 gruppi 1a-1k
4 specie
BVDV2: 4 gruppi 2a-2d
PSC
BDV: almeni 6 gruppi
5 nuove specie proposte
- Bovino e bufalo (Brasile, Asia, Italia) e siero
fetale bovino (BVDV3 o HoBi like virus o atypical
pestivurus)
- Antilope pronghorn (USA)
- Giraffa (md like disease Kenia)
- Bungowannah (pig, Australia)
- Tunisian sheep virus (TSH - isolati Tunisia)
Caratteristiche e distribuzione
geografica dei ceppi sardi analizzati
Strains/year
Municipalities
Species
Genotype
58731/2005
Mores SS
Sheep
BVDV 1k
59460/2005
V. Monteleone SS
Sheep
BVDV 1k
69263/2005
Padria SS
Sheep
BVDV 1c
73088/2005
5287/2006
Sedini SS
V.Monteleone SS
Goat
Sheep
BVDV 1b
BVDV 1b
10541/2006
Palmadula SS
Sheep
BVDV 1b
71140/2006
Laconi OR
Sheep
BVDV 1k
14799/2006
Bonorva SS
Sheep
BVDV 1b
68040/2007
Chiaramonti SS
Sheep
BDV 7
68187/2008
Villaspeciosa CA
Sheep
BVDV 1b
66829/2008
Villaspeciosa CA
Sheep
BDV 7
49680/2009
Ittiri SS
Sheep
BVDV 1e
24129/2009
Villaspeciosa CA
Sheep
BVDV 1b
5085/2009
Ozieri SS
Sheep
BDV 7
41564/2011
Riola Sardo OR
Sheep
BDV 7
94863/2013
Trinità d’Agultu OT
Sheep
BDV7
11748/2014
Martis SS
Sheep
BVDV1b
49712/2014
Perfugas SS
Sheep
BDV7
Albero
filogenetico
dei ceppi
sardi
1e
BVDV1
1c
1k
1b
96
83
100
85
BVDV3
99
100
90
99
BVDV2
93
BDV1
99
95
95
100
100
CSFV
98
100
BDV6
0.05
BDV3
BDV2
TO/121/04
LA/91/05
BDV5
BDV4
Turkey
BDV7
Tunisian
Distribuzione isolati per specie e gruppo
Specie
BVDV
BDV
Ovino
6 - 1b
1 – 1c
1 - 1e
3 - 1k
6
Caprino
1 -1b
Totale
12
Tutti gli isolati sardi appartengono
a due genotipi: BVDV1 and BDV;
non sono stati trovati nè il BVDV2
nè PSC .
L’isolato da capra è un BVDV1 -1b,
6 pecore BDV;
11 pecore BVDV1, suddivise nei
sottogruppi 1a, 1b, 1e, 1k.
6
Tutti gli isolati BDV sono stati
classificati nel nuovo cluster of
BDV (putative BDV-7, Giammarioli
et al.)
I nostri dati mostrano che nell'isola si sono diffusi diversi sottotipi
di BVDV1: 1a, 1b, 1e, 1k (primo rapporto in Italia).
È interessante notare che tutti e 6 BDV isolati clusterizzano nello
stesso gruppo classificato come un nuovo gruppo BDV7.
Altra cosa interessante è che fino al 2009 circolava prevalentemente
BVDV1, dal 2009 in poi BDV7.
Questo genotipo è stato isolato in diverse province della Sardegna,
da allevamenti senza alcun collegamento epidemiologico.
Non sono stati rilevati altri genotipi BDV, anche se BDV1, 3, 5 e 7
sono stati riportati in Italia (in ottobre è stato segnalato un putativo
BDV8).
Il genotipo BD7 è stato precedentemente rilevato solo in Italia,
cinque ceppi sono stati isolati finora, nel corso degli anni 2002-2005,
nelle regioni Toscana e Lazio.
La presenza in questo gruppo di un isolato caprino (712/02), indica
che esso non è peculiare degli ovini .
L'elevato numero di BVDV trovato nei campioni di pecore suggerisce
che BVDV potrebbe essere la principale causa di infezione da
Pestivirus negli ovini.
Ringraziamenti
Si ringrazia tutto il personale dei laboratori di
Malattie Esotiche e Virologia
in particolare:
Dott.ssa Silvia Dei Giudici
Dr. Sandro Rolesu
Dr.ssa Paola Madrau
Sulas Antonella
Zinellu Susanna
Dr.ssa Angela M.Rocchigiani
Anna Pina Murtino












