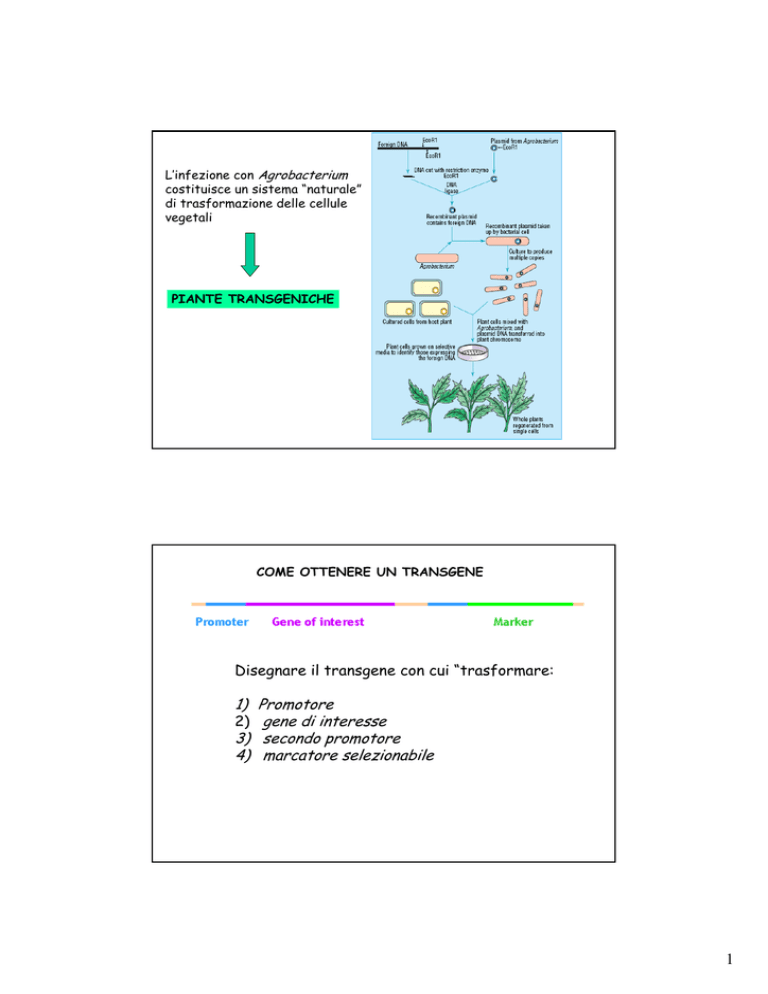
L’infezione con Agrobacterium
costituisce un sistema “naturale”
di trasformazione delle cellule
vegetali
PIANTE TRANSGENICHE
COME OTTENERE UN TRANSGENE
Disegnare il transgene con cui “trasformare:
1) Promotore
2) gene di interesse
3) secondo promotore
4) marcatore selezionabile
1
PROMOTORI:
1. promotori universali attivi in modo costitutivo, in tutti i tessuti
della pianta, e in tutti i tipi di piante; devono garantire livelli
elevati di espressione genica
2. promotori tessuto-specifici: esprimeranno il gene soltanto in
alcuni tessuti
3. promotori tempo-specifici: attivi soltanto in alcuni momenti del
ciclo vitale della pianta, come la fioritura, la germinazione, la
maturazione dei frutti
4. promotori regolati: saranno attivi soltanto in determinate
condizoni – quali luce, calore, mancanza di umidità, oppure in
presenza di specifici segnali biochimici
Viene costruito un vettore Ti modificato contenente il gene che si desidera
inserire nella pianta e una resistenza antibiotica, tra le regioni fiancheggianti
il T-DNA.
Questo vettore può essere replicato in E. coli ma possiede anche una origine
di replicazione di A. tumefaciens.
2
Per coniugazione questo plasmide Ti modificato può essere trasferito in un
ceppo di A. tumefaciens che contiene a sua volta un plasmide Ti ingegnerizzato
(“disarmato”), ossia privo dei geni chiave della patogenesi, ma in grado di
promuovere il trasferimento del T-DNA nelle cellule
vegetali.
Con questo ceppo, contenente un sistema binario di plasmidi si procede
all’infezione e alla integrazione del gene di interesse nella pianta
Per la rigenerazione di piante intere
da singole cellule si utilizzano
solitamente cellule estratte dalle
foglie usando un punzone a cerchi
ottenendo così dei dischi fogliari.
Questi verranno incubati per breve
tempo in terreno con A.
tumefaciens la cui infezione sarà
facilitata dai fattori rilasciati dalle
cellule al margine del disco.
I dischi verrano poi trasferiti in
terreni stimolanti lo sviluppo dei
germogli in presenza di antibiotici
come kanamicina, per selezionare le
cellule che hanno ricevuto il
plasmide, e cefotaximine per
uccidere l'Agrobacterium.
I germogli sviluppatisi verranno trasferiti in terreno stimolante la formazione di radici;
i due terreni differiscono per il rapporto delle concentrazioni di auxina e citochinine.
Uno dei maggiori vantaggi di tale tecnica è la velocità del processo: da quattro a sette
settimane per l'ottenimento della pianta a partire dal disco fogliare.
3
METODI PER IDENTIFICARE I TRASFORMANTI
1. sopravvivenza delle cellule trasformate (o di piante giovani) su
terreno selettivo
Il terreno contiene un antibiotico oppure un erbicida a seconda del marcatore
selezionabile del transgene
Soltanto le cellule trasformate avranno acquisito la resistenza all’antibiotico o
all’erbicida, le altre muoiono.
Nella foto le piantine morte sono bianche in quanto l’antibiotico usato uccide
innanzitutto i cloroplasti.
The transformed plants in this
top dish are resistant to
RoundUp herbicide (glyphosate).
The untransformed plants in
the bottom dish are not:
2. presenza di un gene reporter. secondo questa strategia il marcatore in
particolari condizioni mostra un colore blu o verde generalmente.
Il colore verde è dato dalla, Green Fluorescent Protein (GFP). Il gene
deriva da aluni tipi di meduse e codifica per una proteina che emette
una fluorescenza verde se illuminata con gli UV.
4
gene per la LUCIFERASI
Once a transgenic plant is regenerated, some tests need to be done to verify that it's
new gene is integrated and working properly.
Make sure that the plant contains the marker: grow it on selective media.
Make sure the entire transgene is integrated:
Do a PCR using primers specific to the entire transgene
Do a Southern to detect a specific piece of DNA
Make sure the plant possesses the desired trait:
Does the plant display the new phenotype?
Do a protein assay. Look to see if the proteins are present, folding properly, and
functioning properly.
Make sure the plant is viable:
Grow the plant to full maturity.
Make sure it can reproduce.
Make sure its offspring also contain the transgene.
Possible problems with transgene placement:
Transgene lands inside the coding sequence of another important gene of the plant
and disrupts its function
Positional effects: transgene lands in an unexpressed region of DNA or lands right
behind another promoter
Copy number: usually you just want a single copy of the transgene integrated, not
several
Silencing: the plant's natural defenses against viral attack might notice the
overexpression of the transgene and shut it down. It may be possible to get around
this by using a "quieter" regulated promoter in the transgene.
5
POSSIBILI IMPIEGHI
1) Miglioramento del valore agricolo, orticolo o ornamentale
- Resistenza a erbicidi, insetti, virus, funghi, batteri
- Modificare il tenore nutritivo
- Modificare la durata e l’aspetto dei fiori dopo la raccolta
2) Produzione di proteine o di metaboliti di interesse economico
- le piante come bioreattori
3) Studio dell'azione di geni durante lo sviluppo o altri processi biologici
Resistenza agli erbicidi
Può essere acquisita in vari modi:
1) Conferire alla pianta la capacità di inattivare metabolicamente
l’erbicida.
2) Sovraprodurre la proteina bersaglio sensibile all’erbicida, così da farne
rimanere abbastanza per le funzioni cellulari, nonostante l’erbicida;
1) Il bromossinile è un erbicida che agisce inibendo la fotosintesi.
La nitrilasi è un enzima isolato da Klebsiella ozaenae che inattiva il
bromossinile, è stato clonato nelle piante che diventano così
resistenti all’azione dell’erbicida.
6
Molti erbicidi agiscono attraverso l’inibizione
di un enzima o una proteina chiave della
pianta inibendone la crescita.
L’erbicida glifosato inibisce l’attività di un
enzima della biosintesi degli amminoacidi
aromatici.
E’ stato isolato da un ceppo di E. coli glifosato resistente, il gene di questo enzima
(EPSPS- 5-enolpiruvilshikimato-3-fosfato-sintasi), lo si è posto sotto il controllo di un
promotore delle sequenze di arresto della trascrizione e poliadenilazione vegetali, e lo
si è clonato nelle cellule delle piante.
Le piante così ottenute (tabacco, petunia, pomodoro, patata, cotone) producono una
quantità di EPSPS da E. coli sufficiente a sostituire l’enzima vegetale; risultano
pertanto resistenti al glifosato.
Resistenza agli insetti
Gli insetti rappresentano un grave problema per l'economia dell'agricoltura.
Si è cercato un sistema alternativo all'utilizzo degli insetticidi, costosi e
potenzialmente pericolosi per l'uomo e gli animali superiori, modificando
geneticamente le piante al fine di "difendersi" dagli insetti predatori. Ciò è
possibile attraverso almeno due modalità:
- La protossina di B. thuringiensis non permane nell’ambiente e non è
pericolosa per gli animali quindi può essere utilizzata per irrorare le piante.
Contro quegli insetti che attaccano i tessuti interni delle piante, si possono
generare piante che esprimono i geni delle tossine di B. thuringiensis.
Finora sono state prodotte diverse piante che esprimono il gene della
prototossina di B. thuringiensis (pomodoro, tabacco, patata, riso, mais, melo,
melanzana, pioppo, noce, abete, mirtillo e cotone)
- Inserimento ed espressione dei geni per inibitori di proteasi o di amilasi che
interferiscono con l'idrolisi delle proteine vegetali o dell'amido così che
l'insetto non è capace di digerire il cibo.
7
Resistenza a funghi e batteri :
Le piante infettate dai funghi sintetizzano un gruppo di proteine correlate con la
patogenesi (PR). Sono state modificate piante come il riso ed il tabacco in modo
da produrre costitutivamente alcune di queste proteine, quali ad es. la chitinasi
capace di degradare la parete dei funghi.
Per rendere le pianti resistenti all'infezione batterica è stato introdotto nelle
piante il gene per il lisozima del batteriofago T4, capace di lisare batteri sia
gram-positivi che gram-negativi. Tali piante hanno dimostrato resistenza verso
elevate concentrazione di batteri patogeni.
Resistenza ai virus :
Anche i virus sono responsabili di danni alle coltivazioni; nasce da ciò
l'esigenza di proteggere le piante ricorrendo a diverse strategie:
-Fare produrre alla pianta la proteina di rivestimento di un virus che normalmente infetta
quel genere di pianta; l'espressione di tale proteina è capace di attenuare i processi infettivi
conferendo immunità alla pianta nei confronti di una serie di virus.
- Fare sintetizzare alla pianta un RNA antisenso che impedisca la replicazione del virus
ibridandosi con l' mRNA della proteina del rivestimento del virus.
Produzione di molecole di interesse farmacologico
Le piante crescono con facilità e possono produrre una biomassa
considerevole; possono essere considerate quindi degli ottimi
“bioreattori”.
Diverse specie di patate e pomodori sono stati ingegnerizzati per
produrre varie molecole tra cui l’interferone umano.
Si sperimenta la produzione di anticorpi umani per la produzione di
vaccini “edibili” utilizzabili ad es. per immunizzare dalle malattie indotte
dai batteri enterici.
8
METODI DI INTRODUZIONE DEL DNA NELLE CELLULE VEGETALI
Trasferimento genico mediato
dal plasmide Ti
Sistema eccellente e molto efficiente, limitato
a pochi tipi di piante
Bombardamento con
microproiettili
Applicato ad un elevato numero di piante e
tessuti, facile e poco costoso
Vettori virali
Metodo poco efficace
Trasferimento del gene nei
protoplasti della pianta
Si può applicare solo ai protoplasti delle cellule
che si prestano ad essere rigenerati in piante
vitali
Microiniezione
Limitata utilità, si può iniettare una cellula per
volta, richiede elevata manualità
Elettroporazione
Limitata ai protoplasti delle cellule che si
prestano ad essere rigenerati in piante vitali
Fusione dei liposomi
Si può applicare solo ai protoplasti delle cellule
che si prestano ad essere rigenerati in piante
vitali
FORMAZIONE DEI PROTOPLASTI
Uno dei metodi utilizzati per trasformare
cellule vegetali prevede la formazione
di protoplasti a partire da cellule intatte.
Il tessuto vegetale viene escisso dalla
pianta e sottoposto a digestione
enzimatica
- Vengono isolate singole cellule ed
allontanata la parete cellulare.
Cellule così preparate possono più
facilmente assumere DNA dall’esterno.
I protoplasti vegetali possono essere
mantenuti in coltura oppure, in uno
specifico terreno di coltura, si possono
rigenerare le pareti cellulari,
rigenerando dalle cellule piante intere
9
“GENE GUN”
Macroproiettile Microproiettili
di nylon
Bersaglio
(cellula o tessuto)
Il bombardamento con microproiettili è il sistema più promettente. Si rivestono
particelle sferiche di oro o di tungsteno di diam. di circa 0,2-0,4mm, con DNA
precedentemente precipitato.
Si accelerano le particelle così rivestite “ad alta velocità” (300-600 m/sec)
utilizzando elio o aria compressa come forza propulsiva.
Ad una tale velocità i proiettili sono in grado di penetrare la parete cellulare e la
membrana delle cellule consentendo al DNA di integrarsi nel genoma della pianta.
Confronto tra Agrobacterium e “gene gun”
-Agrobacterium è efficace soltanto sulle dicotiledoni, il “gene gun”
si può utilizzare sia sulle monocotiledoni che sulle dicotiledoni
- Agrobacterium ha bisogno di 3-5 per produrre piante, il “gene gun”
prevede tempi più lunghi (circa 5-7 mesi)
- Agrobacterium consente l’inserimento nel nuleo della cellula
vegetale; con il “gene gun” il DNA si può inserire in qualunque
comparimeno contenga DNA: nucleo, mitocondri, cloroplasti
10
VANTAGGI
SVANTAGGI
Riduzione dell' uso di
pesticidi
Instabilità genetica
Arricchimento del valore
nutritivo
Selezione di insetti
resistenti
Creazione di piante con
fiori dotati di nuovi colori
Comparsa di nuove allergie
Piante come bioreattori
per la produzione
di farmaci, vaccini e
vitamine.
Trasferimento dei geni per la
resistenza a specie
infettanti
Riduzione della biodiversità
ed impatto negativo su altre
specie
Eubatteri Gram-negativi
Spirilli (Proteobatteri):
forma a spirale, mobili, isolati di alcune specie sono patogene (Campylobacter
jejuni e Helicobacter pylori)
specie magnetotattiche
Magnetospirillum magnetotatticum
specie parassite di altri batteri
Bdellovibrio bacteriovorous
11
specie parassite di altri batteri
Bdellovibrio bacteriovorous
-Attacca le cellule e penetra attraverso la parete cellulare replicandosi nello
spazio periplasmico fino a formare una struttura detta BDELLOPLASTO
-Nuove cellule di Bdellovibrio vengono rilasciate in seguito alla lisi della cellula che
lo contiene
Eubatteri Gram-negativi
Batteri prostecati (Proteobatteri):
organismi aerobici, chemiorganotrofi, acquatici, particolare morfologia con
organo di adesione (prosteca) e particolare ciclo vitale
12
Eubatteri Gram-negativi
RICKETTSIE GRAM -, di forma bastoncellare
PARASSITI INTRACELLULARI OBBLIGATI
sono batteri in grado di fare autonomamente biosintesi dei propri
componenti, mentre per l’energia si approvvigionano di ATP dalla cellula
parassitata
Mycoplasmas:
sono i più piccoli organismi a vita libera;
sono pleiomorfi;
sono filogeneticamente affini ai Gram-positivi anche se non si colorano con la
colorazione di Gram;
la membrana contiene lipoglicani che la cellula non sa sintetizzare;
crescita lenta e richieste nutrizionali complesse;
molte specie sono patogene per l’uomo (apparato respiratorio ed uro-genitale)
13












