caricato da
gianbattistabsn
Come Determinare i Numeri di Ossidazione

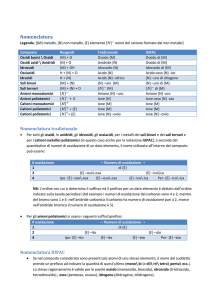
COME DETERMINARE I NUMERI DI OSSIDAZIONE Definizione Numero di ossidazione. Il numero di ossidazione o stato di ossidazione di un elemento è la carica elettrica che esso avrebbe se si assegnassero gli elettroni (di valenza) di ogni suo legame chimico all’atomo più elettronegativo della molecola (o dello ione). Il numero di ossidazione o stato di ossidazione è strettamente legato ai concetti di elettronegatività e di legame chimico. ESEMPI Consideriamo una molecola qualsiasi: l’acqua (H2O). In questa molecola gli idrogeni formano due legami con un atomo di ossigeno. Non abbiamo bisogno di ulteriori specifiche sul tipo di legame. Consultando la tavola periodica appprendiamo una serie di preziosissime informazioni: a) l’ossigeno è più elettronegativo dell’idrogeno; b) l’idrogeno ha 1 elettrone nell’orbitale più esterno il quale è il suo unico elettrone di valenza (vai al Capitolo sulla tavola periodica ); c) l’ossigeno ha sei elettroni esterni di cui 2 sono di valenza (vai al Capitolo sulla configurazione elettronica). Quali saranno le ‘cariche elettriche’ degli atomi nella molecola d’acqua? i) l’idrogeno ha “ceduto” il suo unico elettrone di valenza all’ossigeno perché è più elettronegativo. Assume una carica positiva pari a +1 . Visto che gli idrogeni sono due, allora la carica totale dell’elemento idrogeno è pari a +2; ii) l’ossigeno ha “acquistato” un totale di 2 elettroni. Assume una carica negativa pari a -2. La somma delle cariche, chiamate numeri di ossidazione o stati di ossidazione, idrogeno (+2) e ossigeno (-2) restituisce il valore 0. La somma dei numeri di ossidazione degli elementi, moltiplicati per i rispettivi pedici, in una molecola neutra è zero. 1. Consideriamo la seguente molecola: H2SO4. La tavola periodica degli elementi ci fa sapere che: a) l’ossigeno è l’elemento più elettronegativo; b) l’idrogeno ha 1 elettrone di valenza; c) l’ossigeno ha 2 elettroni di valenza; d) lo zolfo ha 6 elettroni di valenza. Nella molecola di acido solforico, allora: i) l’idrogeno ha “ceduto” all’ossigeno il suo unico elettrone di valenza e assume una carica positiva +1. Visto che gli idrogeni sono due, allora la carica totale dell’elemento idrogeno è pari a +2; ii) lo zolfo ha “ceduto” all’ossigeno sei elettroni di valenza. Assume carica positiva +6; iii) l’ossigeno ha “acquistato” un totale di otto elettroni. Assume una carica totale negativa pari a 8, che equivale ad una carica negativa di -2 per ciascuno dei quattro atomi presenti nell’acido solforico. La somma delle cariche, chiamate numeri di ossidazione, è: +2 + 6 -8 = 0 uguale a zero (anche questa molecola è neutra). 1. Determina se la sostanza in questione è un elemento. Gli atomi degli elementi liberi, non combinati, hanno sempre un numero di ossidazione pari a zero. Ciò si verifica per gli elementi composti da uno ione, così come per le forme biatomiche o poliatomiche. Per esempio, Al(s) e Cl2 hanno entrambi numero di ossidazione 0, perché sono entrambi nella loro forma di elemento non combinato. Nota che la forma elementare dello zolfo, S8, o octasolfuro, sebbene irregolare, ha anche un numero di ossidazione pari a 0. 2. Determina se la sostanza in questione è uno ione. Gli ioni hanno numeri di ossidazione uguali alla loro carica. Ciò è vero per gli ioni liberi così come per gli ioni che fanno parte di un composto ionico. Per esempio, lo ione Cl- ha un numero di ossidazione pari a -1. Lo ione Cl ha ancora numero di ossidazione pari a -1 quando è parte del composto NaCl. Siccome lo ione Na, per definizione, ha una carica pari a +1, sappiamo che lo ione Cl ha una carica di -1, così il suo numero di ossidazione è ancora -1. NaCl-------------Na+ + Cl – 3. Per gli ioni metallici, bisogna sapere che numeri di ossidazione multipli sono ancora possibili. Molti elementi metallici possono avere più di una carica. Per esempio, il metallo ferro (Fe) può essere uno ione con carica di +2 o +3. Le cariche metalliche degli ioni (e così i numeri di ossidazione) possono essere determinati in relazione alle cariche degli altri atomi presenti nel composto di cui sono parte o, quando sono scritti, tramite la notazione numerale romana (come nella frase, "Lo ione Ferro (III) ha carica +3"). Per esempio, esaminiamo un composto contenente lo ione metallico dell'alluminio. Il composto AlCl3 ha una carica complessiva di 0. Siccome sappiamo che gli ioni Cl- hanno una carica di -1 e ci sono 3 ioni Cl- nel composto, lo ione Al deve avere una carica di +3 in modo che la carica complessiva di tutti gli ioni dia 0. Così, il numero di ossidazione dell'alluminio è +3. 4. Assegna un numero di ossidazione di -2 all'ossigeno (con alcune eccezioni). In quasi tutti i casi, gli atomi di ossigeno hanno numero di ossidazione -2. Ci sono alcune eccezioni a questa regola: Quando l'ossigeno è al suo stato elementare (O2), il suo numero di ossidazione è 0, come nel caso di tutti gli atomi di elementi; Quando l'ossigeno è parte di un perossido, il suo numero di ossidazione è -1. I perossidi sono una classe di composti che contengono un singolo legame ossigeno-ossigeno (o l' anione perossido O2-2). Per esempio, nella molecola H2O2 (perossido di idrogeno), l'ossigeno ha un numero di ossidazione (e una carica) di -1; Quando l'ossigeno si lega al fluoro, il suo numero di ossidazione è +2. Controlla le regole del Fluoro per ulteriori informazioni. 5. Assegna un numero di ossidazione di +1 all'idrogeno (con eccezioni). Come l'ossigeno, il numero di ossidazione dell'idrogeno presenta delle eccezioni. Generalmente, l'idrogeno ha un numero di ossidazione di +1 (a meno che, non sia nella sua forma di elemento, H2). Comunque, in caso di speciali composti chiamati idruri, l'idrogeno ha un numero di ossidazione di -1. Ad esempio, in H2O, sappiamo che l'idrogeno ha numero di ossidazione +1 poiché l'ossigeno ha una carica di -2 e noi abbiamo bisogno di 2 cariche da + 1 per fare in modo che la carica del composto diventi zero. Comunque, nell'idruro di sodio, NaH, l'idrogeno ha un numero di ossidazione di -1 perché lo ione Na ha carica +1 e, siccome la carica totale del composto deve essere pari a zero, la carica dell'idrogeno (e così il numero di ossidazione ) deve dare -1. 6. Il fluoro ha sempre un numero di ossidazione pari a -1. Il numero di ossidazione di certi elementi può variare per diversi fattori (ioni metallici, atomi di ossigeno nei perossidi, e così via). Il fluoro, comunque, ha un numero di ossidazione pari a -1, che non cambia mai. Questo accade perché il fluoro è l'elemento più elettronegativo, in altre parole, è l'elemento meno disponibile a perdere i propri elettroni e più predisposto ad accettarne dall'altro atomo. Inoltre la sua carica non cambia. 7. Imposta i numeri di ossidazione del composto pari alla carica del composto. I numeri di ossidazione di tutti gli atomi presenti in un composto devono uguagliare la sua carica. Per esempio, se un composto non ha carica, cioè è neutro, i numeri di ossidazione di ognuno dei suoi atomi devono dare zero; se il composto è uno ione poliatomico con carica pari a -1, i numeri di ossidazione sommati devono dare -1, ecc. Ecco come controllare il tuo lavoro: se l'ossidazione nei tuoi composti non è pari alla carica del tuo composto, allora sai di avere assegnato uno o più numeri di ossidazione in maniera non corretta. Assegnare i Numeri di Ossidazione agli Atomi senza Usare le Regole 1.Trova gli atomi senza regole di numeri di ossidazione. Alcuni atomi non hanno delle regole specifiche sui numeri di ossidazione. Se il tuo atomo non appare nelle regole presentate sopra e non sei sicuro della sua carica (per esempio, se fa parte di un composto più ampio e così non è individuabile la sua carica specifica), puoi trovare il numero di ossidazione dell'atomo procedendo per eliminazione. Innanzitutto, devi determinare il numero di ossidazione di ogni atomo presente nel composto; poi dovrai semplicemente risolvere un'equazione basandoti sulla carica totale del composto. Per esempio, nel composto Na2SO4, la carica dello zolfo (S) non è nota poiché non è in forma di elemento, così non è 0: questo è tutto quello che sappiamo. Si tratta di un ottimo candidato per determinare il numero di ossidazione con il metodo algebrico. 2 Trova il numero di ossidazione noto per gli altri elementi nel composto. Usando le regole per assegnare i numeri di ossidazione, individua quelli degli altri atomi presenti nel composto. Fai attenzione se esistono eccezioni per O, H, ecc. Nel composto Na2SO4, sappiamo, basandoci sulle nostre regole, che lo ione Na ha una carica (e così un numero di ossidazione) di +1 e che gli atomi di ossigeno hanno un numero di ossidazione di -2. 3.Moltiplica la quantità di ogni atomo per il suo numero di ossidazione. Tieni presente che conosciamo numero di ossidazione di tutti i nostri atomi eccetto uno; abbiamo bisogno di prendere in considerazione il fatto che alcuni di questi atomi possono apparire più di una volta. Moltiplica il coefficiente numerico di ogni atomo (scritto in pedice dopo il simbolo chimico dell'atomo nel composto) e il suo numero di ossidazione. Nel composto Na2SO4, sappiamo che ci sono 2 atomi di Na e 4 di O. Dovremmo moltiplicare 2 per +1, numero di ossidazione del sodio Na, ottenendo 2, e dovremmo moltiplicare 4 per -2, numero di ossidazione dell'ossigeno O, ottenendo -8. 4.Somma i risultati. Sommando i risultati delle tue moltiplicazioni ottieni il numero corrente di ossidazione del composto senza prendere in considerazione il numero di ossidazione dell'atomo di cui non si sa nulla. Nel nostro esempio, Na2SO4, dovremmo aggiungere 2 a -8 per ottenere -6. 5. Calcola il numero di ossidazione sconosciuto basandoti sulla carica del composto. Ora hai tutto ciò che ti serve per trovare il tuo numero di ossidazione sconosciuto usando semplici calcoli algebrici. Imposta un'equazione in questo modo: "(somma dei numeri di ossidazione conosciuti) + (numero di ossidazione che devi trovare) = (carica totale del composto)". Nel nostro esempio Na2SO4, possiamo procedere così: (somma dei numeri di ossidazione conosciuti) + (numero di ossidazione che devi trovare) = (carica totale del composto) -6 + S = 0 S=0+6 S = 6. S a un numero di ossidazione pari a 6 nel composto Na2SO4. CONSIGLI Gli atomi nella loro forma di elemento hanno sempre numero di ossidazione pari a zero. Uno ione monoatomico ha un numero di ossidazione pari alla sua carica. I metalli del gruppo 1A in forma di elemento, come di idrogeno, il litio e il sodio, hanno numero di ossidazione pari a +1; il gruppo di metalli 2A nella loro forma di elementi, come il magnesio e il calcio, hanno numero di ossidazione pari a +2. L'idrogeno e l'ossigeno hanno entrambi due possibili numeri di ossidazione, che dipendono da ciò a cui sono legati. È molto utile conoscere come leggere la tavola periodica degli elementi e dove sono posizionati i metalli e non metalli. In un composto, la somma di tutti i numeri di ossidazione deve essere uguale a zero. Se c'è uno ione che ha due atomi, ad esempio, la somma dei numeri di ossidazione deve essere uguale alla carica dello ione.