caricato da
alberto.appruzzese
Numero di ossidazione (N.O.) degli atomi - Chimica

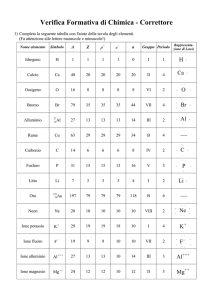
Numero di ossidazione (N.O.) degli atomi (a cura di Gianni Michelon) Per facilitare il calcolo del numero di elettroni in gioco durante una reazione di ossidoriduzione, si attribuisce ad ogni atomo di una molecola o di un gruppo ionico, un “numero di ossidazione” che chiameremo N.O. Questo non rispecchia sempre, salvo che in alcuni casi, una situazione elettronica reale. Per esempio, non si può pensare che un atomo isolato abbia un “reale” N.O.=+5, o +7, dato che esso avrebbe una carica così alta che attrarrebbe fortemente qualsiasi molecola polare che avesse vicino, (generalmente H2O) cercando di ridurre la sua carica effettiva. Ma è utile per capire quanti elettroni vengano scambiati durante la reazione. Ricordando che un N.O. positivo corrisponde a una perdita di elettroni ed uno negativo all’acquisto di elettroni, nel calcolo si seguono alcune regole convenzionali, in particolare: 1) Una sostanza elementare ha sempre N.O.=0; questo vale, per esempio, per tutti i metalli allo stato elementare (cioè prima di qualsiasi reazione) Fe, Cr, Na, Pb, Ca, Ag, etc.; vale anche per le molecole biatomiche gassose come H2, O2, N2, Cl2 (in effetti, essendo due gli atomi costituenti, ed essendo neutre le molecole, è evidente che non si potrebbe attribuire ad un atomo un N.O. positivo e all’altro uno negativo, essendo indistinguibili); per le stesse ragioni la regola vale anche per molecole poliatomiche elementari come P4, S8, ecc. 2) Per uno ione monoatomico con una certa carica, il N.O. è uguale alla carica dello ione; per esempio sarà: N.O.=+1 per Na+, K+, Ag+, ecc.; N.O.=+2 per Ca++, Zn++, Cu++, Fe++, Mn++, ecc.; N.O.=+3 per Fe+++, Cr+++, Au+++, ecc.; ioni positivi con cariche reali maggiori di 3 non esistono (come detto prima) come tali, ma sono associati, in soluzione acquosa, a ossidrili o ossigeno (in questo caso non possiamo parlare di “ioni monoatomici”); è il caso, per esempio, di MnO4- (in cui Mn avrebbe N.O.=+7), di ClO3- (in cui Cl avrebbe N.O.=+5), di SO4-- (in cui S avrebbe N.O.=+6), di NO3- (in cui N avrebbe N.O.=+5), ecc. In effetti succede che un potenziale ione con carica alta, si lega a molecole di acqua rilasciando in soluzione protoni. Vediamo il caso dello ione permanganato MnO4-: Mn7+ + 4H2O (molecole di solvatazione) MnO4- + 8H+ Si può notare che il numero totale di cariche a sinistra e a destra della freccia (+7) è uguale. un caso particolare di ioni può essere inoltre quello di ioni biatomici come Cu2++ e Hg2++: in tal caso N.O. di ognuno degli atomi costituenti sarà N.O.=+1 (due cariche ma con due atomi); ioni monoatomici con carica negativa avranno un N.O. equivalente negativo; per esempio N.O.=–1 per F-, Cl-, Br-, I-; N.O.=–2 per S--, Se--. 3) Alcuni elementi hanno sempre lo stesso numero di ossidazione nei loro composti (se non si trovano cioè allo stato elementare); per esempio: tutti gli elementi del gruppo I (i cosiddetti “metalli alcalini” Li, Na, K, Rb, Cs, Fr), avendo un solo elettrone esterno disponibile (caratteristica elettronica di tutti gli elementi del gruppo I), hanno sempre N.O.=+1; tutti quelli del gruppo II (i cosiddetti “metalli alcalin0-terrosi” Be, Mg, Ca, Ba, Sr, Ra), avendo due soli elettroni esterni, hanno sempre N.O.=+2; altri elementi si presentano, nei composti, sempre con lo stesso N.O., per esempio, N.O.=+2 per Zn; o N.O.=+3 per B e Al; o N.O.=–1 per F; per O è sempre N.O.=–2 (salvo che non faccia parte di un gruppo perossidico, indicato con O2-- in cui ogni O ha N.O.=–1); per esempio, nel caso di Al2O3 (triossido di dialluminio, chiamato un tempo anche sesquiossido di alluminio), ogni Al ha N.O.=+3 e ogni O N.O.=–2, (3x2 = 2x3); H ha pressoché sempre N.O.=+1, salvo nei casi in cui, nel composto, sia associato a un elemento con elettronegatività molto bassa (metalli, per esempio); in questi casi ha N.O.=–1 e corrisponde allo ione “idruro”: NaH, LiH, CaH2, BH3, ecc. 4) In un composto neutro, la somma degli N.O. positivi deve essere uguale alla somma degli N.O. negativi (o, più correttamente, la somma algebrica di tutti gli N.O. deve essere nulla); per esempio in H2SO4 avremmo, per H, 2x(+1), per O, 4x(-2); poiché la loro somma algebrica (+2-8=+6), il N.O. di S sarà necessariamente N.O.=+6; in uno ione poliatomico, invece, tale somma algebrica deve essere uguale alla carica dello ione; per esempio: per lo ione fosfato PO43- la somma algebrica di tutti gli N.O. deve essere –3, perciò, avendo 4x(-2) per O, per P sarà N.O.=+5 (infatti +5-8=-3 che è proprio la carica dello ione fosfato); per lo ione perclorato ClO4- la somma algebrica di tutti gli N.O. deve essere –1, perciò, avendo 4x(-2) per O, per Cl sarà N.O.=+7 (infatti +7-8=-1 che è proprio la carica dello ione perclorato). Ricapitolando, si può perciò attribuire N.O. fissi ai componenti di alcuni gruppi della tavola periodica, in particolare N.O.=+1 a tutti i componenti del gruppo I (metalli alcalini); N.O.=+2 a tutti i componenti del gruppo II (metalli alcalinoterrosi) e ad alcuni metalli che presentano 2 elettroni esterni. Ma più è alto il numero atomico, più è facile che un elemento presenti diversi N.O.: per esempio (e tenendo presente che ognuno, allo stato elementare, possiede comunque anche N.O.=0): Au ha N.O.=+1 ma anche N.O.=+3; Cr sia N.O.=+3 sia N.O.=+6; Mn può avere N.O.=+2, N.O.=+3, N.O.=+4, N.O.=+7; ma anche gli elementi del gruppo VII (secondo la nuova nomenclatura IUPAC gruppo 17), quello degli alogeni (F, Cl, Br, I), se si esclude F che ha solo N.O.=-1 poiché non può avere espansione dell’ottetto, tutti gli altri possono avere diversi N.O.: N.O.=-1,+1,+3,+5,+7; N li ha quasi tutti, per esempio: N.O.=-3 (NH3); -2 (NH2NH2); -1 (NH2OH); 0 (N2); +1 (N2O); +2 (NO); +3 (N2O3); +4 (NO2); +5 (NO3-) Partendo così dagli atomi che hanno N.O. noti e fissi è possibile sempre determinare il N.O. di quello incognito. Per prevedere quali siano i possibili N.O. di un atomo e per capire perché quell’atomo possa presentare quegli specifici N.O. è molto utile esaminare la tavola periodica e la configurazione elettronica dell’atomo, ma occorrono, per questo, anche conoscenze approfondite su altri argomenti (per esempio la possibilità di espansione dell’ottetto, la scala dei vari livelli energetici, le regole empiriche di stabilità di specifiche configurazioni elettroniche…) Di seguito viene ripresa la tavola periodica corta con evidenziati gli elementi cui possiamo attribuire senza incertezze un solo N.O. (a parte quello ovvio N.O.=0 relativo allo stato elementare) 13 14 15 16 17 18 II A * * III A IV A VA VI A VII A VIII A H* +1 * * * * * * * He Li +1 Be +2 * B +3 C N O* -2 F -1 Ne Na +1 Mg +2 * Al +3 Si P S Cl Ar K +1 Ca +2 Sc Ga Ge As Se Br Kr Rb +1 Sr +2 Y In Sn Sb Te I Xe Cs +1 Ba +2 La Tl Pb Bi Po At Rn Fr +1 Ra +2 Ac * * * IUPAC 1 2 ex IA * raramente, per H (ione idruro) e O (ione perossido), N.O.=-1 Dei metalli di transizione (nell’Aufbau vengono riempiti gli orbitali d) normalmente hanno valori fissi di N.O. gli elementi indicati in rosso: IUPAC 3 * 4 5 6 7 ex III B * IV B VB VI B VII B Sc Ti V Cr Mn Fe Co Y Zr Nb Mo Tc Ru Hf Ta W Re Os La Ce 8 9 10 11 12 IB II B Ni Cu Rh Pd Ag +1 Zn +2 Cd +2 Ir Pt Au Hg VIII B VIII B VIII B Qualche esempio di applicazione dei N.O. c’è nel file esercizi (il link anche dalla homepage) in particolare negli esercizi 09GM e 10GM. Per avere un panorama più completo dei N.O. dei vari elementi che possiamo incontrare, nella seguente tavola periodica sono indicati quelli possibili o più comuni (mentre nella precedente comparivano solo quelli “fissi”). Non vengono riportati quelli delle serie dei lantanidi e degli attinidi (aufbau con riempimento degli orbitali f), sia perché meno comuni, sia perché tutti con N.O.=3 (salvo Th che ha solo N.O.=4) oltre ad altri N.O.; forse l’unico interessante può essere U, con N.O.=+3,+4,+5,+6. 13 14 15 16 17 18 II A * * III A IV A VA VI A VII A VIII A * * * * * * * He Li Be B C N O F +1 +2 * -2,-1 -1 Ne Na Mg +1 +2 IUPAC 1 2 ex IA H +1,-1 -3,-2,-1,+1, -4,+2,+4 +2,+3,+4,+5 +3 * Al Si P +3 -4,+2,+4 -3,+3,+5 Cl S -1,+1, -2,+4,+6 +3,+5,+7 Br K Ca Sc Ga Ge As Se +1 +2 +3 +3 +2,+4 -3,+3,+5 -2,+4,+6 Rb Sr Y In Sn Sb Te I +1 +2 +3 +3 +2,+4 -3,+3,+5 Cs Ba La Tl Pb Bi Po At +1 +2 +3 +1,+3 +2,+4 +3,+5 +2,+4 Fr Ra Ac +1 +2 +3 -1,+1, +3,+5,+7 -1,+1, -2,+4,+6 +3,+5,+7 * IUPAC 3 * 4 5 6 7 ex III B * IV B VB VI B VII B 8 9 * 10 VIII B VIII B VIII B Ar Kr Xe Rn * 11 12 IB II B Sc Ti V Cr Mn Fe Co Ni Cu Zn +3 +2,+3, +4 +2,+3 +5,+4 +2,+3 +6 +2,+3 +4,+7 +2,+3 +2,+3 +2,+3 +1,+2 +2 Y Zr Nb Mo Tc Ru Rh Pd Ag Cd +3 +4 +3,+5 +4,+5 +6 +4,+6 +7 +3 +3 +2,+4 +1 +2 La Ce Hf Ta W Re Os Ir Pt Au Hg +3 +3,+4 +4 +5 +6 +4,+6 +7 +3,+4 +3,+4 +2,+4 +1,+3 +1,+2