+
Talassemia β causata da una mutazione di una G con una A in posizione 110 nel primo introne
Questo porta alla creazione di un sito accettare di
splicing anomalo, poiché la nuova sequenza contiene un AG.
Come mostrato nella parte inferiore del diagramma, questo
sistema di splicing è utilizzato all’incirca il 90% delle volte.
Soltanto il 10% del messaggero viene tagliato appropriatamente
e dà origine a catene β-globiniche normali. Y = C o T; N =
qualsiasi nucleotide. L’AG invariabile nella sequenza accettare di
consenso è stato sottolineato. Le linee verticali indicano la
localizzazione dello splicing.
Vantaggio dell’eterozigote per l’anemia falciforme: vedi pag. 20.
EREDITA’ EPIGENETICA ED IMPRINTING GENOMICO
L’eredità epigenetica è causata da modificazioni del DNA o dei cromosomi che hanno luogo durante l’ovogenesi, la
spermatogenesi o i primi stadi di sviluppo embrionale. La modificazione di un gene o di un cromosoma ne altera l’espressione.
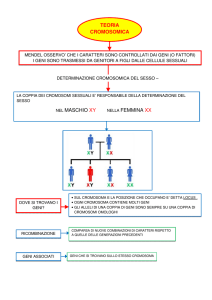
COMPENSAZIONE DELLA DOSE
Per compensazione delle dosi s’intende il fenomeno per cui il livello di espressione di geni localizzati sui cromosomi
sessuali è paragonabile in entrambi i sessi, anche se maschi e femmine hanno un corredo diverso di cromosomi sessuali.
Æ
Processo di inattivazione del cromosoma X
Il processo di attivazione è attivo e inizia dal centro di inattivazione dell’X (Xic), che
contiene il gene XIST. Nel cromosoma X attivo il gene XIST resta inattivo. Il gene XIST viene
quindi trascritto a partire dal cromosoma X inattivo.
1.
Inizio: ha luogo durante lo sviluppo embrionale. Viene contato il numero di centri di
inattivazione dell’X (Xic), e uno dei cromosomi rimane attivo, mentre l’altro viene individuato
come bersaglio per l’inattivazione. Si pensa che l’individuazione dei cromosomi da inattivare
sia dovuta a fattori bloccanti.
2.
Diffusione: ha luogo durante lo sviluppo embrionale. Comincia nello Xic e progredisce verso
entrambe le estremità finché non è stato inattivato l’intero cromosoma X.
3.
Mantenimento: ha luogo dallo stadio embrionale a tutta la vita adulta. Il cromosoma X
inattivato viene mantenuto come tale (corpo di Barr) durante le successive divisioni cellulari.
L’mRNA del gene XIST va a legarsi a diverse regioni del cromosoma X costituendo un
nucleo di inattivazione: l’mRNA blocca l’attività di tutti i geni del cromosoma X.
In seguito vengono reclutati gli istoni H3 e H4, che vengono ipoacetilati provocando una
condensazione del cromosoma.
Æ
Æ
Æ
Posizione del gene XIST
all’interno della regione Xic del
cromosoma X.
Æ
31
IMPRINTING GENOMICO
Nell’imprinting genomico, l’espressione di un gene dipende dal sesso del genitore da cui è stato ereditato.
Igf-2 è un gene che codifica un fattore di crescita (Insuline-like Growth Factor) murino che, se mutato (Igf-2m), determina il
nanismo. Per questo carattere, gli incroci reciproci danno risultati diversi.
eterozigote normale
(è espresso solo l’allele Igf-2)
eterozigote nano
(è espresso solo l’allele Igf-2m)
In questo caso, viene dunque espresso esclusivamente l’allele ereditato dal padre. E’ evidente che gli alleli materni vengono
in qualche modo “marcati” durante l’ovogenesi in modo da impedire la loro espressione.
Igf-2R è un gene che codifica il recettore per l’Insuline-like Growth Factor murino che, se mutato (Igf-2Rm), determina il
nanismo. Anche per questo carattere, gli incroci reciproci danno caratteri diversi.
eterozigote nano
(è espresso solo l’allele Igf-2Rm)
eterozigote normale
(è espresso solo l’alle Igf-2R)
In questo caso viene dunque espresso esclusivamente l’allele ereditato dalla madre. E’ evidente che gli alleli paterni vengono
in qualche modo “marcati” durante la spermatogenesi in modo da impedire la loro espressione.
Imprinting genomico materno e gametogenesi
•
•
•
•
Gli alleli vengono marcati durante l’ovogenesi Æ la metilazione determina inattivazione del cromosoma
La marcatura viene mantenuta durante tutto lo sviluppo
La marcatura viene successivamente cancellata in entrambi i sessi
La marcatura viene poi ripristinata solo negli ovociti
Igf-2/Igf-2m*
nelle cellule somatiche
Igf-2/Igf-2m*
nelle cellule somatiche
ovogenesi
spermatogenesi
Igf-2*
32
Igf-2*
Igf-2m*
Igf-2m*
Igf-2
Igf-2
Igf-2m
Igf-2m
Gene
WT1
INS
Igf-2
Igf-2R
H19
Snrpn
Gabrb
Allele espresso
Materno
Paterno
Paterno
Materno
Materno
Paterno
Materno
Funzione
Sopprime la proliferazione incontrollata di cellule del tumore di Wilms (nefroblastoma)
Sintesi dell’insulina, ormone che interviene nel metabolismo e nella proliferazione cellulare
Fattore di crescita insulino-simile II
Recettore per Igf-2
Sconosciuta
Fattore di splicing
Recettore per il GABA (neurotrasmettitore)
IMPRINTING GENOMICO: SINDROME DI ANGELMAN (AS) E DI PRADER-WILLI (PW)
Entrambe le sindromi sono causate da una delezione nel cromosoma 15.
33
Sindrome di Angelman
Delezione del segmento 15q11 q13 del cromosoma 15 materno. Il gene per la ubiquitina ligasi (UBE3A) si
trova nella regione cromosomica AS. Codifica un enzima chiave del sistema di degradazione delle proteine cellulari.
La AS si manifesta in seguito a mutazioni di UBE3A che alterano il processo di degradazione delle proteine nello
sviluppo cerebrale.
Descrizione: anomalia del cromosoma 15 con microcefalia, grave ritardo mentale e alterazioni motorie, epilessia,
atassia o anomalia anche completa della deambulazione, ipotonia muscolare, anomalie nell’EEG e facies
caratteristica, con ipertrofia della lingua e della mandibola, depressione occipitale, sclere blu.
I bambini appaiono allegri e ridono spesso, senza motivo. I loro movimenti sono irregolari, a scatti, come
quelli di una marionetta. Eredità autosomica recessiva. Comunemente diagnostica tra i 3 ed i 7 anni, quando le
caratteristiche diventano particolarmente evidenti.
Sindrome di Prader-Willi
Dovuta all’assenza del segmento 11-13 del braccio lungo del cromosoma 15 paterno. Alcuni geni
localizzati nella regione cromosomica PWS codificano la small ribonucleoprotein N (SNRNP), coinvolta nella
maturazione degli mRNA.
•
Nel 70% dei casi, il difetto è dovuto a delezione.
•
Nel 25% dei casi, il difetto è dovuto a disomia parentale: una disomia parentale si ha quando tutti e
due i cromosomi paterni o materni finiscono rispettivamente nello stesso spermatocita od ovocita,
mentre l’altro spermatocita od ovocita non riceve alcun cromosoma 15. Se c’è trisomia del 15, ci può
essere nelle prime divisioni dello zigote la perdita di uno di questi cromosomi Æ disomia parentale.
•
Nel 5% dei casi, il difetto è dovuto a mutazioni che alterano il processo di imprinting.
Caratteristiche:
•
ipotonia centrale neonatale ed infantile, con scarsa capacità suttoria che migliora con l’età;
•
problemi di deglutizione e scarso accrescimento nell’infanzia;
•
necessità di alimentazione forzata;
•
tra i 12 mesi e i 6 anni, guadagno eccessivo di peso che determina obesità;
•
iperfagia;
•
caratteristiche facciali tipiche: diametro bifrontale scarso, fessure palpebrali a mandorla, bocca rivolta
all’ingiù;
•
ipogonadismo:
•
ipoplasia dei genitali: piccole labbra e clitoride ridotti nelle femmine;
•
scroto ipoplastico e criptorchidismo nei maschi;
•
pubertà incompleta e ritardata;
•
sterilità;
•
ritardo nello sviluppo, ritardo mentale lieve o moderato, ritardo nell’apprendimento.
GENI E MOLECOLE DEL COMPLESSO MAGGIORE DI ISTOCOMPATIBILITA’
GENI E MOLECOLE DEL SISTEMA IMMUNITARIO
MOLECOLE MHC DELLA SUPERFICIE CELLULARE
Le molecole MHC sono molecole transmembranarie coinvolte nel
riconoscimento dell’antigene nel corso della risposta immunitaria.
•
Le molecole di classe I sono espresse sulla superficie di tutte le
cellule somatiche nucleate (non sui gameti), e sono importanti nella
tolleranza o nel rigetto dei trapianti, per prevenire il quale vengono
utilizzati farmaci immunosoppressori. Porta legata in maniera non
covalente una β2 microglobulina.
•
Le molecole di classe II sono dimeri e sono espresse solo in alcune
cellule del sistema immunitario:
•
monociti
•
cellule dendritiche
•
linfociti T
Queste molecole conferiscono a ciascuno un’individualità
genetica e immunologica. La probabilità di trovare 2 persone compatibili è
1/20 miliardi.
GENI MHC
•
Si trovano sul braccio corto del cromosoma 6
Ogni cellula somatica esprime 7 tipi diversi di molecole di
classe I. I geni MHC sono altamente polimorfici nelle popolazioni
umane: per ciascun locus esistono numerosi alleli; ad oggi:
•
per il locus A: 123 definiti serologicamente e 282 come DNA
•
per il locus B: 272 definiti serologicamente e 540 come DNA
•
per il locus C: 8 definiti serologicamente e 136 come DNA
•
per i loci E, F e G: 23 definiti a livello di DNA
34
La variabilità delle molecole MHC è quindi
genetica, legata cioè alla presenza per ciascun locus di
alleli che si esprimono in maniera codominante.
A causa del linkage fra i 3 loci, le combinazioni
alleliche tendono ad essere tramandate ai figli
preferenzialmente nella disposizione parentale, cioè come
aplotipo: successione di alleli raramente interessati da
eventi di crossing-over.
Naturalmente, occasionalmente possono verificarsi eventi di crossing-over
che danno origine a gameti ricombinanti.
I geni di classe I sono espressi sulla
membrana plasmatica di tutte le cellule somatiche.
Come tutte le molecole di membrana, anche le
molecole di classe I sono sintetizzate nel RER.
Nel viaggio verso la membrana plasmatica,
nella tasca tra i domini α1 e α2, in cui c’è un pavimento
formato da foglietti β, vengono alloggiate tutte le
molecole sintetizzate dalla cellula.
Il solco delle molecole di classe I sporge verso
l’interno del RER: tutti i peptidi contenuti nel RER
(perché sono stati prodotti lì o perché portati lì dai proteasomi) possono interagire con queste molecole. I peptidi viaggiano con le
molecole di classe I vengono esposti sulla membrana.
Se la cellula viene infettata da un virus, esprime sulla superficie anche i peptidi virali (esposizione dell’antigene): la cellula
viene riconosciuta dal sistema immunitario e uccisa dai linfociti T killer. Molti virus hanno come meccanismo di resistenza il fatto che
inibiscono il trasporto delle molecole di classe I sulla membrana.
Le molecole di classe II sono accoppiate al
meccanismo di endocitosi e fagocitosi. La cellula
segrega l’antigene in un endosoma primario, che si
fonde con un lisosoma a formare un endosoma
secondario. L’antigene viene degradato producendo
dei peptidi, che vengono esposti sulla membrana in
corrispondenza delle molecole di classe II. Questi
peptidi reclutano i linfociti T helper, che attivano la
risposta immunitaria nei confronti dell’organismo
responsabile dell’infezione.
I peptidi endogeni non arrivano sulle molecole
di classe II perché le molecole HLA-DM bloccano il
solco delle molecole di classe II stesse.
35
L’interazione tra i peptidi e le molecole di classe I non riguarda tutti gli aminoacidi,
ma soprattutto due residui, il 2° e il 9°. Un virus sintetizza vari tipi di proteine (almeno 10),
quindi ce ne sono quasi sempre una o più che hanno 2 aminoacidi in posizione tale da
potersi collocare nel solco delle molecole di classe I. Si può quindi portare in superficie un
repertorio piuttosto vasto di peptidi, permettendo una risposta immunitaria nei confronti di
molti tipi di virus.
•
Le molecole MHC di classe I espongono regioni degli antigeni estranei espressi
attivamente dalle cellule somatiche e fanno sì che queste possano essere riconosciute
ed eventualmente uccise dalle cellule killer del sistema immunitario.
•
Le molecole MHC di classe II espongono regioni degli antigeni estranei catturati per
endocitosi da cellule specializzate e fanno sì che queste possano interagire con le
cellule del sistema immunitario per indurre la produzione di anticorpi specifici.
GENI DELLE IMMUNOGLOBULINE
Uno dei precursori negli studi sul sistema immunitario fu Jenner. Jenner osservò che il vaiolo vaccino assomigliava al vaiolo
umano, ma non infettava l’uomo e ne induceva invece un’immunizzazione.
Qualunque molecola iniettata induce una risposta. Il numero delle molecole contro le quali possiamo evocare una risposta
anticorpale è di circa 1 miliardo, molte di più quindi dei geni.
La variabilità è generata dal caso ed è clonotipica. La diversità dei recettori antigene-specifici viene generata nei linfociti B
attraverso un meccanismo di riarrangiamento genico causale che produce una varietà praticamente infinita di recettori dotati di siti
combinatori diversi (il repertorio immunologico). Questo repertorio è distribuito in maniera clonale: ogni linfocita esprime un solo tipo di
recettore.
Oltre ad alcune regioni costanti, l’anticorpo ha delle regioni variabili.
Nelle catene pesanti si hanno:
•
geni V (variability): 300
•
geni D (diversity):
20
•
geni J (joining):
10
Nelle catene leggere:
•
geni V:
300
•
geni J:
10
Le possibili combinazioni sono quindi:
300 x 20 x 10 x 300 x 10 = 180 milioni
36
La molecola viene assemblata all’interno della cellula e le
regioni VH e VL contribuiscono a formare il sito combinatorio.
Ciascun sito combinatorio è espresso sulla superficie delle
cellule immunocompetenti sotto forma di recettori clonotipica: un
determinato antigene favorirà la proliferazione e la differenziazione
di pochi cloni.
La variabilità dei recettori per l’antigene sui linfociti T è
anch’essa clonotipica. La natura casuale del meccanismo di
generazione della diversità implica che il repertorio immunologico
debba contenere recettori in grado di riconoscere sia l’universo
degli antigeni esterni, sia quello degli antigeni interni.
FUNZIONI DEI GENI MHC
Le molecole MHC di classe I sono espresse su tutte le cellule somatiche nucleate. Ciascun soggetto esprime, in maniera
codominante, due alleli per ciascun locus. Le molecole MHC di classe I hanno un ruolo determinante nella risposta immunitaria
cellulo-mediata (infezioni da virus, rigetto dei trapianti) e nella determinazione del repertorio immunologico di ciascun individuo
(Self – Non self).
Questo paradigma presuppone che i linfociti T subiscano
un processo di delezione clonale attraverso il quale quelli
potenzialmente autoreattivi vengono o eliminati fisicamente
(apoptosi) o resi incapaci di funzionare (anergia). La definizione
del repertorio avverrebbe solo nelle primissime fasi dello sviluppo
dell’individuo.
Solo linfociti capaci di riconoscere il “sé” inteso come MHC con affinità
intermedia completano il loro percorso maturativo nel timo e vengono immessi in
circolo.
Il riconoscimento dell’antigene da parte del
linfocita T genera un segnale che determina la
proliferazione e l’attivazione clonale. I linfociti
autoreattivi sono stati deleti nel timo, quindi non si ha
risposta contro gli antigeni “propri”. I linfociti maturi hanno
recettori che riconoscono il “diverso da sé”, quindi
vengono attivati.
37
GENETICA QUANTITATIVA
La genetica quantitativa studia i caratteri quantitativi, che si prestano ad essere analizzati per mezzo di parametri numerici.
Esempi:
•
caratteri anatomici:
•
caratteri fisiologici:
•
caratteri comportamentali:
•
malattie complesse:
statura, peso, grado di pigmentazione
livello di attività metabolica, velocità, produzione di latte o di uova
rituali di accoppiamento, richiami di corteggiamento, apprendimento
diabete, ipertensione, obesità, malattie cardiovascolari
A differenza di quanto accade con i caratteri discontinui, i caratteri quantitativi presentano un continuum di variabilità
fenotipica all’interno di un gruppo di individui.
Il valore medio
Uno dei concetti più importanti in probabilità e statistica è quello del valore medio di una variabile casuale. Nel caso di una
variabile casuale discreta X, i cui valori possibili sono x1, x2, … xn, il valore medio (µ) di X è definito, quando le probabilità sono tutte
uguali, da:
µ = (x1 + x2 + … + xn) / n
che viene definito la media aritmetica di X.
La varianza
La varianza è una misura della dispersione dei valori della variabile casuale attorno alla media µ. Se i valori sono concentrati
vicino alla media, la varianza è piccola, mentre la varianza è grande se i valori sono dispersi lontano dalla media. La varianza è la
sommatoria dei quadrati degli scarti rispetto alla media, divisa per il numero di gradi di libertà (di norma n – 1).
2
2
Var (X) = σ = Σ (x – µ) / (n – 1)
cioè
Var (X) = σ2 = [(x1 – µ)2 + (x2 – µ)2 + … + (xn – µ)2] / (n -1)
Esempio di due distribuzioni aventi la stessa media e diversa varianza
La deviazione standard
La deviazione standard è la radice quadrata positiva della varianza: σ = Var ( X )
In una distribuzione normale:
•
il 68,27% dei dati rientra nella zona µ + σ
•
il 95,45% dei dati rientra nella zona µ + 2σ
•
il 99,73% dei dati rientra nella zona µ + 3σ
Il rapporto µ/σ è una misura della fluttuazione attorno alla media.
Confronto tra più variabili
A volte è necessario confrontare tra loro variabili differenti per verificare se esista una correlazione tra queste. Per farlo,
occorre calcolare la covarianza, che descrive quanto variano le due variabili nell’ambito di un gruppo.
_
_
CoV(X) = Σ (x – x)2(y – y)2/ (n – 1)
_ _
dove x e y indicano i valori medi di ciascuna delle due variabili
38
Partendo dalla covarianza, è possibile stabilire quanto siano
associate tra loro le due variabili, calcolando il coefficiente di correlazione:
r(x,y) = CoV (x,y) / σ(x) * σ(y)
Il coefficiente di correlazione varia tra -1 (correlazione inversa) e
+1 (correlazione positiva). Valori che si avvicinino più allo 0 indicano
assenza di correlazione.
Tuttavia, il coefficiente di correlazione va rapportato al numero di
gradi di libertà: infatti, la significatività del coefficiente di correlazione è in
diretto rapporto con le dimensioni del campione e con il gradi di libertà (GL).
Per la verifica della significatività dei coefficienti di correlazione
GL = n – 2
GL
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
5%
0,997
0,95
0,878
0,811
0,754
0,707
0,666
0,632
0,602
0,576
0,553
0,532
0,514
0,497
0,482
1%
1
0,99
0,959
0,917
0,874
0,834
0,798
0,765
0,735
0,708
0,684
0,661
0,641
0,623
0,606
In questa tabella sono riportati i valori limite di significatività (al 5% e all’1%) per quanto riguarda il
coefficiente di correlazione a diversi gradi di libertà. Se i valori ottenuti sono inferiori a quelli riportati in tabella, è
probabile che la correlazione osservata sia dovuta al caso. Se i valori osservati sono superiori, la correlazione è
probabilmente (al 95% o al 99%) vera.
Un certo allele può aumentare il rischio per una malattia. Per stabilire se esista una correlazione
occorre confrontare la frequenza dell’allele nei sani e nei malati.
Rischio relativo
=
malati che presentano l’allele
malati totali
Rischio assoluto
=
1
–
/
sani che presentano l’allele
sani totali
1
rischio relativo
EREDITA’ POLIGENICA
Il termine eredità poligenico designa la trasmissione di caratteri che sono determinati da due o più geni.
Il colore del tegumento del frumento è un esempio di carattere
poligenico determinato da 3 geni diversi con effetto additivo. Ciascun gene ha
un allele per il colore rosso e uno per il colore bianco. Il risultato di un incrocio
fra due triibridi sarà una gamma di fenotipi che vanno dal rosso molto intenso
fino al bianco.
Effetto dell’ambiente su caratteri quantitativi
Nel caso di un carattere dovuto ad un singolo gene, l’effetto
dell’ambiente, pur facendosi sentire, non è tale da mascherare
sostanzialmente il contributo genetico.
L’effetto dell’ambiente può essere rilevante nel caso in cui il
carattere quantitativo sia controllato da più geni con effetto additivo.
39
Nel caso di caratteri poligenico quantitativi, dunque, la variabilità è caratterizzata da una componente genetica e da una
componente ambientale.
varianza totale = varianza genetica + varianza ambientale
VT = VG + VA
Esistono ceppi di animali singenici, cioè geneticamente uniformi, ottenuti mediante incroci fratello-sorella per numerose
generazioni. In questi ceppi, la varianza genetica può essere considerata nulla. Per quanto riguarda alcuni caratteri quantitativi, è
possibile in questi casi determinare la quota di varianza dovuta a fattori ambientali.
Supponiamo ad esempio di aver determinato il peso corporeo in un gruppo di topi singenici ed in un gruppo di topi outbred
(non singenici) allevati nelle stesse condizioni ambientali e di avere ottenuto i seguenti valori di varianza:
•
VT = 225 g2 per i topi singenici
•
VT = 400 g2 per i topi outbred
•
•
VT = VA per i topi singenici perché VG è nulla
VG = (400-225) g2 = 175 g2 per i topi outbred perché VA è pari a quella dei topi singenici
L’ereditabilità è una misura della quota di variazione fenotipica dovuta a fattori genetici:
HB2 = VG/VT
•
•
•
HB2: ereditabilità
VG: varianza genetica
VT: varianza totale
LOD SCORE
•
•
•
•
•
Ad ogni evento di fecondazione, la probabilità che lo zigote sia maschio oppure
femmina è 1/2.
p = probabilità che sia maschio.
q = probabilità che sia femmina.
La probabilità di ottenere questo risultato per puro caso esattamente in quest’ordine
(prima figlia femmina, 5 figli maschi e ultima figlia femmina) è p5q2, cioè (1/2)5 x
(1/2)2 = 0,07813.
La probabilità di trovare una famiglia di 7 figli con quella distribuzione di maschi e femmine è
invece: 21p5 x q2 = 0,164.
Triangolo di Tartaglia
Supponiamo di avere un soggetto eterozigote per due loci indipendenti:
Secondo la legge dell’indipendenza, ci aspettiamo che questo soggetto produca 4 tipi di gameti nelle stesse proporzioni
(probabilità = 0,25% ciascuno). Se incrociamo questo eterozigote con un omozigote doppio recessivo (reincrocio o test-cross), ci
aspettiamo nei figli proporzioni che rispettino le proporzioni tra i gameti.
Gameti prodotti dall’eterozigote
In quest’albero genealogico troviamo valori che si
discostano dal risultato atteso sulla base dell’ipotesi
dell’indipendenza. Qual è la probabilità di ottenere questo
risultato semplicemente per caso?
Per convenzione, definiamo:
•
AB e ab: combinazioni parentali;
•
Ab e aB: combinazioni ricombinanti.
40