Atomi, molecole e ioni
anione
+
catione
-
Teoria atomica di Dalton
1. Un elemento è composto da
particelle minuscole chiamate atomi.
2. In una normale reazione chimica,
nessun atomo di nessun elemento
scompare o si trasforma in un
atomo di un altro elemento
3. I composti si formano per
combinazione di atomi di due o più
elementi.
L’atomo viene quindi definito come la
più piccola particella di un elemento
che interviene in una reazione
chimica.
Teoria atomica di Dalton
spiegò tre leggi fondamentali della chimica:
1. La legge di conservazione della massa
Non avviene alcun cambiamento rilevabile nella massa
durante una reazione chimica.
2. La legge della composizione costante
Un composto contiene sempre gli stessi elementi nelle
stesse proporzioni in massa.
3. La legge delle proporzioni multiple
Le masse di un elemento che si combinano con una massa
fissa di un secondo elemento stanno tra loro in rapporti
espressi da numeri interi piccoli.
Cr2O3
2 Cr : 3 O
CrO3
1 Cr : 3 O
La scoperta dell’elettrone:
Esperimento di Thomson
L’atomo contiene elettroni, particelle cariche
negativamente con carica negativa unitaria e massa
pari a circa 1/2000 di quella dell’atomo più leggero.
Rapporto carica-massa di un elettrone
Carica dell’elettrone
-1.60 x 10-19 C
Esperimento di Rutherford
Il nucleo dell’atomo è pesante e carico positivamente.
Le particelle alfa sono atomi di elio privati dei loro elettroni.
Il nucleo dell’atomo è pesante e carico positivamente.
La maggior parte della massa di un atomo
(>99,9 %) è concentrata nel nucleo, anche se il
volume del nucleo è molto più piccolo di quello
dell’atomo.
Numero atomico
Tutti gli atomi di uno stesso elemento hanno lo stesso
numero di protoni nel nucleo.
Questo numero è definito come il numero atomico di
un atomo.
Z = numero di protoni
In un atomo neutro il numero di protoni è uguale al
numero di elettroni.
Atomo di H: 1 protone, 1 elettrone, Z=1
Numero di massa e Isotopi
Il numero di massa (A) di un atomo è:
A = numero dei protoni + numero dei
neutroni.
Gli atomi di un dato elemento
possono differenziarsi nel numero di
neutroni !!!
Atomi con lo stesso numero atomico,
ma diverso numero di massa si
chiamano isotopi.
Numero
di massa
A
X
Z
elemento
Numero
atomico
Gli isotopi dell’idrogeno:
1H, 2H, 3H
1
1
1
La tavola periodica è una disposizione
di elementi ordinati secondo il numero
atomico crescente e in righe orizzontali
di lunghezza tale che gli elementi con
proprietà chimiche simili cadono
direttamente sotto l’uno o l’altro
gruppo verticale.
H
Gas
Li Be
Liquidi
B
C
N
O
F
Ne
Na Mg
Solidi
Al
Si
P
S
Cl
Ar
K
He
Ca
Sc
Ti
V
Cr Mn Fe Co
Ni
Cu
Zn Ga Ge As Se Br
Kr
Rb Sr
Y
Zr
Nb Mo Tc Ru Rh
Pd
Ag
Cd In Sn Sb Te
Xe
Cs Ba
Lu
Hf
Ta W Re Os
Pt
Au
Hg Tl Pb Bi Po At
Rn
Fr Ra
Lr
Rf
Db Sg Bh Hs Mt Uun Uuu
Ir
I
La
Ce
Pr
Nd
Pm Sm
Eu
Gd
Tb
Dy
Ho
Er
Tm
Yb
Ac
Th
Pa
U
Np
Am Cm
Bk
Cf
Es
Fm Md
No
Pu
Come atomi isolati si trovano in natura solo i gas
nobili: He, Ne, Ar, … In generale, gli atomi tendono a
combinarsi e a formare
molecole e ioni
Gli atomi sono uniti tra loro da grandi forze chiamate
legami covalenti. Le forze tra molecole adiacenti
sono, invece, abbastanza deboli.
Le molecole vengono rappresentate mediante
formule molecolari
H2O
CH4
NH3
H
H–O–H
H–N–H
H
H–C–H
H
e formule di struttura
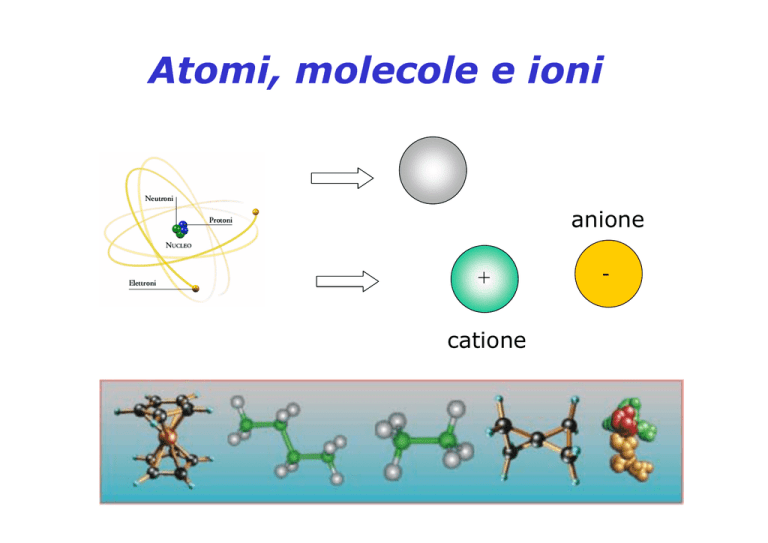
Ioni
Quando un atomo perde o acquista elettroni si
formano particelle cariche chiamate ioni.
Æ ione Na+ + e-
atomo Na
(11p, 11e)
atomo Ca
(11p, 10e)
Æione Ca2+ + 2e-
(20p, 20e)
(20p, 18e)
positivamente vengono
chiamati cationi.
Gli atomi carichi
Gli atomi dei non metalli formano ioni
negativi, che vengono chiamati anioni.
atomo Cl + e- Æ ione Cl(17p, 17e)
(17p, 18e)
atomo O + 2e- Æione O2(8p, 8e)
(8p, 10e)
Notate che in entrambi i casi il numero dei
protoni nel nucleo non cambia
Na+
O2-
Cl-
Ioni monoatomici
Ca2+
NO3-
Ioni poliatomici
NH4+
OH-
SO42-
Poiché un campione di materia è
elettricamente neutro, i composti ionici
contengono sempre sia cationi che anioni.
In ogni campione c’è
un ugual numero di
ioni Na+ e Cl-, ma
nessuna molecola
NaCl.
ClNa+
Cl-
Na+
Cl-
Na+
Cl-
Na+
Cl-
Na+
Cl-
Quando NaCl si scioglie in acqua, la soluzione che si
forma conterrà ioni Na+ e Cl-.
Poiché Na+ e Cl- sono particelle cariche, la soluzione sarà
in grado di condurre corrente elettrica e si dice che NaCl
è un
elettrolita forte.










