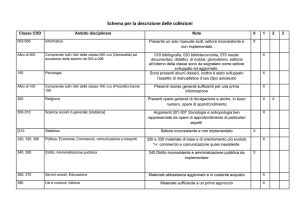
ic
at v
m
ie
te
ys Rew
i
S
ad I
l
ica
in
Cl
L
VA
u r E LL
a cORR
B
DO
OS
Ruolo dell’analisi molecolare
nel bambino
con sospetta diarrea congenita
Vincenza Pezzella e Roberto Berni Canani
Dipartimento di Medicina Traslazionale - Sezione Pediatrica, Laboratorio Europeo per lo Studio
delle Malattie Indotte da Alimenti (ELFID), Università degli Studi di Napoli "Federico II”
INTRODUZIONE
Le diarree congenite (CDD) sono un gruppo di rare enteropatie ereditarie caratterizzate da un tipico inizio nelle prime settimane di vita (1,2). Nonostante la
maggior parte di queste patologie sia caratterizzato da un quadro clinico in gran
parte simile, le cause, la gestione e la prognosi delle varie forme di CDD sono molto diverse. Per gran parte di queste condizioni, la diarrea cronica severa rappresenta la principale manifestazione clinica, più raramente la diarrea è soltanto una
componente di un quadro multiorgano più complesso. Nella maggior parte dei
casi, la terapia appropriata deve essere avviata immediatamente per prevenire la
disidratazione e gravi complicanze a breve e lungo termine (1). Esistono anche forme relativamente più lievi di CDD, con un quadro clinico meno grave e che possono rimanere non diagnosticate fino all’età adulta. Ad oggi, nella maggior parte dei
casi di CDD sono noti i geni responsabili di malattia. Pertanto, l'analisi molecolare
ha assunto un ruolo fondamentale nell’approccio diagnostico in queste patologie.
Recentemente abbiamo proposto una classificazione delle CDD in quattro gruppi in relazione al principale meccanismo fisiopatologico responsabile (3):
Congenital diarrheal
disorders (CDDs) are a group
of inherited enteropathies
with a typical onset early in
the life. Infants with these
disorders have frequently
chronic diarrhea of sufficient
severity to require parenteral
nutrition. For most CDDs
the disease-gene is known
and molecular analysis may
contribute to an unequivocal
diagnosis. We review CDDs
on the basis of the genetic
defect, focusing on the
significant contribution of
molecular analysis
in the complex, multistep
diagnostic work-up. New
entities were also presented.
I
II
III
IV
difetti di digestione, assorbimento e trasporto di nutrienti ed elettroliti
difetti di differenziazione e polarizzazione degli enterociti
difetti della differenziazione delle cellule enteroendocrine
difetti di modulazione della risposta immunitaria intestinale
Questa classificazione può essere un pratico punto di partenza per il complesso approccio diagnostico ai pazienti con sospetta CDD.
EPIDEMIOLOGIA
Come è facile osservare dai dati riportati in Tabella 1 fatta eccezione per il malassorbimento di fruttosio (FM) (3), le CDD sono generalmente molto rare. Alcune
CDD sono più frequenti nei gruppi etnici dove sono consueti le unioni tra consanguinei o in alcune aree geografiche a causa dell’effetto fondatore (2,3). In un
recente studio nazionale italiano, è stata descritta un’incidenza di 3 casi di CDD
su 5.810 neonati ricoverati per diarrea in terapia intensiva neonatale, in un periodo di tre anni (4). Uno studio della Società Italiana di Gastroenterologia Epatologia e Nutrizione Pediatrica (SIGENP nel 1999 denominata SIGEP) ha stimato che
le cause più comuni di CDD sono l’alterata modulazione della risposta immunitaria intestinale e i difetti di differenziazione e polarizzazione degli enterociti (5).
Key Words
Chronic diarrhea, genes,
enteropathies, prenatal diagnosis,
total parenteral nutrition
APPROCCIO DIAGNOSTICO
Il moderno approccio diagnostico alle CDD è un processo a più fasi che prevede
l'attenta valutazione dei dati anamnestici e clinici, i comuni esami di laboratorio
e l’analisi molecolare. In alcuni casi può essere necessario il ricorso a procedure
strumentali [Figura 1]. Una storia familiare positiva per diarrea cronica ad esordio
precoce, polidramnios e/o evidenza ecografica di anse intestinali dilatate durante la gravidanza sono elementi altamente suggestivi di CDD.
Giorn Gastr Epatol Nutr Ped 2013; Volume V(1):9-13
99
Clinical Systematic Rewiev
Tabella 1 Classificazione, Epidemiologia e Geni coinvolti nelle principali forme di CDD
Gene
OMIM
Esone
number
Nome
Posizione
Proteina
Trasmissione e incidenza
AR, 1:60.000 in Finlandia;
più bassa in altri gruppi etnici
AR, 1:5.000; più alta incidenza
in Groenlandia, Alaska e Canada
1. Difetti di digestione, assorbimento e trasporto di nutrienti ed elettroliti
Deficit congenito di lattasi (LD)
Deficit congenito
di sucrasi-isomaltasi (SID)
Deficit congenito
di maltasi-glucoamilasi (MGD)
Malassorbimento
glucosio-galattosio (GGM)
LCT (Lattasi)
603202
17
2q21.3
Lattasi-prolizina
ad attività idrolasica
SI (Sucrasi-Isomaltasi)
609845
48
3q26.1
Sucrasi-isomaltasi
MGAM
(Maltasi-Glucoamilasi)
154360
7q34
Attività maltasi-glucoamilasi
Pochi casi descritti
SLC5A1
182380
22q13.1
Cotrasportatore intestinale
Na/glucosio (SGLT1)
AR, poche centinaia di casi descritti
15
126650
21
7q31.1
SLC7A7
603593
11
14q11.2
SLC10A2
601295
6
13q33.1
CFTR
PRSS7
602421
27
25
7q31.2
21q21
Trasportatore
Glucosio/fruttosio (GLUT5)
Trasportatore basolaterale
di glucosio 2 (GLUT2)
Trasportatore Intestinale
zinco-specifico
Scambiatore
cloro/bicarbonato
Trasportatore
basolaterale di AA
Trasportatore ileale di Sali
biliari dipendente da sodio
CFTR
Inibitore di serina-proteasi
PRSS1
276000
5
7q34
Tripsinogeno cationico
SPINK1
167790
4
5q32
Inibitore della secrezione
di tripsina pancreatica
Deficit congenito di lipasi
pancreatica (APL)
PNLIP
246600
13
10q25.3
Lipasi pancreatica
Abetalipoproteinemia (ALP)
MTTP
157147
17
4q27
Proteina microsomiale
che trasferisce trigliceridi
AR, circa 100 casi descritti;
più alta la frequenza tra Ashkenazi
Ipobetalipoproteinemia
familiare (HLP)
Apo B
107730
26
2p24.1
Apolipoproteina B 100/48
Autosomica co-dominante
5q31.1
SAR 1B proteina che interviene
nel traffico intracellulare
di chilomicroni
AR, circa 40 casi descritti
19q13.2
Inibitore dell'attivatore
del fattore di crescita
degli epatociti (HGF)
AR
Sconosciuta
AR
Malassorbimento di fruttosio (FM) SLC2A5 (?)
Sindrome di Fanconi-Bickel (FBS)
138230
SLC2A2
Acrodermatite enteropatica (ADE) SLC39A4
Cloridorrea congenita (CCD, DIAR 1) SLC26A3
Intolleranza alla proteina
lisinurica (LPI)
Malassorbimento primitivo
di acidi biliari (PBAM)
Fibrosi Cistica (CF)
Deficit enterochinasi
1p36.2
138160
10
3q26.2
607059
12
8q24.3
Pancreatite ereditaria (HP)
Malattia da accumulo
di chilomicroni (CRD)
SAR1B
607690
Diarrea Congenita da perdita
di Sodio (CSD, DIAR 3)
SPINT2
(solo nella forma sindromica)
605124
SBDS
607444
Sindrome
di Shwachman-Diamond (SDS)
Diarrea associata a mutazione
di DGAT1
Diarrea familiare associata
a mutazione di GUCY2C
8
DGAT1
Sintesi di trigliceridi
GUCY2C
Gene codificante
la guanilato-ciclasi intestinale
più di 40%
AR, raro, più alta frequenza
tra consanguinei
AR, 1:500.000
AR, sporadico;
frequente in alcune etnie
AR, circa 1:60.000 in Finlandia
e Giappone; rara in altri gruppi etnici
AR
AR, 1:2.500
AR
AR, casi con mutazioni composte
in diversi geni; le mutazioni di SPINK1
possono provocare una pancreatite tropicale
2. Difetti nella differenziazione e polarizzazione degli enterociti
Atrofia congenita dei microvilli
(DIAR 2)
MYO5B
Enteropatia congenita a ciuffi
(DIAR 5)
EpCAM
Diarrea Sindromica
TTC37 SKIV2L
606540
185535
40
18q21.1
Miosina B
Molecole di adesione
di cellule epiteliali
Proteina con 20
tetratricopeptidi
AR, rara; più alta la frequenza tra Navajo
AR, 1:50-100.000; più alta tra gli Arabici
9
2p21
45
5q15
2
10q21.3
Fattore di trascrizione basico
elica-doppia-elica
AR, pochi casi descritti
5q15-q21
Enzima per elaborazione
della proinsulina di tipo I
AR
Xp11.23-q13.3
Fattore di trascrizione
X-linked, molto rara
21p22.3
Fattore di regolazione
autoimmunitario
AR, 1:400.000
3. Difetti nella differenziazione di cellule enteroendocrine
Diarrea congenita malassorbitiva
(CMD, DIAR 4)
NEUROG3
604882
Deficit di Proproteina convertasi
1/3 (PCD)
PCSK1
162150
4. Difetti di modulazione della risposta immunitaria intestinale
Dsfunzione immunitaria,
FOXP3
poliendocrinopatia, X-linked (IPEX)
Sindrome IPEX-like
11
Sconosciuto
Sindrome polighiandolare
AIRE
autoimmune tipo I (APSI) o APECED
10
304790
Enteropatia autoimmune
associata ad immunodeficienza
Sconosciuto
Enteropatia autoimmune
associata a colite
Sconosciuto
Non X-linked
607358
14
Giorn Gastr Epatol Nutr Ped 2013; Volume V(1):9-13
AR, AD (1 famiglia)
Ruolo dell’analisi molecolare nel bambino con sospetta diarrea congenita
Bisogna tener conto che anche durante le prime settimane di vita infezioni e allergie alimentari sono cause frequenti di diarrea cronica (3), e che tali condizioni, oltre alle malformazioni del tratto gastrointestinale, devono essere sempre preliminarmente escluse (1,2).
Un passo importante nel processo diagnostico della CDD è l'identificazione di una diarrea
conseguente a meccanismo osmotico o secretorio attraverso la misurazione degli elettroliti
fecali (Na+ e K+) [Figura 1]. È sempre importante misurare anche la concentrazione di Clnelle feci per escludere una cloridorrea congenita (CLD), caratterizzata da un’elevata perdita fecale di tale ione (> 90 mmol / L) (6). Successivamente grazie al risultato di altri esami
di laboratorio o strumentali e alla risposta ad eventuali diete speciali il percorso diagnostico
proseguirà sino all'analisi molecolare, oggi disponibile per la maggioranza dei casi [Figura 1].
DIAGNOSI MOLECOLARE
La maggior parte dei geni responsabili della CDD non sono particolarmente grandi, e
questo ha permesso di utilizzare tecniche come il sequenziamento genico per l'analisi
molecolare (1). La Tabella 1 mostra che solo in pochi casi non può essere eseguita una
diagnosi molecolare. L’analisi delle mutazioni nei geni responsabili di CDD può aiutare
a predire il fenotipo della malattia, sulla base dell'effetto della mutazione (una mutazione “nonsense” che abolisce completamente l'attività della proteina dovrebbe dar luogo
ad una malattia più grave di un “missense”, che coinvolge una regione di proteina con
Sospetto di CDD
Elettroliti fecali
Osmotica
Normale istologia/ME
Malassorbimento
generalizzato
Monosaccaridi
o formula
priva di CHO
Na>145mM/L
Sindrome
intestino corto
Normale lunghezza
intestino
Malassorbimento
di fruttosio
No infiammazione
Infiammazione
cronica estesa
alla lamina propria
Anti-cromogranina A
Tri<10mg/dl
Chol. 25-40mg /dl
No cellule enteroendocrine
con altre cellule normali
Abetalipoproteinemia
APOB
Ipobetalipoproteinemia
Normal TG e APOB
MTP
Fruttosio + formula
priva CHO
Neurog3
H2 test
glucosio
SGLT1
SARA2
Malattia da accumulo
di chilomicroni
Normali cellule
caliciformi di Paneth,
enteroendocrine
ed epiteliali
Anendocrinosi
enterica
Disendocrinosi
enterica
DRA
Cloridorrea congenita
No infiammazione
variabile astrofia dei villi
Colestiramina
ASBT
Malassorbimento
di acidi biliari primari
Enteropatia
Autoimmune
Epitelio a ciuffi
EpCAM
Foxp3
S.IPEX-like
Enteropatia a ciuffi
IPEX
Inclusioni microvillari
intracitoplasmatiche al ME
Enteropatia autoimmune
associata a immunodeficienza
Malassorbimento
di glucosio-galattosio
Sodiorrea
congenita
CI>90mM/L
Infiammazione cronica, iperplasia
delle cripte e astrofia dei villi
Rx
digerente
H2 breath test
al fruttosio
Normale istologia
Enterociti ricchi di grassi
Malassorbimento
di nutrienti specifici
Secretiva
MY05B
Enteropatia autoimmune
con colite
M. da inclusione
dei microvilli
AIRE
S. Polighiandolare
autoimmune
Sangue
Breath test
Trial dietetico/terapeutico
Analisi molecolare
Istologia
Elettroliti fecali
Figura 1 Indicazioni per un moderno approccio diagnostico alle principali forme di CDD
Giorn Gastr Epatol Nutr Ped 2013; Volume V(1):9-13
11
Clinical Systematic Rewiev
attività meno critica). Tuttavia, una chiara
correlazione genotipo-fenotipo non è sempre
facile da dimostrare. Inoltre, in alcune forme
di CDD come la CLD è stato suggerito il
ruolo di geni modificatori del fenotipo, ereditati indipendentemente dal gene-malattia (7).
Tabella 2 Analisi molecolare disponibili presso il nostro Centro
malattia
gene
Deficit congenito di sucrasi-isomaltasi (SID)
SI
Malattia da accumulo di chilomicroni (CRD)
SAR1B
RECENTI PROGRESSI
Malassorbimento di acidi biliari primari (PBAM)
SLC10A2
La ricerca nel campo delle CDD è molto
Acrodermatite enteropatica (ADE)
SLC39A4
attiva e nell’ultimo anno sono stati ottenuti
interessanti risultati con la dimostrazione di
Intolleranza alla proteina lisinurica (LPI)
SLC7A7
due nuove entità. In due fratelli appartenenti ad una famiglia di Ebrei Ashkenazi è stata
Cloridorrea congenita (CCD)
SLC26A3
identificata e caratterizzata una rara mutaMalassorbimento glucosio-galattosio (GGM)
SLC5A1
zione nel gene DGAT1, uno dei due enzimi
che catalizza la sintesi dei trigliceridi (8). La
Malattia da accumulo di microvilli (DIAR 2)
MYO5B
perdita di funzione in omozigosi è associata
Enteropatia a ciuffi (DIAR5)
EpCAM
a CDD e la mutazione riguarda una delezione dell'esone 8 e un allele nullo. Come il
Fibrosi Cistica (CF)
CFTR
deficit di DGAT1 provochi diarrea non è
SPINK1
ancora completamente chiaro, probabilPancreatite ereditaria (HP)
PRSS1
mente un accumulo di substrati lipidici come diacilgliceroli o acil CoA a livello intestinale risulta tossico per gli enterociti. Clinicamente entrambi i bambini presentavano pochi giorni dopo la
nascita vomito, dolori addominali, diarrea acquosa non ematica severa (8-10 evacuazioni/die), con sviluppo
di acidosi metabolica e disidratazione, enteropatia protido-disperdente (con valori di α1 anti-tripsina fecale
tra 8 e 20 mg/g e ipoalbuminemia). In entrambi i casi si è resa necessaria la nutrizione parenterale ed infusioni di albumina.
La seconda nuova condizione riguarda una forma di CDD di tipo secretivo secondaria ad una mutazione eterozigote missenso (c.2519G "T) nel gene GUCY2C (9). La sostituzione coinvolge il sito catalitico e probabilmente
altera l’attività guanilato-ciclasica del recettore della guanilina. La guanilina è un peptide secretivo endogeno in
grado di attivare la guanilato ciclasi e aumentare i livelli intracellulari di cGMP. L’esposizione del recettore mutante alla guanilina determina un abnorme aumento della produzione di cGMP in grado di provocare iperattivazione del CFTR con conseguente significativo aumento della secrezione di fluidi da parte degli enterociti. La
mutazione è stata identificata studiando 32 membri di una famiglia norvegese. Le caratteristiche cliniche ricorrenti tra i membri erano diarrea acquosa, meteorismo, dolori addominali, disidratazione, acidosi metabolica e
squilibri elettrolitici, distensione addominale e dilatazione delle anse del piccolo intestino.
Dati recenti, infine, si sono resi disponibili riguardo la diarrea sindromica/sindrome trico-epato-enterica (SD/
THE), una grave e rara malattia intestinale (prevalenza stimata 1/1.000.000 nascite, trasmissione autosomica
recessiva). Durante il loro decorso clinico, la maggior parte dei bambini richiede nutrizione parenterale e spesso
la supplementazione di immunoglobuline. La prognosi dipende dalla gestione ed è in gran parte relativa alla presenza di complicanze legate alla nutrizione parenterale o alle infezioni. Anche con una gestione ottimale, la maggior parte dei bambini riporta ritardo di crescita, bassa statura e lieve ritardo mentale nella metà dei casi. In uno
studio condotto in Francia, presso l’Università di Marsiglia, sono state individuate mutazioni a livello della RNA
elicasi SKIV2L (10). Questo gene, al pari di TTC37 (già in precedenza associato a questa condizione) codifica
per co-fattori del complesso SKI putativo umano. Il complesso SKI è un cofattore eterotetramerico che assicura
il controllo della qualità dei mRNA. La forma classica è caratterizzata da 9 segni clinici, di cui 5 si trovano in più
dei 2/3 dei pazienti: diarrea congenita severa ad esordio nel primo mese di vita che di solito porta a scarsa crescita e richiede nutrizione parenterale; dismorfismi facciali (caratterizzati da fronte prominente, radice nasale larga
ed ipertelorismo); anomalie dei capelli descritti come “lanosi” e fragili; anomalie immunitarie per difetto a carico
di immunoglobuline o della produzione di anticorpi; scarsa crescita intrauterina; anomalie cutanee come macchie caffè-latte o xerosi cutanea; epatopatie; difetti cardiaci; e anomalie del palato. Grazie a queste recenti evidenze la diagnosi SD/THE può adesso essere confermata dal sequenziamento diretto di TTC37 e SKIV2L.
12
Giorn Gastr Epatol Nutr Ped 2013; Volume V(1):9-13
Ruolo dell’analisi molecolare nel bambino con sospetta diarrea congenita
UN SITO DEDICATO
Per favorire l’approccio diagnostico-terapeutico al bambino con sospetta CDD
abbiamo recentemente creato un sito web dedicato a queste condizioni:
www.congenitaldiarrhealdisorders.net
La consultazione del sito permette, oltre alla conoscenza dei più recenti sviluppi in
queste patologie, anche un accesso rapido all’analisi molecolare ed altre procedure
diagnostiche. In Tabella 2 sono riportate le patologie in cui è disponibile l’analisi
molecolare presso il nostro Centro. Il sito funge, inoltre, da piattaforma per un
database dedicato ai pazienti. Questa banca dati fornirà informazioni utili per
futuri studi collaborativi.
RINGRAZIAMENTI
Il lavoro è stato supportato da un finanziamento dell’Agenzia Italiana del Farmaco
(prot. n° MRAR08W002)
Corresponding author
Vincenza Pezzella e Roberto Berni Canani
Dipartimento di Medicina Traslazionale - Sezione Pediatrica
Laboratorio Europeo per lo Studio delle Malattie Indotte da Alimenti (ELFID)
Università degli Studi di Napoli "Federico II"
Via Sergio Pansini, 5 - 80131 Napoli (NA)
Tel. + 39 081 7462680/3266
Fax + 39 081 5451278
E-mail: [email protected]
Key Points
Le diarree congenite (CDD)
•
sono un gruppo di rare e
severe enteropatie ereditarie, caratterizzate da un tipico
inizio nei primi giorni di vita.
• Nella maggior parte dei casi, la
terapia appropriata deve essere avviata immediatamente
per prevenire la disidratazione
e complicanze a volte anche
molto gravi.
• La maggior parte dei geni
responsabili della CDD non
sono particolarmente grandi, permettendo di utilizzare
tecniche come il sequenziamento genico per l'analisi
molecolare.
• L'approccio diagnostico alle
diarree congenite è un processo a più fasi che prevede
l'attenta valutazione dei dati
anamnestici e clinici, i comuni esami di laboratorio, le procedure strumentali e l’analisi
molecolare.
BIBLIOGRAFIA
1. Berni Canani R, Terrin G, Cardillo G et al. Congenital diarrheal disorders: improved understanding
of gene defects is leading to advances in intestinal physiology and clinical management. J Pediatr
Gastroenterol Nutr 2010;50:360-6.
2. Berni Canani R, Cirillo P, Terrin G. Chronic and intractabile diarrhea. In: Guandalini S, ed. Essential
pediatric gastroenterology hepatology and nutrition. Chicago: McGraw-Hill, Medical Publishing
Division 2005;25-47.
3. Terrin G, Tomaiuolo R, Passariello A et al. Congenital diarrheal disorders: an updated diagnostic
approach. Int J Mol Sci 2012;13:4168-85.
4. Passariello A, Terrin G, Baldassarre ME et al. Diarrhea in neonatal intensive care unit. World J
Gastroenterol 2010;16:2664-68.
5. Catassi C, Fabiani E, Spagnuolo MI et al. Severe and protracted diarrhea: results of the 3-year
SIGEP multicenter survey. Working Group of the Italian Society of Pediatric Gastroenterology and
Hepatology (SIGEP). J Pediatr Gastroenterol Nutr 1999;29:63-68.
6. Berni Canani R, Terrin G, Cirillo P et al. Butyrate as an effective treatment of congenital chloride
diarrhea. Gastroenterology 2004;127:630-34.
7. Salvatore F, Scudiero O, Castaldo G. Genotype-phenotype correlation in Cystic Fibrosis: the role of
modifier genes. Am J Med Genet 2002;111:88-95.
8. Haas JT, Winter HS, Lim E et al. DGAT1 mutation is linked to a congenital diarrheal disorder. J Clin
Invest 2012;122:4680-84.
9. Fiskerstrand T, Arshad N, Haukanes BI et al. Familial diarrhea syndrome caused by an activating
GUCY2C mutation. N Engl J Med 2012;366:1586-95.
10.Fabre A, Charroux B, Martinez-Vinson C et al. SKIV2L mutations cause syndromic diarrhea, or
trichohepatoenteric syndrome. Am J Hum Genet 2012 Apr 6;90(4):689-92.
Giorn Gastr Epatol Nutr Ped 2013; Volume V(1):9-13
13