CHEMIOTERAPIA
ANTINFETTIVA
IN ODONTOIATRIA
FABRIZIO MONTAGNA
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
FABRIZIO MONTAGNA
Dompé
Dompé
.
© Cierre Grafica - Verona
Prima edizione maggio 2003
L’Autore e l’Editore di quest’opera hanno posto ogni attenzione per garantire l’accuratezza dei dosaggi citati e il loro accordo con gli standard accettati al momento della pubblicazione. Tenendo però in considerazione la possibilità di errore umano e i continui aggiornamenti della scienza medica, gli autori e l’editore non possono garantire che
le informazioni ivi contenute siano accurate o complete in ogni loro parte; pertanto non possono essere ritenuti responsabili di eventuali errori od omissioni. In particolare il lettore dovrà verificare le informazioni specifiche che accompagnano il prodotto farmaceutico che intende somministrare per assicurarsi che non siano intervenute modificazioni nelle dosi raccomandate, né alle controindicazioni alla sua somministrazione. Tale verifica è particolarmente importante nel caso di farmaci di recente introduzione o utilizzati raramente.
Le poesie che accompagnano il testo sono tratte dal libro “Diario di una ricerca”, F. Montagna, Cierre Edizioni, 2003.
Edizione fuori commercio realizzata esclusivamente per Dompé S.p.A.
Omaggio ai Signori Medici.
Tutti i diritti sono riservati. Nessuna parte di questa pubblicazione può essere riprodotta o memorizzata in qualsiasi forma e con qualsiasi mezzo.
FABRIZIO MONTAGNA
CHEMIOTERAPIA
ANTINFETTIVA
IN ODONTOIATRIA
Dompé
Mattino
Appena stamane
fuori mi sorprese
l’aria fresca e tersa
di ieri e di domani
Sguardo forò le nuvole
nel grigio cielo turchino
su sino al timido sole
oltre il finito giardino
Il petto alla gola
mi spinse ad andare
felice al lavoro
per il solito nuovo
da dire e d’amare
domani come ieri
Libro
Allusioni di specchio falsato
o menzioni di vissuto
disseccato e conservato
si aggiungono e non deformano
il mondo quotidiano
Agito le mie catene
Espongo le mie pene
Scrivo cose già scritte
Tratteggio un ritratto
da cui chiaro emerge
molte volte il mio volto
Magico sogno di comunicare
che a tutti piacesse avrei piacere
5
Fabrizio Montagna è medico chirurgo, specialista in odontostomatologia, diplome Universitaire en Orthodontie,
direttore sanitario del Centro Servizi Odontoiatrici di Sommacampagna (VR). È professore a contratto presso l’università degli studi di Padova nel corso di Laurea in Odontoiatria dal 1995, nella scuola di specializzazione in Ortognatodonzia e di Chiriurgia Maxillo-Facciale. È autore di diversi libri e pubblicazioni in materia di medicina orale e prevenzione delle infezioni in odontoiatria dal 2000, tra i quali vanno ricordati i seguenti.
Libri
- Eroina, epatiti e AIDS in odontoiaria, MONTAGNA F, SERPELLONI F, Cierre Ed, 1994
- Prevenzione delle infezioni in odontoiatria: Epatiti e Aids, MONTAGNA F., Promoass Ed. 1996
- La responsabilità nella professione odontoiatrica, MONTAGNA F, DE LEO D, CARLI O, Promoass Ed. 1997
- Patologia orale orientata per problemi: diagnosi differenziale e terapia, MONTAGNA F, FERRONATO G,
MARTINELLI F, Promoass Ed. 2000
- Le patologie professionali del personale odontoiatrico e il contenzioso odontoiatra paziente, Masson Ed, 2002
- Lavorare al microscopio operatorio in odontoiatria, MONTAGNA F., DAL PONT F., Promodent Ed., in stampa.
Monografie di medicina orale
1. Il trattamento odontoiatrico del paziente con patologia cardiovascolare, MONTAGNA F, Promoass Ed.1998
2. Il trattamento odontoiatrico del paziente in gravidanza, nei primi anni di vita e disabile, MONTAGNA F, FERRO R, Promoass Ed.1999
3. Il trattamento odontoiatrico del paziente con allergia, patologia renale e gastrointestinale, MONTAGNA F,
SMACCHIA C, Promoass Ed, 1999
4. Il trattamento odontoiatrico del paziente con patologia broncopolmonare, neurologica e psichiatrica, MONTAGNA F, FERRONATO G, MARTINELLI F, Promoass Ed, 2000
5. Formulario di terapia farmacologica per l’odontoiatra. Linee ragionate di terapia per gruppo Anatomico Chimico Terapeutico (ATC), MONTAGNA F, FERRONATO G, Promoass Ed, 2000
6. Formulario di terapia farmacologica per l’odontoiatra. Linee ragionate di terapia per patologia odontostomatologica ed emergenza, MONTAGNA F, FERRONATO G, Promoass Ed, 2000
7. Effetti indesiderati e interazioni dei farmaci sistemici in odontoiatria. Prima parte, MONTAGNA F, Promoass
Ed, 2001
8. Effetti indesiderati e interazioni dei farmaci sistemici in odontoiatria. Seconda parte, MONTAGNA F, FERRONATO G, Promoass Ed, 2001
9. Il trattamento odontoiatrico del paziente con patologie sistemiche, MONTAGNA F, Promoass Ed, 2001
10. Epatiti virali e AIDS in odontoiatria, MONTAGNA F, Promoass Ed, 2001
11. Il dolore orofacciale, MONTAGNA F, Promoass Ed, 2002
12. Patologia di confine e assistenza medico-odontoiatrica condivisa, MONTAGNA F, Promoass Ed, 2002
13. Assistenza ORL e odontoiatrica condivisa, MONTAGNA F, Promoass Ed, 2002
14. Malattia focale odontogena, MONTAGNA F, Promoass Ed, 2002
Si ringrazia per la collaborazione, attenta e competente nei capitoli inerenti le reazioni avverse ai farmaci e le lesioni dermatologiche, il dott. Donato Calista, medico chirurgo, specialista in in Dermatologia e Venereologia, specialista in Malattie Infettive, dirigente di I° livello presso Unità Opertativa di Dermatologia dell’ospedale M. Bufalini
di Cesena.
La ricerca e l’esperienza clinica ampliano costantemente le nostre conoscenze soprattutto in relazione alle modalità
terapeutiche e ne consegue la necessità di un continuo aggiornamento dei parametri diagnostici e clinici. Le indicazioni e le dosi dei farmaci citati in questo manuale riportano le raccomandazioni riportate in letteratura internazionale; particolare cura è stata posta nel controllo dei dosaggi che, quando non diversamente specificato, si intendono
espressi per un paziente adulto, normopeso, in assenza di controindicazioni e interazioni. Poiché non è esclusa la possibilità di qualche errore; si consiglia al lettore si verificare attentamente se le indicazioni riportate nel testo abbiano
mantenuto la loro validità al momento di una futura consultazione; di prendere inoltre, visione del foglietto illustrativo che accompagna ogni preparazione farmaceutica.
I diritti di traduzione, di memorizzazione elettronica, di riproduzione e di adattamento totale o parziale con qualsiasi mezzo sono riservati. Le richieste per le pubblicazioni di seguito riportate, vanno inoltrate a: Montagna Fabrizio, via L. da Vinci, 1, Sommacampagna (VR), cap 36077, tel. 045515868.
Che cosa rimarrà
Il numero infinito
di oggetti di fatti
di sogni di immagini
che popolano lo spazio
muoiono con la morte dell’uomo
e scompaiono senza ritorno
o forse accadono una volta
e tornano ad accadere infinite volte
Quale forma o immagine
fuggevole e patetica
si perderà con la mia agonia
o lascerà più povero il mondo?
I miei affetti la mia casa
il mio lavoro il mio scrittoio.
il mio sforzo di perseverare
a essere ciò che sono
Non so perché mi meraviglio delle singole cose
Non esiste pietra sulla terra che persista
e l’oblio non cancelli o la memoria non trasformi
in forme future che nessuno sa come sono
I pensieri abbandonano il corpo mortale
e i semi degli affetti e dei sogni
con cura custoditi e tramandati
fioriscono immortali nel tempo
Motocicletta
Romba il vibrante ruggito il motore
Sibila nel casco il fischio del vento
Risale e riscalda il corpo il calore
Trema la mano sferzata dal vento
Lo sguardo attento è in avanti proteso
all’obiettivo fugace di un dosso
che si ripropone già superato
in un orizzonte nuovo e immutato.
Accennan strette le labbra un sorriso
il polso piega e accelera deciso.
Il mondo è alle spalle ormai sorpassato
e tutti i pensieri appena abbozzati
son come le strisce bianche sfrecciati
dietro un nero asfalto superato.
Così nella vita intensa d’eventi
pensieri in rapido moto abbozzati
veloce sfreccio verso nuovi orizzonti
con entusiasti sorrisi accennati
incredulo a un incidente finale
che inatteso m’attenda privo di male.
INDICE
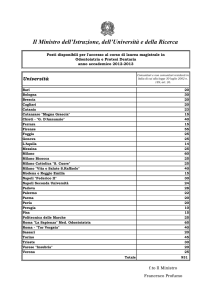
Introduzione ........................................................................................................................................... pag. 11
PARTE A - CHEMIOTERAPIA ANTIBATTERICA .......................................................... pag. 17
A.1 Parte generale ............................................................................................................................... pag. 19
1. PRINCIPI GENERALI DI FARMACOLOGIA ................................................................................ pag.
1.1 Nozioni di farmacocinetica ............................................................................................................... pag.
1.2 Nozioni di farmacodinamica ............................................................................................................. pag.
1.3 Antibioticoresistenza ......................................................................................................................... pag.
19
20
24
25
2. PRINCIPI DI ANTIBIOTICOTERAPIA ......................................................................................... pag.
2.1 Flora commensale e agenti patogeni .................................................................................................. pag.
2.1.1 Streptococchi ................................................................................................................................... pag.
2.1.2 Anaerobi ........................................................................................................................................ pag.
2.2 Scelta del chemioterapico antibatterico ............................................................................................. pag.
2.2.1 Indagini colturali ............................................................................................................................ pag.
2.3 Gestione e monitoraggio della terapia antibiotica .............................................................................. pag.
28
28
28
29
32
33
36
3. REAZIONI AVVERSE ...................................................................................................................... pag. 39
(F. Montagna, D. Calista)
A.2 Parte sistematica ........................................................................................................................... pag. 45
1. FAMIGLIE DI ANTIBIOTICI ......................................................................................................... pag.
1.1 Penicilline ......................................................................................................................................... pag.
1.2 Inibitori delle betalattamasi ............................................................................................................... pag.
1.3 Cefalosporine .................................................................................................................................... pag.
1.4 Macrolidi .......................................................................................................................................... pag.
1.5 Lincosamidi ...................................................................................................................................... pag.
1.6 Tetracicline ....................................................................................................................................... pag.
1.7 Nitroimidazoli .................................................................................................................................. pag.
1.8 Aminoglicosidi ................................................................................................................................. pag.
1.9 Chinoloni ......................................................................................................................................... pag.
46
46
47
47
52
53
53
55
55
55
A.3 Parte pratica .................................................................................................................................. pag. 57
1. RAZIONALE DI TERAPIA DELLE INFEZIONI BATTERICHE .................................................. pag. 57
1.1 Actinomicosi ..................................................................................................................................... pag. 57
1.2 Alveolite postestrattiva ...................................................................................................................... pag. 57
8
INDICE
1.3 Gengivite acuta necrotizzante ........................................................................................................... pag.
1.4 Infezioni odontogene superficiali ...................................................................................................... pag.
1.5 Infezioni odontogene profonde ......................................................................................................... pag.
1.6 Osteomielite ..................................................................................................................................... pag.
1.7 Parodontiti ....................................................................................................................................... pag.
1.8 Parotite batterica ............................................................................................................................... pag.
1.9 Perimplantite .................................................................................................................................... pag.
1.10 Sinusite odontogena ....................................................................................................................... pag.
57
58
62
64
68
71
72
74
2. OSPITI CON PROBLEMI SPECIALI .............................................................................................. pag.
2.1 Pedodonzia ....................................................................................................................................... pag.
2.2 Gravidanza ....................................................................................................................................... pag.
2.2.1 Modificazioni farmacocinetiche ....................................................................................................... pag.
2.2.2 Reazioni avverse .............................................................................................................................. pag.
2.2.3 Razionale di terapia antibiotica ....................................................................................................... pag.
2.3 Allattamento ..................................................................................................................................... pag.
2.4 Gerodontoiatria ................................................................................................................................ pag.
2.4.1 Modificazioni farmacocinetiche ....................................................................................................... pag.
2.4.2 Razionale di terapia antibiotica ....................................................................................................... pag.
2.5 Insufficienza epatica .......................................................................................................................... pag.
2.5.1 Modificazioni farmacocinetiche ....................................................................................................... pag.
2.5.2 Razionale di terapia antibiotica ....................................................................................................... pag.
2.6 Insufficienza renale ........................................................................................................................... pag.
2.6.1 Modificazioni farmacocinetiche ....................................................................................................... pag.
2.6.2 Razionale di terapia antibiotica ....................................................................................................... pag.
2.7 Dialisi ............................................................................................................................................... pag.
2.8 Ospite compromesso ........................................................................................................................ pag.
2.9 Allergia alle betalattamine ................................................................................................................. pag.
2.10 Intolleranza gastrointestinale ........................................................................................................... pag.
76
76
76
77
78
78
79
79
80
80
81
81
82
83
83
83
85
85
87
89
3. PROFILASSI ANTIBIOTICA ........................................................................................................... pag.
3.1 Endocardite infettiva ........................................................................................................................ pag.
3.1.1 Efficacia della profilassi ................................................................................................................... pag.
3.1.2 Stima del rischio di sviluppare l’EI ................................................................................................... pag.
3.1.3 Linee guida ..................................................................................................................................... pag.
3.2 Profilassi per protesi articolari ortopediche ........................................................................................ pag.
3.3 Protesi sistemiche .............................................................................................................................. pag.
3.4 Infezioni post-chirurgiche ................................................................................................................. pag.
3.4.1 Indicazioni ..................................................................................................................................... pag.
3.4.2 Schemi posologici ............................................................................................................................. pag.
92
92
92
94
95
97
99
101
101
103
PARTE B - CHEMIOTERAPIA ANTIMICOTICA ............................................................ pag. 105
1. FAMIGLIE DI ANTIMICOTICI ..................................................................................................... pag. 107
1.1 Antibiotici polienici .......................................................................................................................... pag. 107
1.2 Derivati azolici .................................................................................................................................. pag. 108
2. REAZIONI AVVERSE ...................................................................................................................... pag. 109
INDICE
3. RAZIONALE DI TERAPIA DELLE MICOSI .................................................................................. pag.
3.1 Candidosi orale ................................................................................................................................. pag.
3.2 Cheilite angolare ............................................................................................................................... pag.
3.3 Stomatite da protesi mobile .............................................................................................................. pag.
9
109
109
111
113
PARTE C - CHEMIOTERAPIA ANTIVIRALE ................................................................... pag. 115
1. FAMIGLIE DI ANTIVIRALI ............................................................................................................ pag. 117
2. RAZIONALE DI TERAPIA DELLE VIROSI ................................................................................... pag.
2.1 Gengivostomatite erpetica ................................................................................................................ pag.
2.2 Herpes simplex labiale e intraorale .................................................................................................... pag.
2.3 Herpes zoster .................................................................................................................................... pag.
118
118
118
121
PARTE D - ANTISETTICI ......................................................................................................... pag. 123
PARTE E - FARMACI ANTINFIAMMATORI NON STEROIDEI .............................. pag. 127
1. CLASSIFICAZIONE ......................................................................................................................... pag. 129
2. MECCANISMO D’AZIONE ........................................................................................................... pag. 129
3. EFFETTI COLLATERALI ................................................................................................................ pag.
3.1 Effetti gastrointestinali ...................................................................................................................... pag.
3.2 Effetti sulla coagulazione ................................................................................................................... pag.
3.3 Effetti sulla funzionalità epatica e renale ........................................................................................... pag.
3.4 Gravidanza, allattamento .................................................................................................................. pag.
132
132
132
132
133
4. SCELTA DEL FARMACO ................................................................................................................ pag. 133
5. MODALITÀ DI SOMMINISTRAZIONE ....................................................................................... pag. 133
PARTE F - ODONTOIATRIA LEGALE ................................................................................. pag. 135
1. RESPONSABILITÀ PROFESSIONALE IN ANTIBIOTICOTERAPIA .......................................... pag. 137
2. RESPONSABILITÀ PROFESSIONALE IN PROFILASSI ANTIBIOTICA .................................... pag. 137
3. FARMACOSORVEGLIANZA .......................................................................................................... pag. 139
PARTE G - APPENDICE ............................................................................................................. pag. 143
1. CARATTERISTICHE FARMACODINAMICHE DELLE PRINCIPALI FAMIGLIE
DI ANTIBIOTICI ........................................................................................................................... pag. 145
2. ANTIBIOTICI ELENCATI PER PRINCIPIO ATTIVO IN ORDINE ALFABETICO ................. pag. 146
3. CHEMIOTERAPICI ANTINFETTIVI SUDDIVISI PER FAMIGLIE .......................................... pag. 148
4. ANTIBIOTICI ELENCATI IN ORDINE ALFABETICO PER NOME COMMERCIALE .......... pag. 152
5. ANTISETTICI DEL CAVO ORALE .............................................................................................. pag. 155
6. ANTINFIAMMATORI TOPICI DEL CAVO ORALE ................................................................... pag. 157
PARTE H - BIBLIOGRAFIA ...................................................................................................... pag. 159
PARTE I - INDICE ANALITICO ............................................................................................. pag. 165
INTRODUZIONE
Quando mi proposero di preparare del materiale d’informazione scientifica in tema di antibioticoterarapia. Per impostare il lavoro eseguii la prima indagine presso amici, ricevendo risposte del tipo: “Per le infezioni uso… (amoxicillina), se il caso è più brutto…(amoxicillina con un inibitore delle betalattamasi), se è allergico… (macrolide).
Sempre per bocca”.
La tentazione fu forte di rimandare la richiesta al mittente con il nome di tre nomi commerciali su un biglietto.
Superato il fascino del paradosso, mi interessai all’argomento, giungendo alla banale conclusione che, come spesso
accade, ignoravo cose importanti e ragionavo di inutilità.
Svolgendo la ricerca bibliografica su internet, per supportare questo libro mi incuriosirono alcune interessanti indagini di farmaco-economia e farmaco-epidemiologia.
Non si trattava di nozioni nuove, quanto di studi che confermavano ciò che già sapevo o immaginavo, tali però da
stimolare alcune considerazioni.
Internet amplia l’informazione, ma non la cultura e questa introduzione, come del resto questo libro, non intendono fornire ricette, quanto stimolare nel dubbio la capacità di giudizio attraverso alcune provocatorie domande.
L’immagine che si deduce da questa introduzione, forse un po’ troppo appesantita di dati come tutte le revisioni della letteratura, è quello di una categoria odontoiatrica nel complesso ben preparata sul tema, sia pur con qualche incertezza e necessità di aggiornamento.
Spero di essere riuscito nell’intento di stimolare la vostra curiosità e se lo vorrete, potrete approfondire l’argomento
addentrandovi nella lettura di questo libro.
I principi generali: l’unica cosa su cui siamo tutti d’accordo
Esiste unanime accordo sui principi basilari della terapia antibiotica in odontoiatria che: va prescritta limitatamente alle infezioni batteriche non controllabili meccanicamente o chirurgicamente; risulta di tipo ragionato, cioè rivolta all’agente eziologico presunto per localizzazione e epidemiologia; utilizza antibiotici comuni, capostipiti di famiglie a bassa tossicità e costo, con spettro antibiotico stretto; è somministrata preferenzialmente per via orale.
Del resto altrettanto noti sono gli svantaggi di una scorretta prescrizione antibiotica che consistono nell’incremento dell’antibiotico-resistenza, delle reazioni avverse ai farmaci e dell’immotivata spesa sanitaria.
Il passaggio dai principi generali alla pratica clinica nasconde, però, numerose insidie.
Viaggiando su internet utilizzando le parole chiave “inappropriate or overuse and antibiotic and dentistry”, è possibile ritrovare diversi articoli recenti che analizzano le prescrizioni dei dentisti per correttezza di indicazioni, di tipo
di sostanze, di dosaggi e di durata, evidenziandone abitidini e qualche errore ricorrente.
Le metodiche di indagine si basano prevalentemente su due tipi di analisi statistica:
- questionari anonimi, composti da più sezioni e somministrati a vaste coorti di odontoiatri, che indagano conoscenze e abitudini in antibiotico-terapia
- moduli, preparati ad hoc e compilati nel corso dell’attività clinica, da campioni numericamente più ridotti, per
ogni intervento che abbia richiesto una prescrizione antibiotica svolta in un dato periodo di tempo.
Nessuna meraviglia sulla scarsità di studi nazionali; nel caso specifico siamo fortunati ad averne uno che, nonostante la non elevata rappresentatività statistica, merita tutela come specie rara.
La scelta dell’antibiotico mostra differenze nelle diverse nazioni:
paese che vai antibiotico che trovi?
I tipi di antibiotici prescritti non sono molti, come conferma un’indagine svolta su 17007 prescrizioni eseguite da
odontoiatri inglesi, che evidenziava come fossero utilizzati solo nove tipi di sostanze, prevalentemente di tipo generico (Palmer, Martin et al 2000).
L’amossicillina fa la parte del leone rappresentando, da sola in tutto il panorama mondiale, oltre il 50% delle prescrizioni, fatto sicuramente dovuto al suo ottimo assorbimento orale, spettro di azione corrispondente ai più frequenti patogeni orali e virtuale assenza di affetti tossici e controindicazioni.
La differenza, tra Italia e paesi anglosassoni, risiede prevalentemente nella diversa utilizzazione degli antibiotici di
seconda scelta; utilizziamo molto i macrolidi, mentre sono disconosciuti il metronidazolo e la clindamicina.
Uno studio recente svolto in Italia (Mazzaglia et al 2002) su 1615 moduli compilati da 33 dentisti nel corso dell’attività clinica riportava che l’antibiotico veniva prescritto: nel 23,6% dei casi per ascessi parodontali, nel 20,6%
per parodontite apicale acuta e nel 18,5% per disodontiasi del terzo molare.
Le penicilline erano la famiglia più frequentemente prescritta (40,1%), seguita dai macrolidi (30,2%) e dalle cefa-
12
INTRODUZIONE
losporine (13,4%). Le penicilline erano le più utilizzate dopo terapie chirurgiche (52,1%) e per la disodontiasi del
terzo molare (50,8%), mentre i macrolidi erano utilizzati più comunemente per le gengiviti (44,1%) e parodontopatie (55,0%).
La terapia parenterale era scelta nel 7,8% dei casi in relazione alla maggior gravità della sintomatologia generale, del
dolore e della compromissione linfonodale.
La bibliografia inglese è particolarmente ricca di dati sull’argomento.
Un’indagine svolta attraverso un questionario su 929 odontoiatri inglesi (Palmer, Pealing et al 2000) riportava l’amossicillina come l’antibiotico più frequentemente prescritto per tutte le situazioni cliniche; eccetto per la pericoronarite del dente del giudizio, la gengivite necrotizzante acuta e l’alveolite dove veniva preferito il metronidazolo.
Una successivo studio (Palmer, Dailey e Martin 2001) svolto su una coorte di 175 odontoiatri inglesi, riportava come sostanze più frequentemente utilizzate: l’amossicillina (57,6%), il metronidazolo (23,8%), le penicilline (9,3%),
l’eritromicina (4,8%) e le associazioni di amossicillina e metronidazolo (1,7%).
Si tratta di abitudini diverse, prive di una precisa motivazione scientifica, peraltro in accordo alle indicazioni riportate in letteratura.
Concetti comuni sono che il metronidazolo e la clindamicina sono particolarmente attive sui germi anaerobi gram
negativi, commensali del cavo orale e frequenti patogeni opportunisti nelle infezioni odontogene; l’antibioticoresistenza è del 6% per la clindamicina e assente per il metronidazolo; farmaci che nelle infezioni difficili vanno, comunque, associati alle penicilline per coprire anche i batteri aerobi gram positivi.
Nonostante questo in Italia nelle infezioni difficili da anaerobi si preferisce l’associazione amossicillina + acido clavulanico, di equivalente efficacia ma di costo maggiore.
Inoltre, nei pazienti allergici ai betalattamici, clindamicina e eritromicina sono equivalenti, anche per gli effetti indesiderati gastrointestinali ma soprattutto la prima risulta poco utilizzata; meno indicati per motivi di farmacoeconomia altri i macrolidi più recenti e più costosi di frequente utilizzazione in Italia.
La profilassi antibiotica:
tra immaginazione e realtà nell’applicazione pratica dei principi generali
Un’indagine svolta mediante un questionario su 506 odontoiatri canadesi (Epstain et al 2000) riportava che l’85%
delle terapie era appropriata con una media di 4,45 prescrizioni alla settimana, prevalentemente a base di penicilline, con una durata media della terapia di 6,92 giorni. Il dosaggio raccomandato era rispettato per le penicilline nel
59,2% dei casi e per l’amossicillina nel 72,2%.
La profilassi antibiotica era prescritta 1,15 volte alla settimana, prevalentemente prescritta prima di interventi chirurgici, in pazienti con anamnesi di malattia reumatica, soffi cardiaci, artroprotesi d’anca e nei pazienti con infezione da HIV, più che per altri motivi.
Il 17,5 % degli odontoiatri riportava la durata della profilassi per l’endocardite batterica da 1 a 7 giorni, con una
media di 6,91 dosi somministrate dopo l’intervento.
Nella profilassi antibiotica, quindi, vi era il maggiore, per quanto contenuto, scostamento tra affermazioni e realtà
clinica: la maggior parte degli odontoiatri dichiarava di seguire le linee guida dell’American Hearth Association per
la profilassi dell’endocardite batterica; ma in pratica si rilevavano notevoli discrepanze spesso con terapie immotivatamente lunghe, ben diverse dalla ultrashort (monosomministrazione 1 ora prima dell’intervento) o short prophilaxis (bisomministrazione 1ora prima e 6 ore dopo l’intervento) attualmente raccomandate.
Rimane peraltro irrisolto il problema della identificazione dei pazienti candidati a profilassi dell’endocardite, data
l’inattendibilità negli anziani che nel 14% non riportano all’anamnesi la presenza di un soffio cardiaco e che solo il
78% di tutti i pazienti è al corrente della necessità di una profilassi antibiotica (Randall, 2001; Vogel 2000).
I peccati veniali nella prescrizione del dentista: quanto, quando e come sbaglia.
La prescrizione d’urgenza è la fonte di errore più frequente
Un’indagine svolta su 17007 prescrizioni eseguite da odontoiatri inglesi evidenziava che venivano utilizzati nove tipi di antibiotici, prevalentemente di tipo generico e che molte prescrizioni erano inappropriate per frequenza, dosaggio e durata (Palmer, Martin et al 2000).
Un’indagine svolta attraverso un questionario su 929 odontoiatri inglesi evidenziava che la prescrizione di antibiotici variava considerevolmente e risultava talvolta subottimale (Palmer, Pealing et al 2000).
Il 95% riconosceva la necessità di antibiotici in caso di infezione con tendenza alla diffusione; ma il 12,5% prescriveva antibiotici in caso di pulpite acuta; il 3,35% per le gengiviti marginali croniche; il 69% prescriveva antibiotici
prima del drenaggio di un ascesso acuto e il 23% dopo.
Lo stesso studio riportava che gli odontoiatri dichiaravano di non essere influenzati dalla aspettativa del paziente di
ricevere antibiotici (92%) ma di prescriverli quando si trovavano in ristrettezza di tempo (30.3%), erano incapaci
di formulare una diagnosi definitiva (47,3%) o dovevano ritardare il trattamento (72,5%).
INTRODUZIONE
13
La prescrizione antibiotica in urgenza risultava spesso inappropriata in un’indagine svolta su 1.069 pazienti che si rivolgevano a 5 cliniche dentali inglesi (Dailey e Martin 2001), considerando che il 65% lamentava dolore da ascesso
e il 35% pulpite, ma nel 74% dei casi veniva prescritto un antibiotico senza alcun intervento terapeutico chirurgico.
Non lasciatevi impressionare dall’ordine di esposizione, le statistiche non costituiscono un giudizio di per sé stesse,
ma testimoniano per ambedue le parti; questi dati confermano le affermazioni già citate di Epstain che stima le prescrizioni corrette nell’85% dei casi.
Le indicazioni vengono generalmente rispettate, ma permane una tendenza all’iper-prescrizione in alcune situazioni come: la difficoltà di una diagnosi precisa, spesso per mancanza di tempo; la sopravvalutazione del rischio di diffusione dell’infezione, anche in casi dove la terapia non è indicata, come ad esempio la pulpite acuta o infezioni banali risolvibili con il drenaggio o l’apertura della camera pulpare.
Le differenze interprofessionali: parodontologi versus odontoiatri generici
Le differenze interprofessionali tra odontoiatri con diverse competenze non sembrano rilevanti; pur confermandosi il principio che i meno aggiornati tendono a sottovalutare la fase di diagnosi e di preparazione manuale e a iperprescrivere antimicrobici.
Differenze emergevano sull’uso degli antibiotici in parodontologia in una indagine che coinvolgeva 587 odontoiatri in Inghilterra (Cloudhury et al 2001).
L’uso di antibiotici sistemici nella terapia della parodontite cronica dell’adulto era del 7,4% per i parodontologi e il
18% tra gli odontoiatri generici; peraltro gli specialisti prescrivevano l’antibiotico su indicazione specifica (in presenza di diagnosi di parodontite a inizio precoce e di parodontite refrattaria).
Gli antimicrobici locali erano utilizzati dall’8,9% dei parodontologi e dal 5,4% dei generici; peraltro gli specialisti
prescrivevano l’antibiotico specificatamente nelle parodontite recidivanti (26,3% versus 14,8%) e parodontite refrattarie (30,8% versus 15,2).
Gli specialisti, rispetto i generici, risultavano più aggiornati e più propensi a impiegare un periodo di tempo di almeno 45 minuti per il root planning di un quadrante (33% versus 3,8%).
Le differenze intraprofessionali medici versus dentisti: i medici prescrivono più dei dentisti.
Il falso mito della scarsa preparazione dei dentisti in farmacoterapia
Come facilmente intuibile per le patologie dentarie acute i medici sono più propensi a prescrivere, soprattutto antibiotici a più largo spettro, nei confronti dei dentisti; in omaggio al principio generale che chi meno sa, più prescrive farmaci.
Dall’analisi delle registrazioni di 1185 prescrizioni antibiotiche eseguite in diverse strutture inglesi di medicina generale e odontoiatria emergevano i seguenti dati (Anderson et al 2000): al 68% dei pazienti che si rivolgevano a medici veniva prescritto un antimicrobico, in contrapposizione al 28% di quelli trattati da odontoiatri. Il rapporto rimaneva invariato nelle situazioni di urgenza durante il fine settimana, con un rapporto del 52% in strutture mediche contro il 38% di strutture odontoiatriche.
La differenza interprofessionale giustifica iniziative di aggiornamento e formazione professionale tese a razionalizzare la prescrizione antibiotica: i medici generici dovrebbero essere istruiti sul corretto uso dei farmaci nelle patologie odontoiatriche; mentre i dentisti dovrebbero approfondire i criteri che condizionano la terapia in pazienti con
patologie sistemiche e la profilassi nei casi discrezionali (artroprotesi, immunocompromissione, ecc).
Il ruolo della formazione e dell’audit: quale utilità per l’odontoiatra?
Amara sorpresa per chi vede come fumo negli occhi la formazione continua obbligatoria, i dati disponibili sull’efficacia dei corsi di formazione sul miglioramento delle prescrizioni, sono incoraggianti.
Secondo uno studio svolto su un campione di 1338 odontoiatri inglesi, eseguito mediante un questionario per valutare la necessità di iniziative di formazione, le conoscenze erano reputate: soddisfacenti per i segni clinici e extraclinici (aspettative dei pazienti) che condizionavano la prescrizione; ma povere per quanto riguardava i criteri da seguire in presenza di pazienti con patologie sistemiche e di necessità di profilassi. Gli odontoiatri che avevano frequentato un corso di terapia antibiotica nei precedenti 2 anni erano il 22% e mostravano una conoscenza notevolmente superiore rispetto altri colleghi privi di aggiornamento (Palmer, Martin et al 2001).
L’efficacia dei programmi di formazione, era verificata attraverso uno studio eseguito su una coorte di 175 odontoiatri
inglesi prima e un aggiornamento in antibiotico-terapia (Palmer, Dailey e Martin 2001): il numero delle prescrizioni si
riduceva del 42,5%, da 2316 nelle sei settimane prima dell’audit a 1330 in un uguale lasso di tempo successivo.
Alcune considerazioni conclusive
Nell’ultimo decennio la chemioterapia delle patologie infettive ha visto realizzarsi alcuni cambiamenti riconducibili alla comparsa sulla scena epidemiologica di ceppi con scarsa sensibilità ai chemioterapici tradizionali e alla evolu-
14
INTRODUZIONE
zione qualitativa e quantitativa di alcune famiglie di farmaci (ad esempio le cefalosporine, i chinoloni di ultima generazione) che hanno portato alla produzione e alla commercializzazione di numerose, nuove sostanze da parte dell’industria farmaceutica.
Di fronte alla proliferazione di nuovi chemioterapici è indubbio che l’odontoiatra si trovi oggi spesso in difficoltà
nella scelta, soprattutto a causa di un’informazione che talvolta risulta carente o parziale.
Numerosi studi sono stati condotti in diversi paesi per controllare le modalità di prescrizione degli antibiotici per
infezioni del cavo orale, evidenziando notevoli differenze tra sanitari nell’applicazione delle raccomandazioni riportate dalle linee guida e dalle indicazioni normalmente accettate dalla comunità scientifica internazionale.
Esiste una notevole differenza nella frequenza delle prescrizioni antibiotiche tra medici e odontoiatri: ai 2/3 dei pazienti che si rivolgono ai medici generici per problemi odontoiatrici viene prescritta una terapia antibiotica; mentre
tra coloro che si rivolgono al proprio odontoiatra solo 1/3 sono trattati con chemioterapici antinfettivi.
In media un dentista esegue circa 5 prescrizioni di antibiotico in una settimana con una durata media di soministrazione di 7 giorni, circa una volta alla settimana la prescrizione ha carattere di profilassi per l’endocardite infettiva, per la presenza di protesi articolari o per prevenzione delle complicanze chirurgiche.
Del resto pur riconoscendo che l’80% delle terapie eseguita da odontoiatri è corretta si riscontra una considerevole
variabilità nei dosaggi, frequenza e durata delle prescrizioni in condizioni diverse.
Sussiste, ad esempio, una maggior tendenza a prescrivere antibiotici quando non sia possibile eseguire una diagnosi definitiva o vi sia difficoltà a seguire il paziente per situazioni di ristrettezza di tempo legata alla gestione degli appuntamenti o nel fine settimana.
In linea generale gli odontoiatri non si aggiornano con regolarità sull’antibioticoterapia e solo una minoranza risulta
aver frequentato corsi di aggiornamento sull’argomento specifico negli ultimi due anni, mostrando, sulla base di questionari, una scarsa conoscenza sulla chemioprofilassi e sull’uso di antibiotici in pazienti con patologie sistemiche.
Per contro l’utilità di programmi di formazione sull’argomento è dimostrata dal fatto che odontoiatri, sottoposti a
indagine statistica prima e dopo un programma di audit, diminuisce di circa la metà la frequenza delle prescrizioni
antibiotiche.
Anche la scelta dello specifico antibiotico mostra considervoli differenze in diversi Paesi, pur confermando l’amoxicillina come l’antibiotico più frequentemente prescritto.
L’antibiotico più usato risulta l’amoxicillina seguita nel Regno Unito da metronidazolo, altre penicilline e eritromicina; mentre in Italia gli antibiotici maggiormente utilizzati, accanto alla amoxicillina che rappresenta comunque i
due terzi delle prescrizioni, sono le penicilline, i macrolidi e le cefalosporine.
La somministrazione parenterale rappresenta più l’eccezione che la regola.
La profilassi antibiotica dell’endocardite infettiva è un argomento standardizzato dalle linee guida dell’Americam
Hearh Association (AHA) accettate in ambito internazionale dalla maggior parte delle Associazioni Dentali.
Nell’applicazione pratica gli odontoiatri, pur dichiarando di seguire le linee guida dell’AHA, nell’applicazione della profilassi antibiotica dell’endocardite infettiva mostrano difformità dai protocolli con variazioni della durata che
variano tra 1 e 7 giorni.
Le differenze sono ancora maggiori dove le indicazioni rivestono carattere facoltativo come nella profilassi antibiotica in chirurgia orale e sono, quindi, lasciate al giudizio clincico di operatori con diverse esperienze e convinzioni
personali.
Sulla base delle considerazioni emerse dalle differenze sopraesposte è nata l’idea di questo pubblicazione, con fini eminentemente pratici e dedicata agli odontoiatri che lavorano in regime extraospedaliero; come agile punto di riferimento che non intende essere nulla di più che un manuale di antibioticoterapia da mantenere a portata di mano.
Un ringraziamento particolare va rivolto a Dompé per aver voluto stimolare e sostenere questo progetto, un’azienda farmaceutica da sempre impegnata sul fronte etico e deontologico al servizio della medicina e dell’odontoiatria,
nell’ideale di una sempre migliore qualità del servizio e dell’assitenza ai cittadini.
Ci rendiamo conto che ogni giudizio e ogni scelta logica alla base dell’impostazione di questo lavoro, possono essere incompleti o rivedibili; ma riteniamo che possano rappresentare il punto comune di partenza per un più ampio
dibattito utile per la formazione culturale e l’aggiornamento continuo degli odontoiatri, nell’interesse della tutela
della salute della società.
Sommacampagna, 1 maggio 2003
Montagna Fabrizio
15
INTRODUZIONE
Sagra
Nella confusione
di luci rumori e persone
in una sera di fine estate
frastornato annoiato
ti guardo girare eccitato
su vecchie giostre scrostate.
Inarchi il petto per aiutare
il goffo giostraio a sfilare
dalla tasca i gettoni.
Controlli se disponi
ancora di giri e di quanti
per me sono sempre tanti.
Le tue braccia tese
che la coda afferrano
sono vittorie che mi prendono.
Sulla strada di casa
ti sei addormentato
sulle mie spalle appoggiato.
Oggi ho consegnato
alle stampe la fatica
di un libro di chimica.
Ma di tutto lo scibile
mi rimane solo indelebile
il tuo peso abbandonato.
Medico
Cinismo tecnico
mitigato dal timore
Rigore logico
intriso d’affetto e amore
Infantile pragmatica
fede d’adulto inverno
nel tempo senza dolore
nella vita senza eterno
cielo senza redentore
Regge l’antico ricordo
del sogno di un ruolo
nel quotidiano lavoro
insieme mai solo
Conferenza
Molti che parlano
per alimentare
il proprio clamore.
Non comunicano,
per il proprio amore,
con quanti ascoltano.
Lor reali immagini
convinti mostrano.
Né, aridi, sognano
né danno emozioni.
Bancarotta di valori
Disconoscere il valore reale
e un atto superfluo elevare
a dogma universale.
Un improponibile fine rincorrere
illudendosi grande e importante
come un nano all’ombra di un gigante.
Coronare un sogno triviale
e perplessi rimedio porgere
con un nuovo ideale.
Dalla nevrosi lasciarsi travolgere
e perdere il valore del futile
e l’importanza dell’inutile.
Non rispondere alla vita che passa
per riproporre a distanza fisse
domande irrisolte, sempre le stesse.
PARTE A
CHEMIOTERAPIA
ANTIBATTERICA
.
A.1 PARTE GENERALE
Il termine antibiotico deriva dalla parola antibiosi, coniata da Willermen nel 1889, per descrivere, in una accezione generale, la concorrenza che si genera tra gli
stessi esseri viventi,“la vita che impedisce la vita” secondo la definizione di Pasteur.
Nell’accezione più ampia del termine sono compresi sia
agenti antimicrobici che antitumorali; in senso restrittivo antibiotico indica i farmaci di origine biologica e
chemioterapico quelli di sintesi chimica.
Oggi antibioticoterapia e chemioterapia antinfettiva
sono considerati sinonimi di terapia antimicrobica e
comprendono la terapia antibatterica, antimicotica e
antivirale.
Idealmente l’antibioticoterapia per via sistemica dovrebbe essere selettiva, atossica, rapida, economica e di
facile somministrazione; ma è inevitabile che essa debba rappresentare un compromesso tra vari aspetti inerenti l’ospite, il microrganismo e il farmaco (figura
1.1).
Si deve rispettare il principio basilare di limitare la prescrizione a quelle situazioni in cui la presenza di infezione batterica è certa o altamente probabile; evitando
l’uso indiscriminato in situazioni non necessarie che,
oltre l’inefficacia clinica, presentano il rischio di reazioni avverse, aumento delle resistenze e del costo sociale.
In medicina si distinguono diverse modalità nella scelta del tipo di antibioticoterapia:
- ragionata che, in assenza dell’isolamento batterico, si
basa sulla diagnosi eziologica presuntiva, fondata sulla localizzazione dell’infezione e sull’epidemiologia
dell’infezione stessa (figura 1.2)
- mirata presuppone l’isolamento del germe e la determinazione della sua sensibilità agli antimicrobici
- empirica si attua precocemente in pazienti febbrili ad
alto rischio (ospiti compromessi, come ad esempio i
neutropenici) per evitare gli effetti gravi che comporterebbe il ritardo necessario per instaurare una terapia microbica mirata.
Nella odontoiatria sia il tipo di antibiotici, che le modalità terapeutiche utilizzate, sono generalmente limitate nei confronti della prassi medica e la maggior parte degli odontoiatri, che lavora in regime extraospedaliero, utilizza normalmente terapie ragionate, per via
orale e in cicli brevi di 5-7 giorni.
1. PRINCIPI GENERALI
DI FARMACOLOGIA
Come tutte le discipline anche la farmacologia ha il
proprio vocabolario e linguaggio che comprende termini come farmacocinetica, farmacodinamica, meccanismo d’azione, spettro antibatterico e resistenza.
In estrema sintesi, richiamandoci allo schema di interazione tra farmaco-paziente-batterio, possiamo schematizzare le seguenti definizioni:
- la farmacodinamica descrive l’azione del farmaco sul
paziente
Terapia ragionata
germe
Diagnosi di localizzazione
ospite
farmaco
Dati
epidemiologici
Caratteristiche
della sede
Esigenze
di spettro
Esigenze
farmacocinetiche
(diffusibilità)
Scelta dell’antibiotico
Figura 1.1 - Interazione tra patogeno microbico, agente
antimicrobico e ospite
Figura 1.2 - Chemioterapia antibatterica ragionata
20
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
- la farmacocinetica illustra l’azione subita dal farmaco
da parte del paziente
- il meccanismo d’azione e lo spettro antibatterico l’azione del farmaco sul microrganismo
- la resistenza, l’azione sul farmaco da parte del microrganismo.
Queste conoscenze sono essenziali per comprendere
l’azione dei farmaci e i meccanismi relativi a cui si farà
costantemente riferimento nel testo; in particolare per
spiegare gli adattamenti terapeutici necessari in presenza delle modificazioni farmacocinetiche indotte da patologie sistemiche negli ospiti con speciali problemi di
terapia.
1.1 Nozioni di
farmacocinetica
La farmacocinetica è quella branca della farmacologia
che studia il destino di un farmaco dal momento della
sua introduzione nell’organismo sino alla sua eliminazione. Le tappe fondamentali della cinetica sono l’assorbimento, il trasporto, la distribuzione e l’eliminazione (tabella 1.3).
L’assorbimento è quella fase che permette al farmaco di
giungere dalla sede di somministrazione al torrente circolatorio.
Questa fase manca, pertanto, nella somministrazione
endovenosa ed è tipica della via orale, intramuscolare,
rettale, sublinguale, topica, etc.
Durante l’assorbimento il farmaco deve passare attraverso una o più membrane cellulari, prevalentemente
costituite da strati lipidici. In genere si tratta di un fenomeno passivo dipendente dalla lipofilia del farmaco,
dal suo grado di ionizzazione (pH dipendente), tenendo presente che la quota non ionizzata è quella liposolubile, mentre la ionizzata è idrosolubile.
L’assorbimento orale varia tra le diverse sostanze delle
stesse famiglie di antibiotici e è condizionato dalle caratteristiche chimico-fisiche degli antibiotici (tabella 1.4):
- liposolubilità (tabella 1.5)
- assunzione contemporanea di cibo (tabella 1.6, 1.7)
- acido-resistenza (per l’inattivazione da parte dei succhi gastrici)
- pH che determina la sede dell’assorbimento; le sostanze acide sono assorbite nello stomaco e quelle basiche nell’intestino (tabella 1.8).
La biodisponibilità indica la capacità di assorbire un
farmaco ed esprime la percentuale della dose somministrata che è in grado di raggiungere il torrente circolatorio.
La velocità d’assorbimento e la biodisponibilità dopo
somministrazione intramuscolare dipendono dalla solubilità del farmaco nei liquidi interstiziali, dall’efficienza del circolo periferico e dalla permeabilità della
parete capillare.
Per i farmaci somministrati per via orale si distinguono:
- una biodisponibilità farmaceutica che presuppone la
liberazione del farmaco dalla sua formulazione farmaceutica; l’assorbimento è più rapido per le formulazioni liquide e micronizzate e più lento per quelle
in capsule o compresse
Antibiotico
legato
Plasma
Depositi
tessutali
Antibiotico
non legato
Sito
d’azione
Trasporto
Distribuzione
Assorbimento
Metabolita
Eliminazione
Metabolizzazione
Figura 1.3 - Schema dei
processi farmacocinetici
21
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tabella 1.4 - Assorbimento orale
Antibiotico
Assorbimento
gastroenterico (%)
PENICILLINE
Amoxicillina
Acido clavulanico
74-92
75
CEFALOSPORINE
Cefaclor
Cefuroxime axetil
Cefixime
Cefpodoxime proxetil
Ceftibuten
Cefprozil
35-40* 70-80** (2)
30-40* 50-60** (2)
40 (2)
40* 60** (1)
80 (2)
94 (1)
MACROLIDI
Eitromicina
Claritromicina
Azitromicina
40-50
60 (2)
40 (2)
TETRACICLINE
Clortetraciclina, ossitetraciclina
Doxiciclina, minociclina
75
95
CLINDAMICINA
METRONIDAZOLO
90
90
Tabella 1.5 - Solubilità
Idrosolubili
Liposolubili
Penicilline
Cefalosporine
Tetraciline classiche
(tetraciclina, ossitetraciclina)
Macrolidi
Lincosamidi
Metronidazolo
Tetracicline moderne
(doxiciclina, minociclina)
Tabella 1.6
Influenza della presenza di cibo sull’assorbimento
Non influenza
Amoxicillina
Amoxicillina/acido clavulanico
Bacampicillina
Eritromicina etilsuccinato
Cefprozil
Cefalexina
Doxiciclina
Minociclina
Metronidazolo
Diminuzione
Ampicillina
Clindamicina
Macrolidi (alcuni)
Tetracicline classiche
Aumento
Ketoconazolo
* a digiuno ** dopo mangiato
(1) RCP
(2) Antibiotici Prontuario per l’uso II, ed. Minerva Medica 1999
Tabella 1.7 - Interazioni farmacoalimenti e biodisponibilità degli antibiotici più comunemente usati
Principio attivo
Interazioni con il cibo
Amoxicillina + acido clavulanico
Per migliorare l’assorbimento e la tollerabilità gastrointestinale se ne consiglia la
somministrazione subito prima del pasto (1)
Proxetil cefpodoxima
Si raccomanda di somministrare il prodotto durante i pasti per migliorarne l’assorbimento (1)
Cefaclor
La presenza di alimenti ritarda le concentrazioni massime nel siero; la biodisponibilità è dimezzata se assunto a stomaco pieno (2) (3)
Cefprozil
La presenza di alimenti non influenza la biodisponibilità del farmaco (1)
Cefixime
La presenza di alimenti non influenza la biodisponibilità del farmaco (1) (3)
Acetossietilcefuroxima
Acetossietilcefuroxima va assunto con i pasti per garantire un assorbimento ottimale la biodisponibilità dimezzata se assunto a stomaco pieno (1) (3)
Ceftibuten
Per un migliore assorbimento, si raccomanda l’assunzione del prodotto lontano dai pasti (1) (3)
Azitromicina
L’assunzione di cibo prima della somministrazione del prodotto può attenuare gli eventuali effetti indesiderati di tipo gastrointestinale causati dall’azitromicina (1) (3)
(1) RCP
(2) Barbhaiya RH., “Compatison of the effects of food on pharmacckinetics of cefprozil and cefaclor”, Antimicrobial Agents and Chemotherapy, June 1990; 1210-1213
(3) Antibiotici prontuario per l’uso II, ed. Minerva Medica 1999
22
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tabella 1.8
Caratteristiche acido basiche
A carattere acido
A carattere basico
Penicilline
Cefalosporine
Chinoloni
Tetracicline
Aminoglicosidi
Macrolidi
Lincosamidi
Metronidazolo
- una biodisponibilità farmacologica che consiste essenzialmente nell’assorbimento attraverso la mucosa
gastroenterica e nella sua parziale metabolizzazione
nel primo passaggio a livello epatico (first pass effect).
Nella fase di trasporto nel sangue il farmaco può essere
presente in soluto o legato alle sieroproteine (tabella
1.9):
- la quota libera diffonde nei tessuti e nel liquido interstiziale, è microbiologicamente attiva ed è eliminabile dagli emuntori
- la quota legata (in genere all’albumina) è in equilibrio con la quota libera. Alcuni chemioterapici entrano in competizione con altre sostanze, determinando uno spiazzamento che influisce sulla quota libera dei farmaci e sull’effetto terapeutico o tossico.
Il processo di distribuzione permette la diffusione tissutale di un farmaco, che dipende da più fattori:
- irrorazione tissutale
- coefficiente di ripartizione lipidi/acqua
- stato di ionizzazione del farmaco
- legame con le sieroproteine
- peso molecolare
- gradiente di concentrazione tra sangue e tessuti.
Il volume apparente di distribuzione (VAD o Vd)
esprime la capacità dei farmaci di diffondere in sede extravascolare ed è espressa in l/kg o l/mq di superficie
corporea.
In alcuni organi il passaggio di sostanze presenti nel
sangue è condizionato da una vera e propria barriera
anatomica come la barriera emato-liquorale e la barriera placentare (quest’ultima molto meno efficace).
Alcuni antibiotici vanno incontro a processi di metabolizzazione o biotrasformazione che può avvenire a vari
livelli: nel tratto gastroenterico, nel rene, nel sangue
stesso e, soprattutto, al livello epatico.
Il processo non è obbligatorio e alcuni farmaci sono eliminati inalterati in forma attiva.
La metabolizzazione epatica può avvenire per mezzo di
più processi (riduzione, idrolisi, coniugazione, ecc) e
generalmente comporta una diminuzione dell’attività e
della tossicità del farmaco; in alcuni casi la produzione
di metaboliti intermedi più attivi della sostanza somministrata.
A livello epatico alcuni chemioterapici funzionano da
induttori enzimatici e la loro metabolizzazione è accelerata nei trattamenti prolungati; altri farmaci funzionano da inibitori enzimatici e possono comportare patologie iatrogeniche.
L’utima tappa della cinetica dei farmaci è l’eliminazione che avviene attraverso più vie (tabella 1.10):
- la via renale agisce attraverso tre differenti processi
che sono la filtrazione glomerulare, la secrezione tubulare e il riassorbimento tubulare passivo. La filtrazione glomerulare è tanto maggiore quanto più l’antibiotico è idrosolubile, ionizzato e poco legato alle
sieroproteine
- la via extrarenale è costituita in prevalenza dalla via
biliare, ma anche da polmoni, ghiandole salivari,
mammarie, sudoripare, lacrimali, ecc. Per quanto riguarda l’eliminazione biliare occorre ricordare che
essa varia in funzione del loro peso molecolare, essendo escreti per via biliare i farmaci a peso molecolare più elevato e quelli liposolubili.
Le concentrazioni ematiche dei farmaci sono strettamente correlate a tutte le tappe della farmacocinetica
descritte.
Tabella 1.9 - Legame con le sieroproteine
Ridotto <36%
Medio 36-80%
Elevato >80%
Amoxicillina
Acido clavulanico
Ampicillina
Cefprozil
Cefaloridina
Cefalexina
Ceftibuten
Gentamicina
Metronidazolo
Spiramicina
Cefotaxime
Cefaclor
Ciprofloxacina
Claritromicina
Lincomicina
Minociclina
Penicillina G
Tetraciclina
Cefazolina
Cefoperazone
Ceftriaxone
Clindamicina
Doxiciclina
Eritromicina
Roxitromicina
23
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tabella 1.10 - Via di escrezione
Epatica
Prevalentemente renale
Azitromicina
Clindamicina
Eritromicina
Minociclina
Amoxicillina
Amoxicillina + ac clavulanico
Ampicillina
Ampicillina + sulbactam
Bacampicillina
Cloxacillina
Cefaclor
Cefadroxil
Cefazolina
Ceftibuten
Cefprozil
Ofloxacina
Tetraciclina
Renale e enterica
Ceftriaxone
Doxiciclina
Renale con metabolismo epatico
Ciprofloxacina
Claritromicina
Cefixime
Log concentrazione di antibiotico nel siero
Dopo somministrazioni ripetute si realizza in un certo
tempo uno stato di equilibrio stazionario (steady state),
nel quale i livelli ematici del farmaco rimangono costanti, una volta raggiunto un perfetto equilibrio tra
quantità del farmaco introdotta e quantità metabolizzata ed eliminata.
L’emivita plasmatica (t 1/2) corrisponde all’intervallo di
tempo necessario per ridurre della metà le concentrazioni di antibiotico nel sangue; viene espresso in ore o
minuti.
Il tempo totale di eliminazione di un farmaco è 7-10
emivite, poiché per ogni emivita la concentrazione diminuisce della metà del valore presente all’inizio dell’intervallo.
Si tratta di un valore importante in quanto condiziona
la posologia e il ritmo di somministrazione dei farmaci.
È auspicabile mantenere la concentrazione di un antibiotico nel siero sempre al di sopra della concentrazione minima inibente (MIC), se non c’è un effetto postantibiotico; cioè un effetto che inibisca la crescita batterica per un
certo tempo anche dopo la caduta della concentrazione
serica di antibiotico al di sotto della MIC (fig.1.11).
Con il termine area sotto la curva (AUC) si intende la
superficie delimitata dalla curva delle concentrazioni di
un farmaco in un sito (ad esempio il plasma) in funzione del tempo; è un buon indice della concentrazione
nei tessuti.
La relazione tra risposta tissutale e concentrazione del
farmaco è comunemente chiamata curva dose risposta,
che consiste in un tracciato semilogaritmico che mostra
come l’effetto di un farmaco aumenta al crescere della
concentrazione sino a un massimo (tabella 1.12).
Risposta
(% di risposta massima possibile)
100
80
60
40
20
MIC
0
dose 1
dose 2
dose 3
dose 4
dose 5
Tempo
Tabella 1.11 - Dosaggio intermittente di un antibiotico
(concentrazione ematica superiore alla MIC)
0.002
0.2
2.0
20
Concentrazione del farmaco (mg/ml)
Tabella 1.12 - Curva dose-risposta
200
24
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Batteriocidia indica la riduzione del numero di batteri
a livelli >99,9% dell’inoculo iniziale dopo un periodo
di incubazione maggiore (24-36 ore).
Oggi questa divisione è meno rigida che in passato in
quanto il tipo di attività, battericida o batteriostatica,
non è una caratteristica intrinseca del farmaco, quanto
un fenomeno dipendente dalla sensibilità della cellula
procariotica e dalle concentrazioni raggiunte nei tessuti. Alcuni macrolidi, ad esempio, sono batteriostatici a
basse concentrazioni e battericidi a concentrazioni più
elevate.
Attualmente si attribuisce molta importanza alla velocità di batteriocidia suddividendo i chemioterapici in
rapidamente battericidi (aminoglicosidi, chinoloni) e
battericidi lenti (cefalosporine e penicilline).
Il fatto che un antibiotico uccida o inibisca un batterio
può essere facilmente misurata in laboratorio, esponendo un inoculo standard di batterio a un intervallo di
concentrazioni di un antibiotico (antibiogramma).
1.2 Nozioni di
farmacodinamica
La farmacodinamica rappresenta lo studio di come agiscono i farmaci e permette di capire come e perché un
farmaco provoca un effetto particolare.
L’attività degli antibiotici a livello subcellulare o molecolare può agire a diversi livelli e con meccanismi di
azione differenti (tabella 1.13, figura 1.14).
Un chemioterapico è un farmaco in grado di inibire in
modo temporaneo (batteriostasi) o definitivo (batteriocidia) la crescita di una popolazione batterica (tabella
1.15).
Batteriostasi è un fenomeno per il quale un germe viene inibito nella sua crescita quando è messo a contatto
con un antibiotico, ma è in grado di ricrescere dopo un
certo intervallo di tempo (in genere dopo 8-12 ore di
incubazione).
Tabella 1.13 - Meccanismo di azione
Chemioterapici che inibiscono la replicazione del DNA
Chinoloni
Chemioterapici che alterano la struttura
e la funzione delle mebrane cellulari
Polimixine
Chemioterapici che bloccano la sintesi proteica
Lincosamidi
Macrolidi
Tetracicline
Chemioterapici che agiscono come antimetaboliti
Sulfamidici
Trimetoprin
Chemioterapici che deviano la traduzione
del mesaggio genetico
Aminoglicosidi
Chemioterapici che agiscono con meccanismi
non sicuramente identificati
Metronidazolo
Chemioterapici che inibiscono la sintesi
del peptidoglicano della parete cellulare
Betalattamine (cefalosporine e penicilline)
Sintesi della parete cellulare
cicloserina
bacitracina
ß Lattamine
glicopeptidi
DNA
acido folinico
Metabolismo dell’acido folico
trimetoprima
sulfonamidi
sulfoni
RNA polimerasi
DNA-dipendente
rifamicine
mRNA
ribosomi
acido folico
Membrana cellulare
polimixine
PABA
Figura 1.14 - Meccanismo di azione
Replicazione di DNA
chinoloni
nitroimidazoli
50
50
50
30
30
30
Sintesi di proteina
aminoglicosidi
macrolidi
lincosamidi
streptomicine
anfenicoli
tetracicline
25
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tabella 1.15
Antibiotici batteriostatici e battericidi
Battericidi
Batteriostatici
Penicilline
Cefalosporine
Metronidazolo
Macrolidi
Tetracicline
Lincosamidi
Per la determinazione della sensibilità dei microrganismi nei confronti degli agenti antimicrobici esistono
diverse metodiche:
- diffusione in agar mediante dischetti o antibiogramma classico (secondo Kirby Bauer) che forniscono risultati qualitativi espressi in termini di resistenza, sensibilità, sensibilità intermedia e sensibilità moderata
- diluizioni in brodo che permettono di definire la
quantità (microgr/ml) necessaria per inibire o uccidere un microrganismo in condizioni standard di
crescita in vitro
La concentrazione minima inbente (Minimal Inhibitory Concentration o MIC) cioè la concentrazione più
bassa di antibiotico in grado di determinare l’inibizione della crescita di un microrganismo. La MIC50 è la
concentrazione di antibiotico che inibisce il 50% dei
ceppi saggiati; la MIC90 inibisce il 90% dei ceppi. La
concentrazione minima battericida (Minimal Bactericidal Concentration o MBC) è la concentrazione più
bassa di antibiotico in grado di distruggere la totalità
dei microrganismi della specie in esame.
La MIC e la MBC permettono la valutazione classica
della batteriocidia e della batteriostasi di un antibiotico
testato su un ceppo batterico in coltura.
1.3 Antibioticoresistenza
La resistenza antibiotica si distingue in innata e acquisita:
- la resistenza innata (naturale o non genetica) si riferisce a una resistenza intrinseca, per cui il microrganismo è insensibile a un determinato antibiotico in
base al meccanismo d’azione del farmaco o alla struttura stessa del germe. Ad esempio il metronidazolo
agisce sulla nitroriduttasi che nei batteri anaerobi è
un enzima necessario alla sintesi del DNA; i batteri
aerobi sono per natura resistenti poiché mancano di
nitroriduttasi
- la resistenza acquisita si riferisce a un ceppo batterico
che perde l’originaria sensibilità nei confronti di un
antibiotico per mutazione del proprio corredo genetico. In questo caso la pressione selettiva esercitata dall’antibiotico favorisce la selezione di ceppi resistenti
(che sono in misura maggiore o minore sempre presenti) mediante l’acquisizione di un gene di resistenza.
Il fenomeno della resistenza acquisita è un evento sem-
pre più frequente ai nostri giorni. Si pensi, ad esempio,
allo Streptococcus pneumoniae (patogeno comune delle
vie aeree superiori) di cui solo il 4-5% dei ceppi era penicillino-resistente nel 1990, mentre oggi tale percentuale è aumentata sino al 30-50%.
Oggi il progressivo aumento delle resistenze alle betalattamine richiede all’odontoiatra di integrare le proprie conoscenze su nuove sostanze in precedenza poco
utilizzate come le cefalosporine di II e III generazione e
le associazioni di betalattamici con inibitori delle betalattamasi.
La resistenza a un antibiotico può agire con un meccanismo diretto o indiretto:
- diretto in presenza di ceppi resistenti per cui anche se
gli antibiotici sono in grado di raggiungere i focolai
infettivi in concentrazioni adeguate, possono risultare inefficaci
- indiretto quando alcuni ceppi resistenti possono
svolgere un’azione di protezione su altri ceppi batterici suscettibili inattivando l’antibiotico.
La resistenza batterica geneticamente acquisita viene
classificata in diversi tipi:
- tipo cromosomico legata al trasferimento di frammenti cromosomiali di DNA batterico. Rappresenta
il 10-15% di tutte le resistenze acquisite; è a comparsa lenta e graduale (multistadio) poiché si manifesta
per incrementi progressivi che coincidono con il ritmo delle divisioni cellulari; riguarda antibiotici della
stessa famiglia (monoresistenza) e batteri della stessa
specie (intraspecificità)
- tipo extracromosomico che richiede un contatto fisico (coniugazione) tra due cellule diverse per il trasferimento di DNA a sede citoplasmatica (plasmidi). La
frequenza in natura è estremamente elevata (90%) e
rapida, tale da parlare di resistenza “infettiva o contagiosa”; si trasmette attraverso batteri di diverse specie
(interspecificità) e interessa più antibiotici contemporaneamente (resistenze multiple).
I plasmidi sono molecole circolari di DNA extracromosomiche (se temporaneamente integrate nei cromosomi sono dette episomi) in grado di replicarsi autonoS
1
2
R
3
1-2: La cellula S uccisa al calore libera piccoli frammenti cromosomici.
3: Un frammento cromosomico contenente il gene S entra nella cellula R.
4: Crossing over e divisione cellulare. La cellula S trasformata è il risultato
di questo processo di ricombinazione.
Figura 1.16 - Processo di trasformazione
4
26
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
A
gal
bio
gal
gal
F+
(donatore)
F(ricevente)
F+
F-
Hfr+
(donatore)
F(ricevente)
Hfr+
F-
B
A
B
C
D
E
Figura 1.17 - Processo di trasduzione
Figura 1.18 - Processo di coniugazione
mamente nella cellula batterica e di passare da una cellula all’altra attraverso processi di coniugazione. Sono
responsabili dei fenomeni di resistenza agli antinbiotici; tra essi vanno ricordati i fattori F (responsabili dell’alta frequenza di ricombinazione della cellula) e R (responsabili delle resistenze).
I meccanismi di ricombinazione genetica (genetic exchange), alla base delle resistenze acquisite sia di tipo
cromosomico che extracromosomico, possono avvenire
con diverse modalità:
- trasformazione che avviene per assunzione da parte
di una cellula batterica di DNA libero nell’ambiente,
proveniente dalla lisi di un altro batterio; modalità
che ha più interesse teorico in esperimenti di laboratorio, che pratico (tabella 1.16)
- trasduzione attraverso un batteriofago (tabella 1.17)
- coniugazione che presuppone il passaggio di materiale genetico (cromosomico o plasmidico) da una
cellula all’altra mediante un contatto fisico che avviene attraverso un’appendice filamentosa detta pilo; è
il meccanismo più importante per frequenza e in
quanto responsabile delle resistenze multiple contagiose (figura 1.18)
I molteplici meccanismi con cui i batteri realizzano la
resistenza nei confronti degli antibiotici sono documentati e molteplici, sebbene i primi quattro elencati
siano i più frequenti nelle famiglie di antibiotici comunemente prescritti in odontoiatria (tabella 1.19):
- inattivazione enzimatica extracellulare dell’antibiotico, come le esobetalattamasi dei Gram+ (ad esempio
gli stafilococchi penicillinasi resistenti)
- inattivazione o trasformazione intracellulare dell’antibiotico, come le endobetalattamasi dei Gram-, confinate nello spazio periplasmatico della parete cellulare
- diminuita penetrazione dell’antibiotico nella cellula
batterica per modificazioni della parete cellulare; ad
esempio la scomparsa dei canalicoli delle porine necessarie al trasporto dell’antibiotico nei Gram- modificazione delle strutture bersaglio o diminuita
affinità per l’antibiotico di strutture inizialmente recettive; ad esempio modificazioni delle subunità 50S
dei ribosomi cui si legano i macrolidi
- aumentata produzione di enzimi inibiti dall’antibiotico; ad esempio il sito bersaglio (PBP o penicillin
binding protein) per le betalattamine
- superamento del blocco metabolico con diretta assunzione del prodotto inibito; tipico dell’acido folico
per i sulfamidici
- iperproduzione di enzimi inattivati che si legano all’antibiotico formando una barriera non idrolitica,
detto effetto trapping o “effetto spugna” descritto ad
esempio per la produzione di betalattamasi
Altri meccanismi ipotizzati sono l’aumentata produzione di un metabolita che antagonizza il farmaco, la diminuita richiesta del prodotto della relazione metabolica
bloccata o la comparsa di vie metaboliche alternative.
Tabella 1.19 - Meccanismi di resistenza batterica*
BETALATTAMICI
Inattivazione enzimatica
- endobetalattamasi dei Gram negativi
- esobetalattamasi dei Gram positivi
MACROLIDI
Modificazione della struttura bersaglio
Diminuita penetrazione nella cellula batterica
Inattivazione enzimatica
Modificazione della struttura bersaglio
TETRACICLINE
Diminuita penetrazione nella cellula batterica
Diminuita penetrazione nella cellula batterica
*Le modalità più frequenti sono riportate in corsivo
27
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
I più importanti meccanismi con cui i batteri realizzano la resistenza antibiotica sono legati all’inattivazione
enzimatica intra o extra cellulare che funziona con un
meccanismo tipo key and lock (figura 1.20).
A questo proposito sono tipiche le interazioni tra un
antibiotico betalattamico e diversi enzimi (fig 1.21):
- le acilasi o amilasi spaccano il legame peptidico che
congiunge le catene laterali al nucleo dell’acido 6-aminopenicillanico o dell’acido 7-aminocefalosporanico
- le betalattamasi idrolizzano l’anello betalattamico
delle penicilline (penicillinasi) o delle cefalosporine
(cefalosporinasi)
+
A
B
I batteri Gram+ sono meno resistenti agli antibiotici
perché svolgono attività enzimatica con betalattamasi
extracellulari e presentano, osservati al microscopio
elettronico, una parete formata da uno spesso strato
uniforme più permeabile dei Gram- (figura 1.22).
La maggior resistenza dei batteri Gram- dipende dalla
costituzione della parete cellulare che garantisce una
spessa barriera impermeabile multistrato (resistenza
intrinseca) che dalla sua compartimentazione che protegge l’attività enzimatica. La cell wall dei Gram- osservata al microscopio elettronico, infatti, presenta (figura 1.23):
- una membrana esterna che presenta permeabilità selettiva data da canalicoli o pori ed è una prima barriera agli antibiotici
- uno spazio periplasmatico che rappresenta uno spazio protetto nel quale possono agire enzimi inattivanti (ad esempio le endobetalattamasi)
- la membrana citoplasmatica
Gram-positivi
Gram-negativi
C
mureina +
acidi teicoici
membrana esterna
strato intermedio
mureina
periplasma
membrana
D
+
E
B
A antibiotico
B enzima
C-D complesso
antibiotico-enzima
E antibiotico
modificato
dall’azione
dell’enzima
Figura 1.20 - Interazione key and lock tra un antibiotico
betalattamico e la betalattamasi
ponti
porine
lipopolisaccaridi
acidi teicoici
membrana
esterna
periplasma
peptidoglicani
membrana
citoplasmatica
membrana
citoplasmatica
fosfolipidi
fosfolipidi
proteine
peptidoglicani
proteine
Fig 1.22 - Struttura della parete cellulare di batteri
Gram- e Gram+
Spazio extracellulare
Betalattamina
Pori
Cefalosporine
Penicilline
Recettori per antibiotici
betalattamici
S
R–CO–NH
N
CH3
CH2
COOH
O
Betalattamasi
S
R–CO–NH
O
N
Membrana batterica esterna
Spazio periplasmatico
R
Betalattamasi
Betalattamasi
Membrana batterica
interna
Citoplasma batterico
Figura 1.21 - Acido 6-aminopenicillanico
e 7-aminocefalosporanico con indicazione dei punti
su cui agiscono le betalattamasi
Fig 1.23 - Rappresentazione del concetto di resistenza
dei batteri Gram- mediata da endobetalattamasi protette
dalla cell wall
28
Quando si prescrive una terapia antibiotica si deve
sempre considerare se essa sia necessaria poiché lo stimolo principale allo sviluppo della resistenza acquisita
è l’uso indiscriminato degli antibiotici, che esercita una
pressione selettiva sui batteri per la sopravvivenza.
Del resto in odontoiatria non si dovrebbe mai abusare
di antibiotici per il rischio di reazioni avverse, per motivi di farmacoeconomia (costo economico) e per non
facilitare la comparsa di resistenze acquisite che poterebbero svolgere in futuro un ruolo fondamentale in terapia medica.
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
matologiche sono costituiti da normali componenti
della flora commensale (endogena) del cavo orale: cocchi Gram+ (Streptococcus spp), bastoncelli Gram- (Enterobacteriaceae), anaerobi e aerobi aspecifici (tabella 2.3).
Generalmente questi batteri si comportano da commensali e possono diventare patogeni a fronte di condizioni che diminuiscono la resistenza organica.
Le infezioni causate da germi patogeni esogeni sono invece infrequenti, spesso in relazione a traumi e ferite
cutanee (Staphilococcus aureus e S. epidermidis).
2.1.1 Streptococchi
2. PRINCIPI DI
ANTIBIOTICOTERAPIA
Per compiere la scelta dell’antibiotico è fondamentale
prendere in considerazione tre ordini di fattori (tabella
2.1):
- le condizioni cliniche del paziente sia patologiche
(malattie epatiche e renali, altre terapie con possibili
interazioni farmacologiche, ipersensibilità, ecc.) che
parafisiologiche (gravidanza, allattamento)
- le caratteristiche del chemioterapico antibatterico
(spettro di attività, farmacocinetica, effetti collaterali, posologia)
- l’agente eziologico e la sua sensibilità o resistenza ai
diversi chemioterapici
2.1 Flora commensale
e agenti patogeni
del cavo orale
Numerose sono le specie che compongono la normale
flora commensale del cavo orale che nel suo insieme è
un ecosistema complesso con un equilibrio labile (tabella 2.2):
- è costituito da habitat diversi come la saliva, la mucosa linguale, il solco gengivale e i denti
- varia nella vita dell’individuo con l’età. Alla nascita è
sterile, arricchendosi successivamente di una flora aerobia sempre più eterogenea; compaiono con la dentizione microrganismi anaerobi che divengono nell’età adulta sempre più prevalenti; nell’edentulo tornano a prevalere gli aerobi.
- subisce profondi cambiamenti in seguito a igiene
orale, interventi odontoiatrici e condizioni sistemiche
Gli agenti patogeni eziologici delle infezioni odontosto-
Gli streptococchi sono cellule batteriche sferiche, per lo
più anaerobi facoltativi, Gram+, normalmente immobili, per i quali tuttora non esiste un univoco sistema di
classificazione.
La classificazione in base alle loro caratteristiche emolitiche è utile a scopo clinico e viene determinata dal
comportamento delle colonie su piastre di agar-sangue,
che possono evidenziare:
- un’emolisi completa (beta) che si presenta come zone
chiare prive di colore all’interno, nelle quali i globuli
rossi sono stati completamente lisati; questo pattern
di emolisi è tipico dello S. pyogenes beta-emolitico del
gruppo A normalmente residente nell’orofaringe e
responsabile di faringotonsilliti e della malattia reumatica
- un’emolisi parziale (alfa) in cui le colonie sono circondate da una zona di colore verdastro da cui deriva la definizione spesso utilizzata di S. viridans spp (o
alfa-emolitici), frequenti agenti patogeni nelle infezioni odontogene.
- nessuna emolisi (gamma).
Una più precisa identificazione richiede la differenziazione in sierogruppi come descritto da Lancefield in
base alle differenze antigeniche dei carboidrati della parete cellulare o degli acidi tricolici: la maggior parte degli streptococchi beta emolitici implicati in processi infettivi umani appartengono a gruppi A, B, C, D e G.
Il gruppo D comprende gli enterococchi (tra cui sono
stati riconosciuti con un genere distinto l’enterococcus
faecalis, e. faecium) e i non-enterococchi tra cui lo S. bovis è il principale patogeno
Gli streptococchi viridanti normalmente residenti
nell’orofaringe presentano una tassonomia confusa e lo
schema classificativo distingue alcune specie:
- gli aerobi facoltativi comprendono gli S. pneumoniae, S. salivarius, S. mitior, S. milleri, S. sanguis, S.
mutans
- gli anaerobi appartenenti alla famiglia delle Peptococcaceae, genere Peptostreptococcus; sono presenti in alta
concentrazione nella cavità orale e nel tratto gastroenterico e, in combinazione con altri microrganismi, sono stati isolati in vari ascessi dentari e della testa e del collo.
29
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tabella 2.1 - Fattori che influenzano la terapia antibiotica
Fattori batterici
Identità del patogeno
Antibioticoresistenza
Fattori dell’ospite
Funzione digerente (per assorbimento orale)
Funzione degli emuntori (renale e epatico)
Condizioni parafisiologiche (gravidanza)
Allergia
Patologie sistemiche
Terapie mediche (farmaci)
Compliance alla via di somministrazione
2.1.2 Batteri anaerobi
Gli anaerobi non sporigeni costituiscono parte della
normale flora batterica delle superfici mucose dell’uomo a livello orale, gastroenterico e genitale.
I principali cocchi Gram+ anaerobi patogeni sono Peptostreptococcus species (P. magnus, P. asaccharolyticus, P.
anaerobius, P. prevotii); i clostridi sono bacilli sporigeni
gram+ isolati da ferite e ascessi.
I principali Gram- anaerobi appartengono alla famiglia
dei Bacteroides spp (che includono il B. fragilis, i B. pigmentati) e Fusobacterium spp.
Gli anaerobi non posseggono l’enzima superossido-dismutasi (SOD) che negli altri microrganismi riduce i radicali superossido tossici per la cellula; in effetti vi è una
correlazione tra la concentrazione di SOD e la tolleranza all’ossigeno in base alla quale possiamo distinguere:
- gli anaerobi obbligatori che necessitano per crescere di
una ridotta tensione di ossigeno e non si sviluppano in
terreni di cultura se la percentuale di CO2 nell’aria è
del <10%; molte specie muoiono dopo un breve contatto, anche con basse concentrazioni di ossigeno
- gli anaerobi facoltativi (microaerofili) che possono
sopravvivere in un’atmosfera con il 10% di CO2 in
condizione di aerobiosi e di anaerobiosi. In generale
gli anaerobi patogeni umani sono relativamente aerotolleranti, potendo sopravvivere per 72 ore in presenza di ossigeno, sebbene di regola essi non si moltiplichino in tali condizioni.
Le infezioni da anaerobi si verificano quando l’equilibrio
tra ospite e batteri viene ad essere alterato, quando le barriere mucose o la cute sono danneggiate e l’ischemia e la
necrosi riducono il potenziale di ossidoriduzione.
La capacità di un microrganismo di aderire ai tessuti
dell’ospite è un fattore importante per il verificarsi dell’infezione; ciglia e fimbrie facilitano l’attacco; in questo senso è stato dimostrato che alcuni Bacteroides del
cavo orale aderiscono alle soluzioni di continuità della
mucosa, il B. melaninogenicus aderisce in genere al altri
microrganismi.
Fattori del farmaco
Spettro d’azione
Diffusibilità nel sito d’infezione
Rischio di interazioni farmacologiche
Indice terapeutico
Vie di somministrazione
Posologia
Avvertenze
Controindicazioni
Scadenza
Sapore (per formulazioni pediatriche)
Costo
La progressione dell’infezione è facilitata dalla produzione di un certo numero di esoenzimi tra cui la collagenasi del B. gingivalis che accentua la necrosi e le endotossine del B. fragilis e B. melaninogenicus (peraltro
queste tossine sono meno attive dei Gram-).
Nella flora orale gli anaerobi sono i microrganismi commensali dominanti variando nella loro concentrazione
tra 10 alla nona germi/ml nella saliva sino a 10 alla dodicesima nella placca gengivale; in questa sede il rapporto tra aerobi e anaerobi va dall’1:1 della superficie dentaria sino a 1:100 o 1:1.000 delle tasche gengivali.
I germi anaerobi (Bacteroides spp, Fusobacterium spp,
Actynomices spp) colonizzano aree orali in cui il potenziale di ossido-riduzione è ridotto per la necrosi tissutale, l’anossia e un ridotto flusso sanguigno; il processo è
favorito dai batteri aerobi che utilizzano l’ossigeno e
rendono l’ambiente adatto agli anaerobi.
I Bacteroides spp sono i più comuni patogeni anaerobi
Gram- (80-90% dei casi) e il Bacteroides fragilis e il Bacteroides nigrescens (o melaninogenicus) sono presenti
nella maggior parte delle infezioni odontogene.
La caratteristica di queste specie consiste nel produrre
suppurazione maleodorante e favorirne la diffusione in
flemmoni e ascessi, mediante endotossine e enzimi
proteolitici (come ad esempio le fibrinolisine e le collagenasi del Bacteroides melaninogenicus).
Figura 1.24 Isolamento
colturale
di Bacteroides
gingivalis
30
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tabella 2.2 - Principali microrganismi commensali e patogeni del cavo orale
Gram positivi
COCCHI
BACILLI
Gram negativi
Facoltativi
Anaerobi
Facoltativi
Anaerobi
Streptococcus
S. mitis
S. mitior
S. milleri
S. salivarius
S. sanguis
S. mutans
S. intermedius
Micrococcus
S. mucillaginosus
Peptococcus
P. magnus
P. asaccharolyticus
Neisseria
N. sicca
N. flavescens
Veillonella
V. parvula
V. Alcalescens
Peptostreptococcus
P. anaerobius
P. micros
Branhamella
B. Catarrhalis
Bacterionema
B. matruchotii
Actinomyces
A. viscosus
A. naeslundii
A. meyeri
A. odontolyticus
A. israelii
A. bovis
Actinobacillus
A. actinomycetemcomitans
Rothia
R. dentocariosa
Lactobacillus
L. acidophilus
L. casei
Arachnia
A. propionica
Eubacterium
E. alactolyticum
E. saburreum
E. nodatum
E. brachy
E. timidum
Capnocytophaga
C. gingivalis
C. achracea
C. sputigena
Eikenella
E. corrodens
Helicobacter
(Campylobacter)
H. sputorum
Bacteroides
Pigmentati
B. melaninogenicus
B. intermedius
B. gingivalis
Non pigmentati
B. oralis
B. gracilis
Fusobacterium
F. nucleatum
F. plauti
F. naviforme
F. russii
F. necrophorum
Bifidobacterium
Propionibacterium
P. acnes
Haemophilus
H. influenzae
H. parainluenzae
H. segnis
Clostridium
C. Sporogens
Leptotrichia
L. buccalis
Selenomonas
S. sputigena
Wolinella
SPIROCHETE
MICRORGANISMI
DIVERSI
Treponema
T. macrodentium
T. denticola
T. orale
T. scoliodontium
T. vincentii
T. mucosum
T. buccale
Micoplasmi
M. salivarium
M. orale
M. buccale
M. faucium
Candida
C. albicans
Tricomonas
T. tenax
Entamoeba
E. gingivalis
Herpes
H. hominis
31
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tabella 2.3 - Batteri patogeni nelle infezioni del cavo orale
MALATTIE ODONTOGENE
Ascesso periapicale
Bacteroides melaninogenicus
Bacteroides asaccharolyticus
Fusobacterium nucleatum
Fusobacterium species
Veilonella parvula
Actinomyces viscosus
Streptococcus viridans
Streptococcus salivarius
Streptococcus mitis
Streptococchi anaerobi
Ascesso alveolare
Bacteroides melaninogenicus
Bacteroides asaccharolyticus
Fusobacterium nucleatum
Peptostreptococcus
Actinomyces
Infezioni del canale radicolare
Cisti infette
Fistole
Actinomyces viscosus
Bacteroides oralis
Bacteroides melaninogenicus
Bifidobacterium
Eubacterium
Fusobacterium nucleatum
Streptococcus viridans
Streptococcus faecalis
Peptostreptococcus
Peptococcus
Propionibacterium
Veilonella parvula
Fusobacterium nucleatum
Peptostreptococcus
Peptococcus
Bacilli anarerobi Gram-positivi
Flemmoni
Streptococcus viridans
Bacteroides melaninogenicus
Osteomielite
Stafilococcus aureus
Stafilococcus epidermidis
Streptococcus viridans
Bacteroides
Klebsiella
Proteus
Enterobacter
Escherichia coli
Pericoronariti
Streptococcus viridans
Bacteroides spp
Spirochete
Fusobatteri
Flora anaerobia Gram negativa
Linfoadeniti
Flora anaerobia Gram negativa
Streptococchi
Perimplantiti
Streptococchi
Actinomyces
Prevotella
Bacteroides
Granuloma apicale
Actinomyces viscosus
Bacteroides melaninogenicus
Fusobacterium nucleatum
Streptococcus viridans
Streptococchi anaerobi
Actinomicosi
Actinomyces israelii
Actinomyces propionica
Actinomyces naeslundi
Actinomyces odontolyticus
Osteiti post-estrattive
Aerobi Gram negativi
Stomatiti batteriche
Flora orale mista
Flora fusospirillare
Streptococchi emolitici
Staphilococcus aureus
MALATTIE PARODONTALI
Cellulite
Streptococcus viridans
Bacteroides melaninogenicus
B. asaccharolyticus,
Gengivite iniziale
Cocchi e bacilli Gram positivi
Microrganismi filamentosi
Spirochete
Gengivite stabilizzata
Actinomyces viscosus
Actinomyces israelii
Streptococcus species
Branhamella catarrhalis
32
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
segue Tabella 2.3 - Batteri patogeni nelle infezioni del cavo orale
Gengivite specifica
Mycobacterium tubercolosis
Treponema pallidum
Neisseria gonorrhoeae
Parodontite prepuberale
Scarsa componente batterica
Parodontite giovanile
Actinobacillus actinomycetem comitans
Capnocytophaga ochracea
Capnocytophaga gingivalis
Bacteroides species
Fusobacterium nucleatum
Spirochete
Parodontite rapidamente progressiva
Bacteroides gingivalis
Bacteroides species
2.2 Scelta del
chemioterapico antinfettivo
La scelta di un chemioterapico in odontostomatologia
deve rispettare una serie di criteri:
- il principio della terapia ragionata per l’eziologia prevalente nella patologia in esame
- uno spettro d’azione stretto per non interferire con la
flora batterica commensale orale e sistemica
- un elevato indice terapeutico, ossia la massima efficacia antibatterica a cui corrisponde il minor numero
di effetti collaterali (figura 2.4)
- un favorevole rapporto tra efficacia terapeutica e costo sociale.
Alcune caratteristiche degli ascessi possono far presumere l’agente eziologico (pur ricordando che la quasi
totalità delle infezioni è polimicrobica): gli stafilococchi producono rapidamente necrosi e precocemente
suppurazione con formazione di grandi quantità di pus
giallo; gli streptococchi tendono a diffondere rapidamente nei tessuti causando un intenso edema con eritema, una necrosi poco estesa e un essudato liquido e
sieroso; gli anaerobi infine producono necrosi e ingente quantità di pus maleodorante.
Per quanto riguarda la terapia antimicrobica va tenuto
presente che le penicilline conservano la loro attività
Fusobacterium nucleatum
Treponema species
Actinomyces actinomycetem comitans
Actinomyces species
Eikenella corrodens
Streptococcus species
Parodontite dell’adulto
Parodontite refrattaria
Parodontite necrotizzante
Bacteroides gingivalis
Bacteroides melaninogenicus
Fusobacterium nucleatum
Capnocytophaga gingivalis
Actinomyces actinomycetem comitans
Actinomyces viscosus
Eikenella corrodens
Sinusite odontogena acuta
Streptococcus pneumoniae
Haemophilus influenzae
Moraxella catarrhalis
(meno frequenti: Streptococco beta emolitico gruppo A
e C, Streptococcus viridans, Peptostreptococcus)
Staphilococcus aureus (forme croniche)
antimicrobica in presenza di pus, mentre altri, come ad
esempio gli aminoglicosidi, sono parzialmente inattivati.
La flora batterica patogena endogena del cavo orale è
coperta dallo spettro antibatterico di antibiotici di comune utilizzo nell’ambito dela terapia ragionata e che
presentano caratteristiche di sicurezza e maneggevolezza.
Interferiscono, cioè, con una funzione vitale specifica
dei batteri senza influenzare le cellule ospiti (tossicità
Tossico
Potenzialmente tossico
CONCENTRAZIONE EMATICA
Gengivite ulcero-necrotica
Fusobacterium fusiforme
Treponema vincentii
Bacteroides melaninogenicus
Capnocytophaga gingivalis
Terapeutico
Tossico
Potenzialmente tossico
Terapeutico
Parzialmente efficcace
Parzialmente efficace
non efficace
non efficace
INDICE TERAPEUTICO
AMPIO
INDICE TERAPEUTICO
RISTRETTO
Figura 2.4 - Indice terapeutico
33
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
selettiva) e sono caratterizzati da un elevato indice terapeutico.
Si preferiscono in prima battuta i farmaci capostipiti
caratterizzati da basso costo, sicura efficacia e buona
tollerabilità; il ricorso a farmaci più evoluti è infrequente e deve essere giustificato da indicazioni terapeutiche specifiche.
In relazione alla scelta dell’antibiotico possiamo pragmaticamente distinguere i batteri in gruppi, tenendo
presente che quasi sempre le infezioni orali dipendono
da associazioni di più specie, in media da 1 a 6:
- Cocchi Gram+ commensali che possono divenire patogeni opportunisti; sono generalmente sensibili alle
betalattamine e ai macrolidi (Streptococcus spp)
- Cocchi Gram+ difficili (patogeni esogeni come Staphilococcus aureus e S. epidermidis) che hanno mostrato col trascorre degli anni un adattamento alla
sopravvivenza nei riguardi delle betalattamine sino a
punte del 50% di ceppi resistenti in ambito ospedaliero. In questi ceppi è indicata una penicillina penicillinasi resistente o una betalattamina associata a un
inibitore delle betalattamasi
- Cocchi e bastoncelli Gram- commensali abituali che
presentano un aumento delle resistenze alle penicilline; sono indicati una aminopenicilina associata a un
inibitore delle betalattamasi o una cefalosporina orale betalattamasi resistente
- Anaerobi che sono agenti eziologici quasi sempre
sottostimati, ma spesso presenti. Per i Gram+ (Actinomyces spp, Peptostreptococcus species) non esistono in
genere difficoltà in quanto sensibili alle penicilline e
ai macrolidi; tra i Gram- (Bacteroides spp, Fusobacterium nucleatum) è in aumento il numero di ceppi resistente alla penicillina.
La quasi totalità degli streptococchi viridanti è sensibile alla penicillina; lo S. pyogenes non presenta nessuna
resistenza ai betalattamici, mentre aumenta quella ai
macrolidi, sino al 40% all’eritromicina.
Capita raramente che le infezioni sostenute da microrganismi provenienti dal cavo orale non rispondano alla
penicillina; in questi casi trovano indicazione la clindamicina o il metronidazolo che sono farmaci attivi sugli
anaerobi.
Il trattamento delle infezioni da anaerobi è costituito
dalla terapia antimicrobica in associazione al drenaggio
e al curettaggio delle raccolte purulente fluttuanti.
Gli anaerobi in vitro rispondono costantemente al metronidazolo e all’amoxicillina/ac clavulanico e in misura minore alla clindamicina (resistenza nel 3-6% dei casi) e alla cefoxitina (resistenza nell’8-30%); mentre generalmente mostrano una ridotta sensibilità agli antibiotici di uso più comune come le penicilline, i macrolidi, le tetracicline.
Si deve peraltro tenere presente che, poiché i distretti
colonizzati da anaerobi contengono numerose altre
specie batteriche, le infezioni sono sempre miste; per
cui è ragionevole impiegare associazioni antibiotiche
attive sia contro la flora aerobia che quella anaerobia
(ad esempio betalattamici) associati a metronidazolo o
inibitori delle betalattamasi).
Nondimeno in vivo solo un numero limitato di infezioni non risponde soddisfacentemente alla terapia con
l’amoxicillina e questo è dovuto alle speciali esigenze
dei germi anaerobi che sopravvivono in virtù del sinergismo che si crea con altri batteri aerobi sensibili alla
penicillina; in pratica l’antibiotico funziona perché viene ad alterare l’ecosistema, così come l’intervento chirurgico e il drenaggio.
Nei casi di infezioni odontogene non gravi non è quindi necessario includere lo spettro tipico dei patogeni
anaerobi e aerobi; mentre nei casi più severi il clinico
deve anticipare la terapia sulla base della sua “migliore
intuizione” circa la combinazione antibiotica più efficace per coprire i batteri anaerobi presumibilmente in
causa (tabella 2.5, 2.6 e 2.7).
Nel tempo il pattern d’uso degli antibiotici tra gli
odontoiatri si è modificato, con una riduzione dell’uso
della penicillina standard e cafalosporine di prima generazione, mentre si è incrementato l’impiego delle
aminopenicilline e delle cefalosporine di seconda generazione (tabella 2.8 e 2.9).
Alla luce delle considerazioni esposte attualmente vengono ritenuti:
- di prima scelta l’amoxicillina, l’associazione amoxicillina acido clavulanico, la bacampicilina, alcune cefalosporine di prima e seconda generazione e i macrolidi
- di seconda scelta altre cefalosporine orali, tetracicline, lincosamidi, metronidazolo; le cefalosporine parenterali di terza e quarta generazione in quanto riservate a infezioni sistemiche sostenute da germi difficili
- di terza scelta o scelta eccezionale gli aminoglicosidi e
i chinolonici in quanto quasi inattivi sugli anaerobi e
di scarsa efficacia sugli streptococchi.
2.2.1 Indagini colturali
L’esecuzione di prelievi microbiologici è una prassi eccezionale per l’identificazione dell’agente eziologico e
l’antibiogramma (terapia mirata) nei pazienti ambulatoriali in odontoiatria, è da riservarsi a infezioni gravi,
generalmente da demandare in ambito ospedaliero.
La diagnosi si basa sulla dimostrazione diretta o indiretta di un microrganismo patogeno nei tessuti dell’ospite.
L’esame microscopico diretto dei liquidi biologici e degli essudati dei tessuti è il più semplice e uno degli esami di laboratorio più utilizzati; la colorazione di Gram
rimane a distanza di 100 anni dalla sua utilizzazione la
metodica più rapida nella diagnosi rapida delle infezioni batteriche.
Nonostante il tempo necessario per l’esecuzione dell’e-
34
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Aminopenicilline
Ureidopenicilline
Cefalosporine
1ª generazione
Cefalosporine
2ª generazione
Cefalosporine
3ª generazione
Macrolidi
Aminoglicosidi
Tetracicline
1ª generazione
Tetracicline
2ª generazione
CAF
Vancomicina
Rifampicina
Cotrimoxazolo
Chinoloni
2ª generazione
Batteri
Amoxicillina +
Ac. clavulanico
RESISTENZE BATTERICHE AI PRINCIPALI ANTIBIOTICI
"
!
"
"
#
#
"
"
"
"
"
#
!
"
!
#
!
!
#
"
#
#
!
!
"
!
!
!
"
#
#
"
"
"
"
#
"
!
"
!
!
!
!
#
"
!
"
!
!
"
!
!
"
"
#
#
"
#
"
#
#
"
"
"
"
#
!
"
#
#
!
#
#
!
"
"
!
"
"
!
!
"
"
!
#
#
!
!
"
!
#
!
!
#
#
!
!
!
!
"
#
!
#
"
!
!
"
"
"
"
"
#
#
#
!
#
#
!
#
"
!
"
!
!
"
#
!
#
"
!
!
"
"
"
"
"
#
#
"
#
"
#
!
"
"
!
"
"#
!
"
#
"
#
"
"
#
"
"
#
#
!
!
!
!
!
!
!
!
!
!
"
#
!
"
"
"
#
"
!
!
"
!
#
#
"
"
"
"
"
#
"
"
"
"
"
#
!
#
!
!
"
"
#
"
"
"
"
"
"
#
"
"
!
"
"
"
"
"
"
"
"
"
!
"
"
#
"
"
"
"
"
"
#
#
#
"
#
!
!
!
"
"
!
"
"
#
#
!
"
"
"
#
"
#
#
#
#
#
"
"
#
!
#
#
!
#
!
!
#
#
"
"
!
"
#
"
"
"
#
"
#
"
#
#
"
!
!
!
!
!
!
!
!
!
!
!
#
!
!
#
"
#
"
#
#
#
"
"
"
"
!
!
!
"
!
!
!
#
"
"
"
#
!
#
#
"
#
"
#
!
#
"
#
#
"
"
"
"
#
"
#
#
!
#
"
"
!
!
"
"
"
#
"
"
"
"
"
"
"
"
"
#
#
"
#
"
#
#
#
#
#
!
#
#
#
Staphylococcus aureus
Stafilococchi meticillino-resist.
Staphylococcus epidermidis
Streptococchi A
Enterococchi (Streptococchi D)
Streptococchi B
Pneumococchi
Meningococchi
Gonococchi
Haemophilus influentae
Escherichia coli
Proteus indolo positivo
Providencia
Proteus indolo negativo
Serratia
Klebsiella
Enterobacter
Acinetobacter
Salmonella
Shigella
Campylobacter
Batteroidi
Pseudomonas
Micoplasmi
Spirochete
! = resistenza > 70% " = resistenza 30-70% # = resistenza 10-30% " = resistenza < 10%
Tabella 2.5 - Resistenze batteriche ai principali antibiotici (da Scaglione)
Macrolidi
Cefalosporine
Tetracicline
Lincosamidi
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
#
!
!
!
!
!
!
!
!
!
!
!
!
#
#
#
!
!
"
!
!
"
!
!
!
!
!
!
!
!
!
!
!
!
!
!
#
#
#
!
#
#
"
#
#
#
#
#
!
!
!
!
!
#
#
#
#
!
!
!
!
"
"
"
!
!
!
!
!
#
#
!
!
!
#
#
"
"
!
!
"
"
"
"
"
"
"
!
" !
" !
Tabella 2.7
Diagnosi clinica di presunzione di infezioni
da anaerobi *
Fosfomicina
Aminopenicilline+
inibitori delle
ß lattamasi
!
!
!
!
!
"
!
!
!
!
!
!
!
"
!
!
!
"
#
#
!
Metronidazolo
Aminopenicilline
ATTIVITÀ ANTIBATTERICA DEI PRINCIPALI ANTIBIOTICI SUI
MICRORGANISMI DEL CAVO ORALE PIÙ FREQUENTEMENTE IN CAUSA
Infezione diffusa (flemmone, cellulite)
Necrosi locale del tessuto
Tromboflebite locale
#
#
"
#
#
"
#
#
#
#
"
"
#
"
"
"
"
"
"
"
"
Presenza di pus maleodorante e gas
Ospite compromesso
Microrganismi
Streptococcus sanguis
Streptococcus mitis
Streptococcus faecalis
Streptococcus pneumoniae
Streptococcus pyogenes
Staphylococcus aureus
Peptococcus
Peptostreptococcus
Eubacterium
Propionibacterium
Actinomyces
Arachnia
Lactobacillus
Branhamella catanhalis
Vellonella
Fusobacterium
Selenomonas
Bacteroides fragilis
Bacteroides melaninogenicccus
Capnotytophaga
Eikenella cccorrodens
Actinobacillus
actinomycetemcomitans
Campylobaccter spp.
! = sensibile # = medio sensibile " = resistente
#
#
"
#
#
#
#
#
#
#
#
#
"
"
#
!
!
!
!
!
" ! "
" ! "
* La diagnosi di certezza si basa sulle indagini colturali
Tabella 2.6 - Spettro antibatterico dei principali
antibiotici sui microrganismi patogeni del cavo orale
(da Scaglione)
35
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tabella 2.8 - Antibiotici comunemente prescritti in odontoiatria
PENICILLINE
Aminopenicilline
Ampicillina
Bacampicillina
Amoxicillina
CEFALOSPORINE
I° generazione
Cefalexina
Cefaclor
Cefadroxil
LINCOMICINE
Clindamicina
Penicilline con inibitori delle betalattamasi
Amoxicillina/acido clavulanico
Ampicillina/sulbactam
II° generazione
Acetossietilcefuroxima
Cefprozil
Cefoxitina
TETRACICLINE
Clortetraciclina
Dossiciclina
Minociclina
III° generazione
Ceftriaxone
MACROLIDI
Eritromicina
Claritromicina
Azitromicina
DERIVATI IMIDAZOLICI
Metronidazolo
Tabella 2.9 - Indicazioni alla scelta degli antibiotici di comune utilizzazione in odontoiatria
Amoxicillina
I° scelta
Infezioni da Gram+ e Gram- aminopenicillinosensibili
(non produttori di betalattamasi)
Amoxicillina
+ acido clavulanico
I° scelta
Infezioni da Gram+, Gram- e anaerobi produttori di betalattamasi
Cefalosporine orali
di prima generazione
(cefalessina, cefaclor)
I° scelta
Infezioni da Gram+, Gram- non produttori di betalattamasi
Cefalosporine orali
di seconda generazione
(cefprozil)
I° scelta
Infezioni da Gram+, Gram- e anaerobi sensibili
(inclusi ceppi produttori di betalattamasi)
Macrolidi
(eritromicina, claritromicina)
II° scelta
Infezioni da Gram+, Gram- in presenza di allergia alle betalattamine
Clindamicina
II° scelta
Infezioni da Gram+, Gram- e anaerobi in presenza di allergia alle betalattamine
Metronidazolo
II° scelta
Infezione da anaerobi (efficacia elevata)
Tetracicline
(doxiciclina)
II° scelta
Spettro ampio ma frequente presenza di streptococchi resistenti
Infezioni parodontali (buona concentrazione ossea)
Aminoglicosidi, chinoloni
III° scelta
Scelta eccezionale in quanto non coprono lo spettro batterico delle infezioni
orali (inattivi su anaerobi e parzialmente attivi su cocchi Gram+)
36
same, l’isolamento dell’agente eziologico mediante coltura in terreni artificiali, rappresenta la procedura diagnostica più sicura attualmente.
Il prelievo di campioni (tessuto, secrezioni) può essere
eseguito prima di iniziare la terapia antibiotica o prima
di cambiarla dopo l’insuccesso di una prima terapia ragionata.
In ogni caso, comunque, è sempre necessario impostare una terapia ragionata in attesa dei risultati; che sono
disponibili in 24-48 ore, e permettono di istituire la terapia mirata in un secondo momento.
Nel caso di lesioni aperte il campione può essere raccolto mediante biopsia (eseguita mediante bisturi o
agobiopsia), aspirazione dai margini o prelevando il
materiale con un tampone.
Nel caso della biopsia la ferita deve essere pulita e disinfettata, mentre nel caso del tampone la ferita dovrà
essere pulita con soluzione fisiologica sterile per rimuovere i detriti e la flora saprofita.
Quando si raccolgono campioni da una lesione profonda e chiusa per aspirazione, è necessario prima pulire e disinfettare la zona per puntura cutanea; in particolare, quando si devono raccogliere campioni da una
fistola, l’orifizio deve essere pulito e disinfettato, introducendo poi un catetere di tipo venoso sterile e aspirando con una siringa sterile.
Tutti i campioni prelevati vanno inviati in laboratorio
il più rapidamente possibile, preferibilmente entro
un’ora; poiché un ritardo maggiore può causare la morte di microrganismi labili, la crescita di una flora da
contaminazione o una modificazione della carica batterica.
Nel caso si sospetti un’infezione da anaerobi (situazione peraltro frequente), i prelievi vanno inviati con contenitori che preservino l’anaerobiosi:
- i frammenti bioptici di tessuto possono essere trasportati in contenitori di plastica con coperchio a tenuta
- i campioni ottenuti per aspirazione possono essere trasportati nella stessa siringa utilizzata per la raccolta, facendo prima uscire tutta l’aria o in alternativa si possono iniettare questi liquidi in flaconi sigillati sottovuoto adatti al trasporto di campioni in anaerobiosi
- l’uso di tamponi in caso di infezioni da anaerobi è
controindicato poiché gli anaerobi sono molto sensibili all’essiccamento e all’ossidazione. I tamponi devono essere inviati utilizzando uno dei numerosi terreni di trasporto disponibili in commercio che impediscono l’essiccamento dei microrganismi presenti.
Va infine ricordato che i campioni provenienti dal cavo
orale, da lesioni parodontali o di saliva, danno di solito
esito a una flora mista di aerobi e anaerobi compresi
Actinomyces spp e Candida spp. Per questo motivo l’isolamento di questi microrganismi è privo di significato a
meno che il campione sia stato raccolto in modo da
evitare la contaminazione della flora saprofita.
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
2.3 Gestione e
monitoraggio della terapia
antibiotica
La via di somministrazione più frequentemente utilizzata in ambito odontoiatrico è certamente quella orale
per la maggior compliance del paziente e la minore incidenza di effetti indesiderati rispetto la somministrazione parenterale.
Peraltro la via orale, con antibiotici più comunemente
prescritti in odontoiatria, è in grado di assicurare una
elevata biodisponibilità ed è utilizzabile non solo nelle
infezioni banali, ma anche in quelle più severe.
I tempi ottimali di somministrazione sono, per la maggior parte degli antibiotici, un’ora prima o 2-3 ore dopo i pasti. Alcuni antibiotici vengono presi durante i
pasti per evitare la comparsa di effetti indesiderati come nausea e gastralgia; ma ne viene ridotto l’assorbimento, mentre per altri il cibo non interferisce con l’assorbimento o l’aumenta.
La via parenterale è utilizzata raramente dall’odontoiatra in regime ambulatoriale, rappresenta circa il 7% dei
casi, prevalentemente intramuscolare.
L’indicazione alla via parenterale intramuscolare trova
indicazione nelle seguenti situazioni:
- intolleranza gastrointestinale con nausea, vomito, pirosi, diarrea
- accelerato transito intestinale con scarso assorbimento enterico (diarrea, gastroenterite da antibiotici per
via orale)
- incapacità a deglutire il farmaco per trisma e odinofagia (difficoltà superabile con le formulazioni liquide per bocca)
- necessità di farmaci non assorbibili per via enterica
per infezioni resistenti ai più comuni antibiotici
La somministrazione endovenosa viene limitata a casi
gravi per i quali va considerata la richiesta di una consulenza medica e/o l’ospedalizzazione (2.10):
- interventi in anestesia generale
- infezioni gravi che necessitano di raggiungere rapidamente alte concentrazioni plasmatiche.
L’uso topico di antibiotici nelle infezioni superficiali
(stomatomucositi batteriche) è limitato in odontostomatologia per la difficoltà di identificare con certezza il
patogeno nell’ambito della flora orale ed il rischio di effetti indesiderati: stomatite allergica e dismicrobismo
orale (candidosi orale, lingua nigra, lingua villosa).
In questi casi si preferiscono gli antisettici che risultano
provvisti di un ottimo profilo di tollerabilità, ampio
spettro d’azione e non inducono resistenza.
Alcune terapie topiche trovano indicazione in particolari applicazioni:
- nella terapia delle parodontopatie profonde, i fili impregnati di tetraciclina e il gel di metronidazolo possono essere applicati nelle tasche parodontali
37
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
- gli antibiotici topici per uso dermatologico trovano
indicazione nelle infezioni cutanee periorali circoscritte ad eziologia stafilococcica e/o streptococcica
(piodermite, impetigine, eczema infetto, herpes impetiginizzato, cheilite angolare) o micotica (cheilite
da Candida albicans).
La durata della somministrazione deve essere effettuata a dosaggio pieno e per un periodo sufficiente a eradicare l’agente patogeno, per non facilitare l’insorgenza
di ceppi resistenti o di ricadute.
La risposta clinica è la migliore guida alla durata della
terapia; generalmente nelle infezioni lievi entro 1-2
giorni dall’inizio della terapia antibiotica si manifestano segni di miglioramento come diminuzione della
febbre, del dolore e del gonfiore.
Poiché il trattamento deve continuare per almeno tre
giorni dopo la remissione dei sintomi, onde prevenire
ricadute o l’insorgenza di ceppi resistenti, ne consegue
che, una terapia antibiotica dura non meno di cinque
giorni.
Nelle infezioni più severe possono essere necessari 7-10
giorni di terapia, considerando che il miglioramento
iniziale è limitato.
Alcune infezioni richiedono tempi prolungati di terapia come la sinusite con 15 giorni e l’osteomielite con
4-6 settimane.
Si deve considerare che l’incapacità del farmaco di penetrare nella zona di suppurazione è raramente la ragione di un fallimento terapeutico; peraltro anche se
questa possibilità esiste, ad esempio nelle osteomieliti,
solitamente tale difficoltà viene superata aumentando i
dosaggi e prolungando il tempo di somministrazione.
Gli ascessi presentano alcune particolarità dal punto di
vista terapeutico, visto che un essudato infiammatorio
stabilizzato è un ambiente relativamente povero perché
si possa osservare una rapida moltiplicazione batterica.
Per alcuni antibiotici battericidi (che sono attivi solo
nei confronti di microrganismi in attiva moltiplicazione) l’incapacità di eradicare l’infezione in un ascesso,
può essere collegata allo stato metabolico inattivo del
microrganismo.
Nelle cavità ripiene di liquidi, particolarmente nell’ambiente metabolicamente sfavorevole di un ascesso, la
batteriocidia intracellulare sarà, infatti, ridotta; del resto gli antibiotici batteriostatici (la cui azione dipende
dalla fagocitosi) sono meno attivi dei battericidi.
In un ascesso, a causa della inibizione della moltiplicazione, i batteri possono rimanere quiescenti e sopravvivere a lungo; per ottenere la guarigione in questa situazione è dunque necessario l’impiego di antibiotici battericidi a dosaggi elevati e per periodi adeguati tali da
eradicare l’infezione.
Una precoce antibioticoterapia può prevenire la suppurazione o il diffondersi di un ascesso, ma di solito non
può sostituire il drenaggio chirurgico.
In presenza di ascessi e flemmoni è importante creare
un drenaggio per evacuare le raccolte purulente e i tessuti necrotici; che rappresentano un ostacolo alla diffusione dei chemioterapici e facilitano le infezioni da
anaerobi Gram negativi.
Infatti rilevanti miglioramenti sintomatici fanno seguito a un adeguato drenaggio del pus; ma l’incisione di
tessuti infetti, prima che si realizzi la colliquazione, è
spesso deleteria, non riesce ad alleviare il dolore e, a
volte, può anche facilitare la diffusione dell’infezione.
Per questa ragione è necessario aspettare fino ad ottenere un ascesso maturo prima di incidere.
Tabella 2.10 - Vie di somministrazione
Via e modalità di assorbimento
Indicazioni e precauzioni
Endovenosa
Assorbimento rapido e totale
Effetti immediati per rapide e elevate concentrazioni
ematiche
Emergenza
Uso ospedaliero
Possibilità di regolare la dose in base alla risposta (titolazione)
Adatta a grandi volumi o sostanze irritanti se non diluite
Rischio di reazioni avverse gravi
Intramuscolare
Assorbimento rapido per le soluzioni acquose
Assorbimento lento per le preparazioni deposito
Impossibilità ad utilizzare farmaci per via orale
Necessità di collaborazione e compliance del paziente
Adatta per volumi moderati, veicoli oleosi e sostanze irritanti per via orale
Preclusa nei pazienti con discoagulopatie
Orale
Assorbimento lento
Varia a seconda del farmaco
Compliance del paziente (minima cooperazione)
Preferibile per pazienti ambulatoriali
Biodisponibilità buona per molti farmaci di comune
utilizzo
38
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
L’applicazione di calore può alleviare il dolore e accelerare la regressione senza che si abbia la suppurazione
nelle fasi iniziali; se è già in corso la necrosi facilita la
demarcazione del processo e l’accumulo di pus rendendo praticabili l’incisione e il drenaggio in minor tempo.
La terapia ragionata, condotta secondo i parametri
enunciati, non è sempre seguita da un risultato terapeutico favorevole e in assenza di segnali positivi di ri-
sposta alla terapia entro 48 ore è necessaria una rivalutazione dell’insuccesso terapeutico (tabella 2.11 e 2.12).
I provvedimenti da instaurare nei singoli casi saranno
diversi come ad esempio: l’introduzione locale del farmaco, il drenaggio della sede d’infezione, impiego di
un farmaco diverso con elevata batteriocidia o di un’associazione antibatterica eventualmente guidata dall’esecuzione di un antibiogramma.
Tabella 2.11 - Cause di insuccesso dell’antibioticoterapia
Assunzione di antibiotico per un periodo troppo breve
Mancata compliance del paziente (non si attiene alla prescrizione)
Posologia prescritta insufficiente
Malassorbimento digestivo (gastroenterite, diarrea)
Interazione con altri farmaci o sostanze (ad esempio latte e tetraciclina nella fase di assorbimento)
Comparsa o prevalenza di ceppi resistenti (anche facilitati dal trattamento stesso)
Insufficiente penetrazione e diffusione del chemioterapico nella sede di infezione (membrana piogenica degli ascessi,
sequestro nell’osteomielite)
Diffusione dell’infezione in sedi poco permeabili al farmaco (ascessi cerebrali, sinusiti)
Drenaggio inadeguato e persistenza di condizioni sfavorevoli (pH acido, tessuto necrotico, anerobiosi)
Reazione a un corpo estraneo infetto (protesi, impianti)
Ospite immunocompromesso (mancata cooperazione del sistema immunitario nell’eradicazione del patogeno)
Tabella 2.12 - Errori comuni nella terapia antibiotica
Prescrizione di un antibatterico per infezione virale o fungina
Scelta corretta dell’antibiotico, ma a dosaggio insufficiente
Cambiamento troppo precoce dell’antibiotico
Mancata esecuzione di drenaggio
Utilizzo di due antibiotici quando uno è sufficiente (induzione di resistenza, allergia)
Utilizzo di antibiotici a largo spettro (se efficaci a spettro ristretto; per il rischio di dismicrobismi)
Ricorso a farmaci tossici (se disponibili farmaci efficaci a elevato coefficiente terapeutico)
Prescrizione di farmaci costosi (se disponibili farmaci efficaci a basso costo)
Mancata sorveglianza del decorso clinico e adattamento della terapia
Mancata esecuzione di prelievi microbiologici e antibiogramma (in presenza di mancata risposta alla terapia ragionata)
39
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
3. REAZIONI AVVERSE
Le reazioni avverse agli antibiotici possono essere classificati in diversi modi in base alla localizzazione d’organo o al meccanismo eziopatogenetico (tabella 3.1).
In base alla loro differente localizzazione d’organo si
parla di effetti gastrointestinali, epatotosicità, nefrotossicità, fetotossicità, dermatiti, ecc; certamente le manifestazioni di intolleranza gastrointestinale appaiono tra
i danni da antibiotici più frequenti.
In base alla patogenesi è possibile distinguere reazioni
avverse:
- su base tossica
- su base allergica
- su base idiosincrasica che si realizzino su soggetti con
carenze enzimatiche costituzionali geneticamente
trasmesse
- correlate con l’attività antibatterica del farmaco prodotto integralmente o in parte da modificazioni microbiologiche, tipo dismicrobismi
- correlate ad attività farmacologiche e farmacodinamiche differenti dall’attività antibatterica, come modificazioni indotte sulle risposte immunologiche, interazioni farmacocinetiche e farmacodinamiche degli
antibiotici tra loro e tra altri farmaci
Le principali considerazioni inerenti le betalattamine
non riguardano tanto i potenziali effetti tossici (che si
manifestano solo a dosaggi molto elevati e sono virtualmente assenti), quanto ad un’ampia gamma di reazioni
immunologiche di tipo allergico con presenza di crossreattività tra penicilline e cefalosporine.
La Multiple Drug Allergy Sindrome consiste in reazioni
allergiche tra antibiotici di famiglie diverse tra loro chimicamente non correlate; a tale proposito è stato segna-
lato recentemente un significativo aumento di reazioni
allergiche ad antibiotici non betalattamici (compresi i
macrolidi) in soggetti con pregresse manifestazioni allergiche IgE mediate a penicilline e cefalosporine.
I macrolidi sono metabolizzati ed escreti dal fegato e
possono determinare disturbi della funzionalità epatica; presentano, inoltre, effetti collaterali prevalentemente a livello gastrointestinale. In particolare l’eritromicina causa spesso intolleranza gastrointestinale, inconveniente parzialmente superato dalla claritromicina
con la quale, però, sono stati segnalati casi di discolorazione dei denti.
Tale fenomeno è di solito reversibile con una pulizia
dentale presso un dentista (REFI 2002).
L’eritromicina etilsuccinato è il sale di scelta nell’adulto; l’estolato è controindicato negli adulti e in gravidanza per la possibile insorgenza di epatiti colostatiche,
mentre è indicato nei bambini dove assicura elevate
concentrazioni tissutali. Le reazioni allergiche ai macrolidi sono infrequenti (0,5% dei pazienti trattati) e di
scarso rilievo clinico (orticaria, rash cutaneo).
Il metronidazolo può causare effetti gastrointestinali,
cefalea, sapore metallico in bocca, secchezza delle fauci
e parestesie (reversibili alla sospensione del trattamento), colorazione rossastra delle urine, effetto antabuse
(crampi addominali e vomito per contemporanea assunzione di alcol).
Le tetracicline presentano effetti indesiderati gastrointestinali, si depositano nei tessuti duri (ossa e denti) e
possono provocare fotosensibilizzazione ed epatotossicità. La fotosensibilizzazione è un raro effetto indesiderato che si manifesta con reazioni cutanee (eccezionalmente con fotonicolisi); per tale motivo è consigliabile
evitare l’esposizione al sole e ai raggi ultravioletti durante la terapia.
Tabella 3.1 - Principali effetti indesiderati e controindicazioni degli antibiotici
EFFETTO
SINTOMATOLOGIA
CONTROINDICAZIONI
Ipersensibilità
Reazioni allergiche d’organo o sistemiche
Ipersensibilità nota al farmaco
Ipersensibilità crociata di gruppo
Disturbi gastrointestinali
Intolleranza gastrointestinale
Dismicrobismo intestinale, candidosi, colite pesudomembranosa
Sospensione del trattamento in presenza di sintomi
Epatotossicità
Aumento delle transaminasi
(tetracicline)
Colostasi (macrolidi)
Grave insufficienza epatica
Sindrome ostruttiva delle vie biliari
Gravidanza, allattamento, infanzia
Deposito nei tessuti calcificati
(tetracicline)
Teratogenicità (metronidazolo)
Controindicazione alle tetracicline in
gravidanza e allattamento
Controindicazione all’uso di tetracicline in bambini con età <8anni
40
Le incompatibilità tra antibatterici o tra essi e altri farmaci si verificano prima della loro somministrazione e
possono essere di natura fisica, chimica o fisico-chimica; generalmente interessano farmaci miscelati in soluzione ad uso parenterale.
Le incompatibilità fisiche o chimico-fisiche possono
essere apprezzate all’esame visivo (modificazioni di colore, formazione di gas, di percipitati, ecc.) e non comportano in genere una perdita eccessiva dell’attività antibatterica dei farmaci interessati.
Le incompatibilità chimiche determinano invece la decomposizione irreversibile di uno o di entrambi i farmaci, con perdita dell’attività terapeutica e, spesso, con
la formazione di composti tossici.
Classici esempi di incompatibilità chimica sono l’inattivazione degli aminoglicosidi da parte di penicilline e
la degradazione dell’ampicillina sodica in soluzione di
carboidrati a temperatura ambiente dopo diverse ore.
Le interazioni farmacologiche possono verificarsi a livello di ciascuna delle tappe della farmacocinetica.
Esse possono essere di tipo farmaceutico, farmacocinetico e farmacodinamico; possono determinare effetti
diversi come: indifferenza, antagonismo, potenziamento, sommazione, sinergismo o risposte inattese.
A livello di assorbimento si possono osservare interazioni che determinano sia un aumento che una diminuzione dell’assorbimento, soprattutto in base alle modificazioni del pH endoluminale, alla formazione di legami diretti, a fenomeni di dismicrobismo, di alterata
mobilità intestinale e di malassorbimento.
Molti antibiotici somministrati per via orale, ad esempio, possono causare una riduzione dell’efficacia dei
contraccettivi orali, accelerandone il transito intestinale e l’assorbimento, come ad esempio l’amoxicillina e
amoxicillina + acido clavulanico (RCP REFI 2002).
I topici gastrointestinali, il carbone e gli antiacidi (sali
di alluminio, di calcio e di magnesio), in associazione
o non agli alginati, interagiscono con alcuni farmaci
adsorbiti per via orale, determinando una diminuzione dell’assorbimento gastrointestinale dei medicinali
qualora somministrati contemporaneamente. Per pre-
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
cauzione, conviene somministrare gli antiacidi, il carbone e i topici gastrointestinale a distanza dagli altri
medicinali.
Nella fase di trasporto i farmaci molto legati alle proteine possono competere per i siti di legame, determinando un aumento delle concentrazioni di farmaco libero e quindi attivo. Di questo tipo è, ad esempio, l’interazione tra macrolidi e anticoagulanti orali.
Le interazioni a livello della metabolizzazione sono le
più frequenti e temibili; si tratta di induzioni o inibizioni enzimatiche che possono determinare una riduzione o un’accentuazione dell’attività di uno dei due
farmaci.
Il sistema del citocromo P-450 comprende una serie di
isoenzimi che sono responsabili della metabolizzazione
di molti farmaci. L’isoenzima CYP3A4 rappresenta il
60% del sistema citocromiale degli epatociti e il 70%
di quello degli enterociti della parete intestinale.
Molti antibiotici e antimicotici inibiscono l’isoenzima,
aumentando l’emivita plasmatica, la concentrazione
ematica e la tossicità di altri farmaci che sono metabolizzati dallo stesso sistema di detossificazione. Tale meccanismo è alla base di alcune interazioni farmacocinetiche che sconsigliano l’associazione di alcuni farmaci
(tabella 3.2).
Infine da segnalare che i macrolidi e gli antimicotici derivati dei nitro-imidazoli sono stati associati ad aritmie
cardiache (torsioni di punta) per interazione con farmaci che prolungano l’intervallo QT sull’elettrocardiogramma (tabella).
Altri tipi di interazione si possono verificare nel processo di eliminazione renale per alterazioni del processo di
riassorbimento passivo o della secrezione tubulare attiva o al livello tissutale nel processo di distribuzione (ad
esempio blocchi neuromuscolari per l’associazione di
aminoglicosidi e miorilassanti).
Si ricordi, infine, che le interazioni tra antibiotici possono determinare effetti diversi: sinergismo, addizione
o antagonismo.
Nelle fotografie comprese tra 3.3 e 3.16 è riportata l’iconografia relativa ad alcune reazioni avverse.
41
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tabella 3.2 - Interazioni degli antibiotici
INTERAZIONE RISCHIO *
MECCANISMO E MANIFESTAZIONI CLINICHE
Antibiotici battericidi in
associazione con
batteriostatici
2
Teoricamente i battericidi sono più efficaci sui batteri in attiva replicazione. I batteriostatici possono antagonizzare l’azione battericida arrestando la crescita batterica. L’interazione non è dimostrata in modo
consistente in clinica.
Penicilline, cefalosporine,
eritromicina,
claritromicina,
tetracicline,
metronidazolo
+ contraccettivi orali
estroprogestinici
4
Casi sporadici hanno riportato gravidanze indesiderate per assunzione
orale concomitante di antibiotici e contraccettivi.
Si ipotizza che gli antibiotici riducendo la normale flora batterica intestinale, possano interferire con il ricircolo enteroepatico degli estrogeni, risultando dosi ematiche subterapeutiche ed ovulazione. Con
l’eccezione di amoxicillina, ac. clavulanico e della rifampicina, gli studi clinici non hanno dimostrato tale interazione.
Metronidazolo con alcool
2
Il metronidazolo produce un effetto disulfiram inibendo l’enzima acetaldeide deidrogenasi. L’accumulo di acetaldeide causa cefalea, palpitazioni, nausea, arrossamento del viso.
Metronidazolo con litio
1
Il metronidazolo inibisce l’escrezione renale del litio, elevandone la
concentrazione ematica; la tossicità da litio si manifesta con confusione, atassia, nefrotossicità
Tetracicline con prodotti
contenenti cationi
bivalenti (Al, Mg, Ca,
Fe) o trivalenti (Fe)
2
Le tetracicline chelano i cationi bivalenti e trivalenti, e risultano meno
assorbite. Gli antiacidi aumentano il pH gastrointestinale e ne riducono l’assorbimento. Il livello serico di tetracicline può diminuire del
20-100%, riducendo l’efficacia antibiotica
Tetracicline o altri
antibiotici a largo spettro
con warfarina o
dicumarolici
4
Gli antibiotici a largo spettro diminuiscono la flora intestinale che sintetizza la vit K, cofattore della coagulazione. Poiché il meccanismo anticoagulante di warfarina e dicumarolici agisce sui fattori della coagulazione vit K dipendenti, si determina un aumentato rischio di sanguinamento. L’interazione si manifesta solo nei pazienti con ridotto
introito di vit K
Tetracicline con litio
4
Riportato un singolo caso di tossicità da litio, non confermato da un
ulteriore studio
Eritromicina o
azitromicina, tetracicline
con digossina
1
Questi antibiotici riducono la flora batterica intestinale e in particolare l’Eubacterium Lentum, che metabolizza una quantità significativa di
digossina nel 10% dei pazienti in terapia. Può determinarsi un aumento della digossinemia e sintomi di intossicazione digitalica: salivazione, disturbi della vista e aritmie.
Eritromicina,
claritromicina
azitromicina o
metronidazolo con
warfarina o dicumarolici
1
Gli antibiotici diminuiscono il metabolismo degli anticoagulanti orali e aumento del tempo di protrombina. I sintomi consistono in ematuria, ematomi, ecchimosi
Eritromicina,
claritromicina,
ketoconazolo,
itraconazolo e altri
farmaci metabolizzati
dal citocromo P-450
Varia in
relazione
ai diversi
farmaci
Gli antimicrobici bloccano il metabolismo e aumentano i livelli ematici di molti farmaci. La severità degli effetti indesiderati dipende dall’indice terapeutico dei farmaci interagenti.
42
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Astemizolo, terfenadina,
cisapride
1
Aritmie ventricolari potenzialmente mortali (torsioni di punta).
Il metronidazolo aumenta i livelli ematici di cisapride
Alfentanil
1
Rafforzata e prolungata depressione respiratoria
(eccetto ketoconazolo)
Bromocriptina
1
Aumentato rischio di effetti indesiderati a carico del SNC con discinesie e ipotensione arteriosa
Carbamazepina
1
Ciclosporina
1
Felodipina e calcio
antagonisti
1
Metilprednisolone,
prednisone
1
Teofillina
1
Lovastatina e altre statine
1
Triazolam o midazolam
orale
2
Disopiramide
4
Aumentato rischio di atassia, vertigini, stordimento e confusione. Arresto cardiaco riportato in un bambino in cura con eritromicina
Rinforzo dell’immunosoppressione e nefrotossicità
Aumentato rischio di ipotensione, tachicardia, edema
Aumentato rischio di sindrome di Cushing e immunosoppressione
Aumentato rischio di tachicardia, aritmia, tremori, convulsioni. Il ketoconazolo non è implicato in questi effetti
Dolore muscolare e rabdomiolisi. Interazione farmacocinetica dimostrata per gli antimicotici azoli
Aumenti marcati dei livelli ematici delle benzodiazepine per via orale
con aumento dell’effetto sedativo in durata e profondità
Rare segnalazioni di aritmie o blocco cardiaco per associazione con l’eritromicina. Necessari ulteriori studi
*Punteggio di significatività delle interazioni in base alla gravità dell’effetto e la documentazione scientifica disponibile
- 1 effetto maggiore potenzialmente pericoloso per la vita; stabilito, probabile o sospetto in base alla documentazione
- 2 effetto moderato che può causare patologia; stabilito, probabile o sospetto
- 3 effetto minore di scarsa entità o non rilevabile clinicamente; stabilito, probabile o sospetto
- 4 effetto maggiore o moderato; possibile
- 5 effetto minore; possibile o improbabile.
Figura 3.3 - Eritema fisso da medicamenti
Macchia rosso-violacea, tondeggiante, a limiti netti,
che si ripete nella stessa sede sul labbro, entro alcune ore
dalla somministrazione del farmaco responsabile
(ipersensibilità di IV tipo)
Figura 3.4 - Candidosi eritematosa
Eritema diffuso della mucosa dovuto a infezione
opportunistica da Candida Albicans secondario all’uso di
antibiotici a largo spettro. Sono presenti placche
biancastre spesse simili a ricotte costituite da ife di miceti
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
43
Figura 3.5 - Glossite losangica mediana
Figura 3.8, 3.9, 3.10 - Eritema multiforme maggiore
(Sindrome di Stevens-Johnson) mucosità erosiva dolorosa
del cavo orale indotta da sulfamidici (Bactrim).
I sintomi prodromici (febbre, malessere, faringite, cefalea)
sono seguiti nell’arco di 2-3 giorni dalla formazione
di aree eritematose, bolle, erosioni e croste orali e
pluriorifiziali; nel 50% dei casi sono accompagnate
da lesioni cutanee a bersaglio (dette anche a iride
o a coccarda)
Figura 3.6, 3.7 - Orticaria
Pomfi di colore variabile dal rosso al bianco, circondati
da un alone iperemico, diffusi su tutta la superficie
cutanea e sulle labbra
44
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
3.11 - Eritema multiforme minore con tipiche lesioni
cutanee a iride
Figura 3.12 - Cheilite indotta da retinoidi in donna di
33 anni
Figura 3.13 - Orticaria acuta del volto da anestetico
locale, insorta a distanza di 20 minuti dall’infiltrazione
(Lidocaina cloridrato 2%)
Figura 3.14 - 3.15 Eruzione orticarioide in maschio di
45 anni
Figura 3.16 - Eruzione lichenoide della mucosa genina
indotta da resina metacrilica di protesi mobile
Figura 3.17 - Pigmentazioni dentali da tetracicline
A.2 PARTE SISTEMATICA
Gli antibiotici sono suddivisi secondo la struttura chimica in diverse famiglie in cui ogni componente presenta una struttura di base similare agli altri appartenenti dello stesso gruppo (tabella 1.1 e 1.2).
Le modificazioni strutturali del nucleo di base influenzano le caratteristiche cinetiche e incrementano o selezionano l’attività antimicrobica dei singoli composti.
Ad esempio alla famiglia delle betalattamine appartengono numerosi antibiotici che contengono nella loro
struttura l’anello betalattamico e hanno caratteristiche
sovrapponibili:
- attività battericida selettiva sui procarioti inibendo la
sintesi del peptidoglicano della parete cellulare
- bassa tossicità diretta (salvo poche eccezioni)
- reazioni allergiche crociate
- carattere acido
- capacità di indurre enzimi attivanti detti betalattamasi
Appartengono a questa famiglia le penicilline contenenti l’acido 6-aminopenicillanico, le cefalosporine
contenenti l’acido 7-aminocefalosporanico e le nuove
betalattamine (non penicilline-non cefalosporine),
che si discostano dalla struttura chimica di entrambi
questi gruppi pur conservando inalterato l’anello betalattamico.
La trattazione è limitata ai singoli composti che in ogni
famiglia risultano di comune prescrizione nella pratica
ambulatoriale odontoiatrica.
O
R
C
S
NH
penicilline
N
O
COOH
O
R
C
S
NH
cefalosporine
N
O
C
R
R
S
carbapenemici
N
O
COOH
O
R
C
NH
monobattamici
N
O
SO3H
Figura 1.1 - Struttura chimica di base delle quattro
classi di antibiotici betalattamici
Tabella 1.2 - Famiglie di chemioterapici antibatterici
Amfenicoli
Aminoglicosidi
Betalattamine*
(penicilline, cefalosporine,
inibitori delle betalattamasi)
Chinolonici*
Glicopetidi
Lincosamidi*
Macrolidi*
Metronidazoli*
Monobattami
Non classificati
* Famiglie che contengono antibiotici utilizzati in odontoiatria
Polipetidi
Rifamicine
Sinergistine
Tetracicline *
R
46
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
1. FAMIGLIE DI ANTIBIOTICI
1.1 Penicilline
Le penicilline si compongono di un nucleo comune
acido 6-aminopenicillanico (nucleo penamico), costituito da un anello tetratomico azetinonico (betalattamico) e uno eterociclico (tiazolidinico) al quale si legano differenti catene laterali che condizionano le particolarità farmacocinetiche dei diversi composti (tabella 1.3).
Si dividono in due categorie: quelle naturali ottenute
per sola fermentazione (antibiotici); quelle semisintetiche derivate dalla sintesi dell’acido 6-aminopenicillanico con catene laterali aciliche opportunamente modificate (chemioterapici).
La famiglia di farmaci è caratterizzata da batteriocidia
lenta, per inibizione della formazione del peptidoglicano, costituente della parete cellulare batterica.
La penicillina G e le penicilline acidoresistenti (fenossimetilpenicilina) sono poco utilizzate attualmente in
odontoiatria.
L’addizione di un amino-gruppo sulla catena laterale
delle penicilline da luogo alle aminopenicilline, penicilline semisintetiche a spettro allargato; attualmente
tra i farmaci di I° scelta in odontoiatria.
Le aminopenicilline sono attive su tutti i microrganismi sensibili alla penicillina G che è prevalentemente
orientata nei riguardi di:
- batteri Gram+ (Stafilococchi non produttori di betalattamasi, Streptococchi, Pneumococchi)
- cocchi Gram- (Meningococchi, Gonococchi)
- anaerobi Gram+ (Clostridium, Peptococcus, Peptostreptococcus)
- anaerobi Gram- (Bacteroides spp ma non Bacteroides
fragilis)
- bacilli Gram+ (Corynebacterium, Listeria, B. anthracis)
- bacilli Gram-negativi (Pasteurella multocida e H. ducrey), Spirochete, Leptospire, Borrelie e Actinomiceti.
Inoltre, le aminopenicilline presentano una migliore
attività su Enterococcus, Listeria monocytogenes, Haemophilus influenzae, Proteus mirabilis, Escherichia coli, Salmomelle spp.
La loro maggiore attività su molti bacilli aerobi Gramè legata alla miglior capacità di penetrazione attraverso
la parete cellulare.
Tutte le aminopeniciline sono inattivate dalle betalattamasi; il gruppo comprende l’amoxicillina, l’ampicillina
e la bacampicillina (tabella 1.4, 1.5).
L’amoxicillina rappresenta il farmaco di prima scelta
per l’elevato assorbimento enterico (superiore al 90%),
gli scarsi effetti indesiderati gastroenterici e l’ampio
spettro di azione che coincide con le specie batteriche
più frequentemente in causa nelle infezioni orali. L’attività è estesa su molti ceppi non produttori di betalattamasi, patogeni aerobi e anaerobi del cavo orale: Actinomyces, Propionibacterium, Eubacterium, Peptococcus,
Peptostreptococcus, Veillonella, Fusobacterium, Streptococcus spp (S. sanguis, S. mitis, s. faecalis).
L’ampicillina per via orale è attualmente poco utilizzata poiché presenta un assorbimento ridotto e lievi effetti indesiderati gastroenterici; è utilizzata per somministrazione parenterale.
Le bacampicilline sono profarmaci, analoghi dell’ampicillina, che dopo l’assorbimento sono convertiti in ampicillina; sono dotati di migliore assorbimento digestivo e
gravati da minori effetti indesiderati gastrointestinali.
Le isossazolilpenicilline (oxacillina, dicloxacillina, flucloxacillina) sono penicilline resistenti beta-lattamasi
resistenti; trovano indicazione nelle infezioni sostenute
da stafilococchi penicillinasi produttori; sono più neurotossiche e hanno efficacia pari a 1/10 nei confronti
della penicillina (tabella 1.6).
Tabella 1.3 - Classificazione delle penicilline
Penicilline standard
Penicillina G (ev)
Penicillina V (po)
Procain penicillina G (im)
Benzatin penicillina (im)
Aminopenicilline
Ampicillina (ev, po)
Bacampicillina (po)
Amoxicillina (po)
Penicilline
Antistafilococciche
Meticillina (ev)
Nafcillina (ev)
Isossazolilpenicilline (ev, po)
Oxacillina
Cloxacillina
Dicloxacillina
Flucloxacillina
Penicilline antipseudotumorali
Carbossipenicilline (ev)
Carbenicillina
Ticarcillina
Ureidopeniciline (ev)
Piperacillina
Azlocillina
Mezlocillina
47
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tabella 1.4 - Aminopenicilline
POSOLOGIA
NOTE
Amoxicillina
Adulto per os
1,5-4 gr/die in 2-3 somministrazioni
Adulto im/ev
3-12 gr/die in 4-6 somministrazioni
Bambino per os
50-100 mg/kg/die in 2-3 somministrazioni
Elevato assorbimento orale (90%) non influenzato dal
cibo
Buona tollerabilità per os (diarrea meno frequente di ampicillina)
Non betalattamasi resistente
Ampicillina
Adulto per os
1,5-3 gr/die in 4 somministrazioni a stomaco vuoto
Adulto im/ev
4-12 gr/die in 4-6 somministrazioni
Bambino per os
500-100 mg/kg/die in 4 somministrazioni a stomaco vuoto
Bambino im/ev
100-400 mg/kg/die in 4-6 somministrazioni
Scarso assorbimento orale ulteriormente ridotto in presenza di cibo
Utilizzata preferenzialmente per via parenterale
Reazioni avverse gastrointestinali frequenti dopo somministrazione orale (nausea, vomito, diarrea)
Non betalattamasi resistente
Bacampicillina
Adulto per os
2-4 gr/die per os in 3 somministrazioni giornaliere
Bambino per os
40 mg/kg/die in 3 somministrazioni
Elevato assorbimento orale non influenzato dal cibo
Buona tollerabilità per os (diarrea frequente di ampicillina)
Non betalattamasi resistente
Caratteristiche comuni
I° scelta nelle infezioni del cavo orale
Batteriocidia lenta
Ampio spettro sui principali ceppi patogeni Gram+, Gram-, aerobi e anaerobi patogeni del cavo orale
Inattivazione da parte dei ceppi penicillinasi produttori (aminopenicilino resistenti) e inattività su alcuni anaerobi
Buona tollerabilità per os (minore per ampicillina)
Tossicità sistemica scarsa, virtualmente assente; utilizzabili con dosaggi ampi per l’elevato indice terapeutico
Escrezione renale prevalente (80%); riduzione della posologia solo in presenza di IRC grave (Clearence creatinina inferiore a 30 ml/m)
Allergia più frequentemente rappresentata da esantemi maculo-papulari o morbilliformi non IgE mediati; rara l’anafilassi
Allergia crociata con altre betalattamine (cefalosporine e betalattamine non penicilline-non cefalosporine)
1.2 Inibitori delle
Betalattamasi
Sebbene esistano molti tipi di inibitori nella pratica clinica sono utilizzati solo l’acido clavulanico, il sulbactam e il tazobactam.
Gli inibitori delle betalattamasi contengono un anello
betalattamico, ma nessuno ha attività antibatterica intrinseca clinicamente utile (tabella 1.7, 1.8).
Si legano alle betalattamasi in modo reversibile o irreversibile (inibitori suicidi) consentendo ai farmaci betalattamici, che verrebbero distrutti, di svolgere il proprio compito.
L’associazione di un betalattamico con un inibitore del-
le betalattamasi ottiene uno spettro di attività esteso ai
ceppi produttori di betalattamasi, ne risulta cioè un sinergismo d’azione.
Di seguito sono riportati i dosaggi delle associazioni
delle betalattamine con gli inibitori delle betalattamasi
di comune utilizzo in odontoiatria nell’adulto sano
normopeso in assenza di controndicazioni.
1.3 Cefalosporine
Le cefalosporine sono antibiotici betalattamici in continua espansione che hanno in comune il nucleo cefemico o acido 7-aminocefalosporanico; costituito da un
48
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Struttura di catena laterale R
penicillina G
(benzilpenicillina)
CH2 CO
penicillina V
(fenossimetilpenicillina)
O CH2 CO
ampicillina
CHCO
NH2
HO
amoxicillina
CHCO
NH2
Figura 1.5 - Struttura chimica della catena laterale in
posizione 6 dell’anello lattamico di penicilline standard e
aminopenicilline
Catena laterale R
OCH3
meticillina
CO
OCH3
OC2H5
CO
nafcillina
R2
CO
N
R1
O
R1
H
H
CI
F
isoxazolil
penicilline
CH3
R2
H
CI
CI
CI
oxacillina
cloxacillina
dicloxacillina
flucloxacillina
Figura 1.6 - Struttura in posizione 6 dell’anello
betalattamico delle penicilline antistafilococciche
anello tetratomico (betalattamico) e uno eterociclico
(diidrotiazolidinico) al quale si legano differenti catene
laterali che condizionano le particolarità farmacocinetiche dei diversi composti (tabella 1.9, 1.10, 1.11).
Sono tradizionalmente classificate in farmaci di prima,
seconda, terza e quarta generazione in base all’epoca di
sintesi; il loro spettro verso bacilli aerobi Gram- aumenta dalla prima alla quarta generazione; in cui varia
lo spettro di azione: I° generazione più spostato verso
gram +; II° generazione spettro bilanciato tra Gram + e
-; III° generazione spettro sbilanciato verso Gram -.
Per molti anni la famiglia delle cefalosporine è stata monomorfa (I e II generazione) con buona attività nei confronti dei Gram positivi anche betalatamasi produtori
(con esclusione di enterococco) e discreta attività verso i
Gram- (con esclusione di Pseudomonas, altri Gram- aerobi difficili e anaerobi del gruppo Bacteroides).
In sintesi le cefalosporine classiche di I generazione (e
alcune di II) sono attive su stafilococchi e streptococchi
(poco sulle Enterobacteriaceae) e solo parziale resistenza
alle betalattamasi; non presentano sostanziali vantaggi
nei confronti delle aminopenicilline in terapia odontostomatologica.
Successivamente questa famiglia di antibiotici ha presentato diversificazioni essenziali con nuove cefalosporine di II generazione e quindi di III e IV generazione.
Dapprima sono stati sintetizzati farmaci a spettro d’azione sovrapponibile a quello delle cefalosporine classiche, ma resistenti a quasi tutte le betalattamasi sia dei
Gram+ che Gram-; successivamente si è perfezionato lo
spettro nei riguardi dei Gram- e l’unico gram resistente
oggi è l’enterococco.
Le cefalosporine di II generazione sono divise in due
sottotipi:
- attive su Haemophilus influenzae; risultano attive verso i Gram- produttori di betalattamasi e sono utilizzate nelle infezioni delle vie aerodigestive superiori
- attive su Bacteroides fragilis usate nelle infezioni da
aerobi-anaerobi
Il cefprozil è una cefalosporina orale di seconda generazione attiva sull’Haemophilus influenzae, interessante
per le applicazioni in ambito odontoiatrico (tabella
1.12):
- assorbimento per via orale rapido e con una biodisponibilità del 94% non influenzato dal cibo
- attivo sulle specie anaerobiche patogene nelle infezioni del cavo orale (Peptostreptococcus, Bacteroides
melaninogenicus, Eubacterium, Streptococcus viridans)
per MIC inferiori alla cefalessina e al cefaclor
- buona tollerabilità gastrica, con effetti gastrointestinali lievi e che regrediscono al cessare della terapia
(nausea, vomito nel 2% dei casi), in misura minore
cioè di claritromicina, cefixime, cefaclor e amoxicillina/ac. clavulanico
- efficacia terapeutica pari all’amoxicilina/acido clavulanico
Le cefamicine sono cefalosporine parenterali di sintesi
49
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tabella 1.7 - Aminopenicilline associate a inibitori delle betalattamasi
POSOLOGIA
NOTE
Amoxicillina + acido clavulanico
Adulto per os
2-3 gr/die in 2-3 somministrazioni a stomaco pieno
Adulto ev
1,8-13,2 gr/die ev in 3-4 somministrazioni
Bambino per os
50 mg/kg/die in 2-3 somministrazioni a stomaco pieno
Bambino per ev
110-220 mg/kg/die in 3-4 somministrazioni
Elevato assorbimento orale
Disponibile anche per via parenterale Discreta tollerabilità per os; nausea, vomito e diarrea più frequenti che
con le aminopenicilline, legate all’acido clavulanico
Ampicillina + sulbactam
Adulto im/ev
3-12 gr/die im/ev in 2-4 somministrazioni giornaliere
Bambino im/ev
150 mg/kg/die in 2-4 somministrazioni
Uso parenterale
Possibile diarrea
Possibile aumento delle transaminasi epatiche (6% dei
pazienti trattati)
Caratteristiche comuni
Antibiotici di I° scelta nelle infezioni di germi aminopenicillino sensibili e resistenti
Batteriocidia lenta
Betalattamasi resistenza per inibizione suicida
Spettro di azione esteso ai ceppi betalattamasi produttori e agli anaerobi (praticamente assenti le resistenze)
Tossicità sistemica scarsa, virtualmente assente
Escrezione renale prevalente (80%); ma riduzione solo in presenza di IRC grave (Clearence creatinina inferiore a 30
ml/m)
Allergia alle betalattamine (più frequentemente esantemi morbilliformi non IgE mediati)
CH2 OH
S
H
clavulanato
COOH
N
O
O
O
S
CH3
CH3
sulbactam
COOH
N
O
O
O
S
N
CH2
N
CH3
tazobactam
N
COOH
O
Figura 1.8 - Struttura chimica degli inibitori delle
betalattamasi
N
di seconda generazione; sono betalattamasi resistenti e
presentano spiccata attività verso gli anaerobi; comprendono la cefoxitina, il cefotetan e il cefmetazolo
Le cefalosporine di III generazione sono cefalosporine
orali e iniettabili con elevata attività verso i Gram- produttori di betalattamasi (soprattutto Enterobacteriaceae); sono farmaci importanti per la terapia di patologie sistemiche gravi, solo occasionalmente utilizzate in
odontoiatria, avendo uno spettro più spostato verso i
Gram- e meno verso i Gram +.
Le metossimine sono cefalosporine parenterali di terza
generazione che presentano una struttura di base caratterizzata da un gruppo metossiminico (N-O-CH3) a
livello della catena laterale che conferisce una forte attività verso i germi produttori di betalattamasi Gram+ e
Gram-; comprendono:
- il cefuroxime, il cefotaxime il cefodizime, il ceftizoxime, il ceftriaxone, il cefmenoxime, il cefpirome, il cefepime tra quelli a uso parenterale
- Il cefixime, il cefatemet e il cefpodoxime tra quelle a
uso orale.
Sebbene le cefalosprine siano strutturalmente correlate
alle penicilline, esiste solo un 4-10% circa di allergenicità crociata tra le due famiglie di farmaci. Di conseguen-
50
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tabella 1.9 - Classificazione delle cefalosporine
I° generazione
Cefadroxil (po)
Cefazolina (im, ev)
Cefalexina (po)
Cefapirina* (ev, po)
Cefradina (im, po)
Cefprozil (po)
Cefuroxime (ev, im)
Cefuroxime axetil (po)
Cefmetazolo (ev, im)
Cefotetan (ev, im)
Cefoxitina (ev, im)
II° generazione
Cefaclor (po)
Cefamandolo (ev, im)
Cefroxadina (po)
Cefonicid (ev, im)
Ceforanide*
Cefpodoxima (po)
Cefotiam (im/ev)
III° generazione
Cefdinir (po)*
Cefixima (po)
Cefodizime (im/ev)
Cefmenoxine (im/ev)
Cefotaxime (ev, im)
Cefpodoxima (po)
Cefsulodin (im/ev)
Ceftazidime (ev, im)
Ceftibuten (po)
Ceftizossina (im/ev)
Ceftriaxone (ev, im)
Ceftizoxime (ev, im)
Cefoperazone (ev, im)
Moxalactan (ev, im)
IV° generazione
Cefepima (ev, im)
Cefipirome (ev, im)
* Non in commercio in Italia
Tabella 1.10 - Cefalosporine
POSOLOGIA
NOTE
Cefalexina
Adulto per os
2-4 gr/die po in 4 somministrazioni
Elevato assorbimento orale (90%), più rapido a digiuno
Spettro d’azione discretamente ampio; attività su cocchi e bacilli Gram+, minore su alcuni GramResistenti sono i batteri produttori di cefalosporinasi (Enterobacteriaceae) e molti anaerobi del cavo orale
Bambino per os
50-100mg/kg/die in 4 somministrazioni
Cefaclor
Adulto per os
2-4 gr/die po in 3-4 somministrazioni
Bambino per os
20-40 mg/kg/die in 3-4 somministrazioni
preferibilmente a stomaco vuoto
Discreto assorbimento orale (65%)
Cefadroxil
Adulto per os
2-4 gr/die po in 2-3 somministrazioni
Bambino per os
50-100 mg/kg/die in 3 somministrazioni
Ottimo ma lento assorbimento orale (95%) non influenzato
dal cibo
Discreta tollerabilità per os (diarrea, vomito)
Spettro d’azione sovrapponibile alla cefalexina
Cefprozil
Adulto per os
1 gr/die in 2 somministrazioni
Bambino per os
30 mg/kg/die in 2 somministrazioni
Spettro di azione ampio, esteso ai Gram+, Gram-, aerobi e
anaerobi patogeni del cavo orale e prime vie respiratorie (praticamente assenti le resistenze)
Betalattamasi resistente
Elevato assorbimento orale (94%) non influenzato dal cibo
Buona tollerabilità per os (diarrea e vomito inferiori all’1%)
Escrezione renale prevalente (65-70%); riduzione solo in presenza di IRC grave (Cl creatinina inferiore a 30 ml/m)
Cefuroxime axetil
Adulto per os
0,5-1gr/die po in 2-3 somministrazioni
Bambino per os
15-20 mg/kg/die in 2-3 somministrazioni
Spettro di azione ampio, esteso ai Gram+, Gram- (Enterobacteriaceae)
Betalattamasi resistente
Assorbimento orale ridotto (45%), favorito dalla presenza di
cibo
Discreta tollerabilità per os
Eliminazione prevalentemente renale in forma attiva
Discreta tollerabilità per os (diarrea, vomito)
Spettro d’azione sovrapponibile alla cefalexina
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
51
Cefazolina
Adulto im/ev
1-4 gr/die in 3-4 somministrazioni
Bambino per os
25-100 mg/kg/die in 3 somministrazioni
Spettro di azione ampio, esteso ai Gram+ e alcuni Gram- (Enterobacteriaceae)
Parzialmente resistente alle betalattamasi
Cefoxitina
Adulto im/ev
3-12 gr/die in 3-4 somministrazioni
Bambino im/ev
50-200 mg/kg/die in 3-4 somministrazioni
Spettro di azione ampio, esteso ai Gram+ e molti Gram- soprattutto anaerobi (Bacteroides spp)
Betalattamasi resistente
Ceftriaxone
Adulto im/ev
1-4 gr/die im/ev in 1-2 somministrazioni
Bambino im/ev
30-100 mg/kg/die in 1-2 somministrazioni
Long acting
Betalattamasi resistente
Spettro di azione molto ampio, esteso ai Gram+ e molti
Gram- e discreta attività su anaerobi (Bacteroides spp)
Eliminazione renale (60%) e biliare (40%); necessaria individuazione della posologia solo in caso di sindrome epatorenale
Caratteristiche comuni
I° scelta nelle infezioni del cavo orale
Batteriocidia lenta
Reazioni allergiche crociate con le penicilline (4%)
Discreta tollerabilità per os (diarrea, vomito); buona per cefprozil
Transitori aumenti delle transaminasi seriche e tromboflebite (per ev)
Elevata escrezione renale (80-95%) per quasi tutti i composti; ridotta per cefaclor e ceftriaxone (60%)
Individuazione della posologia in IRC (eccetto ceftriaxone)
O
S
CH2
H O
C
NH
S
C – C – NH
S
NH
N
O
cefalotina
N
O
CH2OCOCH3
cefaclor
COO – Naº
Cl
COOH
O
N
N
O
N CH2 C – NH
N
N
N
N
O
CH2 – S
COO–Na+
cefazolina
C – C – NH
O
S
N
S
O
CH
O
S
CH2 – O – CO – NH2
N
COOH
CH3
cefuroxime
H O
H O
C – C – NH
C – C – NH O – CH3
S
NH2
S
S
N
O
cefalexina
H
CH3
COOH
cefoxitina
N
CH2 – O – CO – NH2
O
COOH
H O
HO
NH2
O
cefadroxil
S
C – C – NH
N
CH3
COOH
HO
NH2
cefprozil
Tabella 1.11 - Struttura chimica di base di diverse cefalosporine
S
CH – CO – NH
O
N
CH=CHCH3
COOH
52
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tabella 1.12 - Classificazione dei macrolidi
Macrolidi short acting
Macrolidi long acting
Eritromicina
Iosamicina
Kitasamicina
Midecamicina
Miocamicina
Oleandomicina
Rokitamicina
Rosaramicina
Azitromicina
Claritromicina
Diritromicina
Fluritromicina
Roxitromicina
Spiramicina
del rischio (ad esempio l’esantema maculo-papulare).
Le cefalosporine long acting hanno un’emivita più lunga
(oltre 3 ore) degli altri betalattamici, assicurando tassi
tissutali ed ematici persistenti con un minor numero di
somministrazioni giornaliere; comprendono la ceforanide, il cefotetan, il ceftriaxone, il cefonicid e il cefodizime.
Le cefalosporine di IV generazione rappresentano una
ulteriore evoluzione e sono attive verso la maggior parte dei batteri Gram+ e Gram-.
1.4 Macrolidi
za possono essere utilizzate spesso in modo sicuro nei pazienti allergici alle penicilline con manifestazioni minori.
In generale vanno evitate in pazienti che abbiano manifestato allergia alla penicillina IgE mediata, ma possono essere usate in modo sicuro in pazienti con altri tipi di reazione sorvegliando ed avvertendo il paziente
I macrolidi costituiscono un gruppo di antibiotici dotati di una comune struttura chimica formata da un
anello macrociclico lattonico (tabella 1.12,1.13,1.14).
Hanno spettro di attività sovrapponibile alle penicilline con spettro di azione elettivo sui Gram+, un pò più
Tabella 1.13 - Macrolidi
POSOLOGIA
NOTE
Eritromicina
Adulto per os
1-4 gr/die in 4 somministrazioni
Adulto im/ev
1 gr/die in 4 somministrazioni
Bambino per os
40-50mg/kg/die in 4 somministrazioni
Bambino im/ev
10-25mg/kg/die in 4 somministrazioni
Discreto assorbimento orale (60%) non influenzato dal
cibo; per etilsuccinato migliorato dal cibo
Discreta tollerabilità per os (diarrea, nausea, vomito)
Metabolizzazione (50%) ed escrezione epatica (95%)
Non necessario individualizzare la posologia in presenza di IRC
Claritromicina
Adulto per os
0,5-1 gr/die in 2 somministrazioni
Adulto ev
4-8 mgr/die in 2 somministrazioni
Bambino per os
15 mg/kg/die in 2 somministrazioni
Discreto assorbimento orale (60%)
Metabolizzazione (50%) ed escrezione epatica e renale
Tollerabilità gastrointestinale migliore di eritromicina
Può causare discolorazione dei denti (RCP)
Modificare la posologia in presenza di grave IRC
Da utilizzare con cautela nei pazienti anziani (>65 anni) (RCP)
Azitromicina
Adulto per os
0,5 gr/die in monosomministrazione per 3 giorni
Bambino per os
10 mg/kg/die in monosomministrazione per 3 giorni
Discreto assorbimento orale
Penetrazione in sede endocellulare
Concentrazioni tissutali elevate e prolungate
Discreta tollerabilità per os (diarrea vomito, nausea)
Eliminazione lenta per via epatica e renale con emivita
di 50 ore; rischio di accumulo
Caratteristiche comuni
Antibiotici di seconda scelta in presenza di allergia alle betalattamine
Batteriostasi
Spettro discretamente ampio su cocchi e bacilli Gram+, cocchi Gram- e alcuni bacilli GramNon utilizzare in pazienti con grave insufficienza epatica
Rare le manifestazioni allergiche (0,5% dei casi trattati)
Interazioni farmacologiche con teofillinici, anticoagulanti e farmaci a elevato legame proteico
53
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
H 3C
CH3
CH3
N
H3C
CH3
HO
O
HO
H3C
O
H3C O
O
O
CH3
H 3C
CH3
HO
H 3C
O
CH3 O
O
CH3
O
O
CH3
CH3
O
azitromicina
OH
H 3C O
CH3
O
H3C
CH3
CH3
N
CH3
HO
OH
CH3O
HO
H3 C
CH3
CH3
OH
H3C OCH3
claritromicina
H
N
O
H H 3C
O
CH3
O
CH3
O
H3CO
N
HO
O
H3C O
CH3
N
CH3 HO
H3C
HO
OH
CH3O
H3C
HO
HO
H3 C
CH3
OH
H3C OCH3
eritromicina
H3 C
O
CH3
O
CH3
CH3
HO
O
OH
CH3
H3C
HO
N
O
H3C O
O
CH3
O
O
CH3
CH3
C
H3
OH
H3C OCH3
diritromicina
1.5 Lincosamidi
Si tratta di una famiglia esigua di antibiotici comprendente la lincosamina e la clindamicina.
Possiedono una attività antibatterica di tipo batteriostatico e agiscono bloccando la sintesi proteica; in particolare si fissano a livello delle subunità 50S dei ribosomi e bloccano l’enzima peptidil-transferasi.
La clindamicina ha un assorbimento digestivo quasi
completo (90%) e buona concentrazione nel tessuto
osseo; ha praticamente soppiantato la lincomicina nell’uso clinico (tabella 1.15, 1.17).
È attiva su streptococchi, stafilococchi e batteri anaerobi, compreso il Bacteroides fragilis; è utilizzata da sola
nei pazienti allergici alle betalattamine in alternativa ai
macrolidi e nelle infezioni da anaerobi.
Il farmaco è ben tollerato ove si escluda la possibilità di
frequenti diarree dopo somministrazione orale; può
causare forme gravi di coliti pseudomebranose.
Tabella 1.14 - Struttura chimica dei macrolidi
ristretto delle penicilline; sono anche attivi su Micoplasmi, Clamidie e Campylobacter.
I macrolidi inibiscono la sintesi proteica dei batteri mediante il blocco del processo di traslocazione degli aminocidi nella protidosintesi ed esercitano un’attività prevalentemente di tipo batteriostatico.
Sono antibiotici poco tossici e ben tollerati con l’eccezione di alcuni esteri come l’estolato di eritromicina che determinano sovente lesioni epatiche da ipersensibilità.
Il prototipo dei macrolidi è l’eritromicina, disponibile in
più sali; ma attualmente si preferiscono la claritromicina e
l’azitromicina per la minore incidenza di effetti indesiderati a livello gastrointestinale (dispepsia, nausea, vomito).
L’azitromicina appartiene a una nuova famiglia a 15
atomi di carbonio (azalidi) ed è caratterizzata da eliminazione lenta.
Sovrapponibili risultano altri macrolidi meno utilizzati
come la spiramicina, la roxitromicina, le midecamicina
e la miocamicina.
Di seguito sono riportati i dosaggi degli antibiotici di
comune utilizzo in odontoiatria nell’adulto sano, normopeso, in assenza di controindicazioni.
1.6 Tetracicline
Questi antibiotici hanno un nucleo di quattro anelli da
cui il nome tetracicline (tabella 1.16,1.18).
Lo spettro d’azione comprende: cocchi e bacilli Gram+;
cocchi Gram-; bastoncelli Gram- tra cui H. influenzae,
Bordetella spp, Pasteurella spp, Brucella spp, Legionella spp,
Vibrio spp, Pseudomonas mallei e paramallei, Francisella tularensis, Spirochete, Rickettsie, Micoplasmi, Ureaplasmi.
Utilizzate per molto tempo come farmaci di prima scelta, oggi sono relegate tra i farmaci di seconda scelta per
la comparsa di resistenze e la disponibilità di chemioterapici più attivi e meglio tollerati.
Tutte le tetracicline possono causare nausea, vomito, diarrea; superinfezione fungina (candidosi orale, vaginiti); enterocolite stafilococcica; fotosensibilizzazione; epatotossicità.
Questi antibiotici agiscono a livello ribosomiale, bloccando la sintesi proteica con attività batteriostatica; si
fissano a livello dell’unità 30S impedendo l’ancoraggio
al sito del complesso aminoacido-RNA-transfer; ne deriva un’attività batterica di tipo batteriostatico.
Tabella 1.15 - Clindamicina
Clindamicina
Adulto po/im/ev
0,6-2,4 gr/die
in 3-4 somministrazioni
Bambino po/im/ev
10-40 mg/kg/die
in 3-4 somministrazioni
II° scelta in presenza di allergie alle betalattamine
Spettro di azione esteso a anaerobi (Bacteroides fragilis, B. melaninogenicus, Fusobacterium varium) e vari streptococchi anaerobi
Ottimo assorbimento orale (90%)
Ottima concentrazione ossea
Metabolismo epatico (80%)
Eliminazione renale (15%) e epatica
Individuazione della posologia in caso di insufficienza epatica o renale
Reazioni avverse (frequenti diarree; possibili coliti pseudomembranose)
54
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tabella 1.16 - Tetracicline
POSOLOGIA
NOTE
Tetraciclina
Adulto per os
1-2 gr/die in 4 somministrazioni
Buon assorbimento orale (75%) non influenzato dal cibo
Eliminazione renale 50%
Individualizzare la posologia in presenza di IRC
Doxiciclina
Adulto per os/ev
0,2 gr/die il primo giorno in unica
somministrazione; 0,1gr/die i giorni
successivi in 1-2 somministrazioni
Ottimo assorbimento orale (98%) anche in presenza di cibo e latte
Eliminazione renale 30%
Non necessario individualizzare la posologia in presenza di IRC
Minociclina
Adulto per os/ev
0,2 gr/die in 2 somministrazione
Ottimo assorbimento orale (95%) non influenzato dal cibo
Eliminazione renale 10%
Individualizzare la posologia in presenza di IRC
Caratteristiche comuni
II° scelta nelle infezioni del cavo orale
Indicate nella parodontite giovanile e nelle parodontopatie dell’adulto sostenute da Actinobacillus actinomycetem comitans e Capnocyophaga
Batteriostasi
Ampio spettro d’azione sui cocchi e bacilli Gram+, cocchi Gram- e alcuni bacilli GramFrequenti reazioni avverse gastroenteriche
Controindicazione in gravidanza e in età pediatrica (sotto gli 8 anni)
Le diverse sostanze sono sovrapponibili come spettro e
tossicità, ma presentano notevoli differenza farmacocinetiche.
CH3
CH3
H
N
H
HC
OH
Possono essere distinte in due grandi gruppi:
- le tetracicline classiche (clortetraciclina, ossitetraciclina, tetraciclina)
- le tetracicline moderne (demetilclortetraciclina, rolitetraciclina, limeciclina, metaciclina, doxiciclina e
minociclina).
Delle tetracicline disponibili solo tre sono usate con
una certa frequenza: la tetraciclina classica e le tetraci-
C3 H7
C
H
O
H
NH
CH
O
HO
OH
R1
H
S
H
lincomicina
CH3
H
CH3
7
R2
R3
R4
6
CH3
N
OH
5
OH
OH
CONH2
CH3
OH
CH3
H
N
H
HC
C
H
O
NH
CH
O
HO
OH
O
H
N
H
S
H
clindamicina
OH
Tabella 1.18 - Struttura chimica delle tetracicline.
Sostituzioni nelle posizioni 5, 6 e 7 danno luogo a
differenti farmaci (doxiciclina, minociclina, tetraciclina)
OH
C3 H7
H
O
CH3
OH
NO2
N
CH3
CH2–CH2 OH
Tabella 1.17 - Struttura chimica della clindamicina e
lincomicina
Tabella 1.19 - Struttura chimica del metronidazolo
55
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tabella 1.20 - Metronidazolo
Metronidazolo
Adulto po/ev
30-35 mg/kg/die
in 4 somministrazioni
Spettro di azione limitato a anaerobi (Bacteroides spp) e protozoi
Ottimo assorbimento orale
Metabolismo epatico e eliminazione renale
Individuazione della posologia solo in caso di insufficienza epatica o renale
Reazioni avverse (nausea, vomito, neuriti, esantemi, teratogenicità)
Tabella 1.21 - Aminoglicosidi *
Streptomicina
Diidrostrptomicina
Neomicina
Framicetina
Kanamicina
Paromomicina-aminosidina
Gentamicina
Tobramicina
Ribostamicina
Bekanamicina
Sisomicina
Lividomicina
Amikacina
Dibekacina
Netilmicina
Isepamicina
*In ordine cronologico di comparsa nel 1947 della streptomicina sino al 1983 della isepamicina
cline a basso dosaggio (la doxiciclina e la minociclina).
La più utilizzata è la doxiciclina che presenta un assorbimento digestivo quasi completo (93%) e buona tollerabilità; diffonde e si concentra nei focolai infiammatori e nel tessuto osseo in modo migliore rispetto alle
tetracicline classiche.
1.7 Nitroimidazoli
Il metronidazolo è l’unico rappresentante di questa famiglia da cui derivano, peraltro anche alcuni antimicotici (derivati degli azoli); è ben assorbito per via orale
con una biodisponibilità del 90% (tabella 1.19, 1.20).
Il meccanismo d’azione della batteriocidia negli organismi sensibili (anaerobi) consiste nella produzione di nitroriduttasi necessarie a produrre intermedi citotossici
che si legano al DNA e ne inibiscono la sintesi: determina perdita della struttura elicoidale del DNA che
non è più in grado di legarsi alla DNA-polimerasi.
È metabolizzato dal fegato (85%) ed eliminato prevalentemente per via renale.
Lo spettro d’azione è limitato ai batteri anaerobi, con
attività maggiore sugli anaerobi Gram negativi (Bacteroides spp); i batteri aerobi presentano resistenza naturale (innata) al metronidazolo poiché mancano di attività di nitroriduttasi.
Non deve essere utilizzato nel primo trimestre di gravidanza per rischio di teratogenicità; non si devono assumere alcolici per un effetto antabuse sino a 48 ore dopo la sospensione del farmaco.
1.8 Aminoglicosidi
Si tratta di una famiglia numerosa caratterizzata da struttura chimica simile: vari aminozuccheri uniti da legame glicosidico a un aglicone aminociclitolo (tabella 1.21, 1.22).
Agiscono con un meccanismo d’azione identico (blocco e deviazione della sintesi proteica) e risultano in una
batteriocidia veloce con spettro d’azione ampio su cocchi Gram+, bacilli Gram- e micobatteri.
Per quanto riguarda la farmacocinetica sono scarsamente assorbiti per via orale e poco metabolizzati dal
fegato, sono eliminati in forma attiva per via renale.
Le reazioni avverse sono rappresentate dalla nefrotossicità e neurotossicità a carico dell’VIII paio di nervi cranici, sia a carico del ramo vestibolare che cocleare.
Gli aminoglicosidi rappresentano farmaci di scelta eccezionale in quanto orientati sui Gram- “difficili” responsabili di gravi infezioni sistemiche; risultano, però,
scarsamente attivi sugli anaerobi e sui cocchi Gram+ tipici delle infezioni odontogene.
Il composto più utilizzato in passato era la gentamicina
nella profilassi antibiotica per via parenterale dell’endocardite infettiva e l’amicacina in associazione con le penicilline nelle sepsi gravi.
Nelle linee guida attuali per la profilassi dell’endocardite infettiva e delle infezioni chirurgiche per interventi
del cavo orale, gli aminoglicosidi sono sostituiti dalle
più moderne cefalosporine.
1.9 Chinoloni
Il capostipite della famiglia è l’acido nalidixico; la I° e
II° generazione sono caratterizzate da scarsa distribuzione tissutale e una rapida escrezione renale con con-
56
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tabella 1.23 - Antibiotici chinolonici
CH2OH
O
HO
HO
NHCH3
O OH
CH3
H
HN=C–NH2 H CHO
H
NH
O
O
HO
H2N–C–HN
– CH2OH Diidrostreptomicina
Streptomicina
OH
OH
NH
CH2–NH2
O
HO
HO
NH2
OH
O
O
CH2OH
OH
O
HO
HO
HO
NH–CO-CHOH–(CH2)2–NH2
O
CH2OH
OH
O
HO
CH3
CH–NH–CH3
O
Amikacina
NH2
Anello desossistreptaminico
NH2
H2N
O
HO
NH2
O
O
HO
CH3
Gentamicina (C1)
CH3NH
OH
Figura 1.22 - Struttura chimica degli aminoglicosidi
centrazione urinaria. La terza generazione è costituita
da un nuovo gruppo: i fluorchinoloni caratterizzati da
ampio spettro d’azione (praticamente il più ampio oggi conosciuto), ottima cinetica e biodisponibilità orale,
buona distribuzione tissutale ed endocellulare e buona
tollerabilità generale (tabella 1.23, 1.24).
I nuovi chinoloni sono farmaci interessanti capaci di curare per via orale anche pazienti con infezioni gravi da PseuO
5
6
O
2
N
1
8
O
COOH
3
4
7
III° generazione
Longacting, a azione
sistemica e a ampio spettro
Fleroxacina
Lomefloxacina
Pefloxacina
Rufloxacina
Sparfloxacina
domonas e da altri Gram- difficili.
Sono stati usati con successo nella terapia delle infezioni
urinarie, respiratorie, della cute, delle ossa, di malattie sessualmente trasmesse, di infezioni chirurgiche e di setticemie. I chinoloni inibiscono le subunità A dell’enzima
DNA-girasi, indispensabile per tutti i processi che esigono
modificazioni della configurazione spaziale del DNA batterico (riparazione, trascrizione, trasposizione, ricombinazione, compattazione, ecc); ne deriva un blocco della replicazione del DNA. Recentemente sono stati introdotti i chinoloni long acting con emivita prolungata.
I chinoloni rappresentano farmaci di scelta eccezionale, in
quanto orientati sui Gram- difficili agenti eziologici di gravi infezioni sistemiche; ma risultano scarsamente attivi sugli anaerobi e sui cocchi Gram+ tipici delle infezioni odontogene. I composti di cui è stata talvolta proposta l’utilizzazione sono la ciprofloxacina e l’ofloxacina; il loro uso deve
comunque essere giustificato dalla presenza di gravi infezioni da germi difficili e non trova generalmente motivazione nelle infezioni del cavo orale sensibili ad antibiotici
meno tossici e di minor costo.
Per la ciprofloxacina vi sono indicazioni specifiche per la terapia sistemica delle parodontiti in associazione all’amoxicillina.
NH2
OH
O
HO
II° generazione
Antisettici urinari ad
ampio spettro Gram-
Kanamicina (A)
NH2
CH2–NH2
O
III° generazione
A spettro amplissimo
Ciprofloxacina
Ofloxacina
III° generazione
A ampio spettro
Enoxacina
Norfloxacina
NH2 Anello desossistreptaminico
HO
I° generazione
Antisettici urinari per
Gram-
H3C
N
HN
N
N
N
ciprofloxacina
N
O
COOH
F
HN
N
O
N
COOH
O
COOH
N
HN
norfloxacina
O
N
F
C2H5
acido nalidixico
F
H3 C
COOH
N
C2H5
4-chinolone
O
F
N
N
HN
N
C2H5
H3C
CH3
Figura 1.24 - Struttura chimica dei chinoloni
N
F
C2H5
ofloxacina
COOH
F
enoxacina
lomefloxacina
A.3 PARTE PRATICA
1. RAZIONALE DI TERAPIA
DELLE INFEZIONI DEL CAVO
ORALE
1.1 Actinomicosi
È un’infezione cronica causata da batteri filamentosi
ramificati, anaerobi, Gram- parte integrante della flora
batterica saprofitica del cavo orale; le specie più frequentemente isolate sono Actinomices Israelii, A. Odontoliticus, A. Viscosus che colonizzano in particolare modo le tasche parodontali, le cavità sierose, le cripte tonsillari, nonché la placca batterica, il tartaro e i siti postestrattivi.
L’actinomicosi si localizza preferenzialmente a livello
dei tessuti molli cervico-facciali, generalmente a seguito di evento traumatico, estrazioni dentarie o chirurgia
parodontale, oppure in pazienti con immunodepressione ed in presenza di osteoradionecrosi (fig. 1.1, 1.2,
1.3, 1.4).
Si tratta di un’infezione che tende alla cronicizzazione
ed è perciò di competenza specialistica ospedaliera.
La terapia nelle forme lievi prevede la somministrazione di una aminopenicillina; i pazienti allergici possono
essere trattati con tetraciclina o clindamicina.
Nelle infezioni miste va associata la dicloxacillina (per
gli stafilococchi) o il metronidazolo (per gli anaerobi).
Nelle forme estese e/o con ascessualizzazione si procede
all’intervento chirurgico di drenaggio con curettaggio osseo, chiusura del tragitto fistoloso e terapia con penicillina G (benzil penicillina) per via parenterale; successivamente si passa a una penicillina deposito (penicillina G
benzatina) o a una penicillina orale per 2-6 (-12) mesi.
Pr: Amoxicillina cpr 1gr
S: 1 gr per quattro volte al giorno per 2-6 mesi
Pr: Penicillina G fiale 100.000 UI
S: 3 megaunità al giorno im/ev in 4 somministrazioni per
2-6 mesi
Il quadro clinico più frequente consiste in un ascesso
sottomandibolare; dalle fistole fuoriesce un caratteristico materiale giallastro (granuli sulfurei) costituito da
colonie di actinomiceti. L’aspetto radiografico è sovrapponibile all’osteomielite con aree di osteolisi a bordi
sfumati e sequestri ossei.
1.2 Alveolite postestrattiva
La terapia sistemica è parzialmente inefficace nel controllare la sintomatologia; il metronidazolo rappresenta l’antibiotico di prima scelta data la prevalente eziologia di batteri Gram- anaerobi; in alternativa si utilizzano anche betalattamine betalattamasi resistenti come ad esempio, l’amoxicillina/acido clavulanico o il cefprozil (figura 1.5).
Il trattamento locale rappresenta la terapia più efficace,
in quanto crea un ambiente favorevole alla guarigione:
- Eseguire una pulizia chirurgica dell’alveolo per eliminare sequestri ossei
- Irrigare la cavità alveolare con una soluzione antisettica (iodiopovidone 10% soluzione), antibiotica (rifamicina fialoidi ad uso topico) o soluzione fisiologica
- Zaffare con una garza iodoformica l’alveolo, nei periodi intermedi tra le irrigazioni, per impedire l’incuneamento di cibo.
- Eseguire sciacqui del cavo orale con collutori antisettici (clorexidina 0,2%)
Pr: Metronidazolo cpr. 250 mg
S: 1 compressa ogni 6-8 ore per 7 giorni
1.3 Gengivite necrotizzante
L’infezione, sostenuta da una flora mista fusospirillare
di Gram- anaerobi, si presenta generalmente in ospiti
compromessi (figura 1.6, 1.7, 1.8).
Si presenta tipicamente con necrosi delle papille interdentali, decapitate e coperte da un indulto giallastro
costituito da pus e materiale necrotico.
L’antibiotico di elezione è il metronidazolo per via orale, ma è anche utilizzabile l’associazione l’amoxicillina/acido clavulanico o una cefalosporina betalattamasi
resistente (ad esempio cefprozil), verso cui non sussistono resistenze.
La terapia antibiotica va integrata con il controllo meccanico e farmacologico della placca mediante appuntamenti ravvicinati e consiste:
- detartrasi, levigatura delle radici, curettaggio gengivale
- lavaggi intrasulculari per rimuovere gli agenti eziologici, i tessuti necrotici e i sequestri ossei
- istruzione del paziente ad eseguire una accurata igiene orale domiciliare e sciacqui con collutorio a base
di antisettici (sciacqui di clorexidina).
58
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Dopo la guarigione si devono eliminare i fattori predisponenti le recidive: individuare condizioni sistemiche
causa di immunodepressione; eseguire una bonifica
mediante interventi di chirurgia parodontale ed estrazioni dei denti non recuperabili; motivare il paziente ad
una igiene orale domiciliare corretta e ai richiami periodici per l’igiene professionale.
Pr: Metronidazolo cpr 250 mg
S: 1 compressa ogni 8 ore per 5 giorni
1.4 Infezioni odontogene
superficiali
Si tratta di infezioni acute che, per la scarsa virulenza
dell’agente patogeno e/o le buone capacità di difesa
Figura 1.1 - Actinomicosi
Figura 1.3 - Actinomicosi
Figura 1.2 - Actinomicosi
Figura 1.4 - Actinomicosi
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Figura 1.5 - Alveolite postestrattiva
Figura 1.6, 1.7, 1.8 - Gengivite ulcero-necrotica acuta
(ANUG)
59
dell’ospite, tendendo a risolversi localmente e in superficie (figura 1.9).
Un piccolo ascesso può regredire del tutto o evolvere in
un graduale processo di incapsulamento del pus con
persistenza del focolaio in uno stato quiescente.
Il drenaggio spontaneo porta generalmente alla risoluzione di una lesione suppurativa localizzata in superficie; se invece l’ascesso è situato profondamente, ben
capsulato, mantenuto da un focus cronico non eradicato, si può osservare la persistenza di un tragitto fistoloso con carattere di cronicità.
Le infezioni superficiali rappresentano l’eventualità più
frequente per la maggior parte delle infezioni: gli ascessi parodontali, le parodontiti apicali acute o riacutizzate, le cisti odontogene infette, le pericoronatiti acute
nella disodontiasi del dente del giudizio.
L’evenienza più frequente è rappresentata da un processo suppurativo circoscritto, costituito da una cavità
piena di pus delimitata da una membrana piogenica e
tragitto fistoloso originato dalla riacutizzazione di una
parodontite apicale cronica.
Il trattamento consiste nella rimozione della fonte di
infezione, incisione e drenaggio (se la raccolta è fluttuante), applicazione di calore umido, prescrizione di
antibiotici e di analgesici-antinfiammatori.
Rilevanti miglioramenti sintomatici fanno seguito a un
adeguato drenaggio del pus, ma l’incisione di tessuti infetti, prima che si realizzi la colliquazione, è spesso de-
60
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
FASE ENDOSTALE
FASE SUBPERIOSTEA
polpa
necrotica
con materiale
infetto
fessura
parodontale
allargata
infiammazione
apicale
polpa
necrotica
con materiale
infetto
progressione
dell’infiammazione
nella spongiosa
e nella compatta
osteito
circoscritto
spongiosa
spongiosa
corticale
corticale
vestibolare
linguale
FASE ENDOSTALE
vestibolare
linguale
FASE SUPPURATIVA
DELLE PARTI MOLLI
(ASCESSO
SOTTOMUCOSO)
tumefazione
vestibolare
vestibolo
pus
essudato
subporiosteo
con sollevamento
del periostio
pus
periostio
sollevamento
del periostio
fase endossea
della parodontite
apicale acuta
infiltrato
infiammatorio
drenaggio osseo
mediante fresatura
vestibolare
linguale
ascesso
palatale
cisti dei seni
mascellari (infettati)
periostio
mucosa
sinusite mascellare
pululenta
Figura 1.9 - Decorso di una parodontite apicale acuta nelle diverse fasi. Il drenaggio può avvenire spontaneamente
e essere accelerato con una incursione mucosa o una fistola ossea chirurgica. L’ascesso del pavimento e del setto nasale
deriva da infezioni degli incisivi superiori attraverso l’osso spugnoso o il canale incisivo
61
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
leteria, non riesce ad alleviare il dolore e può anche facilitare la diffusione dell’infezione. Per questa ragione è
necessario aspettare fino ad ottenere un ascesso maturo
prima di incidere.
L’applicazione di calore può alleviare il dolore e accelerare la regressione senza che si abbia la suppurazione
nelle fasi iniziali; se è già in corso la necrosi facilita la
demarcazione del processo e l’accumulo di pus rendendo praticabili l’incisione e il drenaggio in minor
tempo.
La parodontite apicale acuta in fase endostale, la disodontiasi del dente del giudizio e il tipico ascesso submucoso fluttuante, in cui dopo l’incisione mucosa o
l’apertura del dente si ottenga il drenaggio dell’essudato, non richiedono necessariamente terapia antibiotica;
che trova invece indicazione nei casi in cui esista il rischio di diffusione dell’infezione (figura 1.10, 1.11,
1.12, 1.13, 1.14).
La terapia è somministrata per via orale, indirizzata
verso gli agenti causali più probabili delle infezioni orodentali (terapia empirica o ragionata):
- amoxicillina come prima scelta
- amoxicillina+acido clavulanico o cefprozil nelle infezioni sostenute da microrganismi betalattamasi produttori
- claritromicina nei pazienti allergici alle betalattamine
Altri farmaci (eritromicina, doxiciclina, cefaclor, cefodroxil, axetilcefuroxima, cefixime, ceftibuten, metronidazolo, clindamicina) non presentano particolari vantaggi come attività antibatterica; mentre alcuni richiedono un maggior numero di somministrazioni, altri
presentano minore tollerabilità gastroenterica (nausea,
vomito, diarrea).
Figura 1.10 - Ascesso palatale
Figura 1.11 - Ascesso palatale
Pr: Amoxicillina cpr. 1gr, cps. 500mg
S: 1 capsula ogni 6-8 ore (o 3 compresse al giorno) per 57 giorni
Pr: Amoxicillina+ acido clavulanico cpr. 1gr
S: 1 Compressa ogni 8-12 ore per 5-7 giorni
Pr: Cefprozil cpr 500 mg
S: 1 compressa ogni 12 ore per 5-7 giorni
Figura 1.12 - Disodontiasi del dente del giudizio con
pericoronarite
Pr: Cefalexina cpr. 1 gr
S: 1 compressa ogni 6-8 ore per 5-7 giorni
Pr: Eritromicina cpr. 600 mg
S: 1 Compressa ogni 6 ore per 5-7 giorni
Pr: Clindamicina cps. 150 mg
S: 1-2 compresse ogni 6 ore per 5-7 giorni
Pr: Doxiciclina cpr. 100 mg
S: 1 compresse al giorno per 5-7 giorni
Pr: Metronidazolo cpr. 250 mg
S: 1 compressa ogni 6-8 ore per 5-7 giorni
Figura 1.13 - Ascesso con fistolizzazione vestibolare di
un incisivo superiore
62
1.5 Infezioni odontogene
profonde
Si tratta di patologie infettive che tendono alla diffusione in profondità, in quanto sostenute da germi resistenti ai più comuni antibiotici o per uno stato di immunocompromissione dell’ospite.
L’ascesso è una infezione profonda circoscritta costituita da una cavità contenente pus, tappezzata da una
membrana piogenica, che tende a fistolizzare.
La cellulite è una infiammazione acuta, rapidamente
progressiva del derma e dell’ipoderma, determinata da
microrganismi anaerobi produttori di ialuronidasi che
distruggono le proteine intercellulari facilitando la diffusione dell’infezione. Il flemmone è una infezione
profonda, che coinvolge i tessuti molli e gli spazi fasciali (cellulite diffusiva). I sintomi e segni locali sono
costituiti da tumefazione, difficoltà di deglutizione, aumento di salivazione, alitosi, eritema cutaneo, trisma,
bolle cutanee (flittene); i sintomi sistemici sono dolore,
febbre, astenia e tachipnea. La diffusione per contiguità di ascessi e flemmoni odontogeni può seguire alcune vie tipiche (figura 1.15, 1.16, 1.17, 1.19).
L’ascesso della loggia retromascellare deriva generalmente da patologie dei molari superiori. L’ascesso della
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
loggia paramandibolare e della guancia è riconducibile
senza eccezione a patologie dei molari e premolari
inferiori. L’ascesso perimandibolare è il più frequente e
deriva spesso dai molari inferiori. L’ascesso sottomandibolare è anch’esso il più frequente accanto al
perimandibolare e le cause preponderanti sono le infezioni dei molari mandibolari. L’ascesso mentoniero e
sottomentoniero è causato prevalentemente dai denti
anteriori inferiori e solo più raramente dai premolari e
molari. L’ascesso sottolinguale può derivare da tutti i
denti inferiori. L’ascesso masseterico-mandibolare e
pterigo-mandibolare riconoscono prevalentemente
come causa la disodontiasi del dente del giudizio
inferiore. L’ascesso peritonsillare deriva generalmente
da tonsilliti e angine e più raramente da infezioni
odontogene dei molari. L’ascesso parafaringeo, retrofaringeo e della loggia retromandibolare (o loggia
parotidea) non sono mai primari, ma si realizzano per
diffusione da altre logge; sono raramente odontogeni e
più frequentemente derivano da angine, tonsilliti,
scialoadeniti della ghiandola parotide. L’ascesso
orbitale è raramente di origine odontogena, potendo
derivare per diffusione da infezioni odontogene sinusali o della loggia retromascellare.
L’ascesso temporale è una complicanza secondarie di
suppurazioni primarie in altri compartimenti; le cause
odontogene possono essere rappresentate da infezioni dei
molari. Una complicanza temibile è rappresentata dalla
diffusione negli spazi sottomentale, sottomandibolare e
sottolinguale con spostamento in alto e indietro della
lingua e conseguente ostruzione meccanica delle vie aeree
(angina di Ludwig).
La diffusione può avvenire verso il collo e il mediastino o verso i tessuti cervicali e la base cranica attraverso
diverse modalità:
- per via ematica anterograda causando una setticemia
o una tromboflebite con conseguente batteriemia,
embolizzazione settica, ascessi metastatici intrapa-
disodontiasi
del dente del giudizio inferiore
possibilità di diffusione nelle logge
Figura 1.14 - Radiotrasparenza periapicale riferita a
ascesso di un incisivo superiore
diffusione linguale
diffusione vestibolare
spazio
pterigomandibolare
spazio
masseterico-mandibolare
spazio sottomandibolare,
sottolinguale
e perimandibolare
spazio
parotideo
Figura 1.15 - Possibilità di diffusione dell’infezione in
presenza di disodontiasi del dente del giudizio inferiore
63
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
loggia
temporale
loggia
infratemporale
endocranio
fossa
pterigopalatina
orbita
base cranica
regione
dell’articolazione
temporomandibolare
loggia
retromascellare
spazio
retromandibolare
spazio
retrofaringeo
ascesso
parafaringeo
spazio
pterigomandibolare
regione
parotidea
regione
paramandibolare
e della guancia
spazio
sottomandibolare
spazio
massetericomandibolare
spazio
parafaringeo
fossa
infratemporale
mediastino
posteriore
spazio
pterigomandibolare
Figura 1.16 - Regioni anatomotopografiche in
comunicazione con la loggia retromascellare
Figura 1.17 - Comunicazioni e possibilità di diffusione
degli ascessi nello spazio parafaringeo
renchimali a distanza (cerebrali, polmonari), endocarditi, tromboflebiti settiche;
- per via ematica retrograda attraverso le connessioni
venose e i rapporti topografici col seno cavernoso
(trombosi del seno cavernoso, meningite, ascessi cerebrali e cerebellari);
- per contiguità seguendo i percorsi di minor resistenza lungo i piani fasciali della testa e del collo, sino a
causare quadri di mediastinite e pericardite con tamponamento cardiaco;
- tramite il sistema linfatico che può condurre a linfangite o a linfoadenite regionale talvolta con suppurazione.
Oltre alle classiche manifestazioni locali (rumor, dolor,
calor e tumor), nelle infezioni profonde si sommano
segni e i sintomi riferibili all’interessamento delle strutture vicine (dispnea, disfagia) e sistemici (febbre, prostrazione, alterazione degli esami ematochimici).
Gli esami ematochimici possono evidenziare il riscontro di una leucocitosi neutrofila e di una VES elevata;
una modica albuminuria, riscontrabile occasional-
mente nei pazienti febbrili, non riveste importanza diagnostica.
Sul liquido o pus ottenuto dall’aspirazione o dall’incisione di una lesione, è opportuno eseguire un esame microscopico diretto e dopo colorazione di Gram, si possono
prescrivere culture in aerobiosi e anaerobiosi per istituire
una terapia mirata. Le emoculture possono risultare positive in caso di infezioni intravascolari quali tromboflebiti
settiche o endocarditi e nelle infezioni suppurative con
ascessi metastatici (come ad esempio sepsi sa stafilococchi
e streptococchi). Il trattamento è generalmente di pertinenza ospedaliera e si basa su:
- drenaggio chirurgico
- terapia antibiotica ragionata per via orale o parenterale nei casi più gravi; in alcuni casi dopo una prima
fase per via parenterale si passa alla via orale
- prelievi per il laboratorio di microbiologia per istituire una terapia mirata in caso di insuccesso della terapia ragionata.
Tra le associazioni antibiotiche per via parenterale con
antibiotici a spettro diversificato e complementare, ri-
Tabella 1.18 - Terapia antibiotica delle infezioni profonde
Penicilline
Pr: Ampicillina f 1gr
S: 1 fiala im/ ev ogni 6 ore
Cefalosporine
Pr: Cefoxitina f 1gr
S: 1 fiala im/ ev ogni 6-8 ore
Altri
Pr: Eritromicina f 1gr
S: 1 fiala im/ ev ogni 6-8 ore
Pr: Amoxicillina f 1gr
S: 1 fiala im/ ev ogni 6-8 ore
Pr: Cefazolina fl.1gr
S: 1fiala im/ev ogni 8 ore
Pr: Clindamicina f 600 mg
S: 1fiala im/ev ogni 6-8 ore
Pr: Amoxicillina/acido clavulanico f 1 gr
S: 1 fiala ev ogni 6-8 ore
Pr: Ceftriaxone fl 1gr
S: 1fiala im/ ev al giorno
Pr: Metronidazolo f 500 mg
S: 1 fiala im/ ev ogni 6 ore
Pr: Ampicillina+sulbactam f 1,5 gr
S: 1 fiala im/ ev ogni 12-24 ore
64
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
portiamo i seguenti schemi tra i molti proposti in letteratura (tabella 1.18):
- aminopenicilline in associazione a inibitori delle betalattamasi (amoxicillina/acido clavulanico o ampicillina/sulbactam)
- aminopenicilline/inibitori delle betalatamasi in associazione a clindamicina o metronidazolo
- cefamicine betalattamasi resistenti (cefoxitina) in associazione a clindamicina o metronidazolo
- metossimine betalattamasi resistenti e long acting
(ceftriaxone).
Alcuni casi clinici sono esemplificati nelle fotografie da
1.20 a 1.31.
ASCESSO PERIMANDOBOLARE
1.6 Osteomielite
Le cause più frequenti di osteomielite acuta, oltre i
traumi, sono le infezioni odontogene e parodontali.
I germi implicati nell’eziologia sono lo Stafilococcus aureus e S. epidermidis, seguiti dagli anaerobi e da altri
germi Gram-.
La maggior parte dei pazienti affetti da osteomielite
presenta alterazioni delle difese immunitarie come: diabete, leucemie, anemie, malnutrizione oppure alterazioni della vascolarizzazione ossea (osteoporosi, morbo
di Paget, displasia fibrosa, ecc).
L’osteomielite acuta è caratterizzata da dolore intenso e
ASCESSO SOTTOMANDIBOLARE
ascesso
sottomandibolare
ascesso
perimandobolare
ASCESSO MENTONIERO
E SOTTOMENTONIERO
ASCESSO SOTTOLINGUALE
ascesso
mentoniero
ascesso
sottolinguale
ascesso
sottomentoniero
SINUSITE ODONTOGENA
ASCESSO DELLO SPAZIO BUCCALE
spazio
buccale
ascesso
spazio
sottomucoso
Figura 1.19 - Diverse zone di diffusione per contiguità delle infezioni odontogene
65
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
ASCESSO MASSETERICO-MANDIBOLARE
ASCESSO DELLA LOGGIA TONSILLARE
parotide
diffusione alla
loggia tonsillare
ascesso
massetericomandibolare
diffusione
nella loggia
parotidea
ascesso
spazio buccale
spazio
sottomucoso
ASCESSO PTERIGO-MANDIBOLARE
ASCESSO DELLA LOGGIA RETROMASCELLARE
parete posteriore
dei seni mascellari
coane
ascesso
pterigo-mandibolare
fessura orbitale
interiore
muscolo massetere
muscolo pteriodeo
laterale
raccolta di essudato
purulento dell’ascesso
retromascellare
processo
pterigoideo
ASCESSO RETROTONSILLARE, PARAFARINGEO
E RETROFARINGEO
muscolo pterigoideo
mediale
ASCESSO DELLA LOGGIA PAROTIDEA
ascesso
retrofaringeo
ascesso
della loggia
parotidea
fascia profonda
del collo
tonsilla
ascesso
retronsillare
ascesso
parafaringeo
ASCESSO ORBITALE
muscolo
obliquo
superiore
muscolo
retto
mediale
ASCESSO TEMPORALE
muscolo elevatore
della palpebra
superiore
muscolo retto
superiore
muscolo retto
laterale
ascesso
orbitale
muscolo retto
inferiore
Figura 1.19 (continua) - Diverse zone di diffusione per contiguità delle infezioni odontogene
muscolo
temporale
ascesso
temporale
arco
zigomatico
processo
muscolare
della
mandibola
66
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Figura 1.23 - Fistolizzazione cutanea in sede
sottomandibolare di ascesso di un molare
Figura 1.20, 1.21, 1.22 - Ascesso in sede sottomandibolare
causato da radice ectopica estratto per via percutanea
Figura 1.24, 1.25 - Fistolizzazione cutanea in zona mentoniera di ascesso di un incisivo
67
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Figura 1.26, 1.27 - Ascesso perimandibolare causato
da un molare
Figura 1.28 - Flemmone del pavimento orale in
bambino
Figura 1.29, 1.30 - Angina di Ludwig con flittene cutanea
Figura 1.31 - Ascesso in fase di fistolizzazione cutanea
sulla guancia
68
sintomatologia generale (febbre, malessere); radiograficamente non si osserva nessuna alterazione della trama
ossea o eventualmente una lieve opacizzazione. La cronicizzazione provoca una sintomatologia ridotta ma
persistente (dolore, tumefazione, fistolizzazione) e un
aspetto radiografico tipico: radiotrasparenza con margini maldefiniti contornati da aree di radiopacità (addensamento della trabecolatura ossea e reazione periostale) e la presenza di sequestri (figure 1.32, 1.33).
Vista la prevalenza di stafilococchi, in assenza di dati
culturali (concomitante all’eliminazione del focolaio
infettivo odontogeno, al drenaggio chirurgico e ai
prelievi microbiologici), la terapia antibiotica ragionata consiglia l’impiego iniziale di uno dei seguenti
antibiotici:
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
- una betalattamina resistente alle betalattamasi (oxacillina, dicloxacillina)
- un’aminopenicillina associata a un inibitore delle betalattamasi (amoxicillina/ acido clavulanico, ampicillina/sulbactam)
Successivamente la terapia va proseguita sulla base dell’antibiogramma per 4-6 settimane, con un attento
monitoraggio dei parametri infiammatori e delle immagini radiologiche del focolaio.
L’osteomielite cronica richiede interventi complessi di
tipo chirurgico (sequestrectomia, decorticazione), terapia iperbarica, biopsia ossea per eseguire una terapia
mirata sistemica e locale.
Pr: Dicloxacillina cps 250 mg
S: 1-2 compresse ogni 6 ore
Pr: Dicloxacillina f 500 gr
S: 1 fiala im/ev ogni 6 ore
Pr: Oxacillina f 1gr
S: 1 fiale im/ev ogni 6 ore
Pr: Amoxicillina/acido clavulanico cpr 1 gr
S: 1compressa ogni 6-8 ore
Pr: Ampicillina+sulbactam f 1,5 gr
S: 1 fiala im/ ev ogni 12-24 ore
1.7 Parodontiti croniche
Figura 1.32, 1.33 - Nell’osteomielite acuta il quadro
radiografico presenta alterazioni minime consistenti in
una lieve opacizzazione a vetro smerigliato; l’aspetto dei
quadri cronici è tipico con radiotrasparenze con margini
maldefiniti contornati da aree di radiopacità, dovute a
addensamento della trabecolatura ossea, e reazione
periostale e presenza di sequestri.
Gli agenti eziologici putativi delle malattie parodontali
sono prevalentemente bastoncelli anaerobi Gram- (tabella 1.34). La terapia parodontale si basa sul trattamento
meccanico mediante la corretta igiene orale domiciliare,
la preparazione iniziale (detartrasi, levigatura e curettaggio gengivale) e la chirurgia parodontale; il tutto sostenuto da brevi cicli di antisettici (collutori, gel a base di clorexidina). In alcune situazioni la terapia antibiotica sistemica, in aggiunta al trattamento meccanico, può
migliorare le condizioni dei pazienti parodontali.
Gli svantaggi della terapia antibiotica sistemica, comparati all’applicazione locale, consistono nella incapacità di raggiungere elevate concentrazioni nel fluido crevicolare, nelle reazioni avverse ai farmaci, nella selezione di ceppi antibiotico resistenti e compliance incerta.
Sono considerati candidati alla terapia antimicrobica sistemica i pazienti che mostrano una continua perdita di
attacco parodontale, nonostante l’applicazione diligente
della terapia meccanica convenzionale: la parodontite refrattaria, la parodontite giovanile localizzata, altri tipi di
parodontite a esordio precoce, le parodontiti che dipendono da patologie sistemiche, le parodontiti acute (ascesso
parodontale, gengivite e parodontite necrotizzante acuta).
Gli antibiotici proposti nei diversi protocolli sono diversi:
69
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
- le tetracicline trovano indicazione nelle infezioni parodontali da Actinobacillus actinomycetemcomitans;
tuttavia, tale antibiotico può risultare inefficace nel
fermare la progressione della patologia in presenza di
infezioni miste
- il metronidazolo può arrestare le parodontiti refrattarie causate da Porphyromonas gingivalis e/o Prevotella
intermedia
- la clindamicina si è dimostrata efficace in parodontiti
refrattarie sostenute da Peptostreptococcus, Streptococci beta-emolitici e vari bastoncelli anaerobi Gram- l’amoxicillina-acido clavulanico è utilizzata come alternativa alla clindamicina e trova particolare indicazione nella rigenerazione tissutale guidata
- la ciprofloxacina è efficace contro i bastoncelli enterici, pseudomonas, stafilococci Actinobacillus actinomycetemcomitans e altri patogeni parodontali; è associata a metronidazolo o beta-lattamici nelle infezioni miste con anaerobi. La ciprofloxacina è un valido sostituto della amoxicillina nei pazienti allergici
ai betallamici
- il metronidazolo + amoxicillina è in grado di eradicare Porphyromonas gingivalis, Actinobacillus actinomycetemcomitans, nelle parodontopatie a insorgenza precoce e nelle parodontopatie refrattarie dell’adulto.
La parodontite giovanile localizzata associata a Actynomices actinomycetemcomitans, risulta costantemente
sensibile alle tetracicline.
Nelle parodontiti dell’adulto si utilizza una terapia ragionata indirizzata verso i batteri anaerobi obbligati e
facoltativi, Gram negativi, produttori di beta-lattamasi.
La monoterapia con un singolo agente microbico non
si è dimostrata in grado di eradicare alcuni microrganismi parodontali come Actynomices actinomicetemcomitans e il Porphyromonas gingivalis ritenuti da molti
autori agenti patogeni esogeni della malattia parodontale; mentre a tale scopo la associazione amoxicillina +
acido clavulanico o amoxicillina + metronidazolo è più
appropriata.
Le associazioni antibiotiche utilizzano farmaci con effetto sinergico o additivo in vitro, come ad esempio il
metronidazolo+amoxicillina e il metronidazolo + ciprofroxacina per i quali è dimostrata una azione sinergica
su Actinobacillus actinomicetemcomitans e altri patogeni
parodontali; mentre, vanno evitati gli antibiotici con
azione di antagonismo che possono portare a una riduzione della attività antimicrobica, come ad esempio i
batteriostatici (tetracicline) e i battericidi (betalattamici) come riportato nelle tabelle 1.35, 1.36, 1.37.
Il seguente protocollo rappresenta un approccio pratico all’antibiotico terapia nelle parodontopatie:
1) la terapia iniziale dovrebbe includere il trattamento
meccanico e chirurgico se necessario
2) gli antibiotici possono essere prescritti nel proseguo
del trattamento in base a test microbiologici, condizioni cliniche del paziente e terapie sistemiche concomitanti
3) la risposta clinica dovrebbe essere valutata a distanza
di 1-3 mesi dal termine della terapia meccanica. In
caso di progressione della patologia e infiammazione persistente, un esame microbiologico della flora
sottogengivale può essere di ausilio nel determinare
la persistenza di patogeni parodontali putativi
4) se lo richiede la situazione clinica a distanza di 1-3
mesi dalla terapia sistemica antimicrobica un ulteriore indagine microbiologica può essere necessaria
per verificare l’eliminazione dei patogeni e la presenza di organismi superinfettanti. L’elevata presenza di specie di Streptococcus sanguis/mitis, Actinomices, Veillonella sono suggestivi di salute parodontale
o patologia minimale
5) dopo la risoluzione dell’infezione parodontale il paziente deve essere posto in programmi di mantenimento personalizzati. Recidive di patologie parodontali motivano test microbiologici e terapie antibiotiche sistemiche.
Per il trattamento di malattie parodontali localizzate
recidivanti o refrattarie sono, inoltre, utilizzabili dispo-
Tabella 1.34 - Associazione tra patogeni putativi e patologie parodontali progressive
Molte forte
Forte
Actinobacillus actinomycetemcomitans
Spirochete dell’ANUG
Porphyromonas gingivalis
Bacteroides forsythus
Prevotella intermedia
Eubacterium nodatum
Treponema denticola
Moderata
In fase di verifica
Streptococcus intermedius
Prevotella nigriscens
Peptostreptococcus micros
Fusobacterium nucleatum
Campylobacter rectus
Eikenella corrodens
Selenomonas species
Bastoncelli enterici GramPseudomonas species
Staphylococcus species
70
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
sitivi per il rilascio locale di antibiotici in grado di mantenere una concentrazione terapeutica nell’area sottogengivale per lunghi periodi.
In generale l’irrigazione con clorexidina al 2% e applicazioni locali di tetracicline offrono un effetto supplementare prolungato nei confronti del solo trattamento
meccanico. L’applicazione di clorexidina, metronidazolo, tetracicline può essere effettuata per irrigazioni delle tasche (collutori), gel o attraverso inserzione di slow
release devices (SRD).
Dopo l’inserzione di fibre a lento rilascio di tetracicline, la concentrazione nel fluido crevicolare rimane superiore a 600 microgrammi/ml per 10 giorni, mentre
l’applicazione locale di gel diminuisce a 3 microgrammi/ml dopo 3 giorni.
L’utilizzazione di diversi tipi di tetracicline si rivela sovrapponibile come effetto a distanza di 8 settimane.
Tabella 1.35 - Antibiotici utilizzati nel trattamento della parodontite
Farmaco
Dosaggio nell’adulto
Tetraciclina cloridrato
Metronidazolo
Ciprofloxacina
Metronidazolo e Amoxicillina
Metronidazolo e Ciprofloxacina
500 mg/tid/21 giorni
500 mg/tid/8 giorni
500 mg/bid/8 giorni
500 mg/tid/8 giorni per ciascun farmaco
500 mg/bid/8 giorni per ciascun farmaco
Tabella 1.36 - Terapia antibiotica per ascesso parodontali acuto
Amoxicillina
dose di carico di 1 grammo seguita da dose di mantenimento di 500 mg tid per 3 giorni, seguita dalla valutazione
del paziente per determinare ulteriore necessità di terapia antibiotica o aggiustamento posologico.
In caso di allergia agli antibiotici betalattamici
Azitromicina dose da carico di 1 gr il primo giorno, seguita da 500 mg 1 volta al giorno in seconda e terza giornata
Clindamicina dose da carico di 600 mg seguita da 300 mg/qid/3 giorni.
Tabella 1.37 - Terapia antibiotica delle parodontopatie croniche
Terapia topica
Pr: Tetraciclcina, fili impregnati
S: Posizionare il filo e lasciare nella tasca parodontale per 2-3 giorni
Pr: Metronidazolo gel 25% applicatore monouso
S: Applicare nella tasca parodontale con la siringa 1-2 volte a settimana
Terapia sistemica
Pr: Metronidazolo cpr 250 mg
S: 1 compresse 4 volte al giorno per 7 giorni
Pr: Clindamicina cpr 150 mg
S: 1 compressa 4 volte al giorno per 7 giorni
Pr: Tetraciclina cps 250
S: 1 compressa 4 volte al giorno per 14 giorni
Pr: Amoxicillina + acido clavulanico sosp.
S: 250 mg tre volte al giorno per 14 giorni
Pr: Doxiciclina o minociclina cps 100 mg
S: 1 capsula al giorno per 14 giorni
Pr: Metronidazolo cpr+ amoxicillina sosp.
S: 250 mg di metronidazolo + 250 mg di amoxicillina quattro volte
al giorno per 7 giorni
71
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Figura 1.38 - Paradontite cronica dell’adulto
Figura 1.40 - Gengivite
1.8 Perimplantite
La mucosite perimplantare è una condizione reversibile di tipo infiamatorio e infettivo localizzata alla sola
mucosa perimplantare.
Loading theory indica la perdita non settica della condizione di anchilosi funzionale tra osso e impianto, determinata da fattori meccanici che determinano un
progressivo riassorbimento del tessuto osseo e la sostituzione con una capsula di tessuto fibroso.
La scarsa vascolarizzazione e cellularità del tessuto fibroso rendono meno efficace la difesa delle infezioni
che possono propagarsi in profondità determinando
perimplantiti.
La perimplantite è un processo flogistico e infettivo,
con perdita di tessuto mineralizzato e formazione di difetti ossei.
La microflora saprofita presente nel solco degli impianti endossei con letto implantare sano è costituita dalla
stessa presente nel solco gengivale dei denti sani, con
prevalenza di cocchi Gram+, aerobi, immobili. Con
l’approfondirsi del cono di assorbimento prevale una
flora di Gram-, anaerobi con forme mobili come spirochete e bastoncelli; identificate con le specie batteriche
patogene, normalmente presenti nelle tasche parodontali (Actynomices, Prevotella, Bacteroides spp).
Figura 1.39 - Ascesso paradontale
La diagnosi delle perimplantiti è clinica (iperplasia, flogosi, emorragia, perdita del sigillo mucoso e aumento
della profondità di sondaggio parodontale, mobilità
degli impianti) e radiologica:
- perimplantiti di classe 1, riassorbimento osseo modesto e di tipo orizzontale
- perimplantiti di classe 2, riassorbimento osseo moderato e di tipo verticale con pareti di delimitazione
conservate
- perimplantiti di classe 3, riassorbimento osseo di media entità, di tipo verticale con perdita delle pareti
del difetto
- perimplantiti di classe 4, grave riassorbimento osseo
di tipo verticale con perdita delle pareti del difetto
La terapia della perdita non settica dell’anchilosi funzionale consiste nella correzione del sovraccarico occlusale, eventualmente associata alla correzione del difetto
osseo e della mucosa.
Il trattamento delle mucositi consiste nel controllo della placca con l’igiene orale, collutori antisettici e antibatterici topici nel solco (clorexidina).
Nelle perimplantiti lo scopo della terapia è arrestare il
riassorbimento osseo e ottenere, in casi selezionati, una
nuova rigenerazione del letto implantare:
- le perimplantiti di classe 1 sono trattate come le mucositi + curettaggio a cielo aperto, riposizionamento
apicale del lembo, disinfezione dell’impianto
- le perimplantiti di classe 2 sono trattate come i difetti di tipo 1 + osteoplastica resettiva
- le perimplantiti di classe 3 sono trattate come i difetti di tipo 2 + implantoplastica e rigenerazione ossea
- le perimplantiti di classe 4 sono trattate con rimozione dell’impianto e toilette dei tessuti perimplantari.
La terapia delle perimplantiti è divisibile in tre fasi: farmacologica, di igiene professionale e chirurgica.
La fase farmacologica mira a ridurre la carica batterica
locale e permettere la remissione della flogosi e dell’edema per migliorare la risposta tissutale alla fase chirurgica. L’antibiotico viene somministrato almeno cinque giorni prima dell’intervento, utilizzando amoxicillina/acido clavulanico, cefprozil, metronidazolo o doxiciclina per via orale (si vedano i protocolli di terapia
delle parodontiti).
72
Figura 1.41 - Perimplantite con fistolizzazione
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
La fase di igiene professionale viene eseguita contemporanemente alla fase farmacologica:
- si rimuove la struttura protesica
- si asportano placca e tartaro con curette in plastica
- si collocano nel solco gengivale fili retrattori imbevuti di acqua ossigenata al 10% diluita in acqua al 50%
per una prima detersione
- si collocano nel solco gengivale fili retrattori imbevuti di acido citrico a pH 2 per 30-60 secondi per la decontaminazione
- si risciacqua con soluzione fisiologica e si posiziona
un gel di clorexidina.
Nella fase chirurgica la correzione della superficie implantare (implantoplastica) è eseguita per prima con
fresa diamantata a grana sottile e coppette di gomma;
successivamente si esgue il curettaggio e la chirurgia ossea in base alla morfologia del difetto.
Pr: Amoxicillina+ acido clavulanico cpr 1gr
S: 1 Compressa ogni 8-12 ore per 5-7 giorni
Pr: Cefprozil cpr 500 mg
S: 1 compressa ogni 12 ore per 5-7 giorni
Pr: Doxiciclina cpr 100 mg
S: 1 compresse al giorno per 5-7 giorni
Figura 1.42 - Perimplantite con riassorbimento osseo iniziale
Pr: Metronidazolo cpr 250 mg
S: 1 compressa ogni 6-8 ore per 5-7 giorni
1.9 Scialoadenite batterica
Figura 1.43 - Perimplantite con profondo riassorbimento osseo
Figura 1.44 - Perimplantite con infezione profonda
all’apice degli impianti
La parotite suppurativa è generalmente causata da stafilococchi, occasionalmente da streptococchi (figure
1.45, 1.46, 1.47, 1.48, 1.49). I sintomi e segni locali
(tumefazione, dolore, trisma e fuoriuscita di pus dall’orifizio duttale) possono associarsi a febbre e malessere.
L’infezione può essere causata da calcolosi, infezioni
ematogene o ascendenti, traumi. Il fattore predisponente più importante è rappresentato dalla diminuzione del
flusso salivare per disidratazione (ad esempio pazienti
ospedalizzati per interventi di chirurgia) e terapie farmacologiche. La terapia va instaurata rapidamente per evitare alterazioni irreversibili dell’albero duttale che possono predisporre a successive riacutizzazioni o cronicizzazione; il trattamento dovrebbe prevedere l’utilizzo di:
- isossazolilpenicilline (oxacillina, dicloxacillina) resistente alle penicillinasi stafilococciche, come prima scelta
- cefalosporine orali (cefprozil) o macrolidi per os (claritromicina) come II° scelta nei casi lievi
- cefalosporine iniettive betalattamasi resistenti (cefoxitina, ceftriaxone) nei casi gravi
Il paziente deve essere istruito all’igiene orale con il
controllo meccanico e farmacologico (sciacqui di clorexidina) della placca per evitare il perpetuarsi di infezio-
73
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
ni ascendenti attraverso il dotto di Stenone.
Poiché un flusso salivare elevato facilita il drenaggio
dell’infezione, è opportuno, come misura di supporto:
- aumentare l’introito di acqua (bere abbondantemente) per evitare disidratazione e conseguente diminuzione della salivazione (considerare la contemporanea prescrizione di scialagoghi)
- eliminare potenziali cause di iposcialia (ad es. terapie
farmacologiche).
Dopo la guarigione si devono indagare i fattori predisponenti la riduzione del flusso salivare potenzialmente
cofattori di recidiva (scialolitiasi, iposcialia da farmaci,
xerostomia). La maggior parte delle scialoadenite è causata da calcolosi duttali; la loro diagnosi e asportazione
va posticipata alla risoluzione dell’infezione acuta; poiché l’esecuzione di biopsie, interventi e scialografie potrebbero determinare un’estensione dell’infezione.
Figura 1.45, 1.46 - Parotite suppurativa batterica
I sintomi e segni locali sono rappresentati da tumefazione,
dolore, trisma e fuoriuscita di pus dall’orificio duttale;
possono associarsi a febbre e malessere
I calcoli nella parte distale del dotto di Warthon, riconoscibili alla palpazione del pavimento della bocca, possono essere asportati in ambulatorio; invece i calcoli posizionati nella zona più posteriore richiedono interventi
più complessi, prevalentemente in anestesia generale.
Nei casi di scialolitiasi recidivante può essere necessario
asportare la ghiandola; in alternativa si può eseguire la legatura del dotto che porta a fibrosi della ghiandola.
Pr: Dicloxacillina cps 250 mg
S: 1-2 compresse ogni 6 ore
Pr: Dicloxacillina f 500 gr
S: 1 fiala im/ev ogni 6 ore
Pr: Oxacillina f 1gr
S: 1 fiale im/ev ogni 6 ore
Figura 1.47, 1.48, 1.49 - Scialoadenite della ghiandola
sottomandibolare indagata con scialografia
74
1.10 Sinusite odontogena
Le sinusiti odontogene possono essere causate da infezioni periapicali, parodontopatie profonde, comunicazioni buccosinusali (fistole oroantrali) conseguenti a
estrazioni dentarie, infezioni perimplantari, dislocazione
di materiali odontoiatrici o radici nella cavità sinusale.
Il trattamento delle sinusiti odontogene acute consiste
nelle seguenti misure terapeutiche associate alla terapia
antibiotica:
- fluidificare le secrezioni con trattamento aspecifico
(umidificazione dell’ambiente, idratazione del paziente, inalazioni calde) in modo da facilitare il drenaggio delle secrezioni nasali e sinusali
- agenti mucolitici per aereosol (bromessina, acetilcistei-
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
na) in modo da facilitare il drenaggio delle secrezioni
- decongestionanti delle mucose nasali, applicando vasocostrittori sull’ostio dell’antro ostruito situato nel
meato inferiore per facilitare il drenaggio del seno; i
medicinali più frequentemente utilizzati sono la fenilefrina e la xilometazolina; questi farmaci non devono esser impiegati per più di 3-5 giorni per il rischio
di rinite medicamentosa
- terapia analgesica e antinfiammatoria a base di FANS
Il tasso di insensibilità ad alcuni antibiotici degli agenti eziologici più comuni delle sinusiti risulta elevato:
per lo Streptoccocus pneumoniae il 14,3% dei ceppi batterici è resistente all’amoxicillina e il 22-29% ai macrolidi; il 10,6% dei ceppi di l’Haemophilus influenzae e il
55,9% delle Moraxella catarrhalis sono in grado di sintetizzare betalattamasi.
Limitata risulta anche l’attività di alcune cefalosporine
orali di III generazione (cefixima, ceftibuten) per la loro modesta attività dimostrata verso i ceppi di S. pneumoniae a sensibilità intermedia alla penicillina.
Per questo motivo come farmaco di primo impiego è
consigliabile utilizzare betalatamine betalattamasi resistenti: l’amoxicillina/acido clavulanico, l’acetil-cefuroxime o il cefprozil (cefalosporine orali di II generazione
betalattamasi resistenti).
Il trattamento va protratto per almeno 10-14 giorni a
dosaggio pieno, poiché periodi più brevi favoriscono la
cronicizzazione.
Figura 1.50 - Comunicazione oro-antrale con polipo mucoso
Figura 1.51 - Comunicazione oro-antrale
Figura 1.52 - Penicillium notatum
75
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Generalmente la remissione dei sintomi si verifica in 23 giorni; i pazienti divengono febbrili e si verifica una
evidente riduzione della tosse e delle secrezioni nasali.
Se dopo cinque giorni non si ottiene miglioramento
occorre sospettare una forma di resistenza all’agente patogeno e intraprendere una terapia mirata eseguendo
un esame colturale del secreto.
Nei casi refrattari alla terapia medica è indicato il drenaggio e le irrigazioni endosinusali.
La sinusite cronica costituisce indicazione all’intervento
chirurgico che mira a fornire drenaggio e ventilazione della cavità sinusale (intervento di Caldwell-Luc; antrostomia
intranasale; chirurgia endoscopica sinusale funzionale).
Una complicazione non infrequente in esodonzia è
rappresentata dalle comunicazione oro-antrali che
possono causare sinusiti mascellari (figure 1.50, 1.51).
La diagnosi è generalmente eseguita intraoperatoriamente evidenziando il reflusso di liquido dalla cavità
orale nel naso, il sanguinamento nasale, la manovra di
Valsalva positiva (facendo soffiare il naso mantenendolo chiuso, l’aria esce dalla fistola).
La terapia consiste nelle seguenti misure:
- intervento immediato di chiusura eseguito nella stessa seduta operatoria
- istruzioni al paziente per evitare manovre che au-
mentino la pressione intrasinusale (soffiare il naso,
succhiare con cannuccia, fumare, gonfiare palloncini, suonare strumenti a fiato (per un periodo che può
andare dai 10 giorni alle tre settimane a seconda le
dimensioni della comunicazione).
- terapia medica sovrapponibile alle sinusiti mascellari
acute; data la presenza della fistola oroantrale le irrigazioni con antibiotico sono agevolmente eseguibili
(figura 1.53).
La sorveglianza, dilazionando la chiusura, è sconsigliata; è
tuttavia possibile la chiusura spontanea, limitatamente a
fistole oro-antrali di piccole dimensioni, asintomatiche;
mentre la guarigione spontanea è poco probabile per comunicazioni di diametro superiore a 5 mm.
Comunque, in caso di persistenza oltre un periodo
massimo di 6 settimane, è necessario eseguire la chiusura chirurgica; in presenza di sinusite acuta secondaria
a fistola oroantrale, la chiusura deve essere posticipata
alla risoluzione del fatto infettivo.
Pr: Amoxicillina/Acido clavulanico cpr 1gr
S: 1 compressa ogni 8 ore per 14 giorni
Pr: Cefprozil cpr 500 mg
S: 1 cpr ogni 12 ore per 10-14 giorni
Figura 1.53
Efficacia dei principali antibiotici usati nelle sinusiti in base ai parametri farmacodinamici e farmacocinetici
ANTIBIOTICO
Beta-lattamici
Amoxicillina
Cefpodoxime proxetil
Cefprozil
Cefuroxime axetil
Amoxicillina-Acido
clavulanico
Streptococcus pneumoniae
S
I
R
Haemophilus influenzae
BL BL+
Moraxella catarrhalis
+++
+++
+++
+++
++
+
++
++
-
++
++
++
++
++
++
++
+++
+++
+++
+++
+
-
+++
+++
+++
Macrolidi
Azitromicina
Claritromicina
+++
+++
+
+
-
++
++
+
+
++
+
Fluorchinolonici
Ciprofloxacina
++
+
-
+++
+++
+++
Altri
Trimetroprimsulfametossazolo
Clindamicina
++
+++
++
++
++
-
-
+
-
S = penicillino-sensibile
I = resistenza intermedia
alla penicillina
R = penicillino resistente
BL - = non produttore
beta-lattamasi
BL+ = produttore
beta-lattamasi
+++ = copertura ottima
++ = copertura buona
+ = copertura sufficiente
+ = copertura insufficiente
- = nessuna attività
76
2. OSPITI CON PROBLEMI
SPECIALI DI TERAPIA
Il trattamento antibiotico degli stati infettivi insorti in
pazienti con particolari patologie d’organo quali insufficienza renale o epatica, in situazioni parafisiologiche
(gravidanza e allattamento) o nelle età estreme (senilità e
infanzia) rappresenta un problema complesso che condiziona la scelta dell’antibiotico e della sua posologia.
In queste situazioni acquista particolare importanza la
conoscenza della farmacocinetica normale degli antibiotici, delle situazioni parafisiologiche o patologiche
dell’ospite e delle modificazioni cinetiche che vengono
a determinarsi, per poter istituire una terapia razionale
improntata a una corretta valutazione del rapporto rischio-beneficio.
2.1 Pedodonzia
La flora del cavo orale nel paziente pedodontico mostra
alcune particolarità:
- dopo una iniziale fase sterile nel neonato, il cavo orale viene rapidamente contaminato da una flora aerobica
- con l’eruzione dei denti decidui compare una popolazione anaerobia (composta prevalentemente da Actinomyces naeslundii, Actinomyces viscosus e Bacteroides melaninogenicus) che con l’aumentare dell’età
tende sempre più a prevalere.
Nei bambini, inoltre, gli spazi midollari delle ossa mascellari sono più ampi e favoriscono l’estensione del
processo infettivo acuto con sintomi sistemici; per questo motivo la somministrazione di antibiotici è da attuarsi tempestivamente in associazione alla eliminazione del focolaio infettivo.
Si deve tenere in considerazione anche il rischio disidratazione secondaria a febbre, sudorazione e mancata
alimentazione; la febbre richiede un aumento dell’introito di liquidi del 12% per ogni grado sopra i 37,5C°.
Le sospensioni orali estemporanee aromatizzate ottengono la migliore compliance dei piccoli pazienti; tra
queste andrebbero preferite le formulazioni con zuccheri non cariogenici.
L’amoxicillina è il farmaco di elezione, sostituita dall’amoxicillina+acido clavulanico o dall’associazione amoxicillina+metronidazolo nelle infezioni di maggior impegno sostenute da germi anaerobi.
In presenza di allergia alla penicillina si utilizzano i macrolidi (l’eritromicina etilsuccinato è prontamente assorbita); in alternativa possono essere utilizzate le cefalosporine (cefalessina, cefprozil) utilizzando cautela in
presenza di reazioni allergiche gravi per la possibilità di
reazioni crociate tra betalattamine (4% dei casi).
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tra i farmaci controindicati nell’infanzia si devo ricordare le tetracicline al di sotto degli 8 anni che causano
pigmentazioni dentali e ritardo di crescita.
Poiché alcuni bambini sono sottoposti a frequenti terapie antibiotiche per infezioni delle prime vie respiratorie (ad esempio adenoiditi, faringotonsilliti) è opportuno eseguire un’anamnesi e prescrivere antibiotici diversi da quelli utilizzati recentemente, per evitare la possibilità di ceppi antibioticoresistenti.
In caso di mancata risposta alla terapia, prima di ipotizzare la presenza di germi resistenti e sostituire l’antibiotico, è opportuno verificare la presenza di fattori che
interferiscono con una adeguata somministrazione, che
possono presentarsi con una certa frequenza, soprattutto come conseguenze di un mancato assorbimento dovuto:
- a un bambino che sputi il farmaco
- a vomito legato ad acidosi metabolica
- a diarrea e accelerato transito intestinale.
In questi casi è indicato ricorrere alla somministrazione
parenterale.
Un problema frequente nella prescrizione dei farmaci
in pedodonzia riguarda la determinazione dei dosaggi
pediatrici, per il quale sono state proposte diverse soluzioni.
Come guida orientativa proponiamo di calcolare la dose pediatrica come frazione percentuale di quella dell’adulto, raccomandando, comunque, di consultare i foglietti illustrativi dei farmaci acclusi alle confezioni o
l’Informatore Farmaceutico sia per i dosaggi che per le
controindicazioni (tabella 2.1 e 2.2).
Il calcolo del dosaggio mg/kg evidenzia che i bambini
ricevono in proporzione dosaggi più alti di quelli utilizzati nell’adulto; mai comunque come valore assoluto
superiori a questi.
2.2 Gravidanza
In gravidanza, a causa della possibile comparsa di reazioni avverse a carico della madre e del feto, nonché
delle nostre incomplete cognizioni farmacologiche e
tossicologiche, si deve limitare l’impiego di farmaci ai
casi di necessità e utilizzare sostanze sicure.
Un aspetto di particolare importanza riguarda i danni
iatrogeni da embriotossicità e teratogenicità nel primo
trimestre, fetotossicità nel secondo e terzo trimestre,
complicanze durante il parto.
Nel prescrivere un farmaco in gravidanza si deve tenere
presente la classificazione dei farmaci in base al livello
di rischio:
- sicuri dei quali è stata dimostrata l’assenza di pericolosità intrinseca in campo umano
- da utilizzarsi con cautela in quanto non sono disponibili dati definitivi in campo umano o animale
77
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tabella 2.1 - Antibiotici in pedodonzia
Antibiotico
Amoxicillina
Amoxicillina/ac. clavulanico
Cefalexina
Cefprozil
Eritromicina etilsuccinato
Metronidazolo
Clindamicina
Dosaggio per os
25-50 mg/kg/giorno
20-40 mg/kg/giorno
25-50 mg/kg/giorno
30 mg/kg /giorno
25-40 mg/kg/giorno
10-15 mg/kg/giorno
15-40 mg/kg/giorno
Frequenza giornaliera*
tds
tds
qid
bid
qid
tds
qid
* Bid, bis in die, due volte al giorno; tds, tres in die, tre volte al giorno; qid, quattuor in die, quattro volte al giorno; stat, in unica somministrazione
Tabella 2.2 - Determinazione della posologia pediatrica*
Età
Peso medio
Percentuale della dose dell’adulto
Rapporto tra dose bambino/ adulto
1 anno
10 kg
25%
2
3 anni
15 kg
33%
1,5
6 anni
23 kg
50%
1,5
12 anni
37 kg
75%
1,25
* Oltre i 12 anni per molti antibiotici la dose è uguale a quella dell’adulto
- controindicati per i quali è stata dimostrata un effetto tossico in campo animale o umano
Un aspetto particolare consiste nella correlazione tra
l’uso degli antibiotici nella donna e gli insuccessi della
contraccezione orale per interazioni farmacologiche,
dismicrobismo, aumentato transito intestinale; rischio
del quale la paziente dovrebbe essere avvertita dall’odontoiatra.
2.2.1 Modificazioni farmacocinetiche
Le modificazioni prodotte dalla gravidanza a carico di
vari organi e apparati determinano alterazioni a carico
di tutte la tappe della farmacocinetica:
- rallentamento del transito digestivo
- aumento del volume plasmatico
- aumento del flusso renale e della filtrazione glomerulare
- aumento dell’attività metabolica epatica
- passaggio transplacentare
L’assorbimento gastroenterico è aumentato, specie per
le sostanze liposolubili, a causa dell’aumento del pH
gastrico e della riduzione della motilità intestinale.
Anche l’assorbimento intramuscolare dei farmaci è aumentato, favorito dal ridotto ritorno venoso, causato
dalla compressione dell’utero sulla vena cava inferiore.
Per quanto riguarda il trasporto, gli antibiotici sono
meno legati alle proteine plasmatiche (è maggiore
quindi la quota libera che è attiva), a causa dell’aumento del volume plasmatico totale, con conseguente emodiluizione e ipoalbuminemia.
Il volume di distribuzione è aumentato, in relazione all’aumentata quota libera dei farmaci che ne determina
una maggiore diffusibilità e biodisponibilità.
La metabolizzazione epatica è accelerata e l’eliminazione renale è più veloce in relazione ad un aumentato
flusso plasmatico renale e filtrazione glomerulare, con
conseguente riduzione dei livelli ematici dei farmaci.
Come conseguenza di tali alterazioni farmacocinetiche,
gli antibiotici presentano riduzioni dei livelli ematici
del 10-50%, tendendo questi valori ad aumentare in
prossimità del parto.
Il fenomeno è particolarmente evidente per le betalattamine, il cui dosaggio in gravidanza deve in alcuni casi essere più elevato (ad esempio sino al 50% per le
aminopenicilline).
Infine è da ricordare che anche l’emivita plasmatica di
alcuni antibiotici (betalattamine, macrolidi) appare ridotta come effetto delle complesse variazioni farmacocinetiche descritte, pur questo dato non richiedendo
alterazioni posologiche.
78
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
2.2.2 Reazioni avverse
Per quanto riguarda i danni materni, occorre rammentare che in gravidanza esiste un maggior impegno funzionale epatico e renale ed è quindi opportuno evitare
farmaci con potenzialità lesive su tali organi; come ad
esempio le tetracicline e gli esteri dei macrolidi che sono potenzialmente epatotossici.
Va inoltre segnalato l’opportunità di limitare la chemioterapia antibatterica ai casi effettivamente necessari, data la maggior frequenza di reazioni avverse quali
le micosi genitali (già di per sé frequenti in gravidanza)
e i rash cutanei da antibiotici.
Per quanto riguarda i danni fetali, la comparsa di effetti indesiderati risulta secondaria alla capacità del
farmaco di superare la barriera placentare; possibilità
legata a diversi fattori non sempre completamente prevedibili: peso molecolare inferiore a 500 dalton, liposolubilità, grado di ionizzazione, legame con le proteine plasmatiche, spessore della placenta.
In linea generale poiché tutti i farmaci (con l’eccezione delle eparine ad alto peso molecolare) sono in grado di superare la barriera placentare, è necessario limitare la prescrizione ai casi necessari e utilizzare sostanze sicure.
I danni fetali appaiono differenti non soltanto in relazione al tipo di farmaco, ma soprattutto all’epoca della gestazione in cui viene somministrato.
In base all’epoca di somministrazione è possibile suddividere i danni in tre gruppi:
- teratogenesi da farmaci somministrati prima della
14° settimana (periodo embrionale); il metronidazolo e la vancomicina sono sospettati di tale effetti
- fetotossicità con lesioni anatomiche a carico di singoli organi e apparati dovute alla somministrazione
di farmaci dopo la 14° settimana (fase fetale); come
ad esempio le tetraciclina (alterazioni dentarie, e ossee) e gli aminoglicosidi (sordità congenita)
- lesioni legate alla somministrazione di chemioterapici negli ultimi giorni di gestazione, che dipendono
dalla particolare farmacocinetica del neonato; come
ad esempio l’iperbilirubinemia e il kernicterus da
betalattamine ad elevatissimo legame farmacoproteico (isossazolilpenicilline).
2.2.3 Razionale di terapia antibiotica
In gravidanza si utilizzano i farmaci per i quali si dispone una buona documentazione sull’assenza di fenomeni dannosi come ad esempio le betalattamine, i macrolidi, le lincosamidi e la fosfomicina.
Sono invece da proscrivere i farmaci che possono determinare effetti teratogeni o embriofetotossici come ad
esempio le tetracicline e gli aminoglicosidi.
La FDA (Food and Drug Administration) ha classificato il rischio di effetti indesiderati dei farmaci in gravidanza in diverse categorie.
1. Categoria A: farmaci per cui sono disponibili dati
definitivi sulla sicurezza e assenza di tossicità dimostrata da studi sull’uomo
2. Categoria B: nessuna prova o segnalazione della presenza di rischio
3. Categoria C: rischio non escludibile in base a studi
eseguiti o all’assenza di dati definitivi
4. Categoria D: rischio dimostrato da studi o esperimenti sull’uomo
5. Categoria 3D: rischio dimostrato per uso nel terzo
trimestre di gravidanza:
6. Categoria X: dimostrato rischio di teratogenicità o
tossicità materna o fetale
I prodotti A e B possono essere utilizzati in quanto
considerati sicuri; quelli C devono essere utilizzati con
cautela per la presenza di effetti indesiderati; quelli D e
X devono essere evitati in quanto sicuramente dannosi
(tabella 2.3).
Da notare, peraltro che la FDA indica il metronidazolo in categoria B ma studi effettuati su animali per
somministrazione parenterale dell’antibiotico ne hanno dimostrato la fetotossicità.
Tabella 2.3 - Chemioterapia antibatterica in gravidanza
Farmaco
Penicillina V, amoxicillina
Cefalessina, clindamicina metronidazolo
Eritromicina base, estolato, etilsuccinato
Rischio
B
B
B
Gentamicina
Tetraciclina, dossiciclina
Cloramfenicolo
C (3D)
D
X
Possibili manifestazioni cliniche e raccomandazioni
Farmaco raccomandato come prima scelta
Farmaci di seconda scelta
L’uso dell’eritromicina base va preferito all’estolato
che comporta un aumentato rischio di epatite
colestatica della madre
Potenziale totossicità nel feto
Discromie dentali, inibizione della crescita ossea
Tossicità materna, sindrome grigia del neonato e possibile
morte nell’infanzia (aplasia midollare)
79
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
2.3 Allattamento
La possibilità di somministrare un farmaco in allattamento dipende da due elementi subordinati: dal suo
passaggio nel latte e dalla sua pericolosità per il neonato.
Il rischio non è elevato considerando che per molti antibiotici la quantità secreta nel latte non è generalmente superiore all’1-2% del livello ematico della madre e
difficilmente raggiunge livelli significativi per il figlio.
L’escrezione mammaria di un antibiotico con peso molecolare inferiore a 800 dalton avviene per diffusione
passiva e sotto tale peso i farmaci passano in quantità
discrete nel latte materno.
Il passaggio di farmaci con peso molecolare maggiore
avviene attraverso escrezione, modalità attiva che è facilitata dalla liposolubilità, dallo scarso legame con le
proteine, dal basso grado di ionizzazione e dal pH basico della sostanza (tabella 2.4).
In base a quanto esposto risultano quindi molti i farmaci antibatterici potenzialmente pericolosi nell’allattamento:
- penicilline e cefalosporine ad elevato legame con le
sieroproteine (spiazzamento della bilirubina dal legame con l’albumina e ittero)
- tetracicline (riduzione dell’apporto dietetico di calcio
per complessazione, pigmentazioni dentarie, deposizione nelle ossa con arresto dell’accrescimento, sindrome della fontanella ipertesa, dismicrobismo intestinale)
- esteri dei macrolidi (epatotossicità)
- lincosamidi (diarrea)
- metronidazolo (i livelli di chemioterapico presenti
nel latte materno sono circa il 50% di quelli ematici
materni)
I farmaci considerati sicuri sono le aminopenicilline
(amoxicillina, amoxicillina+acido clavulanico), le cefalosporine ad uso orale (cefprozil) e l’eritromicina etilsuccinato; occasionalmente effetti collaterali per il neonato possono manifestarsi con coliche addominali e
diarrea dovute al dismicrobismo intestinale.
Una precauzione consiste nel consigliare di assumere il
farmaco (a emivita breve) subito dopo l’allattamento
ed evitare di allattare nelle quattro ore successive, cioè
quando è più elevato il livello plasmatico e quindi maggiore la secrezione nel latte.
È, comunque, necessario avvertire la puerpera che l’assunzione di farmaci può provocare variazioni del sapore del latte e causare un rifiuto dell’allattamento da parte del bambino.
2.4 Gerodontoiatria
La scelta dell’antibiotico in gerodontoiatria richiede
conoscenze degli aspetti microbiologici del cavo orale e
delle condizioni cliniche del paziente.
La flora batterica orale si modifica in funzione all’età e
nella parodontopatia dell’anziano è stato evidenziato
un netto aumento della flora anaerobica Gram- (spesso
con ceppi betalattamasi produttori), rappresentata in
particolare da Bacteroides melaninogenicus, Bacteroides
gingivalis, Capnocytophaga gingivalis, actinobacillus Actinomycetem comitans, Eikenella corrodens, Fusobacterium nucleatum, Actynomices viscosus, Actynomices species, Streptococcus species.
Nel paziente edentulo la flora batterica è di tipo aerobio e con un minor numero di specie. La terapia antibiotica nel soggetto anziano presenta problematiche
che derivano essenzialmente dalla parafisiologica riduzione della capacità funzionale epatica e biliare.
Le alterazioni farmacocinetiche determinano una ridotta e rallentata eliminazione dei chemioterapici per
via renale e biliare a cui consegue un aumento dell’emivita plasmatica, con rischio di reazioni avverse da
tossicità da iperdosaggio a da accumulo. Molti pazienti, inoltre, assumono polifarmacoterapie e risultano
particolarmente esposti a interazioni farmacologiche.
Infine va ricordato che nella meiopragia d’organo dell’anziano possono concorrere patologie sistemiche diverse causa di insufficienza epatica e renale, prime fra
tutte le patologie cardiovascolari.
Tabella 2.4 - Caratteristiche dei principali antibiotici e implicazioni nell’allattamento
Caratteristiche
Note
PH basico
Macrolidi, clindamicina, metronidazolo
Gli antibiotici basici passano con più facilità nel latte
che ha pH acido
Liposolubilità
Macrolidi, lincosamidi, doxiciclina,
minociclina, metronidazolo
Gli antibiotici liposolubili sono più facilmente escreti nel latte
Legame farmacoproteico elevato
Eritromicina, clindamicina,
doxicilina, alcune cefalosporine
Gli antibiotici a elevato legame proteico competono
con la bilirubina e la spiazzano dall’albumina
80
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
2.4.1 Modificazioni farmacocinetiche
2.4.2 Razionale di terapia antibiotica
Nelle persone anziane tutte le principali tappe farmacocinetiche subiscono modificazione (assorbimento,
distribuzione, metabolizzazione, eliminazione).
L’assorbimento gastroenterico risulta modestamente diminuito (in misura maggiore per gli antibiotici acidi e
minore per quelli basici) a causa della riduzione delle
secrezioni gastriche e dalla motilità gastrointestinale.
Il volume di distribuzione dei farmaci muta sia in relazione alla ipoproteinemia che all’aumento della massa
adiposa.
Da una parte, infatti, la riduzione dell’albumina plasmatica diminuisce la quota di antibiotici legata alle
proteine ematiche, aumentando la quota libera che risulta farmacologicamente attiva.
Dall’altra la massa corporea varia aumentando la frazione lipidica e diminuendo l’acqua extracellulare. Ne
consegue che gli antibiotici idrosolubili raggiungono
tassi ematici più elevati, in quanto diminuisce il volume di distribuzione; mentre i liposolubili raggiungono
concentrazioni ematiche meno elevate e hanno la tendenza all’accumulo nel tessuto adiposo.
Il fegato diminuisce la capacità di metabolizzare i farmaci in metaboliti attivi o inattivi in relazione ad una
ridotta efficienza del sistema microsomiale.
Soprattutto per i farmaci a somministrazione orale viene a ridursi il first pass effect, cioè quella quota che viene metabolizzata al suo primi passaggio attraverso il fegato dopo l’assorbimento gastroenterico.
L’influenza dell’età si manifesta anche sull’eliminazione renale dei farmaci attraverso una riduzione di tutti
i parametri di filtrazione glomerulare e secrezione tubulare.
Da notare peraltro che i valori di creatininemia possono risultare normali in relazione alla riduzione delle masse muscolari e che, per tale motivo, nell’anziano
la valutazione della funzionalità renale residua viene
eseguita con la determinazione della clearence della
creatinina.
Dalle premessi di ordine fisiopatologico discendono alcune indicazioni pratiche (tabella 2.5, 2.6, 2.7).
La terapia non dovrebbe prescindere dall’uso di farmaci battericidi, in particolare betalattamici betalattamasi
resistenti come l’amoxicillina+acido clavulanico o il
cefprozil.
Le penicilline sono farmaci battericidi, eliminati prevalentemente per via renale e il dosaggio può rimanere
inalterato nell’insufficienza renale di medio grado, reperto frequente nell’anziano; utilizzabili anche i macrolidi, eliminati quasi esclusivamente per via epatica.
In relazione agli aspetti eziopatogenetici data la parafisiologica riduzione della capacità funzionale degli
emuntori sembra opportuno limitare nell’anziano
l’impiego di quei chemioantibiotici che:
- richiedono un’intensa metabolizzazione epatica (ad
esempio la clindamicina) o possono incrementare la
meiopragia d’organo tramite la loro epatossicità
(clortetraciclina, ossitetraciclina, eritromicina stearato o base)
- richiedono un’intensa metabolizzazione renale come
alcune cefalosporine di prima generazione (soprattutto la cefaloridina)
- presentano un’emivita plasmatica molto lunga e rischio di accumulo (azitromicina, 50 ore circa di emivita)
Sono generalmente preferibili farmaci con ridotto numero di somministrazioni giornaliere considerando che
molti pazienti assumono polifarmacoterapie; inoltre la
formulazione liquida o in compresse (piuttosto che in
capsule) incontrano maggiormente la compliance del
paziente per la facilità di deglutizione e tolleranza gastrica.
Tabella 2.5 - Caratteristiche dei principali antibiotici e implicazioni in gerodontodonzia
Caratteristiche
Note
PH acido
Penicilline, cefalosporine, tetracicline
Minore assorbimento gastroenterico di antibiotici acidi
Liposolubilità
Macrolidi, lincosamidi, doxiciclina,
minociclina, metronidazolo
Accumulo nel tessuto adiposo di antibiotici liposolubili
con minore biodisponibilità e attività
Legame farmacoproteico elevato
Eritromicina, clindamicina
Doxicilina, alcune cefalosporine
Maggiore biodisponibilità e attività di antibiotici
a basso legame proteico
Effetti tossici da interazioni farmacologiche per antibiotici
a elevato legame proteico (competizione e spiazzamento di altri
farmaci legati alle proteine seriche)
81
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tabella 2.6 - Reazioni avverse più comuni agli antibiotici utilizzati in gerodontodonzia
Effetti indesiderati
Interazioni farmacologiche
Tetracicline
Epatotossicità
Aggravamento nefrotossicità preesistente
Alterazioni emocoagulative
Macrolidi (in particolare eritromicina, claritromicina)
con digossina (aumento del 10% della biodisponibilità
del digitalico)
con teofillina (aumento delle concentrazioni
plasmatiche, nausea, vomito, convulsioni)
con anticoagulanti orali (potenziamento dell’effetto
anticoagulante)
con carbamazepina (aumento delle concentrazioni
plasmatiche e sedazione)
Clindamicina
Colite psudomembranosa
Cefalosporine con catena laterale N-metiltiotetrazolo
(cefoperazone, cefamandolo, cefmenoxime)
Emorragia
Doxiciclina, minociclina con carbamazepina,
fenobarbital, alcool etilico
(riduzione dell’emivita e dell’attività terapeutica
dell’antibiotico)
Tabella 2.7 - Antibiotici indicati in gerodontodonzia
Penicilline
Amoxicillina
Amoxicillina+ acido clavulanico
Bacampicillina
Ampicillina
Ampicillina+sulbactam
Macrolidi
Eritromicina etilsuccinato
Claritromicina
Tetracicline
Minociclina
Doxiciclina
Cefalosporine
Cefprozil
Cefazolina
2.5 Insufficienza epatica
2.5.1 Modificazioni farmacocinetiche
Nei pazienti con insufficienza epatica (cirrosi) esiste un
aumentato rischio di infezioni: sia sistemiche per ridotta efficienza del sistema reticoloendoteliale (epatico e
splenico); che locali per il rallentamento della protidosintesi che causa una progressiva immunodepressione e
rallentamento dei processi rigenerativi e di guarigione
delle ferite.
Data l’enorme riserva funzionale del fegato, comunque, i sintomi dell’insufficienza ed i rischi ad essa collegati compaiono tardivamente, quando la cirrosi ha determinato la perdita della funzione di circa il 90% del
tessuto epatico; il paziente in questi casi presenta evidenti sintomi clinici (ascite, ittero).
Per l’odontoiatra il problema della chemioterapia antibatterica può essere riassunto nella norma fondamentale di evitare antibiotici potenzialmente epatotossici o
causa potenziale di colostasi intraepatica e adeguare la
posologia dei farmaci a metabolizzazione epatica.
L’insufficienza epatica induce modificazioni sulla farmacocinetica di alcuni antibiotici interessandone tutte
le tappe e cioè l’assorbimento, il trasporto, la metabolizzazione e l’eliminazione.
Per i chemioterapici somministrati per via orale e molto metabolizzati dal fegato, si assiste a un aumento della biodisponibilità per la diminuzione del first pass effect.
Le modificazioni che intervengono nel trasporto dipendono dalla riduzione della protidosintesi epatica e
quindi dell’albuminemia, nonché dall’aumento della
bilirubina che compete con gli antibiotici per lo stesso
sito di legame con le proteine plasmatiche. Questa alterazione cinetica, pur comportando un aumento della
quota libera (cioè attiva) del farmaco, in genere non
rende necessarie modificazioni posologiche.
Le modificazioni della percentuale e della velocità di
metabolizzazione da parte del sistema microsomiale
epatico, causano un aumento dell’emivita plasmatica
82
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
di tutti quei chemioterapici che devono essere metabolizzati dal fegato per essere eliminati (cefalosporine acetilate, ceftriaxone, cefoperazone clindamicina, tetracicline e macrolidi).
Un effetto analogo è determinato dalla riduzione dell’escrezione in presenza di colostasi.
2.5.2 Razionale di terapia antibiotica
Un’epatotossicità diretta è rara con i farmaci ai dosaggi
corretti.
Per le tetracicline è stata dimostrata la possibilità di danno epatocellulare con conseguente aumento delle transaminasi, steatosi e distrofia epatica sino a danni potenzialmente fatali (per elevate dosi per via parenterale).
Gli esteri dei macrolidi (estolato di eritromicina) e la
clindamicina possono causare colostasi intraepatica
con segni di ittero ostruttivo, aumento della fosfatasi
alcalina, eosinofilia e febbre di origine allergica.
Tra i molti chemioantibiotici, metabolizzati dal fegato
o escreti dal tratto biliare, relativamente pochi richiedono modificazioni della posologia nelle epatopatie,
per la elevata riserva funzionale del fegato. Con poche
eccezioni, i dosaggi sono normalmente modificati solo
se concorre una insufficienza renale o una epatopatia
acuta o una severa insufficienza epatica con ascite, colostasi e ittero.
Gli aggiustamenti posologici possono essere eseguiti sia
attraverso la riduzione del dosaggio totale giornaliero,
che con il distanziamento delle dosi; accorgimenti che
sono da considerare per i macrolidi, la clindamicina, il
metronidazolo e alcune cefalosporine metabolizzate dal
fegato (ceftriaxone, cefoperazone).
Quando si utilizzino questi farmaci il paziente deve essere controllato e i farmaci sospesi immediatamente se
compaiono alterazioni significative dei test di funzionalità epatica.
Gli antibiotici che non sono influenzati nella loro cinetica dalla insufficienza epatica, possono essere tranquillamente impiegati senza modificazioni della posologia
anche nella insufficienza epatica grave; tra essi ricordiamo le penicilline e le cefalosporine non metabolizzate
dal fegato e a prevalente eliminazione renale (tabella
2.8 e 2.9).
Per le penicilline, ad esempio, la riduzione della poso-
Tabella 2.8 - Chemioterapia nell’insufficienza epatica
Modalità d’uso degli antibiotici antiinfettivi in caso di insufficienza epatica
Possono essere usati senza restrizione al dosaggio abituale
La maggior parte della penicillilne e le cefalosporine
(non metabolizzate)
Possono essere usati con riduzione della posologia giornaliera
Ceftriaxone, cefixime, cefalosporine metabolizzate per
ossacetilazone, macrolidi (a 15 e 16 C), ciprofloxacina
Da utilizzare con precauzione, riducendo la posologia e
sotto controllo di test di funzionalità epatica
Oxacillina e derivati.
Cloramfenicolo, claritromicina.
Controindicati
Tetracicline
Eritromicina estolato
Tabella 2.9 - Farmacocinetica degli antibiotici orali
ANTIBIOTICO
PENICILLINE
Amoxicillina (500-1000 mg)
Acido clavulanico
CEFALOSPORINE
Cefaclor (500 mg)
Cefprozil (500 mg)
Cefuroxime axetil (500 mg)
Cefixime (400 mg)
Cefpodoxime proxetil (200 mg)
Ceftibuten (200 mg)
MACROLIDI
Eritromicina (500 mg)
Claritromicina (500 mg)
Azitromicina (500 mg)
% di eliminazione urinaria nelle 24 ore
70-80
45 (OS)
> 80
65-70 (G+T)
30-40
20
40-50 (G+T)
85-90
5
30-40
6
83
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
logia è indicata solo nei casi di insufficienza epatica associata a insufficienza renale (sindrome epato-renale
nella cirrosi epatica).
La profilassi antibiotica in presenza di cirrosi, prima di
interventi di chirurgia orale non è obbligatoria e la sua
somministrazione va stabilita caso per caso in relazione
alle condizioni generali del paziente, entità dell’intervento chirurgico e rischio di infezione della ferita.
2.6 Insufficienza renale
La somministrazione di chemioterapici nei pazienti
con insufficienza renale è un compito complesso per
l’odontoiatra per le modificazioni farmacocinetiche
che la patologia comporta.
La valutazione del rischio di reazioni avverse connesse
alla somministrazione di un farmaco in corso di insufficienza renale deve tenere conto di alcuni fattori:
- la via di eliminazione elettiva del farmaco
- il coefficiente terapeutico
- la eventuale nefrotossicità.
Per regolare il dosaggio degli antibiotici escreti per via
renale è necessario conoscere l’entità dell’insufficienza
renale che risulta bene espressa come riduzione della
clearence della creatinina e meno precisamente dai valori dell’azotemia e della creatininemia (tabella 2.10).
In linea generale una clearence della creatinina di 40
ml/min corrisponde ad una creatininemia di 2 mg/dl e
una di 10-20 ml/min a 4-8 mg/dl.
Se non si dispone del valore di laboratorio, la clearence
della creatinina può essere calcolata attraverso una formula conoscendo la creatininemia.
Clearence creatinina in ml/min =
peso in Kg x (140 - età in anni)
72 x creatinina serica (mg/dl)
Questa formula permette di calcolare il valore nel maschio; nella femmina si moltiplica il valore del maschio
per 0,85
2.6.1 Modificazioni farmacocinetiche
Nella insufficienza renale si producono rilevanti modificazioni di quasi tutte le tappe della cinetica degli antibiotici.
L’assorbimento orale può essere aumentato o diminuito:
- l’assorbimento della doxiciclina e delle penicillina V
è in genere diminuito
- nei pazienti anurici la somministrazione parenterale
è preferita, poiché l’assorbimento e la tollerabilità
delle dosi orali di diversi antibiotici può essere influenzata dalla gastrite uremica.
Il volume di distribuzione risulta aumentato specie per
gli antibiotici acidi molto legati alle proteine e a eliminazione renale.
La fase di trasporto presenta delle variazioni; è diminuito, ad esempio, il legame farmaco-proteico tra gli
antibiotici acidi e le sieroproteine (aumenta quindi la
quota libera attiva), come conseguenza dell’ipoalbuminemia, della composizione aminoacidica dell’albumina
e la presenza di sostanze endogene che competono per
il legame.
Vi sono alterazioni della velocità di metabolizzazione
di alcuni antibiotici; per i betalattamici incrementa,
mentre per altri diminuisce.
Per i farmaci ad eliminazione renale, l’insufficienza
comporta elevati livelli ematici e un aumento dell’emivita plasmatica.
2.6.2 Razionale di terapia antibiotica
In linea generale sono da preferire i farmaci a metabolizzazione ed escrezione epatica poiché i principi ad
escrezione renale presentano il rischio di tossicità da accumulo (tabella 2.11) e richiedono quindi un aggiustamento del dosaggio ottenibile alternativamente mediante:
- una riduzione posologica
- un aumento dell’intervallo tra le somministrazioni
(tabella 2.12).
Il metodo più pratico per l’aggiustamento posologico
dei chemioantibiotici potenzialmente tossici si basa sul
Tabella 2.10 - Stadiazione della IRC
Esame
Clearence creatinina (ml/ min)
Creatinina serica
(mg / ml)
Azotemia
(mg /ml)
Valore normale
IRC iniziale
(completo
compenso)
IRC avanzata
(ritenzione
compensata)
IRC terminale
(uremia)
> 100
50-99
15-49
< 15
0,7-1,4
1,4-3
3-8
>8
5-25
25 - 55
55-150
>150
84
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tabella 2.11 - Chemioterapia antibatterica nella IRC
Sicuri
Penicilline (ampicillina, penicillina V, penicillina G,
bacampicillina, oxacillina, cloxacillina, dicloxacillina)
Cefalosporine
(cefprozil, cefoperazone, ceftriaxone)
Tetracicline (doxiciclina, minociclina)
Da usare con cautela
Penicilline *
(amoxicillina, amoxicillina-ac clavulanico, ampicillinasulbactam)
Cefalosporine
Tetracicline**
(ossitetraciclina, clortetraciclina)
Macrolidi
Clindamicina
Metronidazolo
Aminoglicosidi***
* Riduzione posologica solo in caso di grave insufficienza renale
** Da evitare
*** Regole specifiche per determinare la posologia, utilizzate in ambito ospedaliero
Tabella 2.12 - Modificazione dell’intervallo tra le dosi nella IR
Antibiotico
Benzil-penicillina
Amoxicillina
Emivita (ore)
Normale
0,65
1
IR grave
7-10
15-20
1
8-16
Intervallo tra le dosi (ore)
per clearence (ml/min)
>80
6
80-50*
8
0,25-0,5 g
ogni 12 ore
Usuale
Amoxicillina
+ acido clavulanico
Ampicillina
Ampicillina
+ sulbactam
Oxacillina
Cefalessina
Cefaclor
Cefprozil
1
1
8,5
8-12
6
8
0,4
1
1
1,3
2
30
6-10
5-6
4-6
6
6
6
6
8
Usuale
Ceftriaxone
6-9
12-15
Usuale
Cefuroxime
1,3-1,7
20
Usuale
Tetraciclina
Doxicilina
Minociclina
Clindamicina
Azitromicina
Eritromicina
Metronidazolo
8-9
14-25
11-26
3
68
1,2-1,6
6-14
30-128
15-30
17-30
3-5
68
4-6
8-15
6
6
*Somministrazione per via parenterale, normale funzionalità renale
12
Usuale
Usuale
6
Usuale
Usuale
Usuale
% escrezione
urinaria
50-10
8
0,25-0,5 g
ogni 12-14 ore
0,25-0,5 g
ogni 12 ore
12
1-2 g
ogni 8 ore
6
8
8
0,25 g ogni
12-24 ore
Usuale
<10
12
0,25-0,5 g
ogni 12-14 ore
0,25-0,5 g
ogni 24-36 ore
12-24
1-2 g
ogni 8 ore
8
24-48
12
0,25 g ogni
12-24 ore
Usuale
0,7-1,5 g
ogni 8-12 ore
48
Usuale
Usuale
8
Usuale
Cautela
Usuale
0,75 g
ogni 8-12 ore
72-96
Usuale
Usuale
12
Usuale
Cautela
Usuale
90
60
1-2 g
ogni 12 ore
25
90
60
65%
Epatica
e enterico
60
Epatica
Epatica
40
Epatica
Epatica
Epatica
85
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
prolungamento degli intervalli tra le somministrazioni:
dopo la dose iniziale, le dosi successive sono somministrate al dosaggio usuale distanziando le somministrazioni di un periodo di tempo pari a tre emivite plasmatiche del farmaco.
Tra i chemioantibiotici escreti elettivamente con la bile
vanno menzionati i macrolidi, la doxiciclina e la minociclina, che non sono influenzati dall’insufficienza renale.
Le tetracicline classiche sono da evitare perché escrete
al 10-25% per via renale e al 50-70% per via epatica;
possono accumularsi e risultare epato e nefrotossiche.
Le penicilline, per quanto escrete per via renale, sono
farmaci maneggevoli con un ampio intervallo posologico tra dose terapeutica e dose tossica; sono praticamente atossiche e rappresentano un problema solo
nell’insufficienza renale grave (clearence della creatinina inferiore a 30ml/min) o quando si usino dosaggi
molto elevati
Le cefalosporine devono essere utilizzate con cautela,
ad eccezione del ceftriaxone e del cefoperazone. Queste
due sostanze sono eliminate sia per via biliare che renale e, in caso di insufficienza di uno dei due emuntori, il
farmaco viene eliminato per l’altra via; possono essere
utilizzati sia nell’insufficienza renale che epatica richiedendo modificazioni posologiche solo nella sindrome
epatorenale.
modo simile in emodialisi e dialisi peritoneale.
I farmaci privi di eliminazione extrarenale e non dializzabili con l’emodialisi (come ad esempio la vancomicina) vanno somministrati in unica dose e possono persistere per settimane in concentrazioni sufficienti nel
sangue.
Gli antibiotici dializzabili dovrebbero essere somministrati alla fine di ogni seduta di emodialisi per rimpiazzare la quantità di antibiotico dializzato; può essere necessario aumentarne la posologia per garantirne l’effetto terapeutico.
Il rischio di endocardite batterica e/o endoarterite della
fistola arterovenosa utilizzata per l’emodialisi è limitato; da considerare comunque che il rischio di endoarterite è maggiore nei tre mesi successivi l’intervento di
esecuzione della fistola arterovenosa e in tale periodo è
consigliabile la somministrazione della profilassi antibiotica perchè qualsiasi intervento può causare sanguinamento. Diversamente la profilassi antibiotica non è
di norma indicata e va valutata in base alle invasività
dell’intervento e le condizioni generali del paziente.
Si utilizza il protocollo di profilassi dell’endocardite
batterica; alcuni autori consigliano la somministrazione endovenosa di vancomicina (1gr in mezz’ora ev) attuata dal medico nel corso della dialisi, somministrazione che assicura il livello serico inalterato sino alla seduta successiva di emodialisi.
2.7 Dialisi
2.8 Ospite
immunocompromesso
I pazienti con IRC sono sottoposti a dialisi peritoneale
nelle IRC iniziale e avanzata e a emodialisi nella IRC
terminale.
I farmaci ad escrezione extrarenale non sono soggetti
ad accumulo e possono essere utilizzati a dosaggio pieno (doxiciclina, macrolidi); mentre i farmaci ad escrezione renale devono essere somministrati ad intervalli
più lunghi in relazione a: (tabella 2.13 e 2.14)
- diuresi residua
- frequenza della dialisi
- dializzabilità dell’antibiotico
La dializzabilità varia in relazione alle caratteristiche
delle diverse sostanze:
- il volume di distribuzione, in quanto è dializzato solo l’antibiotico presente nel plasma
- il legame farmaco-proteico poiché solo la quota libera è dializzata
- il peso molecolare, visto che la dializzabilità diminuisce con l’aumentare del peso molecolare e non sono
dializzati farmaci con pm superiore a 800 dalton.
La dialisi peritoneale è meno efficace (dializza solo la
quota di farmaco non ionizzata e liposolubile) e alcuni
antibiotici che possono essere rimossi dall’emodialisi,
non sono rimossi o lo sono incompletamente in corso
di dialisi peritoneale; mentre altri si comportano in
L’aspettativa di vita di questi pazienti è stata prolungata grazie ai progressi in campo medico e oggi con maggior frequenza rispetto il passato, essi richiedono terapie odontostomatologiche, ponendo all’odontoiatra
problemi terapeutici complessi nel trattamento e nella
profilassi delle infezioni odontogene.
Le infezioni presentano il rischio di evoluzione verso
forme gravi, proprio per la carenza di quell’immunità
che è il fondamentale ausilio alla terapia antibiotica per
la guarigione degli stati infettivi.
Il concetto di ospite immunocompromesso fa riferimento a un vasto gruppo di soggetti in relazione a diverse patologie che determinano una immunodepressione o una immunodeficienza (tabella 2.15).
Questi pazienti risultano esposti ad un maggior rischio
di infezioni sia da parte di patogeni esogeno che da virulentazione della flora commensale (endogena).
In linea generale i pazienti immunodepressi sono esposti a differenti tipi di rischio infettivo in relazione al tipo di immunocompromissione:
- deficit dell’immunità umorale: sono più esposti al rischio di alcune infezioni batteriche (Streptococcus
pneumonieae, Haemophilus influenzae)
86
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tabella 2.13 - Chemioantibiotici dializzabili
Dializzabili con emodialisi
Dializzabili con dialisi peritoneale
e emodialisi
Non dializzabili
Penicillina G
Ampicillina
Cefazolina
Acido clavulanico
Aminopenicilline (amoxicillina)
Cefalosporine (basso legame
con sieroproteine)
Tetraciclina
Ossitetraciclina
Metronidazolo
Cefalosporine (alto legame con
sieroproteine)
Lincosamidi
Macrolidi
Doxiciclina
Vancomicina
Tabella 2.14 - Dosaggio dei chemioterapici antibatterici in dialisi
Farmaco
Emodialisi
Dialisi peritoneale
Amoxicillina
Amoxicillina + ac clavulamico
0,25 g post dialisi
0,50 g Amoxicillina + ac clavulamico
a metà dialisi e un’altra post dialisi
Dose usuale dopo dialisi
2 g ampicillina dopo dialisi
Regime usuale
Ripetere la dose dopo dialisi
0,5-1 g post dialisi
250-500 mg dopo dialisi
0,25-0,5 g post dialisi
1-2 gr post dialisi
Nessuna extra dose
Ripetere la dose dopo dialisi
0,25-1 g post dialisi
250-500 mg 24 ore dopodialisi
Regime usuale
Regime usuale
Regime usuale
Regime usuale
Regime usuale
Regime usuale
Regime usuale
Regime usuale
500,000 U post dialisi
0,25 gr post dialisi
500 mg post dialisi
Regime usuale
Regime usuale
Ampicillina
Ampicillina + sulbactam
Azitromicina
Cefaclor
Cefadroxil
Cefprozil
Cefazolina
Cefoxitina
Ceftriaxone
Cefuroxime
Cefalessina
Ciprofloxacina
Clindamicina
Cloxaciclina
Dicloxaciclina
Doxiciclina
Eritromicina
Metronidazolo
Minociclina
Oxaciclina
Penicillina G
Penicillina V
Tetraciclina
Regime usuale
Regime usuale
Regime usuale
Regime usuale
0,5 g/die
250 mg ogni 12-24 ore
0,5 g ogni 12
1 g/die
Regime usuale
750 mg/die
250 mg po tid
250-500 mg/die
Regime usuale
Regime usuale
Regime usuale
Regime usuale
Regime usuale
Regime usuale
Regime usuale
Regime usuale
Usare doxiciclina
Tabella 2.15 - Ospite compromesso
Immunodeficienze congenite
del complemento
Diabete mellito scompensato
Ipogammaglobilinemie e disgammaglobulinemie
(mieloma multiplo, deficienze congenite o acquisite,
leucemia linfocitica cronica)
Insufficienza renale grave
Immunodeficienze cellulari acquisite
(AIDS, linfomi, in particolare linfomi di Hodgkin)
Età estreme
(anziani defedati e denutriti)
Inibizione midollare
(agranulocitosi e pancitopenie da chemioterapia
antitumorale, leucemia, reazioni avverse a farmaci)
Terapia immunosoppressiva o steroidea ad alto
dosaggio (trapianti d’organo, malattie
autoimmunitarie)
Insufficienza epatica grave (cirrosi)
Iposplenismo
(splenectomia, anemia emolitica)
87
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
- deficit dell’immunità cellulo-mediata: presentano
maggiori rischi di infezioni batteriche a localizzazione intracellulare, fungine, protozoarie e virali
- i neutropenici (o granulocitopenici): sono più esposti
a infezioni batteriche sostenute da bacilli Gram-, da
cocchi Gram+ e da miceti.
In questi pazienti si sovrappongono diverse difficoltà
sia a livello diagnostico che nella istituzione e monitoraggio della terapia antibatterica:
- l’eziologia delle infezioni appare spesso difficilmente
ipotizzabile
- le infezioni, anche se inizialmente localizzate, tendono rapidamente a generalizzarsi e decorrere con andamento tumultuoso
- gli interventi chirurgici possono complicarsi con infezioni della ferita
- infine l’efficacia degli antibiotici è spesso diminuita a
causa del deficit immunitario.
Oggi si sono raggiunti buoni risultati nel trattamento
dei pazienti compromessi, grazie a protocolli di terapia
che prevedono:
- ospedalizzazione del paziente compromesso che presenta un’infezione
- la terapia antibiotica deve essere iniziata al minimo
sospetto d’infezione
- la terapia antibiotica ragionata o empirica deve essere ad ampio spettro, sfruttando associazioni di chemioterapici battericidi, somministrati preferenzialmente per via endovenosa, a elevati dosaggi (spesso i
massimi consentiti). La scelta dell’antibiotico per la
terapia ragionata si deve basare sulle conoscenze relative al tipo di compromissione dell’ospite, sull’ecologia batterica del distretto anatomico e sulla sensibilità agli antibiotici dei microrganismi potenzialmente
in causa. È importante utilizzare antibiotici dotati di
una notevole velocità di battericidia per poter determinare la distruzione dei batteri anche in carenza
delle difese immunitarie dell’ospite; di elevata diffusibilità nei tessuti in modo da raggiungere i focolai
infettivi (preferibili quindi gli antibiotici con basso
legame sieroproteico e elevata quota libera terapeuticamente attiva)
- prima di iniziare la terapia antibiotica vanno eseguiti
i prelievi di materiale per le colture batteriologiche,
l’identificazione del microrganismo e l’antibiogramma (disponibili generalmente nell’arco di 48 ore) in
modo da poter procedere a una terapia mirata in caso di insuccesso di quella ragionata o empirica
- la terapia va protratta per almeno 5 giorni (sino a 710) dopo lo sfebbramento
La situazione paradigmatica è rappresentata dalle sindromi da inibizione midollare in cui il rischio di contrarre infezione è molto elevato per valori di granulociti neutrofili inferiori a 500/mmc.
Le infezioni sono sostenute da bacilli Gram-negativi
nel 60% dei casi (Pseudomonas aeruginosa, Bacteroides,
Klebsiella, Escherichia coli) e nel 40% da cocchi Gram+
(stafilococchi); deve però essere valutata la possibilità di
infezione da parte dell’intero gruppo di patogeni facoltativi, il cui principale serbatoio d’infezione è costituito dalla flora orale e del colon.
Per quanto riguarda le sedi delle infezioni, in oltre la
metà dei casi si tratta di infezioni della bocca, della faringe e delle vie respiratorie.
Il razionale della terapia prevede l’impiego di associazioni sinergiche che coprano l’intero range di patogeni
facoltativi: betalattamici diversamente associati a aminoglicosidi, glicopetidici e fluorochinoloni.
La prognosi sfavorevole delle infezioni conclamate nei
pazienti granulocitopenici è il motivo della necessità di
attuare una profilassi riducendo la flora batterica intestinale, cutanea e orale; quest’ultima con antibiotici,
antisettici e bonifica dei foci infettivi.
2.9 Allergia alle
Betalattamine
Le principali considerazioni inerenti le penicilline riguardano un’ampia gamma di reazioni immunologiche
che si verificano con un’incidenza variabile dallo 0,7
all’8% dei cicli terapeutici.
Le reazioni allergiche alle penicilline possono riconoscere patogenesi diverse, presentarsi distanziate nel
tempo e forme contraddistinte da diversa gravità: con
localizzazione d’organo come rash cutanei locali o generalizzati, broncospasmo; o sistemici come l’anafilassi
(tabella 2.16, 2.17).
Le reazioni più frequenti sono costituite da un’eruzione
diffusa eritematosa o morbilliforme (rash maculo-papulari non IgE mediate).
Le emergenze sono rare e sono rappresentate da ipersensibilità immediata (tipo IgE-mediato) come l’orticaria angioedema, l’edema della glottide, l’asma bronchiale ed eccezionalmente l’anafilassi. Quest’ultima
presenta un’incidenza dello 0,004-0,015% per ciclo terapeutico e si complica con esito letale ogni 50.000100.000 trattamenti.
Le cefalosporine possono causare reazione allergica crociata con le penicilline per la potenziale cross-reazione
tra gli anelli lattamici.
In passato si riteneva che nei soggetti allergici alle penicilline il rischio di reazioni allergiche in caso di assunzione di cefalosporine fosse 4-8 volte superiore ai non allergici. Studi recenti hanno ridimensionato il rischio quantificandolo nel doppio rispetto la popolazione generale.
L’incidenza di allergia indotta da cefalosporine si aggira sul 4%; il rischio di anafilassi è modesto: inferiore
allo 0,02% nella popolazione generale e minore allo
0,04-0,08% nei pazienti con pregeressa allergia alle
penicilline.
Inoltre la maggior incidenza di reazioni crociate si rife-
88
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tabella 2.16 - Reazioni immunologiche alle peniciline
Tipo I
Ipersensibilità immediata (IgE mediata)
Frequenza 0,02%
Mortalità 10%
Anafilassi, orticaria, angioedema, asma, edema laringeo
Tipo II
Citotossica (IgM, IgG mediata)
Citopatie (anemie emolitiche, leucopenie,
trombocitopenie), alcune vasculiti
Tipo III
Da immunocomplessi (IgM, IgG mediata)
Malattia da siero, glomerulonefriti, alcune vasculiti e
anemie emolitiche
Tipo IV
Cellulomediata (linfociti T mediata)
Dermatite da contatto con preparazioni topiche
Idiopatiche
a genesi sconosciuta
Rash maculopapulari (frequenti)
Nefrite interstiziale, febbre da farmaco, eosinofilia,
dermatite esfoliativa, sindrome di Stevens-Johnson
Tabella 2.17 - Classificazione delle reazioni allergiche alle penicilline
Immediate (2-30 min)
Anafilassi
Ipotensione, shock
Edema laringeo
Dispnea
Ritardate (>72 ore)
Rash morbilliforme
Rash maculopapulare
Accelerate (1-72 ore)
Orticaria-Angioedema
Prurito
Edema laringeo, dispnea
Altre reazioni allergiche ritardate
Malatia da siero
Febbre
Anemia emolitica
Agranulocitosi
Nefrite interstiziale
Orticaria/artralgie ricorrenti
Disordini della coagulazione
risce all’uso di cefalosporine di I° generazione.
Contraltare negativo alla riduzione della cross-reattività delle betalattamine sono l’aumento delle segnalazioni di reazioni selettive a singole molecole di penicilline
e cefalosporine dovute a risposte immunitarie specifiche per altri antigeni diversi dall’anello betalattamico,
come le catene laterali.
Le reazioni allergiche ai macrolidi sono in genere rare
(0,5% dei pazienti trattati) e di scarso rilievo clinico come l’orticaria e il rash cutaneo. L’aspetto clinicamente
più importante è rappresentato dai casi di asma professionale da spiramicina in personale medico e paramedico. Tuttavia recentemente è stato segnalato un aumento delle resistenze allergiche ai macrolidi, probabile
espressione di un loro più largo impiego in alternativa
alle betalattamine. In letteratura è presente una sola segnalazione di anafilassi da eritromicina confermata di
recente dalla dimostrazione in vitro della presenza di
IgE specifiche nei confronti di questa molecola.
Per il trattamento dei pazienti allergici, come per tutte
le patologie, l’anamnesi rimane il punto di partenza
dell’iter diagnostico. Infatti in presenza di anamnesi
positiva di allergia alla penicillina il rischio di successive reazioni è 6 volte superiore in caso di somministrazione rispetto i soggetti normali.
Se la raccolta anamnestica è compatibile con una reazione allergica alla penicillina è razionale scegliere un antibiotico alternativo (macrolide); tenendo presente che la
somministrazione orale è preferibile poiché questa via di
somministrazione è a minor rischio di reazioni gravi.
È generalmente considerata prassi sicura prescrivere cefalosporine a pazienti con manifestazioni di ipersensibilità
non IgE mediata alle penicilline come i rash maculopapulari, data la bassa frequenza di reattività crociata.
Il ricorso a test diagnostici (test cutanei, test di provocazione, test in vitro con metodica RAST) è raro e va
demandato a reparti specializzati in allergologia.
Peraltro, è infrequente l’esclusiva indicazione all’uso di
penicilline o altra betalattamina pur in presenza di storia compatibile con allergia a tale farmaco.
89
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tabella 2.18 - Trattamento dell’anafilassi
SINTOMI
Lipotimia, coma
Ipotensione acuta
Rantoli e fischi respiratori (broncospasmo, edema laringe)
Angioedema, orticaria
TRATTAMENTO
Liberare il cavo orale
Porre il paziente supino con le gambe rialzate (Trandelenburg)
Mantenimento di adeguata ventilazione (maschera facciale e ossigeno)
Controllare parametri vitali (polso, respiro, pressione arteriosa)
Rianimazione cardio-respiratoria (respirazione artificiale e massaggio cardiaco)
Predisporre il trasporto al Pronto Soccorso (il paziente deve rimanere sotto controllo per almeno 24 ore per il rischio
di recidive dopo 6-8 ore)
Adrenalina
0,3-0,5 cc al 1‰ sc/im nell’adulto (nel bambino 0,01 cc/kg) ripetibili dopo 15 min se necessario. Se non c’è miglioramento 0,1-0,2 cc ev diluiti in 10 cc di soluzione fisiologica. Farmaco salvavita.
Antistaminici
Desclorfeniramina 20 mg im/ev
Se non c’è stata risposta all’adrenalina; sono poco efficaci nel ridurre la reazione acuta, ma ne riducono la durata e
le recidive
Cortisonici
Idrocortisone 0,5-1 gr ev (bambini 10 mg/kg) o metilprednisolone 0,5 gr
Non sono salvavita in quanto il loro effetto non è immediato (>1 ora)
Altri farmaci (se disponibili)
Gluconato di calcio 1 gr ev ripetibile o cloruro di calcio ev 5cc al 20% ripetibili
Vasopressori tipo noradrenalina o dopamina se persiste collasso cardiovasolare
Parimenti eccezionale è la necessita di desensibilizzazione da eseguirsi in ambienti ospedalieri forniti di potenzialità rianimatorie.
Per il trattamento delle reazioni allergiche in atto da penicillina si devono considerare le seguenti indicazioni:
- epinefrina per le reazioni IgE mediate
- antistaminici per le orticarie e i rash maculo-papulari
- glucocorticoidi per le orticarie severe, anafilassi, malattia da siero, dermatite da contatto, reazioni esfoliative e bollose, nefrite interstiziale, reazioni polmonari e epatiche
Il trattamento delle reazioni anafilattiche è schematizzato nella tabella 2.18.
Nell’orticaria sono utili gli antistaminici per via sistemica e i cortisonici per via topica (raramente usati per
via sistemica), pomate dermatologiche a base di antistaminici.
Astemizolo, loratadina, cetirizina
10 mg per os al mattino in monosomministrazione
(bambini: 0,2 mg/kg/die di astemizolo; loratadina indicata sopra i 12 anni di età, cetirizina 5 mg/die)
Desclorfeniramina
5-20 mg/die im/ev in 2 somministrazioninell’adulto
(bambini sopra i 6 anni, metà della dose dell’adulto)
Prometazina
25-50 mg po/im in 2 soministrazioni nell’adulto
(Bambini 5-15 mg/die)
2.10 Intolleranza
gastrointestinale
Gli effetti indesiderati gastrointestinali sono le reazioni
avverse più frequenti in cui risultano implicati tutti gli
antibiotici somministrati per via orale e anche per via
sistemica
Si tratta di reazioni avverse che risultano generalmente
di ridotta significatività clinica ma possono variare da
quadri aspecifici tendenti alla risoluzione sino a una
grave enterocolite infettiva.
In particolare i farmaci con assorbimento intestinale
90
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
lento o incompleto, possono interferire con la flora
batterica intestinale, determinando:
- intolleranza gastrointestinale caratterizzata da nausea, vomito, anoressia, dispepsia, crampi gastrointestinali, senso di peso, dolori addominali, distensione
addominale, meteorismo (flatulenza), disturbi dell’alvo (stipsi, diarrea)
- dismicrobismo intestinale con candidosi, dolori addominali, tenesmo, diarrea, colite pseudomembranosa
La diarrea è un problema che comunemente si associa
alla terapia antibiotica sia per via orale che parenterale;
viene definita come una condizione caratterizzata da 5
o più scariche semiliquide nelle 24 ore.
La diarrea da antibiotici può essere suddivisa in tre tipi:
- diarrea senza enterocolite
- enterocolite aspecifica
- colite pseudomenbranosa
La terapia delle diarree infettive, in medicina, si basa
sulla terapia dietetica, la reidratazione (per os o endovenosa), la terapia antinfettiva con disinfettanti intestinali, la terapia sintomatica collaterale con farmaci antimotilità e antisecretivi.
Le diarree da reazioni avverse ai farmaci sono generalmente di modesta entità e si avvalgono della terapia
dietetica e della sospensione o sostituzione dell’antibiotico responsabile.
La terapia sintomatica con farmaci antimotilità (loperamide, difenossilato) o antisecretivi (miscele di caolino e pectina) non è generalmente utilizzata in quanto,
bloccando la motilità intestinale, può prolungare la durata dell’infezione.
Da evitare è anche la somministrazione di antibiotici e
disinfettanti intestinali (diiodoidrossichinolina), visto
che le diarree da reazione avversa agli antibiotici sono
autolimitanti e non rispondono al trattamento nella
maggior parte dei casi.
Disturbi di lieve entità (cioè la maggior parte delle
diarree senza enterocolite e enterocoliti aspecifiche)
tendono a risoluzione spontanea con la fine del trattamento e possono essere prevenute o trattate con terapia
dietetica e con alcuni accorgimenti nella scelta e prescrizione dell’antibiotico.
I diversi metodi vanno graduati in relazione alla gravità degli effetti collaterali:
- prescrivere farmaci ad assorbimento gastro-intestinale più pronto e completo (amoxicillina, cefprozil)
- assumere l’antibiotico durante i pasti; accorgimento
che può diminuire l’assorbimento di alcuni farmaci;
mentre per altri l’assorbimento non è influenzato dal
cibo
- associare yogurt (fermenti lattici) o prodotti specifici
che contengono ceppi di germi vivi antibioticoresistenti
- passare all’utilizzazione di farmaci per via parenterale
Il 95% degli zuccheri e il 70% dei grassi ingeriti vengono assorbiti anche in corso di diarrea ed è, quindi,
utile continuare l’alimentazione e la reidratazione per
os con alcune restrizioni dietetiche (tabella 2.19).
La sete del paziente adulto è una buona guida per la
quantità di liquidi da somministrare; mentre va controllato lo stato di idratazione dei bambini piccoli e degli anziani che con maggior facilità possono disidratarsi.
Si possono utilizzare preparati specifici in commercio
per la reidratazione per os; nel caso la soluzione dovesse essere preparata a domicilio si consiglia la seguente
formulazione: aggiungere a 1 litro d’acqua 4 cucchiai
da minestra rasi di zucchero + 1 cucchiaino da caffè raso di sale da cucina + un succo di due arance o di un
pompelmo o 2 banane + un cucchiaio di bicarbonato
di sodio (Simon, Current Therapy, 1998).
La reidratazione per via endovenosa è di pertinenza
ospedaliera e limitata ai casi con vomito incoercibile,
ileo, malassorbimento, stato di incoscienza o un bambino che rifiuti la terapia.
In particolare un’infezione di Clostridium difficile, bacillo anaerobio produttore di una esotossina, causa una
grave forma di colite pseudomembranosa che, non trattata, può evolvere sino in megacolon tossico e perforazione intestinale.
Quasi tutti gli antibiotici sono stati implicati nell’infezione da Clostridium difficile (penicilline, macrolidi, cefalosporine, tetracicline) ma la frequenza è relativamente più frequente per la clindamicina (1:50.000
trattamenti).
Tabella 2.19 - Terapia dietetica delle diarree
Cibi permessi
Tè diluito, bibite non gassate e a temperatura ambiente
Riso, crema di riso, semolino
Carne di manzo e vitello
Pesce
Prosciutto magro, bresaola
Formaggio non fermentato (ricotta, mozzarella, parmigiano)
Grassi di condimento in piccole quantità
Verdure inizialmente lessate, in piccola quantità
(insalata, carote, spinaci, patate)
Pane tostato, grissini
Cibi sconsigliati
Caffè, alcolici, cacao
Maiale, selvaggina
Lardo, pancetta, salame
Legumi, cipolle
Pane integrale o di segale
91
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
In presenza di colite pseudomembranosa, con un numero di scariche >5/die, è necessario (tabella 2.20):
- sospendere il trattamento antibiotico orale e passare
per via parenterale
- inviare il paziente dal medico o dal gastroenterologo
che provvedono alla terapia reidratante (eventualmente per via parenterale) e antinfettiva specifica
con vancomicina per os.
Tabella 2.20 - Colite pseudomebranosa
Diagnosi
Sospettare una colite pseudomembranosa e inviare al medico o al gastroenterologo i pazienti che nel corso di una
terapia antibiotica presentino i seguenti sintomi:
- Diarrea sierosa e/o sanguinolenta
- Diarrea persistente >5 scariche/die per più di 48 ore
- Altri sintomi (crampi addominali intensi, disidratazione)
- Febbre e leucocitosi
Terapia
Pr: Vancomicina capsule
S: 250-500 mg per os in 2-4 somministrazioni per 7-10 giorni nell’adulto. Inocraggiare la reidratazione per os con soluzioni ricche di zuccheri ed elettroliti.
(nel bambino: vancomicina 40 mg/kg/die)
92
3. PROFILASSI ANTIBIOTICA
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
La definizione del miglior approccio alla chemioprofilassi è materia di discussione; prima di iniziare a trattare l’argomento è necessario definire alcuni concetti di
ordine generale.
Il termine infezione definisce la presenza di microrganismi in un determinato distretto senza che necessariamente sia in atto uno stato patologico, cioè una malattia infettiva.
Il termine profilassi significa uso di antibiotici o chemioterapici volto a prevenire l’insorgenza di patologie;
più precisamente lo scopo della profilassi antibiotica è
proprio quello di impedire che un’eventuale infezione
sostenuta da germi endogeni si trasformi in malattia infettiva locale o sistemica.
Per tale motivo la profilassi differisce in modo sostanziale nella posologia e durata dalla terapia antibiotica
che serve a curare una malattia infettiva.
La prima, infatti, è somministrata per un tempo più
breve (dalla monosomministrazione sino a 2-3 giorni
dopo l’intervento) e utilizza dosaggi più elevati per assicurare la presenza dell’antibiotico nel sangue e nel sito operatorio in dosaggi 3-4 volte superiori alla MIC
per un periodo limitato.
La chemioprofilassi, al pari dell’antibioticoterapia, per
risultare efficace deve essere ragionata in base alla flora
batterica residente nel sito di intervento e quindi sui
potenziali patogeni endogeni.
L’impiego di farmaci ad ampio spettro, nel tentativo di
coprire tutti i possibili agenti patogeni, è un equivoco
che confonde i compiti della profilassi con quelli dell’asepsi che deve limitare la contaminazione esogena
del campo operatorio.
Schematicamente è possibile affermare che l’antibioticoprofilassi è efficace nei confronti di infezioni sostenute da Gram positivi (aerobi e anaerobi) e Gram negativi anaerobi (Bacteroides) in genere abbastanza sensibili ad antibiotici a spettro limitato, mentre è spesso
inutile verso molti batteri Gram negativi aerobi.
In linea generale possiamo distinguere due tipi di antibioticoprofilassi: la profilassi per l’endocardite batterica
la cui somministrazione è obbligatoria nei pazienti a rischio e le altre profilassi che hanno solo un valore indicativo e sono lasciate alla discrezionalità del clinico in
base all’apprezzamento del rischio nel singolo caso.
gnostico e terapeutico la EI rimane una causa importante di morbidità e mortalità.
Infatti, anche se è diminuita la mortalità acuta grazie
alle terapie antibiotiche, quasi sempre in grado di eradicare l’infezione, sono aumentati i danni permanenti a
livello delle strutture valvolari e le loro sequele a distanza, ad esempio le embolie e l’insufficienza cardiaca
(figura 3.1, 3.2, 3.3).
In passato le condizioni predisponenti erano rappresentate prevalentemente dalla endocardite reumatica in
pazienti giovani, mentre oggi è in aumento la patologia
che si verifica come complicanza di diverse patologie
cardiache in pazienti anziani.
Inoltre sempre più spesso la porta d’ingresso nell’inoculo di agenti patogeni è iatrogenica e viene determinata da manovre strumentali e diagnostiche a carico di
diversi organi come la cavità orale, le vie respiratorie,
l’apparato urogenitale, gastrointestinale e vascolare.
Le procedure oro-dentali comportano una incidenza di
batteriemia transitoria superiore a interventi di pertinenza di altre specializzazioni mediche e chirurgiche;
per tale motivo questo argomento è stato oggetto di
crescente dibattito e diverse linee guida sono state elaborate da autorevoli Comitati Scientifici Internazionali e Società Scientifiche.
Una commissione istituita ad hoc dall’American
Hearth Association (AHA) e dalla American Dental
Association (ADA) ha il compito di fornire e aggiornare periodicamente le raccomandazioni sui regimi di
profilassi più efficaci in relazione alla particolarità della
flora di germi patogeni, alle manovre diagnostiche e terapeutiche fonte di rischio e al tipo di cardiopatia come
fattore predisponente.
La compliance da parte di sanitari e di pazienti alle linee guida proposte dagli organismi internazionali e
dalle singole associazioni medico-scientifiche è un argomento complesso e, nel nostro Paese, si può affermare che la semplificazione introdotta dai recenti protocolli non è stata raccolta ancora in modo capillare.
La maggioranza dei pazienti sembra ricevere una profilassi in linea con le attuali raccomandazioni dell’AHA,
anche se persistono atteggiamenti da parte di alcuni
odontoiatri a un insufficiente o a un eccessivo ricorso
alla profilassi dell’EI.
Per contro risulta infrequente una scarsa compliance da
parte del paziente, soprattutto i pazienti anziani non
hanno consapevolezza delle proprie condizioni cardiache e della necessità di antibioticoprofilassi.
3.1 Endocardite infettiva
3.1.1 L’efficacia della profilassi
L’endocardite infettiva (EI) è una malattia che ha mutato nel tempo la propria eziologia ed epidemiologia
discostandosi da quelle che per molto tempo sono state le sue caratteristiche sostanziali.
Nonostante i progressi compiuti dal punto di vista dia-
La medicina basata sulle evidenze (EBM) rappresenta
materia di formazione sempre più largamente insegnata che ben si confronta con la necessità di uniformare
l’erogazione di prestazioni sanitarie ponendole al più
alto livello possibile.
93
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
embolizzazione
settica
aneurismi micotici da
ascesso cerebrale
embolizzazione
settica con formazione
di ascesso
embolia
acuidente
cerebro-vascolare acuto
infarto del miocardico
infarto di milza, reni,
altri visceri
occlusione di arterie
ileofemorali o altri vasi
maggiori
danno al cuore
Figura 3.1 - Lesioni di Janeway, noduli purpurici a
livello dei polpastrelli delle dita delle mani in soggetto
affetto da endocardite batterica subacuta
perforazione
di valvola con
insuffienza
ascesso
miocardico
Vi è stata inoltre una lunga controversia sulla profilassi
antibiotica dell’EI, peraltro non ancora esaurita.
La difficoltà a dimostrare la validità della profilassi dell’EI nasce da una serie di questioni irrisolte alla cui base si trova l’impossibilità, per motivi etici, di eseguire
studi randomizzati ben disegnati; del resto anche statisticamente la stessa rarità della patologia richiederebbe
coorti statistiche molto numerose di pazienti suscettibili, difficilmente reclutabili. In linea generale sussiste
unanime consenso sul fatto che:
- il rischio di sviluppare EI dopo varie procedure non
è stato quantificato
- l’efficacia della profilassi antibiotica non è stata dimostrata
- non sono state stabilite con certezza le procedure e
gli interventi ai quali applicare la profilassi
- non è stata dimostrata la superiorità di uno schema
di profilassi sull’altro.
In assenza di dati scientifici definitivi, le raccomandazioni sono basate su informazioni di ordine secondario,
che rappresentano una evidenza indiretta della efficacia
della profilassi, quali case report, osservazioni su serie
limitate di pazienti, esperimenti in laboratorio in vitro
o su animali.
Molti studi caso controllo, basati su analisi di serie limitate di casi, hanno evidenziato l’efficacia della profilassi, mentre altri ne hanno messo in rilievo la ridotta
efficacia e lo sfavorevole rapporto costo-beneficio.
I dati retrospettivi presentati da Hortskotte (1986) in
pazienti portatori di protesi valvolari dimostrano un
maggior rischio in pazienti in cui non veniva attuata alcuna profilassi in occasione di procedure diverse di chirurgia generale: 6 EI su 300 nei confronti di un gruppo di controllo in cui nessuno di 287 pazienti presentava complicanze.
Il lavoro di Durack svolto tra il 1979 e il 1982 raccolse
52 casi di endocardite infettiva per apparente fallimento della profilassi; dei quali 17 (33%) erano affetti da
prolasso della valvola mitrale.
pericardite
suppurativa
deiscienza
di valvola
artificiale
complessi
immuni
circolanti
glomerulonefrite
focale
glomerulonefrite
diffusa
batteriemia
con infezioni
da metastasi
ascessi renali
da osteomielite
ascessi disseminati
in vari siti
Figura 3.2 - Potenziali complicazioni dell’endocardite
infettiva
Nel 92% dei casi l’endocardite infettiva era preceduta
da una terapia odontoiatrica, effettuata in genere 2-5
settimane prima della comparsa dei sintomi.
Nel 75% dei casi il germe responsabile era lo Streptococcus viridans, che nel 60% dei casi era sensibile all’antibiotico utilizzato all’epoca (penicillina).
Quest’esperienza evidenziò la possibile fallacità della
profilassi, ma oggi l’affermazione deve essere mitigata dal
fatto che i protocolli di allora erano diversi dagli attuali.
Studi in vitro della sensibilità agli antibiotici dei germi
abitualmente responsabili dell’EI hanno dimostrato
una tendenza allo sviluppo di antibiotico-resistenza:
sono in aumento i ceppi di Streptococcus viridans resistenti a concentrazioni minime battericide di 0,1-1
mg/ml di penicillina G; le infezioni ospedaliere da stafiloccocchi nel 50% dei casi sono sostenute da ceppi
meticillino-resistenti; gli enterococchi resistenti alla
vancomicina e alla gentamicina sono in aumento.
Negli ultimi anni è stato osservato un incremento dei
94
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
mal di gola
malattia cardiaca
reumatica acuta
reazioni crociate
steptococco
ß emolitico
risposta immunitaria
vegetazioni
linfociti ß
anticorpi
antisteptococco
pericardite fibrinosa
Figura 3.3 - Malattia cardiaca reumatica
casi di EI causate da germi del gruppo HACEK (Haemophilus, Actinobacillus, Cardiobacter, Eikenella, Kingella), frequenti produttori di betalattamasi.
In questo contesto la profilassi antibiotica tradizionale
con la sola amoxicillina potrebbe non essere più supportata, in alcuni casi, da un razionale scientifico.
Per tutti questi motivi la profilassi dell’EI resta una pratica empirica, non supportata da inoppugnabili evidenze scientifiche; ciononostante le più prestigiose associazioni medico-scientifiche concordano sul fatto che una
profilassi antibiotica in pazienti predisposti vada effettuata e tale raccomandazione vieni quindi a costituire
un obbligo.
3.1.2 Stima del rischio
di sviluppare EI
L’EI si sviluppa di solito in pazienti con lesioni cardiache preesistenti in cui si realizza una batteriemia che
può avvenire spontaneamente, complicare un’infezione
focale o essere provocata da procedure chirurgiche o
diagnostiche strumentali che coinvolgono superfici
mucose o tessuti contaminati (tabelle 3.4, 3.5).
Per poter stabilire l’opportunità di effettuare una profilassi antibiotica in un singolo paziente è necessario stimare il rischio di EI valutando diversi fattori:
- il tipo di germe e la sua sensibilità agli antibiotici
- il tipo di procedura diagnostica o terapeutica a cui è
correlato il numero di germi immessi in circolo (batteriemia)
- la gravità della cardiopatia sottostante.
I germi più spesso responsabili di EI di origine orodentale sono Streptococcus viridans, Enterococcus, Staphilococcus aureus, Staphilococcus epidermidis, Pseudomonas
aeruginosa o quelli del gruppo HACEK (Haemophilus,
Actinobacillus, Cardiobacter, Eikenella, Kingella).
La batteriemia transitoria dopo un intervento odontoiatrico raramente persiste oltre 15 minuti, ma i germi
possono depositarsi su strutture valvolari danneggiate o
95
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
anomale o sull’endotelio arterioso adiacente a difetti
anatomici, dando luogo a endocardite o endoarterite
batterica.
La batteriemia è una eventualità molto frequente e la
maggior parte dei casi di EI (88-95%) sarebbero secondari a batteriemie che si verificano abitualmente nel
corso di normali attività quotidiane svolte dai pazienti.
È noto, ad esempio, che la stessa masticazione, l’esecuzione di sciacqui orali o l’igiene dentale con spazzolino
possono produrre batteriemie transitorie che risultano
di maggior rilievo quanto più scarsa è l’igiene orale.
Nei pazienti portatori di protesi dentali non perfettamente adattate, piccole ulcerazioni gengivali e relativi
sanguinamenti possono comportare batteriemie; del
resto la mucosa orale rappresenta, con la cute, una delle porte di ingresso più abituali dei germi responsabili
della EI.
Anche le infezioni periapicali e parodontali possono
provocare batteriemie spontanee indipendentemente
da procedure odontoiatriche; la loro incidenza e entità
sono direttamente proporzionali alla gravità della flogosi e dell’infezione.
Questi piccoli eventi quotidiani comportano l’immissione in circolo di una quantità inferiore di germi di
quelle provocate da manovre odontoiatriche, ma vengono tuttavia ad esercitare cumulativamente un peso
maggiore dal punto di vista del rischio di EI, soprattutto in pazienti con infezioni orali e cattiva igiene orale.
Diversi autori hanno studiato l’incidenza di batteriemia transitoria e il rischio dopo procedure odontoiatriche di vario tipo; si stima ad esempio che i casi di EI
che seguono ad una estrazione dentale in pazienti predisposti vari da 1:533 a 1:3000 estrazioni.
Il tempo di latenza fra la procedura dentale e l’esordio
dei sintomi dell’EI influisce sulla frequenza con cui è
identificabile un rapporto tra la procedura stessa e l’identificazione di un germe proveniente dal cavo orale.
Considerando un tempo di 8 settimane dopo la procedura odontoiatrica, l’incidenza di EI causata da flora
orofaringea non supera il 26% (Strom, 1998) e su un
periodo di incubazione di 4 settimane si attesta attorno
al 13 %.
Anche entro un limite temporale più appropriato di 23 settimane durante il quale si calcola che la maggior
parte dei casi di EI diventi sintomatica, si deve tenere
presente che l’associazione tra procedura dentale e EI
sia fortuita.
I dati portano a concludere che non più del 5-12% dei
casi di EI, causata da germi di accertata provenienza orofaringea, siano effettivamente correlati a terapie odontoiatriche. Del resto è riscontro comune che molti pazienti predisposti si sono sottoposti a terapie odontoiatriche in assenza di profilassi senza mai sviluppare EI.
Alcune cardiopatie mostrano un’associazione con EI
elevata rispetto ad altre.
In uno studio caso-controllo il rapporto di probabilità
di sviluppare EI rispetto la popolazione generale era:
- 75:1 per pazienti portatori di protesi valvolari
- 37:1 per storia pregressa di EI
- 17:1 per altri dati anamnestici di anomalie valvolari.
All’altro estremo dello spettro si collocano difetti che
comportano un rischio così basso che si è generato unanime consenso sull’inutilità della profilassi antibiotica.
Tra le condizioni a rischio intermedio il prolasso della
valvola mitrale (PVM) merita particolare menzione per
la sua prevalenza nella popolazione generale (pari al 4%).
La presenza di questa anomalia si associa a un aumento
del rischio di EI di 5-8 volte e può essere riscontrata nel
20% dei casi di EI subacuta.
Si ritiene che il rischio sia maggiore in presenza di un
soffio da rigurgito per insufficienza e di lembi valvolari
ispessiti per degenerazione mixomatosa.
Secondo le indicazioni dell’AHA, attualmente si somministra la profilassi nei pazienti affetti da PVM con
soffio da rigurgito mitralico, evitando l’iperprescrizione in pazienti con PVM senza fattori di rischio.
Inoltre, secondo alcuni autori, tale approccio dovrebbe
essere considerato facoltativo, considerando che esita in
un rischio superiore di reazioni anafilattiche all’amoxicillina rispetto ai casi di EI realmente evitabili grazie alla profilassi.
3.1.3 Linee guida
L’odontoiatra può approntare una serie di misure preventive per interrompere la catena di eventi che possono portare allo sviluppo di una EI di provenienza orodentale.
L’istruzione e la motivazione a un’accurata igiene orale
domiciliare rappresenta un efficace ruolo preventivo.
L’utilizzazione di sciacqui con collutori antisettici provoca una temporanea riduzione del numero di batteri
individuabili nella cavità orale e tale approccio è da
considerare, anche in assenza di pubblicazione di studi
rappresentativi.
I richiami per l’igiene professionale periodica e la bonifica delle patologie dentali e parodontali sono obiettivi
da perseguire con costanza e precisione nei soggetti con
patologie cardiache predisponenti alla EI.
L’ADA e l’AHA hanno aggiornato nel 1997 le raccomandazioni per l’attuazione della profilassi antibiotica
a seconda della particolare procedura odontoiatrica da
effettuare (tabella 3.6).
I pazienti affetti da cardiopatia ad elevato o medio rischio per l’EI, devono ricevere una profilassi antibiotica in occasione di ogni procedura in grado di produrre
batteriemia transitoria, cioè in cui sia prevedibile un
sanguinamento.
La profilassi antibiotica non è indicata nei pazienti con
cardiopatie a basso rischio di EI.
Lo Streptococcus viridans è il germe più frequentemente
responsabile e pertanto il regime di profilassi antibiotica è diretto contro questo specifico germe.
96
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Studi sperimentali su animali di laboratorio hanno dimostrato che gli antibiotici batteriostatici sono perlopiù privi di efficacia e vi è un unanime consenso sull’opportunità di scegliere antibiotici battericidi.
Lo schema attuale ha ridotto il dosaggio in una singola
somministrazione orale di 2 grammi di amoxicilina
un’ora prima della procedura, rispetto i 3 gr consigliati
in precedenza (tabella 3.7).
Studi di confronto hanno dimostrato una sostanziale
sovrapponibilità fra i due protocolli, visto che i livelli
plasmatici non scendono mai al di sotto della MIC per
gli streptococchi del cavo orale, ma la dose inferiore
provoca minori disturbi collaterali gastrointestinali.
Per i pazienti che non possono assumere farmaci per via
orale si ricorre alla via intramuscolare o endovenosa di
ampicillina o amoxicillina; quest’ultima non è riporta-
ta nelle linee guida della AHA in quanto non disponibile per via parenterale negli USA.
Nei pazienti allergici alla penicillina si utilizza la clindamicina, preferita per il suo ampio spettro e la scarsità di effetti collaterali rispetto all’eritromicina.
In alternativa sono indicati tra i macrolidi l’azitromicina e la claritromicina. Nei pazienti che stanno già assumendo un antibiotico è opportuno sostituirlo con un
altro di diversa classe per evitare problemi connessi alla
selezione di flora microbica resistente.
In particolare nei pazienti in profilassi a lungo termine con penicilline deposito per prevenire le recidive
della febbre reumatica è consigliabile orientarsi su un
macrolide.
Qualora siano previste ripetute sedute è consigliabile
lasciare trascorrere un intervallo di 10 giorni fra un in-
Tabella 3.4 - Frequenza percentuale di batteriemia dopo interventi chirurgici
Terapie odontoiatriche
Estrazione dentaria
Chirurgia parodontale
Curettaggio e levigatura radicolare
Profilassi parodontale
Cure endodontiche
Igiene orale
51-85%
36-88%
8-80%
0-40%
0-15%
Spazzolatura dei denti
Uso di filo interdentale
Uso di stuzzicadenti
Uso di idropulsori per irrigazioni orali
Masticazione
0-26%
20-58%
20-40%
7-50%
17-51%
Tabella 3.5 - Stima del rischio di sviluppare E.I. in relazione alla condizione preesistente
Rischio relativamente elevato*
Rischio intermedio*
Rischio molto basso o
insignificante
• Protesi valvolari
• Altre cardiopatie congenite
• Difetto interatriale ostium
secundum
• Pregressa E.I.
• Valvulopatie acquisite
• Difetto interatriale o
intraventricolare o dotto di
Botallo trattati chirurgicamente
• Cardiopatie congenite cianogene
complesse (ventricolo unico,
trasposizione dei grossi vasi,
tetralogia di Fallot)
• Cardiomiopatia ipertrofica
ostruttiva
• Pregresso by-pass
aortocoronarico
• Condotti o shunt
chirurgicamente costruiti
• Prolasso valvolare mitralico con
rigurgito
• Prolasso valvolare mitralico senza
rigurgito
• Soffio cardiaco innocente
• Pregressa malattia di Kawasaki
senza disfunzione valvolare
• Pregressa febbre reumatica senza
disfunzione valvolare
• Pacemaker cardiaci e
defibrillatori impiantabili
* La profilassi è raccomandata nei pazienti con condizioni cardiache di rischio intermedio-elevato
97
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
tervento e il successivo per evitare la comparsa di germi
resistenti e per permettere alla flora sensibile di tornare
a colonizzare il cavo orale.
Negli ultimi anni è stato osservato un incremento dei
casi di EI causate da germi del gruppo HACEK frequenti produttori di betalattamasi; inoltre dati recenti
indicano che in bambini affetti da cardiopatie congenite ci può essere un aumento dell’incidenza di colonizzazione gengivale con questi germi. Pertanto in occasione di procedure odontoiatriche in questi pazienti, la
profilassi con sola amoxicillina può non essere appropriata, essendo preferibile una cefalosporina di terza
generazione (ceftriaxone) o l’associazione ampicillinagentamicina.
3.2 Profilassi per protesi
articolari ortopediche
Gli interventi di artroprotesi sono un intervento relativamente frequente in ortopedia e, negli ultimi anni,
l’applicazione di profilassi antibiotiche perioperatorie
ha ridotto considerevolmente l’incidenza di insuccessi
nel periodo postoperatorio immediato dovuta a contaminazione intraoperatoria. Un altro fattore di rischio è
rappresentato dalle batteriemie, che possono causare
contaminazione di artroprotesi sia nel periodo immediato postoperatorio che a molti anni di distanza, sebbene si ammetta che il periodo più critico coincida con
i primi due anni dopo l’intervento.
Peraltro va ricordato che la maggior parte delle batteriemie, che si verifica quotidianamente, avviene spontaneamente o in relazione a normali attività e solo una
piccola minoranza è in relazione a terapie odontoiatriche (cfr Endocardite infettiva).
Secondo le linee guida elaborate congiuntamente dalla American Dental Association (ADA) e dalla American Association of Orthopaedic Surgeons (AAOS), la
somministrazione di profilassi antibiotica nel corso di
procedure odontoiatriche non è indicata per pazienti
portatori di viti o placche di fissazione ortopediche e
nemmeno routinariamente per i pazienti con protesi
articolare.
Se ne deve, comunque, considerare la prescrizione in
un ridotto numero di pazienti che sono sottoposti a un
aumentato rischio di infezione ematogena delle protesi
articolari.
Le indicazioni riportate, peraltro, non costituiscono linee guida (sono prive cioè di valore cogente), ma solo
indicazioni che possono essere applicate nei singoli casi
in relazione al giudizio clinico dell’odontoiatra, eventualmente avvalendosi di una consulenza ortopedica.
Infatti, assimilare per analogia le infezioni di artropro-
Tabella 3.6 - Procedure di terapia odontoiatrica profilassi dell’EI
Profilassi dell’E.I. raccomandata*
Estrazioni dentarie
Procedure parodontali incluse chirurgia, levigatura e curettaggio
Implantologia di protesi e/o di denti avulsi
Strumentazioni endodontiche oltre apice
Impianto sottogengivale di benderelle antibiotiche
Posizionamento di bande ortodontiche (non attacchi incollati alla corona)
Iniezioni interlegamentose di anestetico
Pulizia dentale, rimozione del tartaro o comunque ogni procedura dove è previsto sanguinamento
Profilassi dell’E.I. non raccomandata
Interventi restaurativi (otturazioni e sostituzione di denti mancanti) **
Iniezioni locali di anestetico, non intralegamentose
Trattamenti endocanalari
Posizionamento di spessori in gomma anti-digrignamento
Rimozione di punti di sutura
Ortodonzia non traumatica
Presa di impronte
Trattamenti al fluoro
Radiografie orali
Controllo di protesi ortodontiche
Perdita naturale della dentizione decidua
* La profilassi è raccomandata nei pazienti con condizioni cardiache di rischio intermedio-elevato
** L’impiego di antibiotici può essere indicato in previsione di significativo sanguinamento
98
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
tesi alle endocarditi infettive e proporre la somministrazione di un’antibioticoprofilassi di routine non è
giustificato poiché sono diversi sia i microrganismi
implicati che i meccanismi infettivi, anatomici e fisiopatologici.
I pazienti candidati a interventi di artroprotesi dovrebbero essere in buone condizioni fisiche generali e essere
incoraggiati a sottoporsi a terapia odontoiatriche prima
di sottoporsi all’intervento ortopedico.
Successivamente i pazienti con artroprotesi dovrebbero
eseguire un accurata igiene orale quotidiana per mantenere un buon stato di salute orale (mediante spazzolino,
irrigatori), visto che il rischio di batteriemia è più elevato in una bocca con infiammazione che in una sana.
Poiché è possibile che una batteriemia associata ad una
infezione orale causi una infezione tardiva dell’artroprotesi, tali pazienti devono essere trattati tempestivamente con terapia antibiotica e manovre di eliminazione del focolaio infettivo (drenaggio, estrazione, endodonzia).
Esiste una limitata evidenza della possibilità che pazienti immunocompromessi con artroprotesi siano a
maggior rischio di infezione ematogena e per essi va
considerata l’opportunità di utilizzare un regime antibiotico profilattico in corso di procedure odontoiatriche (tabella 3.8, 3.9).
L’antibiotico profilassi va considerata nei pazienti immunocompetenti sottoposti a manovre odontoiatriche
Tabella 3.7 - Schemi di antibiotico-profilassi per procedure dentali, orali, esofagee o del tratto respiratorio
SITUAZIONE
FARMACO
REGIME
Profilassi generale standard*
Amoxicillina
Incapace di assumere farmaci per os
Ampicillina
Allergico alla penicillina
Clindamicina
Adulti: 2 g;
Bambini: 50 mg/Kg per os 1 h prima della procedura
Adulti: 2 g i.m. o e.v.;
Bambini: 50 mg/Kg i.m. o e.v. entro 30 minuti prima
della procedura
Adulti: 600 mg
Bambini: 20 mg/Kg per os 1 h prima della procedura
Allergico alla penicillina ed incapace
di assumere farmaci per os procedura
oppure
Cefalexina
o Cefadroxil
oppure
Azitromicina o
Claritromicina
Clindamicina
oppure
Cefazolina
Adulti: 500 mg
Bambini: 15 mg/Kg per os 1 h prima della procedura
Adulti: 2 g
Bambini: 50 mg/Kg per os 1 h prima della procedura
Adulti: 600 mg
Bambini: 20 mg/Kg e.v. entro 30 minuti prima della
Adulti: 1 g
Bambini: 25 mg/Kg i.m. o e.v. entro 30 minuti prima
della procedura
* Nella prassi clinica risultano frequentemente utilizzate le betalattamine betalattamasi resistenti (amoxicillina+ac. clavulanico, cefprozil) che presentano uno spettro d’azione più ampio esteso anche a nuovi patogeni emergenti.
Tabella 3.8 - Pazienti con aumentato rischio di infezione ematogena di protesi articolari
Paziente con immunocompromissione o immunodepressione
Altri pazienti
Artropatie infiammatorie
Artrite reumatoide
Lupus eritematoso sistemico
I primi due anni dopo il posizionamento di protesi articolare
Immunosoppressione indotta da patologie, farmaci,
radiazioni
Malnutrizione
Diabete insulinodipendente (tipo 1)
Precedente infezione di protesi articolare
Emofilia
99
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
a elevato rischio entro i primi due anni dall’impianto
della protesi; per coloro che hanno sofferto di precedente infezione della protesi o altre condizioni foriere
di aumentato rischio indipendentemente dalla distanza
dall’intervento.
I regimi di antibioticoprofilassi consigliati sono stati riportati nella tabella 3.10.
Nella pratica clinica sono ultimate anche le betalattamine betalattamasi resistenti come l’amoxcillina-acido
clavulanico e il cefprozil.
3.3 Protesi sistemiche
Un sempre maggior numero di dispositivi protesici è
applicato nelle diverse branche della chirurgia:
- valvole cardiache biologiche e meccaniche (per queste
ultime è necessaria la terapia anticoagulante) per valvulopatie congenite e acquisite
- protesi vascolari arteriose sintetiche (generalmente in
dacron) per aneurismi e trombosi vascolari causate
dall’aterosclerosi
Tabella 3.9 - Stratificazione dell’incidenza di batteriemia dopo procedure odontoiatriche
per pazienti con protesi ortopediche
Incidenza elevata (1)
Incidenza bassa (2)
Estrazioni dentali
Odontoiatria conservativa e protesica (3) con o senza fili di retrazione (4)
Procedure parodontali compreso: chirurgia, posizionamento sottogengivale di fibre impregnate di antibiotico,
curettaggio e levigatura radicolare, sondaggio, terapia di
mantenimento periodica (richiami)
Posizionamento di impianti o di denti avulsi
Iniezioni locali di anestetico (non intraligamentose)
Trattamento endodontico intracanalare, posizionamento di perni canalari e ricostruzione
Posizionamento della diga
Rimozione di suture
Iniezioni intraligamentose di anestetico
Pulizia profilattica di denti o impianti quando si preveda sanguinamento
Posizionamento di apparecchi rimovibili ortodontici o
protesi mobili
Presa di impronte
Trattamenti di fluorizzazione
Esecuzione di radiografie
Regolazione di apparecchi ortodontici
* AAOS adattato dalla American Hearth Association (AHA)
(1) La profilassi dovrebbe essere considerata per pazienti con protesi articolare completa che soddisfa i criteri riportati nella “tabella 1 Pazienti
con aumentato rischio di infezione ematogena di protesi articolari”. Nessun altro paziente con impianti ortopedici (viti, placche) dovrebbe essere considerato candidato ad antibioticoprofilassi prima di procedure odontoiatriche
(2) Profilassi non indicata
(3) Restauro di denti cariati o mancati
(4) A giudizio del clinico può essere indicato l’antibiotico in circostanze selezionate che possono provocare un sanguinamento significativo
Tabella 3.10 - Regimi di antibiotico profilassi suggeriti nei pazienti con protesi ortopediche
Pazienti non allergici alla penicillina
Cefalexina, cefradina o amoxicillina 2gr per os 1 ora prima della procedura
Cefprozil 1gr 1 ora prima della procedura
Pazienti non allergici alla penicillina ma incapaci di assumere farmaci per via orale
Cefazolina 1 gr o ampicillina 2 gr im/ev 1 ora prima della procedura
Pazienti allergici alla penicillina
Clindamicina 600 mg per os 1 ora prima della procedura
Pazienti allergici alla penicillina ma incapaci di assumere farmaci per via orale
Clindamicina 600 mg im/ev 1 ora prima della procedura
100
- pacemaker transvenosi per la terapia delle aritmie cardiache
- shunts cerebrospinali con diverse derivazioni (ventricolo-peritoneale, lombo-peritoneale e ventricoloatriale) per la terapia dell’idrocefalia
- protesi articolari in particolare del femore e del ginocchio per artriti, artrosi, fratture e necrosi avascolare
della testa del femore
- impianti penieni (rigidi, semirigidi, gonfiabili) per
l’impotenza coeundi
- lenti intraoculari per la terapia della cataratta
- protesi mammarie a scopo estetico o ricostruttivo
- cateteri endovenosi tipo Uldal (emodialisi, plasmaferesi) e Hickman (chemioterapia endovenosa centrale),
ecc.
Le infezioni dei dispositivi protesici ammontano complessivamente allo 0,5-3% nel primo anno e derivano
principalmente da una infezione della ferita chirurgica o
da infezioni tardive localizzate; in alcuni casi si ammette
che possano derivare da batteriemie transitorie che si verificano in seguito a traumi diversi.
Il problema dell’odontoiatra consiste nel determinare se
esista un aumentato rischio di infezione localizzata dei
dispositivi protesici, secondario a batteriemie transitorie
da interventi invasivi che causino sanguinamento. Le
batteriemie secondarie a interventi odontoiatrici, comunque, rappresentano un fattore di minore importanza, in cui la dimostrazione del rapporto causale non è
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
agevole, dovendo soddisfare alcuni criteri eziologici:
identità del microrganismo isolato in bocca, nel sangue e
sul dispositivo protesico; compatibilità temporale tra intervento odontoiatrico e infezione dell’organismo (da 2
a 7 mesi secondo alcuni autori).
Il rischio di infezione di qualunque dispositivo protesico
è maggiore nei periodi immediatamente successivi il suo
impianto sino a guarigione avvenuta dall’intervento.
La possibilità di una profilassi antibiotica, in questi casi, può essere considerata entro 2-3 mesi dall’intervento
di osteosintesi per fratture, protesi articolari, protesi peniene, protesi vascolari arteriose sintetiche, patches cardiaci previa consulenza medica.
Per le protesi valvolari cardiache il rischio di endocardite
batterica è da considerare dimostrato e sono state formulate linee guida che prevedono l’applicazione della profilassi antibiotica, considerata lo standard di cura obbligatorio a tempo indeterminato per tutta la vita del paziente.
Per altri tipi di protesi, invece, non sono disponibili in
letteratura dati scientifici che dimostrino una correlazione causale tra batteriemie transitorie odontogene con infezioni secondarie; in assenza di indicazioni univoche, la
decisione è lasciata al singolo operatore e si basa su valutazioni individuali dello specifico caso (tabella 3.11).
Per quanto attiene le protesi articolari-femore e ginocchio che rappresentano il riscontro clinico più frequente, sono stati proposti alcuni schemi posologici per una
profilassi antibiotica. La profilassi non è consigliata co-
Tabella 3.11
Indicazioni alla profilassi antibiotica per trattamenti odontoiatrici in pazienti con dispositivi protesici sistemici
Nessuna dimostrazione scientifica a supporto
Profilassi antibiotica inutile, sconsigliata
Protesi mammarie
Impianti in odontoiatria
Impianti in oculistica (lenti per cristallino)
Shunts per fluido cerebrospinale
(ventricolo-peritoneale e lomboperitoneale)
Mezzi di osteosintesi per fratture in ortopedia
(viti, placche, fissatori)*
Scarse o nulle evidenze scientifiche a supporto
Profilassi antibiotica non raccomandata
Applicabile in presenza di fattori di rischio aggiuntivi confermati da consulenza medica
Protesi articolari (anca, ginocchio)*
Protesi peniene *
Pacemaker transvenosi
Defibrillatori-cardioconvertitori impiantati
Cateterismo e accesso venoso centrale
(alimentazione parenterale)
Alcune evidenze scientifiche a supporto
Profilassi antibiotica di routine non consigliata. Eseguire
una valutazione individuale dei casi specifici mediante
consulenza medica
Protesi vascolari arteriose sintetiche *
Patches cardiaci*
Cateteri di Uldal (emodialisi, plasmaferesi)
Cateteri di Hickman (chemioterapia endovenosa centrale)
Shunts per fluido cerebrospinale (ventricolo-atriale)
Evidenza scientifica
Profilassi antibiotica necessaria e obbligatoria
Protesi valvolari cardiache
(meccaniche e biologiche)
*Il rischio permane sino a guarigione avvenuta dall’intervento chirurgico di posizionamento della protesi
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
me intervento di routine in quanto è assente un’evidenza scientifica sul nesso di causalità tra batteriemia
associata a trattamento odontoiatrico e infezioni di
protesi ortopediche. L’opportunità va valutata in base a
considerazioni individuali nello specifico caso, nei pazienti con un aumentato rischio. Anche in questi casi,
comunque, l’applicazione rimane facoltativa e non obbligatoria.
Nei pazienti con dispositivi protesici dove sono disponibili alcune evidenze scientifiche a supporto del rischio potenziale, alcuni operatori tendono ad applicare
la profilassi antibiotica anche in assenza di evidenza
scientifica di efficacia. Tale atteggiamento non è da ritenersi corretto, poiché in assenza di beneficio, espone
il paziente agli effetti indesiderati dei farmaci e ad un
inutile costo sociale.
3.4 Infezioni
post-chirurgiche
La profilassi è utile quando l’infezione post-chirurgica
deriva direttamente dall’intervento, come conseguenza
di un’infezione endogena; viceversa quando l’infezione
è correlata ad un’asepsi incompleta (contaminazione
esogena) la profilassi non è in genere in grado di agire.
Il razionale della profilassi antibiotica delle infezioni
post-chirurgiche è generalmente correttamente applicato da parte degli odontoiatri; ma in taluni casi si assiste ancora a prescrizioni scorrette: anticipate di alcuni
giorni prima dell’intervento (che sortiscono l’effetto di
aumentare le resistenze batteriche) o ritardate dopo
l’intervento, risultando inutili.
3.4.1 Indicazioni
La profilassi antibiotica in occasione di interventi chirurgici è la somministrazione di antibiotici in assenza di
malattia infettiva, al fine di prevenire le complicanze infettive: la batteriemia e le infezioni metastatiche sistemiche o localmente la colonizzazione batterica della ferita.
L’indicazione ad eseguire una chemioprofilassi antibatterica sussiste quando il rischio di infezione è significativo e coincide con la possibilità di ridurre significativamente le complicanze infettive direttamente legate
all’intervento chirurgico (secondo alcuni autori con
una riduzione dell’incidenza di almeno il 50%).
Il rischio risulta associato ai seguenti fattori, dai quali
sono escluse le indicazioni per i pazienti a rischio di endocardite infettiva o con endoprotesi ortopediche trattati nei precedenti capitoli:
- tipo di intervento in riferimento all’entità della contaminazione batterica.
- durata dell’intervento considerando che a parità di
101
altre condizioni un intervento che superi le due ore
presenta un rischio infettivo doppio.
- condizioni generali di salute del paziente come malnutrizione, cachessia.
- l’entità del trauma chirurgico in quanto le manovre
traumatizzanti comportano sofferenze tissutali e necrosi che favoriscono le infezioni.
- ospite compromesso per immunodepressione correlata a patologie sistemiche.
L’ospite compromesso presenta il rischio di infezioni
metastatiche o locali in relazione al grado di immunodepressione causato dalla patologia di base.
Non sono disponibili linee guida unitarie sulla prescrizione della profilassi antibiotica delle complicanze infettive in chirurgia e la decisione va valutata dal clinico
individualmente caso per caso.
Esiste comune consenso sulla opportunità di somministrare la profilassi antibiotica nei pazienti con granulocitopenia grave (inferiore a 500 cell/mm3), situazione
riscontrabile nella inibizione midollare e nell’AIDS; tale indicazione sussiste per tutti gli interventi causa di
batteriemia (cfr Profilassi dell’endocardite infettiva).
Le infezioni operatorie più frequenti che si realizzano
nel paziente normale (non immunodepresso) sono a livello della ferita chirurgica e a questo proposito gli interventi sono classicamente suddivisi in classi in base al
rischio infettivo (tabella 3.12).
In chirurgia generale la chemioprofilassi antibiotica coincide con la possibilità di ridurre significativamente le
complicanze infettive direttamente legate all’intervento
chirurgico ed è quindi legata agli interventi pulito-contaminati e contaminati.
Per quanto riguarda l’odontoiatria valgono alcune considerazioni particolari.
La quasi totalità degli interventi di chirurgia orale viene considerata di tipo pulito-contaminato sia per le
condizioni di intervento in ambito ambulatoriale, sia
per la notevole presenza di flora orale e la costante contaminazione salivare.
L’esodonzia sia di denti privi di patologia che per infezioni croniche, il curettaggio gengivale, la levigatura radicolare e la chirurgia parodontale, la chirurgia endodontica e preprotesica sono interventi pulito-contaminati in cui l’uso routinario di profilassi antibiotica non
è giustificato per la trascurabile incidenza di infezioni,
che, nel caso si realizzino, sono localizzate, autolimitanti e facilmente trattabili con drenaggio e terapia antibiotica (tabella 3.13).
L’estrazione di denti inclusi, cistectomie e cistostomie,
gli interventi di chirurgia ossea e implantare (anch’essi
considerati pulito-contaminati) sono, invece, generalmente trattati con una terapia o una copertura antibiotica (termine improprio che intende una profilassi
prolungata 2-3 giorni per diminuire il rischio di infezione).
Con tale trattamento ad esempio dopo la rimozione
dei terzi molari in inclusione ossea l’incidenza di infe-
102
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tabella 3.12 - Classificazione degli interventi chirurgici in funzione del grado di contaminazione a rischio
di complicanze infettive
Chirurgia pulita (infezione <5%)
Interventi che non coinvolgono superfici mucose; incisioni in assenza di infezioni o flogosi in atto, drenaggi, difetti di tecnica chirurgica; viene rispettata l’asepsi
Chirurgia poco contaminata (infezione 10%)
Interventi in cui viene incisa la mucosa delle vie aerodigestive superiori (VADS); interventi con drenaggi, difetti lievi di tecnica chirurgica
Chirurgia contaminata (infezione 20%)
Incisioni in tessuti infetti con flogosi acute non purulente; ferite traumatiche avvenute da meno di 4 ore; grave difetto di tecnica chirurgica; assenza di asepsi
Chirurgia sporca (infezione 40%)
Incisioni di raccolte purulenta; ritenzione di corpi estranei e tessuti necrotici; ferite traumatiche avvenute da più di
4 ore
Tabella 3.13 - Possibili indicazioni alla profilassi antibiotica in chirurgia orale*
Ospite compromesso per interventi causa di
sanguinamento e/o batteriemia
Immunodeficienze congenite
Immunodeficienze acquisite (AIDS)
Inibizione midollare (leucemie, agranulocitosi,
pancitopenie)
Diabete mellito scompensato
Insufficienza renale grave
Insufficienza epatica grave (cirrosi)
Splenectomia
Età estreme (anziani defedati e denutriti, neonati)
Neoplasie in terapia radiante e/o antiblastica
Terapia immunosoppressiva o steroidea ad alto
dosaggio (trapianti d’organo, malattie
autoimmunitarie)
Interventi pulito-contaminati in pazienti sani
Implatologia, autotrapianti e innesti d’osso
Esodonzia di denti inclusi
Chirurgia ossea (cistotomia, cistectomia, interventi con
osteoresezione)
Interventi contaminati o sporchi in pazienti sani**
Incisione e drenaggio per infezioni odontogene da
piogeni (ascessi, flemmoni)
Estrazioni dentali con processi infettivi in atto
* Non disponibili linee guida unitarie, la decisione va affrontata caso per caso
**Terapia antibiotica precoce
Tabella 3.14 - Chemioprofilassi ed infezioni post-chirurgiche in chirurgia generale
Tipo di chirurgia
Pulita
Pulito-contaminata
Contaminata
Sporca*
* Terapia antibiotica precoce
Percentuali di infezione
Senza chemioprofilassi
Con chemioprofilassi
1,5-2%
1,5-2%
10%
3-4%
15-18%
9%
40%
9%
103
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
zioni postoperatorie è <1% e la percentuale è ancora
più ridotta nell’implantologia.
La chemioprofilassi è consigliata negli interventi con
applicazione di protesi (cioè impianti alloplastici e innesti ossei in odontoiatria), alla luce della particolare
gravità delle complicanze infettive post-operatorie che
comportano il fallimento dell’intervento.
Questa considerazione rimane valida anche per interventi eseguiti in condizioni di elezione e che possono
essere considerati come puliti in quanto eseguiti secondo i dettami dell’asepsi in chirurgia (in sala operatoria,
con disinfezione del sito chirurgico).
La chirurgia contaminata e sporca (incisione e drenaggio di ascessi) non viene modificata dalla chemioprofilassi, quanto da una terapia antibiotica precoce, ovviamente differente per ritmo di somministrazione e durata del trattamento rispetto la profilassi (tabella 3.14).
3.4.2 Schemi posologici
I criteri per la scelta dei farmaci antibiotici da utilizzare a scopo profilattico dovrebbero consistere nelle seguenti caratteristiche:
- aziona battericida
- spettro d’azione adeguato in base ai germi più proba-
bili agenti patogeni causa di infezione nel distretto
interessato dall’intervento
- favorevole farmacocinetica per ottenere elevate concentrazioni ematiche e nei tessuti orali durante l’intervento superiore alle MIC del maggiore numero
possibile di batteri patogeni
- tossicità scarsa; nulla o buona tollerabilità
- comoda posologia.
La via di somministrazione preferenziale è quella orale in quanto diminuisce il rischio e la gravità di reazioni allergiche; mentre la parenterale viene utilizzata
solo in determinate situazioni come interventi in anestesia generale o altri fattori che rendano obbligatoria
la scelta di un antibiotico non disponibile in formulazione orale (ad esempio cefalosporine di terza generazione per la presenza di germi resistenti ai più comuni antibiotici).
Le molecole più utilizzate sono le aminopenicilline appartenenti al gruppo delle penicilline ad ampio spettro
(amoxicillina, ampicillina, bacampicillina) ed alcune
cefalosporine.
Alcune specie anaerobie beta-lattamasi produttrici
(quindi resistenti alle aminopenicilline) possono avere
un ruolo primario nelle complicanze di interventi chirurgici implantari, parodontali o nel caso di comunicazione con le cavità nasali e/o il seno mascellare.
Tabella 3.15 - Schemi posologici della profilassi antibiotica delle infezioni post-chirurgiche
ULTRA SHORT TERM - unica somministrazione
PER OS
I.M.
E.V.
Bacampicillina 2,4g 1 ora prima
Amoxicillina 2-3 g 1 ora prima
Amoxicillina + Ac clavulanico 2-3 g 1 ora prima
Cefprozil 1gr 1 ora prima
Ampicillina 2 g 30 minuti prima
Ampicillina + sulbactam 1,5-3 g 30 minuti prima
Ceftriaxone 2 g 30 minuti prima
Ampicillina 2 g 15 minuti prima
Ampicillina + sulbactam 1,5 -3 g 15 minuti prima
Amoxicillina + Ac. clavulanico 2,4 g 15 minuti prima
Ceftriaxone 2 g 15 minuti prima
SHORT TERM - Una somministrazione prima dell’intervento proseguita per 24-48 ore
PER OS
Becampicillina da 1,2 a 2,4 g 1 ora prima seguiti da 1,2 g 2 volte al giorno per 1-2 giorni
Amoxicillina da 1 a 2 g 1 ora prima, seguiti da 1 g 2 volte al giorno per 1-2 giorni
Amoxicillina + Ac. clavulanico da 1 a 2 g 1 ora prima, seguiti da 1 g 2 volte al giorno per 1-2 giorni
Cefprozil 1gr 1 ora prima, seguito da 500 mg ogni 12 ore per 1-2 giorni
I.M.
Ampicillina 2 g 30 minuti prima, seguiti da 1 g 2 volte al giorno per 1-2 giorni
Ampicillina + sulbactam 1,5-3 g 30 minuti prima, seguiti da 1,5 g 2 volte al giorno per 1-2 giorni
Ceftriaxone 2 g 30 minuti prima, seguiti da 1 g 2 volte al giorno per 1-2 giorni
E.V.
Vedi profilassi short term. La somministrazione E.V. è da riservarsi al paziente in struttura adeguata
104
In questo caso sono indicati antibiotici efficaci contro i
germi betalattamasi produttori, come l’amoxicillina +
acido clavulanico, alcune cefalosporine (ad esempio il
cefprozil), il metronidazolo o l’ampicillina + sulbactam; in caso di allergia alle betalattamine si utilizzano i
macrolidi.
La concentrazione dell’antibiotico nel sangue deve raggiungere al momento dell’intervento un picco pari a 34 volte la MIC (concentrazione minima inibente), cioè
doppia rispetto a quella terapeutica.
La prima somministrazione viene eseguita ½ ora o 1
ora prima dell’intervento e questo è il migliore momento d’inizio per assicurare la concentrazione tissutale ideale.
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
In alcuni casi la somministrazione è effettuata nel corso dell’intervento o subito dopo; la somministrazione a
distanza di 3 ore risulta invece inefficace anche per via
parenterale.
Le opinioni sulla durata ottimale variano da una dose
singola (one shot therapy) sino a 3 giorni di trattamento (shot therapy o copertura antibiotica), per durate
maggiori si intende terapia antibiotica (tabella 3.15).
Nella maggior parte dei casi è consigliata una monosomministrazione perioperatoria (ultra-short term); in
alternativa si utilizza una somministrazione preoperatoria proseguita per 24-48 ore (short term).
In presenza di chirurgia contaminata con rischio protratto di infezione si utilizza una terapia antibiotica.
PARTE B
CHEMIOTERAPIA
ANTIMICOTICA
Marciapiede
Un mazzo di fiori appassiti
a un paracarro legati
sul ciglio di una strada affollata
in ricordo di un affetto rubato
forse un figlio perduto.
In una società che fugge la malattia
reclude negli ospedali il dolore
esilia dalla vita la morte,
mi commuovo e rimuovo
in un attimo la mia umanità.
Apotropaico
Alla vista meno acuta
ora appare nitida la vita
che chiama con chiare
parole senza pudore
il concreto reale
e l’affetto leale
La fine s’allontana
nell’attimo vissuto
Convenzionalmente le micosi umane vengono denominate sulla base dell’agente eziologico (candidosi,
aspergillosi, criptococcosi, istoplasmosi) e suddivise in
relazione alla profondità e gravità dell’infezione nei vari distretti anatomici: micosi superficiali, mucocutanee,
sottocutanee e profonde.
Le infezioni fungine di interesse per la terapia odontoiatrica sono rappresentate dalle candidosi, micosi superficiali che interessano solo gli strati superficiali della mucosa orale con scarsissima reazione immunitaria
da parte dell’ospite.
La Candida albicans è la specie patogena più frequentemente riscontrata nell’uomo; si tratta di un normale
commensale delle mucose che, in presenza di opportune condizioni predisponenti, può provocare affezioni
morbose (patogeno opportunista).
La terapia topica delle stomatomicosi, mediante antibiotici polienici in sospensione o gel orale a base di miconazolo, rappresenta sempre il trattamento di prima
scelta.
Mentre la terapia sistemica va riservata al trattamento
di forme resistenti al trattamento locale o in presenza
di intolleranza alle formulazioni topiche; si utilizzano i
derivati azolici.
Quando si somministra un antimicotico si deve prolungare la terapia dopo la guarigione clinica per 3-5
giorni, per evitare la recidiva dovuta a incompleta eradicazione del micete; mediamente la durata di un trattamento antimicotico è di 7-15 giorni, ma molto più
lungo nelle cheiliti angolari (sino a 3-4 settimane).
Per evitare le recidive, inoltre, la terapia farmacologica
deve essere sempre associata alla correzione dei fattori
predisponenti locali (protesi incongrue, dieta, xerostomia, acidità orale) o sistemici (diabete, immmunodepressione, dismicrobismo da antibioticoterapia, terapie
immunodepressive).
1. FAMIGLIE
DI ANTIMICOTICI
L’utilizzazione in stomatologia è limitata a poche famiglie, poiché gli antimicotici ad uso dermatologico
non trovano indicazione per la loro caratteristica di
concentrarsi nei tessuti cheratinizzati (cheratina di cute, capelli e unghie) e di essere escreti attraverso la cute (tabella 1.1).
Il meccanismo d’azione degli antibiotici polienici e degli azoli è comune ed è legato al loro ancoraggio a gruppi sterolici della membrana cellulare: l’ergosterolo in
genere funge da recettore specifico.
Questo spiega sia la tossicità selettiva nei confronti dei
miceti, nei quali gli steroli sono costituenti essenziali
della membrana cellulare, sia l’insensibilità dei batteri
che, come le cellule umane, ne sono privi.
L’ancoraggio ai gruppi sterolici determina distorsione e
formazione di pori e canali nella membrana e di conseguenza un’alterazione della permeabilità con perdita di
componenti citoplasmatici essenziali.
L’azione degli antimicotici può essere sia fungistatica
quando, somministrati a basse dosi, si legano alla
membrana cellulare in modo reversibile; sia fungicida
quando, somministrati a dosaggio più elevato, si legano
in modo irreversibile.
1.1 Antibiotici polienici
I più importanti farmaci del gruppo hanno una struttura tetraenica (nistatina) o eptaenica (amfotericina-B)
e rappresentano i farmaci di prima scelta nella terapia
delle micosi orali.
Questi antibiotici hanno in comune alcune caratteristiche farmacocinetiche e sono:
- pochissimo solubili in acqua
- non assorbiti a livello gastrointestinale
- elimitati pressochè immodificati nelle feci.
Tabella 1.1 - Antimicotici utilizzati in odontoiatria
MACROLIDI POLIENICI
DERIVATI AZOLICI
Nistatina (topico)
Amfotericina B (topico)
Derivati nitroimidazolici
Ketoconazolo (sistemico, po)
Miconazolo (topico)
Derivati triazolici
Fluconazolo (sistemico po, im/ev)
Itraconazolo (sistemico po)
108
Si caratterizzano per un ampio spettro d’azione e sono
attivi in vitro contro la maggior parte dei funghi patogeni con un’azione che può essere sia fungistatica che
fungicida.
La resistenza ai polienici si manifesta difficilmente in
vivo; i meccanismi più noti sono legati alla presenza di
concentrazioni ridotte di ergosterolo nelle membrane
cellulari dei miceti resistenti.
Sono utilizzate esclusivamente nella terapia topica in
forma farmaceutica di sospensione, la quale è in grado
quasi di tappezzare la parete intestinale, senza essere assorbita, impedendo la penetrazione dei miceti.
La nistatina è utilizzabile solo per via orale e non viene
assorbita attraverso l’apparato gastroenterico. Il dosaggio è molto variabile ed è dosato in unità, essendo i preparati disponibili non del tutto purificati: 1 mg di sostanza pura corrisponde a 3.500 UI.
Si possono consigliare dosi di 400.000 UI/Kg/die nel
bambino e 2-5.000.000 UI/die nell’adulto suddivise
un tre quattro somministrazioni giornaliere.
L’amfotericina B esplica la stessa azione della nistatina
anche se vi è un modesto assorbimento per via orale; la
somministrazione parenterale non è utilizzata in odontoiatria.
1.2 Derivati azolici
Dal punto di vista strutturale si distinguono derivati
azolici a struttura:
- nitro-imidazolica che contengono due atomi di azoto nell’anello azolico (miconazolo, chetoconazolo)
- triazolica che contengono tre atomi di azoto nel nucleo azolico (difluconazolo e itraconazolo).
Sono dotati di una buona attività antimicotica su Candida, Aspergillus, Histoplasma capsulatum, Coccidioides
immitis, su numerosi dermatofiti; presentano inoltre
una buona attività antibatterica nei riguardi di cocchi
e bacilli gram-positivi, oltre che su Actinomyces; sono
presenti, anche se rari ceppi di miceti resistenti agli
azoli.
Il miconazolo presenta un assorbimento intestinale
scarso e ridotta biodisponiblità dopo somministrazione
orale (<10%); viene utilizzato in formulazioni topiche
specifiche per il cavo orale (gel orale) per il trattamento
delle cheiliti angolari e delle stomatiti da Candida Albicans.
Nelle stomatiti da protesi il tempo di contatto e quindi
la capacità di penetrazione e l’azione del farmaco può
essere considerevolmente aumentata disponendolo sulla superficie interna della protesi mobile (medicazione
occlusiva).
Nelle dermatiti periorali e cheiliti angolari si utilizzano
anche altri derivanti imidazolici in pomata dermatologica (econazolo, miconazolo, ketoconazolo).
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Le associazioni di antimicotici con cortisonici e antibiotici topici, in pomata dermatologica, vanno riservate a casi mirati come cheiliti e micosi cutanee con forte
componente infiammatoria e somministrate solo per
qualche giorno al fine di ridurre la componete infiammatoria.
L’impiego è sistemico per fluconazolo, itraconazolo e
ketoconazolo.
Dopo somministrazione per via sistemica gli azoli sono
assorbiti per via intestinale, metabolizzati dal fegato ed
eliminati con le urine; sono molto maneggevoli e presentano ridotta tossicità e scarse reazioni avverse: nausea, dolore gastrico, diarrea, epatotossicità; cautela deve
essere usata nei pazienti con grave deficit della funzionalità epatica e renale.
Il chetoconazolo presenta un ottimo assorbimento per
via orale soprattutto se somministrato prima o durante
i pasti, poiché l’acidità gastrica ne facilita l’assorbimento (figura 1.2).
Gli effetti collaterali possono essere rappresentati da
nausea, dolore gastrico, diarrea, epatotossicità; cautela
deve essere usata nei pazienti con grave deficit della
funzionalità epatica e renale; non richiede modifiche in
caso di insufficienza renale (eliminazione dell’1% per
via renale).
In gravidanza, per il possibile effetto teratogeno, in allattamento e in età prepubere, per la mancanza di dati
definitivi sulla tossicità sistemica, è consigliabile utilizzare le formulazioni topiche di antimicotici azolici; comunque in caso di necessità nei bambini è utilizzabile
il ketoconazolo per via sistemica.
La posologia è 0,2-0,8 g/die nell’adulto e 3,3-6,6
mg/Kg/die nel bambino in un’unica somministrazione
giornaliera.
Il fluconazolo ha caratteristiche peculiari rispetto gli altri antomicotici della stessa famiglia: idrosolubilità,
buona tollerabilità, maggior selettività del meccanismo
d’azione, possibilità di somministrazione sia orale (biodisponibilità al 90%) che parenterale; è disponibile in
capsule, in sospensione orale e in fiale im /ev.
Presenta minori effetti collaterali rispetto il ketoconazolo, ma sono presenti ceppi di candida resistenti.
Il fluconazolo viene utilizzato per via orale alla dose iniziale di 0,4 g, quindi di 0,2-0,4 g/die nell’adulto, 3-6
N
N
Cl
CH2
O
Cl
O
CH2
O
N
N
O
C
CH3
Ketoconazolo
Figura 1.2 - Formula di struttura dei derivati azolici
109
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
mg/Kg/die nel bambino in unica somministrazione
giornaliera. La posologia va individualizzata in caso di
insufficienza renale (eliminazione del 90% per via renale) ed è controindicato in gravidanza e allattamento.
L’itroconazolo è utilizzato come alternativa ai primi; è
un farmaco notevolmente lipofilo e per tale ragione il
suo assorbimento dopo somministrazione orale è migliore se avviene insieme al pasto (50%); si impiega per
via orale alla dose di 0,2-0,4 g/die in 1-2 somministrazioni giornaliere.
2. REAZIONI AVVERSE
I macrolidi polienici in sospensione orale, non sono assorbiti per via enterale e possono produrre effetti indesiderati limitati a livello dell’apparato gastrointestinale;
che risultano di lieve entità (gastralgia, diarrea).
La presenza di una sintomatologia totalmente importante da richiedere la sospensione del trattamento è eccezionale e i pazienti che lamentano effetti collaterali
conseguenti all’uso di uno dei due farmaci possono essere trattati con l’altro.
Gli antimicotici imidazolici, somministrati per via sistemica, sono assorbiti per via enterale e possono produrre effetti indesiderati.
Gli effetti indesiderati più frequenti sono di modesta
entità (tabella 2.1); si presentano prevalentemente come intolleranza gastrointestinale rappresentata da
inappetenza, nausea, vomito, dispesia, crampi gastrointestinali, senso di peso, dolori addominali, distensione
addominale, meteorismo (flatulenza), disturbi dell’alvo
(stipsi, diarrea). Nel 5-10% dei casi per il ketoconazolo
(e in misura minore per gli altri azoli) è stato descritto
un aumento delle transaminasi epatiche, in assenza di
sintomatologia clinica, reversibile alla fine del trattamento; raramente sono state segnalate epatiti colestatiche o citolitiche di natura immunoallergica.
Altri effetti indesiderati si manifestano per trattamenti
a lungo termine o con dosaggi elevati: cefalee, vertigini,
astenia, ipokaliemia, edema, neuropatia periferica.
Non sono disponibili dati definitivi di tossicità sull’uso
degli antimicotici per via sistemica in età infantile e in
gravidanza: ne è, pertanto, sconsigliata la prescrizione
in queste condizioni in cui sono utilizzabili i preparati
per via topica.
Gli imidazolici esercitano un effetto di inibizione sulla
sintesi degli steroidi con lo stesso meccanismo con cui
agiscono sull’ergosterolo della parete cellulare fungina;
ne consegue che trattamenti prolungati possono causare effetti endocrini come insufficienza corticosurrenale
ed effetto antiandrogenico (ginecomastia, impotenza,
riduzione della libido, oligospermia).
L’assunzione concomitante di alcol e azoli può determinare un effetto “antabuse” con sensazione di calore,
rossore, vomito, tachicardia.
Le interazioni farmacologiche sono numerose ma raramente di importanza clinica significativa (tabella 2.2).
3. RAZIONALE DI TERAPIA
DELLE MICOSI
3.1 Candidosi orale
Il trattamento topico con antimicotici (nistatina, amfotericina B) rappresenta la terapia di elezione; la guarigione avviene in 7-15 giorni; la terapia va prolungata
per alcuni giorni (2-5 gg) dopo la scomparsa dei sintomi per evitare la ricaduta immediata dovuta alla mancata eradicazione del micete (tabella 3.1).
La sospensione di antimicotico, dopo lo sciacquo, può
essere deglutita per esercitare un’azione sulle mucose
del tubo digerente che possono essere infettate (esofagi-
Tabella 2.1 - Principali effetti indesiderati degli antimicotici imidazolici
EFFETTO
SINTOMATOLOGIA
CONTROINDICAZIONE
Gastrointestinali
Intolleranza gastrointestinale
Tossicità epatica
Allergia
Endocrini (ketoconazolo)
Aumento delle transaminasi epatiche
Reazioni d’organo o sistemiche
Effetto antiandrogenico
Inibizione corticosurrenale
Ipokaliemia, edema
Rischio di teratogenicità
Escrezione nel latte materno
Sospensione del trattamento
in presenza di sintomi
Grave epatopatia
Ipersensibilità nota al farmaco
Insufficienza corticosurrenale
Metabolici
Gravidanza e allattamento
Gravi nefropatie
Controindicati i farmaci per via sistemica
110
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tabella 2.2 - Interazioni farmacologiche degli antimicotici imidazolici e triazoli
INTERAZIONE
EFFETTO
PRECAUZIONI
FLUCONAZOLO, ITRACONAZOLO, KETOCONAZOLO, MICONAZOLO
Anticoagulanti orali
Inibizione del metabolismo epatico e aumento dell’effetto dell’anticoagulante orale con rischio di emorragia
Precauzioni di impiego
Controllo del tempo di protrombina e dell’INR; aggiustamento della posologia dell’anticoagulante orale durante il trattamento e negli otto giorni
successivi alla sua sospensione.
Midazolam, triazolam
Riduzione del metabolismo epatico e aumento della
concentrazione plasmatica della benzodiazepina con
conseguente incremento dell’effetto sedativo.
Controindicazione Triazolam
Associazione sconsigliata Midazolam
Medicinali che causano torsione di
punta Antistaminici anti-H1 non sedativi (astemizolo, ebastina, terfenadina),
cisapride
Aumentato rischio di aritmia ventricolare per riduzione del metabolismo epatico
Controindicazione
Non associare farmaci potenziali causa di torsione di punta, considerata
la gravità della aritmia
Ciclosporina, tacrolimus
Effetto non segnalato per miconazolo
Inibizione del metabolismo e aumento della concentrazione plasmatica dell’immunosoppressore e della
creatininemia
Precauzioni di impiego
Controllo della funzionalità renale, e del dosaggio della concentrazione
plasmatica di immunosoppressore; aggiustamento della posologia.
Rifampicina
Effetto meno rilevante per fluconazolo
e non segnalato per miconazolo
Diminuzione della concentrazione plasmatica e dell’efficacia dei due antimicrobici per: induzione enzimatica ad opera della rifampicina; diminuzione dell’assorbimento intestinale da parte dell’antimicotico.
Precauzioni di impiego
Intervallare la somministrazione dei due antinfettivi. Aggiustare la posologia o intervallare l’assunzione di 12 ore.
Didanosina con itraconazolo
e ketoconazolo
Diminuzione dell’assorbimento a livello gastro-intestinale dell’itraconazolo a causa dell’aumento del pH
gastrico (presenza di un antiacido nella compressa di
didanosina)
Precauzioni di impiego
Somministrare il ketoconazolo o 2 ore prima o 6 ore dopo la didanosina.
Fenitoina con miconazolo e
fluconazolo
Inibizione del metabolismo epatico della fenitoina. con
aumento della concentrazione plasmatica e tossicità
Precauzioni di impiego
Controllo medico, dosaggio della concentrazione plasmatica della fenitoina e aggiustamento della posologia
Sulfaniluree con fluconazolo
e miconazolo
Aumento dell’emivita della sulfanilurea con possibile
insorgenza di crisi ipoglicemiche.
Precauzioni di impiego
Avvisare il paziente del rischio di ipoglicemia, della necessità di controllare la glicemia e di aggiustare la posologia della sulfanilurea
Rifabutina
Aumento della concentrazione plasmatica e tossicità
(uveite)
Precauzioni di impiego
Controllo medico
Teofillina e aminofillina
Diminuzione della clearance della teofillina con aumento della concentrazione plasmatica e rischio di sovradosaggio
Precauzioni di impiego
Controllo medico, adeguare la posologia della teofillina
Zidovudina
Aumento della concentrazione plasmatica e effetti indesiderati della zidovudina
Precauzioni di impiego
Controllo medico
Digossina
Riduzione della clearence e aumento della digossinemia con sintomi di intossicazione digitalica (nausea,
vomito, aritmia)
Precauzioni di impiego
Controllo medico, ECG e della digossinemia; aggiustamento della posologia della digossina durante il trattamento
Diidropiridine
Rischio aumentato di edemi per diminuzione del metabolismo epatico della diidropiridina
Precauzioni di impiego
Controllo medico ed eventuale aggiustamento della posologia della diidropiridina
Idrochinidina, chinidina
Diminuzione del metabolismo epatico dell’antiaritmico, e tossicità con acufeni e/o riduzione dell’udito
(cinconismo)
Precauzioni di impiego
Controllo della concentrazione plasmatica dell’antiaritmico ed eventuale
diminuzione della posologia.
Induttori enzimatici:
anticonvulsivanti: carbamazepina, fenobarbital, fenitoina, primidone
Aumento del metabolismo epatico e diminuzione della concentrazione plasmatica e dell’effetto dell’itraconazolo
Associazione sconsigliata per fenitoina
Utilizzare un altro antimicotico.
Precauzioni di impiego per gli altri farmaci
Controllo medico, aggiustamento della posologia.
Simvastatina
Riduzione del metabolismo dell’ipocolesterolemizzante con rischio di rabdomiolisi
Associazione sconsigliata
Interrompere il trattamento con la simvastatina per tutta la durata del
trattamento con l’itraconazolo.
Alcool
Effetto antabuse (sensazione di calore, rossore, vomito, tachicardia)
Associazione sconsigliata
Evitare il consumo di bevande alcoliche
Isoniazide
Riduzione della concentrazione plasmatica di ketoconazolo
Precauzioni di impiego
Intervallare di almeno 12 ore l’assunzione dei 2 antiinfettivi.
Topici gastrointestinali
Sali, ossidi e idrossidi di magnesio,
alluminio e calcio
Riduzione dell’assorbimento gastrointestinale del ketoconazolo per aumento del pH gastrico
Precauzioni di impiego
Somministrare i topici gastrointestinali a 2 ore di distanza dal ketoconazolo
FLUCONAZOLO
INTRACONAZOLO
KETOCONAZOLO
111
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
te da candida). L’esecuzione di sciacqui con una soluzione debolmente alcalina (bicarbonato o borato di sodio) è un trattamento coadiuvante in quanto riduce l’acidità orale che è un fattore facilitante la riproduzione
dei miceti
Il trattamento sistemico è indicato nei casi resistenti al
trattamento topico e utilizza quali farmaci di prima
scelta il ketoconazolo e il difluconazolo; quest’ultimo
presenta minori effetti collaterali.
Il trattamento profilattico continuativo è indicato
esclusivamente nei pazienti con immunodepressione
(AIDS, leucemie, neoplasie).
La eliminazione dei fattori predisponenti coadiuva la
risoluzione dei quadri acuti ed è fondamentale per
prevenire le frequenti recidive che si verificano dopo
la sospensione della terapia.
- Motivare il paziente a una corretta igiene orale spazzolando denti e mucose, disinfettando le protesi mobili
- Correggere o rieseguire le protesi mobili incongrue
- Identificare potenziali fattori predisponenti locali o
sistemici (xerostomia, somministrazione di steroidi o
antibiotici, anemia,, stati di immunodepressione).
Nelle figure comprese tra 3.2 e 3.9 sono riportati alcuni casi clinici.
3.2 Cheilite angolare
La cheilite angolare richiede un trattamento prolungato di almeno di 4 settimane con antimicotici topici
poiché l’angolo della bocca rappresenta una area intertriginosa particolarmente resistente alla terapia (figura
3.10).
Il miconazolo è provvisto anche di una efficace azione
antibatterica; comunque nelle forme resistenti alla terapia, dopo un mese, si deve passare a una terapia con antibiotici topici per la possibile coinfezione e/o sovrainfezione batterica da Staphilococcus aureus e epidermidis.
Le associazioni con corticosteroidi non sono in linea generale indicate; possono essere utilizzate solo per pochi
giorni, all’inizio della terapia, per ridurre una cospicua
componente infiammatoria eventualmente presente.
La eliminazione dei fattori predisponenti coadiuva la
risoluzione dei quadri acuti ed è fondamentale per
prevenire le frequenti recidive; in particolare sono importanti la correzione delle protesi con dimensione
verticale diminuita ed evitare l’abitudine di umettarsi
ripetutamente le labbra.
Tabella 3.1 - Terapia delle candidosi orali
Terapia topica
Pr: Nistatina o Amfotericina B sosp. Orale
S: Sciacquare 4 volte al giorno con 5-15 ml (un cucchiaio da tè o da minestra) tenendo in bocca per 2 minuti e poi deglutire; protrarre il trattamento per 10-14 giorni e comunque per almeno 2 giorni dopo la risoluzione delle manifestazioni cliniche.
Pr: Miconazolo gel orale
S: 4 applicazioni al giorno sulle lesioni o sulla superficie interna delle protesi (dopo ogni pasto e prima di coricarsi). Non
introdurre cibi o bevande nell’ora successiva. Il trattamento è prolungato per 1-2 settimane o almeno per 2 giorni dopo
la risoluzione delle lesioni
Terapia sistemica
Pr: Fluconazolo cps. 100 mg
S: 2 capsule il primo giorno in una unica somministrazione, in seguito 1 capsula al giorno per 7-14 giorni
Pr: Ketoconazolo cpr. 200 mg
S: 2 compresse al giorno per 7-14 giorni durante i pasti
Pr: Itroconazolo cps. 100 mg
S: 1-2 capsule al giorno per 7-14 giorni
Pr: Miconazolo compresse 250 mg
S: Sciogliere in bocca 1 compressa, 3 volte al giorno per 7-14 giorni
Prevenzione a lungo termine delle recidive
Pr: Fluconazolo cps. 150 mg
S: 1 capsula 1 volta alla settimana.
Figura 3.6, 3.7 - Candidosi eritematosa
La candidosi eritematosa può esprimersi con macchie
eritematose puntiformi, con chiazze o con eritema diffuso della mucosa orale.
Figura 3.2, 3.3, 3.4, 3.5 - Candidosi
pseudomembranosa
La candidosi pseudomembranosa di presenta con placche biancastre (simili a ricotta) composte da ammassi
di ife fungine, spore e cellule desquamate.
Lo sfregamento con garza evidenzia una base eritematosa.
Figura 3.8, 3.9 - Candidosi atrofica della lingua
La glossite è caratterizzata dalla perdita delle papille linguali con comparsa di un’area eritematosa. Si distinguono varianti a superficie piatta e superficie rilevata (lobulato o multinodulare). Tutta la superficie dorsale della lingua può
presentare atrofia ed eritema o in forma localizzata (glossite losangica mediana).
Tabella 3.12 - Terapia delle cheiliti angolari
Pr: Miconazolo gel orale
S: Applicare sugli angoli della bocca 4 volte al giorno per un periodo di 4-6 settimane; quindi 1-2 volte al giorno
per 1-2 mesi
Pr: Pomata antibiotica (acido fusidico, mupirocina, gentamicina)
S: Applicare sugli angoli della bocca 4 volte al giorno, per 2-3 settimane.
Pr: Associazioni di antibiotici, antimicotici e steroidi (Triamcinolone+Neomicina+Gramicidina+Nistatina crema, ung.)
S: Applicare sugli angoli della bocca 4 volte al giorno per 4-5 giorni, poi passare al solo antimicotico
3.3 Stomatite da protesi
mobile
Figura 3.10 - Cheilite angolare
La cheilite angolare può presentarsi con eritema e fissurazione delle commisure labiali sino alla formazione di
vere e proprie ragadi; in qualche caso è visibile una pseudomembrana micotica asportabile con lo sfregamento.
Prima di istituire una terapia con antimicotici si deve
attuare l’eliminazione dei fattori predisponenti la candidosi; il trattamento aspecifico, come unica misura terapeutica, può essere sufficiente a garantire la guarigione e prevenire le recidive:
- migliorare l’igiene orale consigliando di togliere la
protesi di notte e di spazzolare la mucosa e la protesi
- eseguire sciacqui alcalinizzanti con bicarbonato di
sodio; l’acidità orale favorisce la candidosi e le soluzione debolmente alcalina per ridurre l’acidità orale
fattore facilitante la riproduzione dei miceti)
- controllare la dieta (un aumentato apporto di zuccheri favorisce la candidosi)
- disinfettare le protesi con soluzioni antisettiche o
prodotti specifici; la disinfezione delle protesi è necessaria in quanto le porosità della resina funzionano
come un serbatoio di microrganismi e veicolo di
reinfezione
- riadattare o rieseguire le protesi larghe che facilitano
il ristagno di detriti o con schema occlusale sbilanciato che traumatizza la mucosa
114
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Il trattamento antimicotico topico deve essere prolungata per 4 settimane poiché le superfici di supporto
della base protesica sono aree intretriginose soggette a
scarsa autodetersione e macerazione nelle quali si può
verificare una resistenza alla terapia (tabelle 3.11, 3.12
e 3.13).
Gli sciacqui con antimicotici topici sono ampiamente
utilizzati; comunque l’applicazione di antimicotici in
gel all’interno della protesi costituisce medicazione occlusiva o a sandwich che assicura un prolungato contatto del farmaco con la mucosa. Applicando le precedenti misure terapeutiche il ricorso alla terapia con antimicotici per via sistemica (derivati degli azoli) è infrequente; se applicato va protratto per 7-14 giorni.
Tabella 3.11 - Terapia della stomatite da protesi mobile
Disinfezione della protesi
Pr: Clorexidina 0,2% o cloroderivati 0,1-0,5% (1000-5000 ppm di Cl disponibile)
S: Togliere la protesi di notte. Spazzolare quotidianamente la mucosa orale e la protesi. Immergere la protesi nella soluzione antisettica per 15 minuti due volte alla settimana (o quotidianamente) e risciacquare.
Terapia antimicotica
Pr: Bicarbonato o borato di sodio
S: 3-4 sciacqui al giorno
Pr: Nistatina o amfotericina B sospensione orale
S: Sciacquare 3-6 volte al giorno con 5-10 ml tenendo in bocca per 2 minuti e poi ingoiare; protrarre il trattamento per
10-14 giorni e comunque per almeno 2 giorni dopo la risoluzione delle manifestazioni cliniche.
Pr: Miconazolo gel orale
S: 3-5 applicazioni al dì sulle lesioni cutanee e mucose (dopo ogni pasto e prima di coricarsi). Non introdurre cibi o bevande
nell’ora successiva. Il trattamento è prolungato per 1-2 settimane o almeno per 2 giorni dopo la risoluzione delle lesioni.
Figura 3.12, 3.13 - Stomatite da protesi
La stomatite da protesi è confinata alla mucosa mascellare di pazienti portatori di protesi mobili, delle quali
riproduce il disegno. Può presentarsi in forma eritematosa con piccole zone di iperemia puntiformi, eritema
diffuso o superficie nodulare.
Figura 3.14 - IFE di Candida Abbicaus isolate da protesi
mobile
PARTE C
CHEMIOTERAPIA
ANTIVIRALE
Movimento
Non mi piace stare
seduto ad aspettare
un’idea o soppesare
se convenga faticare
Preferisco stare a esaminare
variabili non per vedere
se si possono utilizzare
ma per il piacere di sapere
Mi attirano pensieri nuovi
per adattarvi fatti selettivi
e dare scientifica dignità
a una immaginaria realtà.
Mi sento crescere
nell’espandere le possibilità
e nel contraddire il comune sapere
come fosse una falsa verità
La conoscenza è solitudine
nevrosi nell’inconscio
che comprende l’accaduto
e quanto sarà in futuro avvenuto.
Vi è un’ignoranza prescolare
che precede la cultura abbecedaria
e una ignoranza dottorale
che si ripropone alla laurea secondaria
Misero chi per autorità non usa l’ingegno
chi con i dati esercita solo la memoria
chi s’aggrappa alla pratica o alla storia
per cercare la forza assente in sé medesimo
Il ricercatore diviene un tecnico
privo del linguaggio metaforico
lo specialista un impiegato
nella fantasia sterilizzato
Le percezioni della maturità
sono conoscenze prive di stabilità
metafore poetiche in tensione
in uno stato di fibrillante trasformazione
Una entusiastica e vivida cultura
che prova meraviglia e sorpresa
che risiede in doppia camera
tra scienza e fantasia divisa
Una profonda umana cultura
che conosce fatto e soluzione
che modifica metodo struttura
direzione con entusiastica intuizione
Sogno perduto
Come al risveglio da un sogno
cerco e non trovo
quanto avevo ricevuto
che ancora intravedo
nelle molte cose o nell’unica cosa
che si ripete molte volte
nei miei atti quotidiani
per indecifrabile legge o volubile caso
Ho perso una parola infinita
o un verso di parole abituali
che contenevano intere e minuziose
l’immenso universo.
Destino accettato e incompreso
con rassegnata e coraggiosa ignoranza
troppo complesso per essere inteso
da un uomo semplice e ottuso
I virus sono caratterizzati da un meccanismo di replicazione intracellulare e l’utilizzazione dei farmaci antivirali può danneggiare anche le cellule umane che ospitano i virioni
Tale situazione ha condizionato la ricerca farmacologica, visto che è difficile ottenere un chemioterapico con
un coefficiente terapeutico sicuro e una tossicità selettiva, tenendo conto degli intimi rapporti che legano il virus alla cellula umana.
La chemioterapia antivirale, a seguito della comparsa
dell’HIV e delle conseguenti ricerche, ha fatto notevoli
progressi nell’ultimo decennio, ma è ancora arretrata
(tabella 1.1, 1.2) offrendo un numero di farmaci disponibili minore rispetto alla chemioterapia antimicotica e antibatterica.
O
N
HN
acidovir
H 2N
N
N
HO
1. FAMIGLIE DI ANTIVIRALI
I farmaci antivirali possono essere distinti in due gruppi in base allo spettro d’azione: a spettro allargato e a
spettro ristretto.
Questi ultimi comprendono l’aciclovir e la iododeossiuridina utilizzati in odontoiatria, dove l’interesse è limitato ad alcuni ceppi di herpesvirus (HSV1 e 2,
HZV).
L’aciclovir è il miglior farmaco antivirale attualmente
in uso clinico, dotato di elevato coefficiente terapeutico, di selettività di azione e di spettro specifico per il
trattamento delle infezioni da herpetoviridae.
Il farmaco è un nucleoside aciclico derivato dalla guanosina, che agisce in modo selettivo in quanto viene attivato solo mediante intervento della timidinachinasi
virale. Inibisce specificamente la DNA polimerasi virale (non quella dell’ospite) e viene incorporato nel DNA
con precoce interruzione della catena del DNA virale.
Per quanto riguarda la farmacocinetica il farmaco; si assorbe per via orale nella misura del 20%; viene escreto
dal rene (65%) in forma immodificata.
Nella insufficienza renale l’aumento dell’emivita pla-
O
O
HSV-TK
O
acidovir
N
HN
H 2N
acidovir
monofosfato
H 2N
P
N
HN
N
N
O
N
N
HO
O
O
HSV-TK
O
GMP chinasi
O
N
HN
acidovir
monofosfato
N
HN
acidovir
difosfato
H 2N
P
P
P
N
N
O
H 2N
N
N
O
O
O
GMP chinasi
O
enzimi cellulari
O
N
HN
N
HN
acidovir
difosfato
acidovir
trifosfato
H 2N
P
P
P
N
N
O
H 2N
P
P
N
N
O
O
O
O
Tabella 1.1 - Formula di struttura dell’aciclovir e
trasformazione enzimatica nelle sue forme attive mono-,
di- e trifosfato
enzimi cellulari
Tabella 1.2 - Meccanismo di azione dell’aciclovir
mediante interruzione del DNA virale quando viene
incorporato come sostituto di analogo della guanosina
118
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
smatica richiede un adeguamento posologico; mentre è
rimosso rapidamente con la dialisi.
La sua somministrazione per via sistemica può causare
aumento degli enzimi epatici, eruzioni cutanee e deve
essere utilizzato con cautela in gravidanza e nell’insufficienza renale.
L’acyclovir viene utilizzato nel trattamento di infezioni
erpetiche per uso topico (4-6 volte al giorno) e per via
orale (1 g/die in 5 somministrazioni); la somministrazione parenterale non è utilizzata in odontoiatria.
Il famciclovir (profarmaco del penciclovir) e il valaciclovir (profarmaco dell’aciclovir) sono utilizzati nelle
infezioni da herpes virus, senza particolari vantaggi sul
farmaco capostipite.
La idoxiuridina è un analogo strutturale della timidina
che viene incorporata al suo posto nel DNA virale che
non può estrinsecare le sue funzioni biologiche.
È utilizzata solo per uso topico nelle infezioni da herpetoviridae.
2. RAZIONALE DI TERAPIA
DELLE VIROSI
2.1 Gengivostomatite
erpetica
La patologia si presenta in bambini al loro primo contatto con l’HSV, è autolimitante tendendo a guarigione
spontanea in 7-10 giorni e, per questo motivo, è generalmente sufficiente un trattamento sintomatico.
Per alleviare la sintomatologia generale (febbre, malessere) si consiglia riposo e la somministrazione di farmaci analgesici e antitipiretici sistemici ad azione lieve o
moderata (paracetamolo, acido acetilsalicilico o altri
farmaci antinfiammatori non steroidei).
Non è, invece, indicata la prescrizione di antibiotici in
quanto inutili nelle infezioni virali.
La sintomatologia orale dolorosa, causata dalle vescicole e dalle erosioni, può essere trattata attraverso la somministrazione di analgesici topici (antistaminici; analgesici; anestetici; citoprotettori o antiacidi).
I citoprotettori e gli antiacidi esercitano effetto antalgico depositando un film che ricopre l’erosione mucosa,
proteggendola da stimoli in grado di scatenare una sensazione dolorosa; gli antistaminici esercitano un effetto
antalgico diretto.
La sintomatologia dolorosa nei bambini può generare
un rifiuto del cibo per cui può essere necessario supportare l’introito calorico e liquido: consigliando una
dieta liquida o semiliquida ipercalorica; evitando cibi
consistenti che possano scatenare dolore da contatto;
somministrando integratori alimentari (liquidi, proteine, vitamine, minerali - tabella 2.1).
2.2 Herpes Simplex labiale
e intraorale
La maggior parte dei casi presenta sintomatologia modesta e tende a guarigione spontanea in 14-21 giorni e
non richiede, pertanto, nessuna terapia.
I pazienti devono essere avvertirti di non toccare con le
mani le lesioni per il rischio autoinoculare l’infezione
estendendola localmente o in altre zone (patereccio ereptico; cheratocongiuntivite erpetica; infezioni genitali).
Alcuni trattamenti aspecifici dimostrano una certa efficacia terapeutica (tabella 2.2):
- Le pomate emollienti neutre presentano un basso costo e un favorevole effetto terapeutico nell’herpes labialis: nella fase acuta coprono la lesione e riducono
la possibilità di autoinoculazione locale e a distanza
dell’infezione; nel periodo di guarigione sono utili
nel prevenire la rottura delle croste sulle labbra con
conseguente un ritardo di guarigione o formazione
di ragadi labiali.
- L’applicazione locale e intermittente di impacchi di
ghiaccio o alcol sulla zona eritematosa e dolente può
abortire lo sviluppo delle lesioni; devono essere applicate nella fase prodromica cioè elle prime 24-48 ore.
Tabella 2.1 - Terapia della gengivostomatite erpetica
Pr: Difenidramina sciroppo (o Prometazina)+ Sucralfato (o Idrossido di magnesio e alluminio) sospensione
S: Miscelare in parti uguali le due sospensioni in un’unica soluzione. Sciacquare per due minuti ogni due ore e prima di
ogni pasto utilizzando la quantità corrispondente a un cucchiaio da té (5ml) o un cucchiaio da minestra (10ml); espettorare senza deglutire
Pr: Analgesici collut. (flurbiprofene, ketoprofene sale di lisina, benzidamina)
S: 3-4 sciacqui al giorno in base alla sintomatologia. Espettorare senza deglutire
Pr: Integratori alimentari ipercalorici
S: Preparare come indicato nelle istruzioni; somministare 3-5 dosi al giorno servendo freddo.
119
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Nel caso si decida di prescrivere una terapia, questa deve
essere iniziata nella fase prodromica (tensione, eritema e
bruciore nelle prime 24-48 ore) sortisce l’effetto di ridurre l’entità dei sintomi e la durata della malattia (10-14
giorni). Nelle lesioni labiali da virus dell’Herpes Simplex
(HSV1 e 2) che tendono a estendersi, una pomata dermatologica a base di idoxuridina o di aciclovir applicata
nella fase prevescicolare (prime 72 ore) più volte al giorno può dimostrata una certa efficacia nel ridurre la durata ed estensione della patologia. Nei casi lievi che non
tendono alla diffusione, la terapia è superflua e il meccanismo di azione è sovrapponibile all’effetto di pomate
neutre e consiste principalmente nel coprire la lesione impedendone la diffusione per contatto alle aree contigue.
La terapia con pomata topica antibiotica ad uso dermatologico è indicata nei casi con sovrainfezione delle
lesioni labiali (impetiginizzazione).
Le stomatiti erpetiche (HSV 1 e 2) possono beneficiare
di un trattamento aspecifico a base di collutori antisettici per prevenire la sovrainfezione batterica delle ulcerazioni e analgesica topica; possono essere associati sciacqui eseguiti mediante sospensione orale di aciclovir nei
casi con sintomatologia particolarmente invalidante.
Richiedono un trattamento per via sistemica solo le
forme di infezione da HSV resistenti alla terapia topica, di particolare estensione ed evoluzione (che possono associarsi a immunodepressione primaria o secondaria) che sono trattate con un dosaggio di 200 mg x
5/die per 5 giorni eventualmente prolungabili in relazione alla risposta clinica.
Un trattamento profilattico con aciclovir trova indicazione nei pazienti affetti da recidive frequenti che possono essere scatenate a seguito di esposizione solare e da
trauma conseguente a seduta odontoiatrica:
- L’utilizzazione profilattica di creme solari per le labbra previene le recidive di herpes labialis causate da
esposizione solare
- La somministrazione sistemica di aciclovir per brevi
cicli trova indicazione anche nella prevenzione di recidive nei pazienti che riferiscono frequenti recidive
conseguenti al trauma locale causato da terapie
odontoiatriche.
Nelle fotografie comprese tra 2.3 e 2.7 sono riportati
alcuni casi clinici.
Tabella 2.2 - Terapia dell’herpes simplex labiale e intraorale
Terapia aspecifica
Pr: Impacchi di ghiaccio
S: 3-4 cicli di 5 minuti intervallati da 15 minuti esguiti una sola volta alla comparsa dei primi sintomi (senso di tensione e di bruciore).
Pr: Soluzione al 50% di etere e alcol
S: 3-4 impacchi al giorno sulla zona interessata alla comparsa dei primi sintomi.
Pr: Pomata emolliente (vaselina, burrocacao, ecc.)
S: Applicare sul labbro 6 volte al dì cominciando all’inizio dei sintomi e protraendo sino a guarigione avvenuta.
Terapia topica
Pr: Aciclovir 5% o idossuridina crema derm.
S: Applicare sul labbro 4 volte al giorno cominciando all’inizio dei sintomi e protraendo sino a guarigione avvenuta.
Pr: Pomata antibiotica (tetraciclina, gentamicina, acido fusidico)
S: Applicare sul labbro 4 volte al dì sino a risoluzione della lesione infettata da batteri
Terapia sistemica
Pr: Aciclovir compresse 200mg
S: 1 compressa 5 volte al giorno (1gr/die), ogni 5 ore omettendo la dose notturna, per 5 giorni prolungabili sino a risoluzione delle lesioni (in alternativa 2 compresse 3 volte al giorno)
Pr: Aciclovir sciroppo 8%
S: Sciacquare 4-6 volte al giorno con 2,5 ml di sospensione e deglutire; evitare cibo e bevande nell’ora successiva; prolungare la terapia sino a guarigione
Profilassi
Pr: Crema solare con elevato fattore di protezione 15 o total block
S: Applicare sul labbro 1 ora prima della esposizione e ogni ora successiva
Pr: Aciclovir compresse 800 mg
S: 1cp due volte al dì il giorno precedente l’appuntamento dal dentista; poi 1 cp/die per i 7 giorni successivi
Pr: Aciclovir compresse da 800 mg
S: 1 compressa al giorno in modo continuativo (nei pazienti immunodepressi)
120
Figura 2.3, 2.4 - Herpes simplex intraorale
Il quadro clinico si presenta con numerose vescicole
disposte sulla gengiva cheratinizzate e/o sul patato
duro; la rottura esita in lesioni singole con aspetto di
ampie aree policicliche formate dalla confluenza di
più lesioni.
Figura 2.5, 2.6 - Herpes simplex labiale
L’evoluzione è costituita da una fase prodromica con
edema e eritema; seguita dalla comparsa di vescicole a
gruppi a livello del bordo vermiglio del labbro; la cui
rottura esita in erosioni coperte da croste, in taluni casi
con sovrainfezione batterica (impetigine)
Figura 2.7 - Impetigine bollosa stafilococcica in bimba di
5 anni (diagnosi differenziale)
121
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
2.3 Herpes Zoster
La terapia eziologica consiste nella somministrazione sistemica di alte dosi di aciclovir per via orale o parenterale.
L’aciclovir per via sistemica (800 mg x 5/die o 5-10
mg/Kg ev ogni otto ore) rappresenta il farmaco di prima scelta per la terapia delle infezioni da HZV.
Il farmaco è disponibile in diverse formulazioni terapeutiche: Compresse 200 mg, compresse 800 mg, sospensione orale 8%, fiale ev. (tabella 2.8).
In presenza di resistenza all’aciclovir trova indicazione
la somministrazione di foscarnet ev, farmaco di uso
ospedaliero.
Il dolore richiede una terapia di supporto con antidolorifici sistemici per dolore moderato-severo.
La terapia ad alto dosaggio e breve durata con corticosteriodi (60-80 mg/die di prednisone o 20-30 mg prednisolone/die) riduce l’incidenza della nevralgia posterpetica che rappresenta una complicanza frequente nei
pazienti con età oltre i 60 anni.
In presenza di interessamento della branca oftamica è
necessaria la consulenza oculistica urgente per il rischio
di lesioni permanenti
Una ulteriore indicazione alle pomate dermatologiche
a base di acyclovir è data dal trattamento topico delle
lesioni da Herpes Zoster in supporto al trattamento sistemico.
Le pomate antibiotiche ad uso dermatologico sono utili
per prevenire o curare l’impetiginizzazione delle lesioni.
Il trattamento delle lesioni cutanee con immunomodulatori topici sembra ridurre la durata della malattia ma
non risulta di frequente utilizzazione a causa dello sfavorevole rapporto costo economico- beneficio terapeutico.
Nei pazienti immunodepressi i quadri clinici hanno la
caratteristica comune di potersi presentare in forme recidivanti, con tendenza all’estensione (multidermatomeriche) e persistenti; in questi casi si deve considerare
l’opportunità di istituire una profilassi a lungo termine.
La casistica clinica è riportata nelle figure comprese tra
2.9 e 2.14.
Tabella 2.8 - Terapia dell’herpes zoster
Terapia acuta
Pr: Aciclovir cpr. 800 mg (aciclovir scir. 8%)
S: 1compressa (10 ml di sciroppo) 5 volte al giorno per 7-10 giorni
Pr: Aciclovir f ev
S: 10-12 mg/kg ev ogni 8 ore per 7-10 giorni
Pr: Foscarnet fiale
S: 40 mg/kg/die per via parenterale per 7-10 giorni salvo necessità di prolungamento
Profilassi delle recidive
Pr: Aciclovir compresse da 800 mg
S: 1 cp/die in modo continuativo per la profilassi delle recidive in pazienti immunodepressi
Profilassi della nevralgia posterpetica
Pr: Prednisone compresse 25 mg
S: 3 compresse 3 volte al giorno per 3 giorni; metà dose per tre giorni; metà dose per altri 3 giorni, infine sospendere
Pr: Prednisone compresse da 25 mg
S: 3 compresse al giorno per 2 settimane
122
Figura 2.9, 2.10, 2.11, 2.12, 2.13, 2.14 - Herpes zoster
Il quadro clinico è caratterizzato dalla presenza di dolore intenso e dalla comparsa di vescicole distribuite lungo il dermatomero (il nervo mandibolare nel caso riportato) senza oltrepassare la linea mediana. Le iniziali
lesioni eritemato-vescicolose, con la comparsa di più
gettate, assumono un aspetto “a cielo stellato” con aree
in diverse fasi di evoluzione (aree eritematose, vescicole, erosioni, pustole e croste).
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
PARTE D
ANTISETTICI
Melanconia
A volte ci ritroviamo in compagnia
in due, io insieme alla mia melanconia.
Il petto pien di tristezza qual brace
in nessun luogo riesce a trovar pace.
Scuri i miei pensieri scorrono vuoti
attorno alle stesse cose attoniti.
Vede il mondo com’è la melanconia
sensazione di bellezza che va via
di gioventù e di vita che si muore
in un disperato desio d’amore.
La mia melanconia è l’amato vizio
con cui la mia vita ha un sodalizio
senso immotivato d’infelicità
d’essere tristi dolce felicità.
E’ la sua eccessiva greve presenza
così patologica come assenza
perché senza un poca di melanconia
non esisterebbe neppur la poesia.
Dormire
Anelo a un fondo sonno
la mia stanchezza aprire
scordar le pene e il suono
riposarmi e dormire.
Un tempo in un ambiente
stavo viso all’entrata
per vedere la gente
oggi spalle alla porta
per non vedere niente.
Un tempo al telefono
accorrevo curioso
oggi ne ascolto il suono
a novità scontroso
Il mio cuore selvaggio
persa l’infantil pace
il giovanil coraggio
muta in pena che tace.
La pace mi strabilia
del meschino stimato
e l’orgoglio mi esilia
da un mondo falsato
Finito un giorno lottato
schivo ai lunghi sentieri
cammino impolverato
perso in grigi pensieri.
Anelo a un fondo sonno
la mia stanchezza aprire
scordar le pene e il suono
e annullarmi e finire.
Con il termine antisettico si definisce qualsiasi sostanza in grado di distruggere o di inibire la moltiplicazione dei germi, quando applicata su tessuti vitali; sono in
pratica antinfettivi per uso esterno che devono essere in
grado di agire in presenza di materiale organico (sangue, pus) senza danneggiare i tessuti e senza essere assorbiti nel circolo sistemico.
Sono raggruppabili in una dozzina di famiglie chimiche che si differenziano per lo spettro di attività e la tollerabilità (tabella 1)
Lo spettro di attività varia da un preparato all’altro e
comprende i batteri Gram- e Gram+, i miceti e i virus,
in modo non selettivo colpendo anche la flora residente; contrariamente a quanto avviene con gli antibiotici
che interferiscono selettivamente con il metabolismo di
alcuni batteri in base allo specifico spettro d’azione.
La comparsa di resistenza per modificazione della permeabilità batterica non è significativa per gli antisettici.
L’azione è rapida e si manifesta con un effetto letale o
un’inibizione temporanea della crescita dei microrganismi, associata a un effetto di persistenza che permette
di limitarne il numero per alcune ore (tabella 2).
Alle concentrazioni consigliate sono privi di effetti collaterali sistemici.
Le indicazioni d’uso degli antisettici sono molteplici:
- la terapia delle gengiviti, stomatiti e parodontopatie
di origine batterica
- la prevenzione della sovrainfezione batterica di patologie vescicolose e ulcerative (autoimmunitarie, allergiche, virali, traumatiche)
- l’antisepsi del cavo orale prima e dopo interventi di
chirurgia orale
- disinfezione di strumenti chirurgici
- disinfezione della mucosa delle mani dell’odontoiatra
- irrigazioni di aree infette (cavità ascessuali, canali radicolari).
La clorexidina è una sostanza largamente utilizzata che
agisce sui microrganismi legandosi alla membrana cellulare, modificandone la permeabilità e causando la
morte nel microrganismo a seguito delle alterazioni
delle concentrazioni dei costituenti plasmatici.
La molecola è cationica e ha un elevata affinità per i
componenti del cavo orale, legandosi all’idrosiapatite
dello smalto, alle proteine acide salivari, alla parete cellulare dei batteri e alla mucosa orale.
Per questo motivo il 30% del principio attivo viene ritenuto da questi tessuti e rilasciato lentamente prolungandone l’attività dopo l’applicazione.
L’uso può provocare una colorazione brunastra delle
superfici dentali, protesiche e della lingua che tende a
regredire dopo la sospensione della terapia con la normale igiene; rare, invece, risultano le manifestazioni allergiche e le tumefazioni parotidee a insorgenza acuta
segnalate in letteratura.
Il prodotto è disponibile in forma di collutorio allo
0,12% e allo 0,20%, in gel all’1% e in forma associata
con fluoruri.
I fenoli denaturano le proteine della parete cellulare batterica con conseguente alterazione del citoplasma. Il triclosan è un collutorio antiplacca che rientra anche nella
composizione di diverse paste dentifricie. Allo stesso
gruppo appartengono alcuni alcoli molto utilizzati in
endodonzia come l’acetato di metacetrile (cresatina), il
timolo, l’eugenolo e il clorofenolo-canfora-mentolo.
L’esetidina è un’amina terziaria che agisce con un meccanismo competitivo con la tiamina, substrato necessario alla crescita batterica; è dotata anche di efficacia antinfiammatoria topica.
I sali di ammonio quaternario sono dotati di azione
detergente e disinfettante e agiscono legandosi alla parete cellulare e alterandone la permebilità; la loro azione è più evidente sui batteri Gram+; il tiobenzonio cloruro è la sostanza più comunemente utilizzata ed è disponibile in pastiglie, collutorio e spray.
L’alcol diclorobenzilico è utilizzato come in diversi preparati farmaceutici in associazione ad altri principi attivi.
Gli alogeni comprendono il cloro e lo iodio e i loro derivati (ipocloriti, iodiopovidone, ecc). Lo iodoformio a
contatto con i tessuti infiammati libera iodio e svolge
azione antisettica; è utilizzato in terapia endodontica e
in chirugia orale in forma di garza e pasta iodoformica.
I perossidi e i perborati agiscono sia liberando ossigeno
che ossida i microrganismi sia attraverso l’azione antifermentativa e alcalinizzante.
La sanguinarina è un alcaloide estratto dalla pianta
Sanguinaria Canadensis, appartenente alla famiglia
delle papaveracee; agisce inibendo l’adesività batterica
alle superfici organiche ed è utilizzato in collutori per la
prevenzione delle carie.
Tabella 1 - Principali antisettici utilizzati in odontoiatria
Biguanidi
Clorexidina
Fenoli
Triclosan
Amine terziarie
Esetidina
Perossidi, perborati, borati
Borato di sodio
Perborato di sodio
Sali di ammonio quaternario
Benzalconio cloruro
Benzetonio cloruro
Benzoxonio cloruro
Cetilpiridinio cloruro
Tibenzonio cloruro
Alogeni
Iodio
Estratti vegetali
Sanguinarina
126
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tabella 2 - Principali caratteristiche degli antisettici*
PRINCIPALI CARATTERISTICHE DEGLI ANTISETTICI
Famiglia
Prodotti
Batteri
Spettro d’azione
Spore
Miceti
Virus
Assorbimento
cutaneo
molto modesto
Tossicità
Biguanidine
- clorexidina
1
0
Candida
allergia cutanea, irritazione
Carbaniline
- tridiocarban
2
0
Tricophyton
0
0
metaemoglobinemia
se riscaldato
Ammoni
quaternari
(tensioattivi)
- cloruro di
benzalconio
- bromuro di cetexonio
1
0
1
1
0
allergia cutanea
Ossidanti
alogenati o non
- derivati clorati
- derivati iodati
- perossidi
(acqua ossigenata,
permanganato di K)
1
1
1
1
modesto
Alcoli
- alcol etilico 70%
1
0
1
1
modesto
–
Derivati
metallici
- derivati
organo-mercuriali
- sali d’argento
- sali di rame e zinco
2
0
2
0
+
sindrome acrodinica,
incompatibile con lo iodio
allergia cutanea
allergia cutanea
Coloranti
- blu di metilene
- eosina
- verde + violetto
di metile
2 (alcuni)
0
0
0
0
–
–
Derivati
aminici
- esamidina
- esetidina
2
0
Candida
2
–
irritazione
allergia cutanea, irritazione
allergia cutanea
1: attività letale; 2: attività inibitrice.
* da Scaglione
Figura 3, 4 - Stomatite allergica
Il paziente dopo l’assunzione di un collutorio antisettico
lamentò l’insorgenza di: eritema ed edema della mucosa
orale; formazioni di vescicole sulla superficie interna del
labbro superiore; erosioni della mucosa della superficie
dorsale della lingua con atrofia delle papille filiformi.
PARTE E
FARMACI ANTINFIAMMATORI
NON STEROIDEI
Calore di un bacio
Mi pare ieri che seguivo
i tuoi primi incerti passi
per rialzare il mesto pianto
con teneri umidi baci
e freme ancora il ricordo
Ora non per te ma per me
forte senso della vita
ti seguo ancora come ieri
anche se ora si sottrae
il tuo pudore ai miei baci
Nel tuo sicuro crescere
scorgo i miei incerti passi
strada che non può essere
insegnata o consolata
Vieni vicino e dammi un bacio
In tinello
In vicina intesa senza parole
sfogli stesa sul divano il tuo libro
Dallo scrittoio ti leggo l’emozione
di uno scritto ancora non finito
Calmo tepore in tinello
mentre il freddo fuori piove
in attesa senza tempo
che vorrei fosse infinita
dei figli riuniti a cena
Appartengono a questa classe di farmaci sostanze che, pur
avendo strutture chimiche diverse, sono dotate di azione
antiflogistica, analgesica e, spesso, antipiretica; in base a
un comune meccanismo di azione che consiste nella inibizione dell’enzima cicloossigenasi e nella riduzione della
sintesi delle prostaglandine proinfiammatorie.
È lecito porsi la domanda se i nuovi FANS siano veramente superiori ai capostipiti (acido acetilsalicilico, indometacina, fenilbutazone) e gli studi disponibili indicano che le nuove molecole in molti casi non possiedono una efficacia terapeutica superiore alle vecchie, ma
sono meglio tollerate rispetto alle precedenti.
relazione alla struttura chimica, anche se spesso esiste
una scarsa correlazione tra l’attività terapeutica di molecole analoghe.
La tabella 1 non comprende alcuni analgesici di frequente utilizzo in odontoiatria: gli analgesici oppioidi
(codeina) e para-aminofenolderivati (paracetamolo o
acetaminofene); in quanto sono classificate come antalgici e antipiretici con ridotto effetto antinfiammatorio,
in relazione all’azione esclusiva a livello del sistema nervoso centrale.
2. MECCANISMO DI AZIONE
1. CLASSIFICAZIONE
La classificazione comunemente utilizzata distingue i
FANS classici o molecole capostipite (acido acetilsalicilico, fenilbutazone, indometacina) dai nuovi FANS che
rappresentano un gruppo in continua crescita.
Un secondo tipo di classificazione può essere fatto in
Il meccanismo principale dell’azione antiflogistica di
tutti i FANS è costituito dalle inibizioni delle biosintesi delle prostaglandine mediante il blocco dell’enzima
ciclossigenasi nel sito di lesione.
Le cellule danneggiate da insulti chimici, meccanici o
microbiologici, innescano un fenomeno conosciuto
con il nome di cascata dell’acido arachidonico che, at-
Tabella 1 - Principali FANS usati in odontostomatologia
Salicilati
Acido acetilsalicilico
Salicilato di lisina
Diflunisal
Acidi fenilpropionici
Flurbiprofene*
Ibuprofene
Ketoprofene
Ketoprofene sale di lisina*
Naproxene
Acido tiaprofenico
Acidi fenamici
Acido niflumico
Acido meclofenamico
Oxicam
Piroxicam
Tenoxicam
Pirazolici
Metamizolo sodico
Propifenazone (associazioni)
Acidi acetici eterociclici
Indometacina
Etodolac
Ketorolac
Acidi fenilacetici
Diclofenac*
Altre molecole
Benzidamina*
Nimesulide
Inibitori selettivi delle COX 2
Rofecoxib
Celecoxib
*Queste molecole sono disponibili anche in forma di collutorio
130
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
traverso la produzione delle prostaglandine, origina il
processo infiammatorio (tabella 2).
Questo importante fenomeno di difesa produce una serie di eventi che provocano il dolore e favoriscono la
guarigione (vasodilatazione, chemiotassi, accelerazione
del metabolismo cellulare).
La risposta infiammatoria può autoalimentarsi attraverso diverse modalità:
- durante il processo di conversione dell’acido arachidonico nei suoi prodotti terminali, si generano radicali liberi, sostanze reattive, capaci potenzialmente di
provocare un danno tessutale esteso
- le membrane cellulari danneggiate rilasciano ulteriori quantità di acido arachidonico, determinando un
circolo vizioso che sostiene infiammazione e dolore.
Le prostaglandine da sole sarebbero dei mediatori algogeni poco importanti, ma in grado di produrre sensibilizzazione delle terminazioni nervose nocicettive ai diversi mediatori (bradichinina, istamina, acetilcolina,
serotonina, adenosintrifosfato).
Le prostaglandine si suddividono in diverse classi: le
più potenti nell’evocare direttamente il dolore e la flogosi sono le PGE2 (proinfiammatorie); mentre le
PGE1 riconoscono prevalentemente funzioni di regolazione fisiologica in quanto vasodilatanti e citoprotettive (gastroprotezione, aggregazione piastrinica, funzione renale).
La differenza di attività e l’incidenza di effetti collaterali riflettono la selettività nella inibizione dei diversi tipi
di ciclossigenasi dei vari FANS (tabella 3):
- la COX1 che porta alla formazione delle PGE1; la
cui inibizione è ritenuta prevalentemente responsabile degli effetti indesiderati dei FANS
- la COX2 che presiede alla sintesi delle PGE2, alla cui
inibizione è ricollegabile l’azione antalgica e antiflogistica.
L’aspirina è un inibitore non selettivo delle COX, gravata quindi da maggiori effetti collaterali; l’ibuprofene
e il ketoprofene sale di lisina presentano un minore effetto sulla COX1 e maggiore nella COX 2 e sono caratterizzate da una maggiore tollerabilità.
È stato osservato che esiste una dissociazione tra l’effetto antinocicettivo e antinfiammatorio dei FANS: l’effetto antalgico compare per dosaggi inferiori di quelli
necessari per ridurre la flogosi; inoltre per alcuni farmaci, l’effetto analgesico compare nella prima ora dalla
somministrazione, mentre il picco delle loro concentrazioni plasmatiche viene raggiunto dopo 4-5 ore.
Ketoprofene sale di lisina è il FANS che possiede il più
rapido assorbimento: dopo 5 minuti dalla somministrazione raggiunge la concentrazione sufficiente (1µg/ml)
per evidenziare i primi effetti antalgici; il picco ematico
viene raggiunto a 15 minuti dalla somministrazione.
Si sono, quindi ipotizzati anche altri meccanismi di
Tabella 2 - Cascata dell’acido arachidonico
CASCATA DELL’ACIDO ARACHIDONICO
FOSFOLIPIDI DI MEMBRANA
Fosfolipasi
Sede di azione degli steroidi
ACIDO ARACHIDONICO
Ciclossigenasi
Sede di azione dei FANS
ENDOPEROSSIDI CICLICI
Lipossigenasi
IDROSSIDI ACIDI
Prostacicline
Trombossani
Leucotrieni
Prostaglandine
131
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
azione dei FANS non attribuibili esclusivamente all’inibizione delle ciclossigenasi:
- l’azione come “spazzini” dei radicali liberi nel sito di
lesione
- l’azione sul sistema nervoso centrale attraverso meccanismi serotoninergici e dopaminergici.
Va, quindi, tenuto presente che l’effetto analgesico per
diverse classi di farmaci si verifica prevalentemente in
siti diversi, ma può anche derivare da una sovrapposi-
zione di tali meccanismi: gli oppioidi agiscono a livello
del sistema nervoso centrale per alterare la percezione
del dolore; i derivati del paracetamolo sono presumibilmente anch’essi attivi a livelli del sistema nervoso
centrale; gli anestetici locali bloccano la trasmissione
dello stimolo nervoso a livello del neurone periferico;
l’azione dei FANS è correlata alla inibizione delle prostaglandine del tessuto leso o malato (tabella 4).
In particolare ketoprofene sale di lisina possiede un
Tabella 3 - Meccanismo di azione dei FANS
stimoli fisiologici
stimoli infiammatori
infiammatori
stimoli
(es.caldo,
caldo, meccanico, chimico)
(es.
chimico)
COX-1
presente costituzionalmente
in molti tessuti
COX-2
quantità marcatamente ! inducibili
in risposta a stimoli
trombossano A2
funzione piastrinica
prostaglandina E2
funzione renale
perossidi prostaglandine
altri mediatori infiammatori
prostaciclina
• gastroprotettiva
• proprietà antitrombotiche
verso endotelio vascolare
infiammazione
Tabella 4 - Siti di azione dei oppioidi, FANS e anestetici locali
corteccia cerebrale
precursori
di bradichinina
acido arachidonico
citoplasma
talamo
istamina
membrana cellulare
danno cellulare
Sede di azione
dei FANS
ipofisi
fosfolipasi A2
cascata
PGE2
Sede di azione
dei farmaci oppicidi
bradichinina
nervo
Sede di azione
degli anestetici locali
132
profilo diverso da altri FANS. Infatti presenta sia un’azione locale sulle prostaglandine sia un’azione a livello
del sistema nervoso centrale con innalzamento della soglia del dolore e blocco delle prostaglandine anche a
questo livello.
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Il misoprostolo è stato il primo farmaco di cui si è dimostrata l’efficacia nel ridurre l’incidenza di effetti avversi gastrointestinali da FANS, ma recenti studi hanno
confermato la maggiore efficacia dell’omeprazolo (20
mg/die in un’unica somministrazione per os); mentre
non è confermata l’utilità degli inibitori H2 (ranitidina), che sono, invece, indicati per la terapia delle ulcere, previa sospensione dell’antinfiammatorio.
3. EFFETTI COLLATERALI
I diversi FANS condividono azioni terapeutiche e effetti indesiderati in base al comune meccanismo di azione; la differenza tra le varie molecole risiede nella percentuale di incidenza degli effetti indesiderati e prima
di intraprendere una terapia si dovrebbero valutare i
benefici e i possibili effetti collaterali.
In linea generale i FANS vanno utilizzati con cautela
nei pazienti con insufficienza renale, cardiaca, epatica,
e nei soggetti con anamnesi positiva per sanguinamento e ulcera gastrointestinale; sono controindicati nei
soggetti con intolleranza all’aspirina o a altri FANS, in
gravidanza e allattamento, nei difetti della coagulazione e nei soggetti con ulcera peptica attiva.
3.1 Effetti gastrointestinali
La lesività gastrointestinale è dovuta sia all’azione diretta sulla mucosa gastrica per contatto di sostanze acide
(come l’aspirina), sia all’azione indiretta che consiste
nel blocco delle COX1 e della sintesi delle PGE1 (vasodilatanti, citoprotettive e gastroprotettive) da parte
della mucosa e delle cellule parietali. Si stima che l’12% all’anno dei soggetti trattati con FANS presentino
il rischio di complicanze gravi, che richiedono l’ospedalizzazione.
I consigli per prevenire gli effetti gastrointestinali sono:
- ricordare che i FANS sono controindicati nei soggetti con ulcera peptica.
- non utilizzare più di un FANS alla volta
- iniziare la terapia con una dose più bassa ed efficace
- preferire FANS associati a un basso rischio di effetti
gastrointestinali
La profilassi farmacologica dell’ulcera peptica trova
giustificazione nei soggetti a rischio in cui l’incidenza
risulta aumentata di 4-5 volte nei confronti della popolazione generale:
- gli ultrasessantacinquenni
- pazienti con storia documentata di ulcera peptica
non guarita
- anamnesi di precedenti emorragie digestive
- pazienti in concomitante terapia con anticoagulanti
o cortisonici.
3.2 Effetti sulla coagulazione
I FANS inibiscono l’aggregazione piastrinica e accelerano il tempo di sanguinamento, quale risultato dell’inibizione della formazione piastrinica di trombossano
A2 (TxA2), enzima vasocostrittore e proaggregatore.
I meccanismi che contribuiscono alla interazione tra
anticoagulanti e FANS sono due:
- l’inibizione delle COX1 da parte dei FANS
- lo spostamento competitivo dell’anticoagulante orale dall’albumina sierica, a cui i FANS sono legati in
notevole misura (circa 95-99%)
È più difficile controllare la coagulazione quando un
paziente in terapia orale anticoagulante assuma FANS
e si dovrebbe consigliare di usare paracetamolo o la codeina (tabella 5).
In caso di interventi chirurgici caratterizzati da elevato
rischio di sanguinamento, l’aspirina deve essere sospesa
7 giorni prima in quanto acetila in modo irreversibile le
COX piastriniche e richiede la sostituzione della massa
circolante; gli altri FANS 2-3 giorni prima in quanto
provocano una inibizione reversibile.
3.3 Effetti sulla funzionalità
epatica e renale
Il rischio di epatotossicità sussiste per trattamenti prolungati a dosi elevate (antinfiammatorie), specialmente
in soggetti a rischio (epatopatie, anziani); perlopiù il
danno è reversibile e non grave, consistendo in movimenti delle transaminasi sieriche.
La nefropatia da FANS deriva da ingestione per lungo
tempo di FANS e dipende dal blocco delle COX 1; è
caratterizzata da nefrite interstiziale e necrosi papillare
renale, la perdita di tessuto papillare può danneggiare i
nefroni e la funzione renale; il rischio è maggiore nei
pazienti anziani, soprattutto se affetti da diabete, ipertensione e insufficienza renale cronica.
L’insufficienza renale acuta si sviluppa in conseguenza
di necrosi tubulare acuta nel 2% circa dei pazienti che
hanno assunto un sovradosaggio di paracetamolo; è di
solito accompagnata da una insufficienza epatica grave.
133
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
3.4 Gravidanza, allattamento
L’inibizione della biosintesi delle prostaglandine nelle
ultime settimane di gravidanza può prolungare la durata della gestazione, influenzare negativamente la progressione del travaglio, causare emorragie postpartum.
L’acido acetilsalicilico può essere utilizzato a basse dosi
in gravidanza, ma va sospeso prima della data prevista
del parto; utilizzabile invece rimane il paracetamolo.
Poichè i FANS passano nel latte materno, vanno evitati
pirazolonici e indometacina per i quali sono stati segnalate crisi di anemia emolitica e cianotiche del lattante.
Tabella 5 - Interazioni farmacologiche dei FANS
FANS
• Possibile compromissione degli effetti antipertensivi
dei β-antagonisti, degli ACE-inibitori o dei diuretici
• Possono aumentare il tempo di emorragia con anticoagulante o altri farmaci che influenzano i meccanismi di coagulazione
• Evitare l’uso con metotrexato a meno di controllo
dei livelli nel plasma
• Etanolo o FANS aumentano il rischio di emorragia
GI o di effetti avversi GI
• Antagonismo dell’effetto uricosurico di probenecid
• Sospetto di rischio di aumento dei livelli di litio nel
siero
maggiormente il paziente, la scelta del farmaco in base
a questo criterio può risultare determinante, ai fini di
una rapida remissione del dolore (tabella 6).
Le differenze di attività antinfiammatorie tra molti
FANS sono modeste, ma vi sono considerevoli diversità nella risposta individuale del paziente: il 60% circa
dei pazienti è sensibile a ogni tipo di FANS; i restanti
che non rispondono a un farmaco, possono trovare giovamento con un altro.
Menzione a parte meritano alcuni antinfiammatori
disponibili in collutorio: ketoprofene sale di lisina,
flurbiprofene, diclofenac, benzidamina.
Poiché nel caso di utilizzo di un collutorio è necessario
una quantità di principio attivo superiore rispetto alla
somministrazione orale in quanto il grado di assorbimento locale è inferiore rispetto al sistemico, riportiamo in tabella 7 le concentrazioni dei 4 principi attivi in
forma collutorio.
Le loro indicazioni d’uso consistono nelle affezioni algiche della mucosa, come malattie vescicolo-bollose,
erosioni e ulcerazioni, esiti di interventi di chirurgia
orale come, ad esempio, le gengivectomie.
Per ottenere un valido effetto antalgico e antiflogistico,
è opportuno eseguire gli sciacqui 2-3 volte al giorno a
seconda della sintomatologia ed evitare di bere o mangiare nel tempo immediatamente successivo alla applicazione del farmaco.
4. SCELTA DEL FARMACO
5. MODALITÀ
DI SOMMINISTRAZIONE
La disponibilità di una ampia ed eterogenea gamma di
FANS pone all’odontoiatra il dilemma di quale farmaco prescrivere, a cui è possibile rispondere ponendosi
alcune semplici domande: Si vuole un analgesico di
modesta o elevata potenza? Vi sono potenziali effetti
collaterali da tenere in conto in grado di condizionare
la scelta?
Generalmente i FANS vengono considerati come analgesici blandi, tuttavia la valutazione della efficacia analgesica, mette in luce che nel dolore da estrazione dentale alcuni FANS possono dimostrarsi equivalenti agli
analgesici oppiacei come la codeina, pentazocina, la
buprenorfina e il tramadolo, con il vantaggio di una
minore incidenza di sintomi collaterali.
Ketoprofene sale di lisina ha dimostrato un’efficacia
antidolorifica specifica nell’algesia da estrazione dentale del 3° molare ritenuto, superiore non soltanto ad altri FANS quali diclofenac, ketorolac, naprossene, piroxicam, ma anche alla codeina.
Un altro fattore importante per la scelta è la rapidità
d’azione. Poiché il dolore è l’elemento che infastidisce
L’uso dei FANS nel modello del dolore da chirurgia
orale ha dimostrato maggiore efficacia rispetto a somministrazioni singole di codeina, aspirina o paracetamolo e analgesia confrontabile con quella ottenuta con
combinazioni di oppioidi con aspirina o paracetamolo.
Se somministrati in dose singola i FANS hanno efficacia
sovrapponibile a quella del paracetamolo, mentre somministrati in modo continuativo e a dose piena hanno
un effetto analgesico e antinfiammatorio duraturo, che li
rende particolarmente efficaci e, per tali motivo, sono
più indicati del paracetamolo e degli analgesici oppiacei.
È importante non assumere i farmaci a domanda ma
mantenere una terapia continuativa a dosaggio adeguato per almeno 72 ore.
In tal modo è possibile inibire la produzione di prostaglandine proinfiammatorie nel momento di massima intensità della flogosi che, dopo un intervento di chirurgia
orale normalmente perdura per circa 2 o 3 giorni, raggiungendo dopo tale periodo il massimo dell’edema.
I regimi che prescrivono 1-2 dosi di farmaci al giorno
per via orale sono più convenienti in quanto aumenta-
134
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
no la compliance del paziente, ma non migliorano l’efficacia nè riducono gli effetti collaterali dei farmaci.
Inoltre gli effetti gastrointestinali non variano in relazione alla via di somministrazione orale o parenterale; a causa della reazione indiretta data dal blocco delle COX e solo parzialmente dal contatto del farmaco con la mucosa.
La somministrazione preoperatoria di FANS detta
analgesia preventiva o “preemptive analgesia” migliora
l’analgesia e riduce il fabbisogno di analgesici nel perio-
do postoperatorio; effetto che probabilmente dipende
dalla minore irritazione delle terminazioni nocicettive e
memorizzazione del dolore.
Si ritiene infatti che l’intervento chirurgico determina
una sensibilizzazione periferica e centrale in grado di
causare alterazioni neurofisiologiche nel sistema nervoso centrale (fenomeno di wind up), implicate anche
nella memoria neuronale del dolore e nella sua amplificazione, che amplificano la risposta al dolore.
Tabella 6 - Rapidità d’assorbimento
PRINCIPIO ATTIVO
Ketoprofene sale di lisina
Ketoprofene
Ibuprofene
Piroxicam
Nimesulide
Diclofenac
MINUTI NECESSARI PER RAGGIUNGERE
IL PICCO EMATICO
15
60
90
120
120
120
Tabella 7 - Concentrazione di principio attivo in 100 ml di collutorio
PRINCIPIO ATTIVO
Ketoprofene sale di lisina
Flurbiprofene
Benzidamina
Diclofenac
CONCENTRAZIONE IN 100 ML
DI COLLUTORIO
1,6%
0,25%
0,15%
0,074%
PARTE F
ODONTOIATRIA LEGALE
Colpa
Il malato disse, non sono guarito,
eppur curato dal medico, ho molto patito,
questa è dei fatti la realtà.
L’avvocato perorò l’ipotesi di evidente iniquità.
Il consulente confermò dell’errore la possibilità.
Il giudice desunse la colpa per probabile responsabilità.
La realtà era interpretata in parziale verità,
che il verbale mutava in dubbia meta-verità,
che la sentenza fissava in sicura meta-meta-verità.
La condanna del medico fu la spiacevole novità,
giudizio sibillino, forse ingiusto, ma all’unanimità.
Diversità
Aveva sempre creduto
che tutti fossero della sua specie
e che il sogno fosse parte
della memoria e della mente di tutti
Lo stupore di un compagno
gli rivelò il suo errore
Capì che non potevano capirsi
con destini tanto diversi
Lo indispettìva soprattutto un fatto
La sua non era differenza sostanziale
ma differenza marginale
indistinguibile nel mondo globale
Se fosse mutato si sarebbe perduto
e perseverò a essere se stesso
ammesso che fosse qualcuno
uno tra molti o molti e nessuno
Nella eventualità di un paziente che subisca un danno
a causa di una scorretta terapia antibiotica può essere
posta ipotesi di colpa professionale a carico dell’odontoiatra che ha eseguito la prescrizione o la somministrazione.
Per il riconoscimento della colpa si deve appurare tre
condizioni fondamentali:
- un danno apprezzabile
- il nesso di causalità materiale tra farmacoterapia e
evento dannoso
- il nesso di causalità psicologico riconducibile a un
comportamento caratterizzato da imprudenza, negligenza o imperizia del sanitario
L’indagine medico-legale verte sull’analisi sequenziale
dei fatti e le motivazioni di responsabilità possono essere sia ravvisate sia in un errore che in una omissione (in
agendo, in omittendo) relativo a:
- diagnosi della patologia infettiva
- prescrizione del farmaco
- somministrazione
- comportamento a fronte della reazione avversa.
toiatra e a riconoscere la responsabilità ai medici che
successivamente seguirono il paziente.
- Per quanto riguarda la responsabilità inerente la
comparsa di reazioni avverse va ricordato che fonte di responsabilità può derivare da diverse situazioni (tabella 1.1 e 1.2):
- dalla mancata anamnesi, ad esempio di precedenti
episodi di allergia prima di prescrivere o somministrare un farmaco
- da effetti tossici da sovradosaggio assoluto a seguito di prescrizione di posologie eccessive in pazienti sani o sovradosaggio relativo in pazienti con insufficienza funzionale degli emuntori
- da reazioni avverse inerenti interazioni farmacologiche o condizioni parafisiologiche come la gravidanza a cui è connesso il rischio di danni fetali
- dal mancato tempestivo soccorso in caso di emergenze (ad esempio uno shock anafilattico) insorto
nello studio odontoiatrico
Tabella 1.1
Motivi di responsabilità in terapia delle infezioni
1. RESPONSABILITÀ
PROFESSIONALE IN
ANTIBIOTICOTERAPIA
Le ipotesi di responsabilità professionale conseguente a
errore nella prescrizione o somministrazione di farmaci
sono diverse.
L’assenza di diagnosi tempestiva di infezione odontogena, in un caso complicatosi successivamente con un’angina di Ludwig mortale, fu motivo di condanna penale
per l’odontoiatra per omicidio colposo.
Un procedimento civile fu intentato contro un odontoiatra per la prescrizione di antibiotico per telefono a
un paziente che, a seguito dell’estrazione di un dente
del giudizio, sviluppò un flemmone sottomandibolare
che richiese un ricovero ospedaliero in un reparto di
chirurgia maxillo-facciale e poi di rianimazione; nonchè l’estrazione di quattro denti mandibolari nella necessità di eliminare tutti i foci infettivi possibili e assicurare il drenaggio del flemmone.
La richiesta di risarcimento fu rigettata in quanto la
prescrizione per telefono era stata motivata dalla mancata possibilità del paziente di recarsi presso lo studio
odontoiatrico; inoltre l’evoluzione dell’infezione nell’arco di due settimane fu oggetto di visita da parte di
medici di due diversi reparti di Pronto Soccorso che
somministrarono terapie diverse.
Tale situazione fu considerata sufficiente a interrompere il nesso di causalità tra danno e operato dell’odon-
Assenza di diagnosi
Errata prescrizione
Errata somministrazione
Mancata sorveglianza
2. RESPONSABILITÀ
PROFESSIONALE IN
PROFILASSI
Il verificarsi di infezioni locali della ferita (ascessi o
flemmoni della testa e del collo, angina di Ludwig) o di
infezioni metastatiche (a carico di protesi ortopediche,
di protesi di altro tipo o a carico di diversi organi) a seguito di terapie odontoiatriche può prestarsi al contenzioso legale ai fini di risarcimento per errore professionale.
La natura del contenzioso si basa sulla mancata o scorretta adozione di norme profilattiche cioè per negligenza riferibile a culpa in omittendo.
Va ricordato che la validità della profilassi antibiotica
in chirurgia orale o nei pazienti con protesi ortopediche
questi casi non è dimostrata da evidenze scientifiche; si
tratta, quindi, non di linee guida con valore cogente,
ma di indicazioni la cui applicazione è lasciate alla discrezione del sanitario a cui è demandata la decisione in
base alla valutazione del caso individuale.
Viene, così, a mancare il supporto che costituisce la ba-
138
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tabella 1.2 - Motivi di responsabilità per reazioni avverse
Farmaco tossicità
Tipo
Considerazioni medico legali
Dipendente dagli effetti
farmacologici primari
Sovradosaggio assoluto
Sovradosaggio relativo
Cancerogenicità
Dismorfogenicità
Sempre prevedibili e prevenibili;
sinonimo di responsabilità
Effetti collaterali
Effetti secondari
Indesiderabili ma non evitabili;
responsabilità ipotizzabile in caso
di mancato controllo
Intolleranza
Idiosincrasia
Allergia
Reazione autoimmune
(tipo LES)
Reazione anafilattoide
Non prevedibili e prevenibili in
caso di prima somministrazione del
farmaco (assenza di responsabilità)
Responsabilità accertata in caso di
avvenute reazioni pregresse non
indagate con anamnesi (quindi
prevedibili e prevenibili con una
corretta anamnesi della prescrizione)
Indipendente dagli effetti
farmacologici primari
se della prevedibilità e prevenibilità del fatto che si pone alla base della dimostrazione dell’esistenza di responsabilità professionale, cioè che il fatto avrebbe potuto essere evitato con una condotta prudente e diligente.
Una sentenza di condanna non è, quindi, giustificata
per la omessa prescrizione di antibioticoprofilassi sia
nel paziente immunocompetente che immunocompromesso.
Del resto il fatto che un eventuale paziente immunocompromesso presenti il rischio di infezioni metastatiche o locali (anche in presenza di una carente raccolta
anamnestica dei dati e valutazione clinica preoperatoria), non costituisce un problema inerente la profilassi
(di per sé facoltativa), quanto piuttosto è inerente un
tempestivo intervento di antibioticoterapia una volta
comparsa la complicanza.
Più complessi si rivelano gli aspetti di responsabilità
professionale connessi nella profilassi dell’endocardite
batterica in corso di interventi odontoiatrici.
Il verificarsi di un’EI a seguito di terapie odontoiatriche
in pazienti predisposti può prestarsi al contenzioso legale ai fini di risarcimento per errore professionale.
La natura del contenzioso si basa ancora sulla mancata
o scorretta adozione di norme profilattiche cioè per negligenza riferibile a culpa in omittendo, situazione aggravata dall’esistenza di linee guida accettate dalla comunità internazionale e quindi con valore cogente.
In assenza di precedenti giurisprudenziali, secondo
dottrina medico-legale, non sembrerebbe giustificata
una sentenza di condanna data l’evidente impossibilità
di dimostrare un nesso eziologico certo tra l’intervento
odontoiatrico e lo sviluppo dell’EI; anche qualora sia
identificato quale agente un germe appartenente alla
flora oro-dentale e si sia sviluppata la EI entro un tempo compatibile.
Non può, infatti, essere dimostrata l’effettiva occorrenza di batteriemia; né è dimostrabile l’impianto del germe sulla superficie endocardica a seguito dell’intervento, piuttosto che a seguito di una batteriemia spontanea delle molte che si verificano quotidianamente.
Del resto, anche se c’è unanime consenso su un tempo
medio di incubazione di 1-2 settimane, il periodo di
incubazione secondo autori diversi può variare entro limiti ampi di durata.
Nondimeno sono state tentate richieste di risarcimento
anche con EI insorte clinicamente a distanza di diversi
mesi da interventi di chirurgia.
In relazione a questa ipotesi di responsabilità è opportuno che l’odontoiatra sia consapevole dei fattori
anamnestici indice di condizioni predisponenti all’EI
che vanno raccolti sulla cartella clinica e che informi
del rischio il paziente.
Rimane assodato che l’obbligo di prescrizione della
profilassi antibiotica è limitato al sottogruppo di pazienti con rischio elevato-intermedio, mentre al di fuori di questo contesto le indicazioni sono meno definite
e non cogenti.
Infine va ricordato che anche la prescrizione di un regime antibiotico diverso, da quello indicato nelle correnti linee guida, non dovrebbe essere giudicato alla stregua di un errore, poichè non è dimostrata la superiorità di un protocollo rispetto un altro.
139
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
3. FARMACOSORVEGLIANZA
Le aziende farmaceutiche, hanno, a loro volta, l’obbligo di segnalare le reazioni alle Unità Sanitarie Locali O
ALLE Direzioni Sanitarie secondo tempi e modalità
prestabilite.
I tempi di segnalazione previsti dalla legge vengono
giustificati dalla necessità, da parte del Ministero della
Sanità, di riportare rapidamente all’agenzia europea
(EMEA) tutte le informazioni che provengono dagli
operatori sanitari e dalle aziende farmaceutiche.
La violazione dell’obbligo da parte dei medici, dei farmacisti, dei sanitari, dei direttori sanitari delle ASL e
degli istituti di cura, dei responsabili delle aziende farmaceutiche sono puniti con l’ammenda da lire 1 milione a dieci milioni e con l’arresto fino a sei mesi (ex art
4 DLgs n.44/97).
Dallo studio del disposto di legge risulta evidente che
l’obbligo va ottemperato anche dagli odontoiatri che
operino in regime libero professionale; i quali, in presenza di una reazione avversa, che sia osservata nello
svolgimento della loro attività professionale e che riconosca un probabile nesso di causalità con farmaci da loro prescritti, hanno l’obbligo di notificare la reazione
avversa all’Unità Sanitaria Locale, nel cui ambito territoriale operino; inviando l’apposito Scheda di segnalazione di sospetta reazione avversa, entro tre giorni lavorativi per le reazioni avverse gravi e sei giorni per le reazioni non gravi
Ricordiamo che, uniformandosi alla classificazione internazionale del Council for International Organization of Medical Sciences (CIOMS), per reazione avversa grave si intende “una reazione avversa ad esito letale,
o una reazione avversa che minaccia la sopravvivenza, che
crea invalidità, incapacità o che provoca o prolunga il ricovero in ospedale”.
La nuova “Scheda di segnalazione di sospetta reazione
avversa”, riportata nella Circolare esplicativa del Ministero della Sanità n. 12/97, sostituisce il ben conosciu-
Il decreto legislativo del Ministero della Sanità n.
44/97 Attuazione della direttiva 93/39/CEE, che modifica le direttive 65/65/CEE, 75/318/CEE e 75/319/CEE e
la Circolare esplicativa del Ministero della Sanità n.
12/97 organizzano la Farmacovigilanza in Italia, auspicando un aumento delle segnalazioni sul territorio nazionale.
Il decreto legislativo introduce l’obbligo, per gli operatori sanitari, di notificare alle Autorità competenti tutti i casi di presunte reazioni avverse, prevedendo, in caso di violazione, pesanti sanzioni.
Di fatto con il decreto è stato creato un sistema completo di segnalazione incrociata, con la possibilità da
parte delle Unità Sanitarie Locali, di ricevere segnalazioni multiple relative ad una medesima reazione; come viene esemplificato dalla tabella seguente che descrive graficamente il nuovo flusso informativo previsto
dalla legge (tabella 3.1).
Le segnalazioni devono essere effettuate con diverse
modalità in relazione al profilo del rapporto di lavoro:
- all’Unità Sanitaria Locale nel caso di medici e farmacisti che operano sul territorio
- alle Direzioni Sanitarie nel caso di medici e di farmacisti di Aziende Ospedaliere e Istituti di Ricovero e
Cura a Carattere Scientifico
- all’Unità Sanitaria Locale ed in copia alla direzione
sanitaria della struttura stessa nel caso di medici e farmacisti che svolgano la loro attività in presidi ospedalieri ed in case di cura private.
Il Direttore Sanitario e il responsabile della Farmacovigilanza delle Unità Sanitarie Locali devono, a loro volta, inoltrare le segnalazione avverse al Dipartimento
per la valutazione dei Medicinali e per la Farmacovigilanza del Ministero della Sanità.
MEDICO
FARMACISTA
ASL
AZIENDA
FARMACEUTICA
REGIONE
MINISTERO
DELLA SALUTE
AZIENDA
FARMACEUTICA
Tabella 3.1 - Flusso informativo della farmacovigilanza
EMEA
140
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
SCHEDA DI SEGNALAZIONE DI SOSPETTA REAZIONE AVVERSA
(Da compilarsi a cura del medico o farmacista)
N.B.: È obbligatoria soltanto la compilazione dei seguenti campi: 2; 4; 7; 8; 12; 22.
1
INIZIALI DEL PAZIENTE
2
3
7
DESCRIZIONE DELLE REAZIONI ED EVENTUALI DIAGNOSI*
ETÀ
SESSO
4
DATA D’INSORGENZA DELLA REAZIONE
5
ORIGINE ETNICA
6
8
GRAVITÀ DELLA REAZIONE
CODICE MINISTERO SANITÀ
MORTE
HA PROVOCATO/PROLUNGATO
L’OSPEDALIZZAZIONE
HA PROVOCATO INVALIDITÀ GRAVE
O PERMANENTE
HA MESSO IN PERICOLO
* NOTA: SE IL SEGNALATORE È UN FARMACISTA RIPORTI SOLTANTO LA DESCRIZIONE DELLA REAZIONE AVVERSA, SE È UN MEDICO ANCHE L’EVENTUALE
DIAGNOSI
9
LA VITA DEL PAZIENTE
10
ESAMI STRUMENTALI E/O DI LABORATORIO RILEVANTI
ESITO:
RISOLTA
RISOLTA CON POSTUMI
PERSISTENTE
11
SPECIFICARE SE LA REAZIONE È PREVISTA NEL FOGLIO ILLUSTRATICO
MORTE:
SI
DOVUTA ALLA REAZIONE AVVERSA
NO
COMMENTI SULLA RELAZIONE TRA FARMACO E REAZIONE
IL FARMACO POTREBBE AVER CONTRIBUITO
NON DOVUTO AL FARMACO
SCONOSCIUTO
INFORMAZIONI SUL FARMACO
12
13
FARMACO (I) SOSPETTO (I)
LA REAZIONE È MIGLIORATA
NOME SPECIALITÀ MAEDICINALE (*)
DOPO LA SOSPENSIONE DEL FARMACO?
A)
SI
NO
B)
C)
* NEL CASO DI PRODOTTI BIOLOGICI INDICARE IL NUMERO DEL LOTTO
14
DOSAGGIO
15
IN VIA DI
16
DURATA DELLA TERAPIA
17
RIPRESA DEL FARMACO
GIORNALIERO
SOMMINISTRAZIONE
DAL
A)
A)
A)
SI
B)
B)
B)
RICOMPARSA DEI SINTOMI
C)
C)
C)
SI
18
INDICAZIONI PER CUI IL FARMACO È STATO USATO
19
FARMACO (I) CONCOMITANTE E PREDISPONENTI
20
CONDIZIONI CONCOMITANTI E PREDISPONENTI
AL
21
NO
NO
LA SCHEDA È STATA INVIATA ALLA:
AZIENDA PROD
DIR SANITARIA
MINISTERO DELLA SANITÀ
INFORMAZIONI SUL SEGNALATORE
22
FONTE
OSPEDALIERO
MEDICO BASE
FARMACISTA
SPECIALISTA
ALTRO
23
NORME ED INDIRIZZO DEL MEDICO FARMACISTA - N. ISCRIZIONE
ORDINE PROFESSIONALE - PROVINCIA
24
DATA DI COMPILAZIONE
25
FIRMA
26
CODICE USL
26
FIRMA RESPONSABILE
Tabella 3.2 - Scheda di segnalazione di sospetta reazione avversa
USL
141
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tabella 10 - Mod B
SCHEDA DI SEGNALAZIONE DI SOSPETTE REAZIONI TOSSICHE E SECONDARIE DA FARMACI
(da compilare a cura del cittadino e inviare a ASL)
01. Quale reazione indesiderata ha osservato?
..............................................................................................................................................................................................................
02. Quando ? .....................................................................................................................................
03. Quando è durata? ......................................................................................
04. Quali medicinali stata prendendo?
5. Quante volte al giorno?
a.
Fiale
..................................................................................................................................................................................................................................................................................................
b. Supposte
........................................................................................................................................................................................................................................................................................
c.
uso locale
.......................................................................................................................................................................................................................................................................................
d. per bocca
.......................................................................................................................................................................................................................................................................................
e.
.......................................................................................................................................................................................................................................................................................
per bocca
........................................................................................................................................................................................................
06. Da quanto tempo?
a
07. Per quale disturbo?
...............................................................................................................
.................................................................................................................
b
..............................................................................................................
.................................................................................................................
c
...............................................................................................................
.................................................................................................................
d
..............................................................................................................
.................................................................................................................
e
...............................................................................................................
.................................................................................................................
f ................................................................................................................
.................................................................................................................
08. Il farmaco le è stato prescritto dal medico?
( ) Si
( ) No
09. L’aveva già preso in passato?
( ) Si
( ) No
10. Ha mai avuto la stessa reazione
( ) Si
( ) No
11. Con quale medicinale ...........................................................................................................................................................................................................................................................
12. Chi è il suo medico curante?
(cognome, nome, indirizzo e telefono) .....................................................................................................................................................................................................................
...............................................................................................................................................................................................................................................................................................................
13. Lo ha informato?
( ) Si
( ) No
Sospeso il medicinale
( ) Si
( ) No
Ridotta la dose
( ) Si
( ) No
14. Come è stata curata la reazione?
Altro (specificare)
....................................................................................................................................................................................................................................................................
15. Adesso la reazione è scomparsa
( ) Si completamente
USL .......................................................................... Data ................................................................................ Firma
( ) Non del tutto
( ) No
.................................................................................................................
Indirizzo e tel. del paziente ..........................................................................................................................................................................................................................................................
Osservazioni del medico della USL a cui viene riferito il caso:
..........................................................................................................................................................................
.........................................................................................................................................................................................................................................................................................................................
.........................................................................................................................................................................................................................................................................................................................
Firma del medico
(Cognome in stampatello)
............................................................................................................................
..........................................................................................................
Tabella 3.3 - Scheda di segnalazione di sospette reazioni tossiche e secondarie da farmaci
142
to “Allegato A” utilizzato precedentemente in base al
DM20.4.1991; mentre rimane in vigore, anche se facoltativo, il modello B da compilare e inviare a cura del
cittadino.
Note sulla compilazione della scheda di segnalazione
di sospetta reazione avversa
- Il campo n. 6 (codice Ministero della Sanità) non va
compilato dal sanitario che segnala, ma dall’Ufficio
competente della Sanità.
- Per ciò che attiene il campo n. 7, la descrizione della
reazione deve essere il più ampia possibile e non limitarsi a pochi termini, cioè la descrizione dell’evento avverso dovrebbe, per quanto possibile, non coincidere con la diagnosi.
- Il campo n. 8 è stato inserito come obbligatorio in
quanto, dato che alcune segnalazioni originano poi
interventi incisivi per la salute pubblica, è di fondamentale importanza conoscere il livello di gravità della reazione stessa. Ovviamente, se la segnalazione si riferisce a segnalazioni non gravi il segnalatore può scegliere se scrivere non grave o non applicabile, sbarrare
l’intero campo, o semplicemente lasciarlo in bianco.
- Il campo n. 11 è anch’esso importantissimo, in quanto la menzione o meno della reazione avversa nel fo-
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
glio illustrativo, e di conseguenza nella scheda tecnica, permette al Ministero della Sanità come inaspettata o meno. Ciò è particolarmente utile nel caso vada avviata una procedura d’urgenza di variazione degli stampati. Sempre in questo stesso campo è riportata la richiesta di commenti sulla possibile relazione
tra l’assunzione del farmaco e l’insorgenza della reazione avversa. In questo caso è opportuno rispondere dopo aver compiuto opportune verifiche (consultazione degli stampati e di testi scientifici, follow up,
esami di laboratorio).
- Il campo n. 21 serve soprattutto ad evitare le duplicazioni, in caso la scheda sia stata spedita a più destinatari (Azienza USL, Industria Farmaceutica,
ecc…).
- Il campo n. 27 va firmato dal responsabile del servizio farmacovigilanza della USL dopo che questi ha
controllato la congruità della segnalazione stessa. In
caso la segnalazione risultasse mancante di elementi
importanti, è auspicabile che il responsabile suddetto si adoperi per acquisirne il più possibile.
- Per quanto riguarda il resto della scheda si fa presente che esso va compilato dall’Azienda titolare dell’Autorizzazione all’Immissione in Commercio, e
non da chi riporta, né dalla USL.
PARTE G
APPENDICE
Malattia
Non immaginate quanta forza
abbia nella malattia la volontà
che si concentra sulla guarigione
e che si rifiuta di diventare complice
della propria infermità
Ho visto persone atterrite
in attesa di diagnosi
rese consapevoli del proprio destino
cedere alla rassegnazione e alla depressione
altre guardare alla morte con gli occhi aperti
e tramutare l’ansia in speranza
Ho visto persone incapaci
di lottare con le loro vite ordinarie
rifugiarsi in patologie immaginarie
ammalati ipocondriaci
dell’impossibilità di ammalarsi
Ho scorso l’elenco delle malattie
e non ho trovato preoccupazioni
tristi pensieri e altre pigioni
pagate al corpo dagli inquilini
Dolore e tristezza sono malattie
che lasciano sane solo le persone
senza coscienza
Alla malattia non compete
funzione o intenzione
Dipende dal malato
impoverire lo spirito
o arricchire l’anima
Le vittime delle malattie
sono sacrifici offerti
per elevare la capacità
di sentire dell’umanità
Passeggiata invernale
Rami spogli si stagliano nel cielo azzurro
Il bianco tiepido sole squarcia la foschia
e disegna lunghe nere ombre oblique
sul prato verde d’erba rada, molle di fango
e d’umide brune foglie appassite.
Colori di luci e ombre presagio di fine
e inizio che a noi la natura nega.
Il riflesso del sole sull’acqua mi segue come un arcobaleno
Sullo sfondo le rovine medievali di un castello e di un ponte
le macchine lontane veloci si muovono senza rumore.
Prospettive soggettive di una vita reale a cui partecipo estraneo
Oltre il promontorio il canale vorticoso
affluisce al fiume placido in un lento corso
come la vita scorre impassibile tra i vortici delle sensazioni
nella lenta abitudine dei compiti quotidiani
Inalano le narici l’aria fredda
che si espande nel petto gonfio
un nodo sale alla gola
incrina la voce e inumidisce gli occhi
Attimi di risveglio da un letargo
di consapevolezza assopita e intravista
che valgono una vita
Io e tua madre ti teniamo stretto per mano
per una inconcepibile, irrazionale paura
dell’acqua vorticosa che scorre nel canale
della vita che passa del freddo
che il calore della tua mano lenisce.
145
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
1. CARATTERISTICHE FARMACODINAMICHE DELLE
PRINCIPALI FAMIGLIE DI ANTIBIOTICI
Tabella 1 - Aminoglicosidi
FARMACO
Aminoglicosidi
Amikacina
Gentamicina
Kanamicina
Tobramicina
Natura
Pka2
T1/2 (ore)
B
B
B
B
8,2
7,2
6,7;7,3;9,9
2-3
2-3
2-5
2-3
Vd (L/Kg) Legame proteico%
0,2-0,3
0,28
0,2-0,3
0,31
<10
<10
0-3
<10
Tabella 2 - Cefalosporine, nitroimidazoli e lincomicine
FARMACO
Cefalosporine
Cefalexina
Cefaloridina
Cefalotina
Cefamandolo
Cefapirina
Cefatrizina
Cefazolina
Cefoxitina
Cefprozil
Cefradina
Cefuroxima
Clindamicina
Eritromicina
Lincomicina
Metronidazolo
Natura
Pka2
T1/2 (ore)
A
A
A
A
A
A
A
A
2,5-7,3
3,4
2,5
A
A
2,6-7,3
2,5
7,45
8,8
5,35
7,6
0,5-1
1-1,5
0,5-1
1
0,6
1,4
1,75-2
1
1,3
0,7
1,1-1,4
1,4
4,8-16,5
4,6-5,6
6,12
B
B
B
2,3
Vd (L/Kg) Legame proteico%
0,23
0,23
0,26
0,145
0,14
0,13
0,1-0,2
0,29
0,2-0,3
1,14
0,57
0,41-0,57
0,6-0,8
15
20
70
67-80
44-50
58
84
65-80
36
10
40
94
73
72
<20
Tabella 3 - Penicilline
FARMACO
Penicillina
Amoxicillina
Ampicillina
Bacampicillina
Benzilpenicillina
Cloxacillina
Dicloxacillina
Fenoximetilpenicillina
Flucloxacillina
Oxacillina
Spiramicina
Natura
Pka2
T1/2 (ore)
A
A
A
A
A
A
A
A
A
B
2,4-7,4-9,6
2,5-7,2
1
1-1,5
0,7-1,0
0,5
0,5
0,7
0,5
0,8
0,5
5-6
2,8
2,7
2,7
2,7
2,7
2,9
8,0
Vd (L/Kg) Legame proteico%
0,2
0,4-0,7
0,36
0,5
0,14
0,1-0,2
0,73
0,12
17
15-29
65
95
98
79
94
146
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tabella 4 - Tetrracicline e vancomicina
FARMACO
Tetraciclina
Clortetraciclina
Demetilclortetraciclina
Doxiciclina
Minociclina
Oxitetraciclina
Rolitetraciclina
Tetraciclina
Vancomicina
Natura
Pka2
T1/2 (ore)
B
B
Amp
3,3-7,4-9,3
3,3-7,2-9,4
3,4-7,7-9,7
2,8-5,0
9,5-7,8
3,3-7,3-9,1
7,4
6,4
5-6
10-13
15-24
12-16
9-10
6-12
6-10
6-11
Vd (L/Kg) Legame proteico%
0,2
B
B
B
0,97
0,14
0,8
1,3-1,6
1,2
50-60
40-50
28-31
65-75
20-30
20
20-40
<10
A= acido; Aac= aminoacido; Alc=alcool; Amp= anfolita;
B= base; B4= base d’ammonio quaternaria; Gly= glicoside;
Pep= peptide; S= steroide; Sa= sostituto amidico.
2 pH al quale il farmaco è ionizzato al 50%
3 Vita media di eliminazione (plasma; t1/2 b) (valore normale nell’adulto). Molti farmaci hanno valori individuali di vita,media estremamente
variabili dovuti a differenze di metabolismo. Un valore singolo rappresenta la media dei valori di t1/2 e non esclude la variabilità interindividuale.
4 Volume apparente di distribuzione (valore normale nell’adulto). Di solito si tratta di valori medi approssimati per la fase b o per il volume di
distribuzione allo steady-state. I valori con un asterisco sono calcolati sulla base di un peso corporeo di 70 Kg.
5 Valori medi.
2. ANTIBIOTICI ELENCATI PER PRINCIPIO ATTIVO
IN ORDINE ALFABETICO
PRINCIPIO ATTIVO
FARMACO
ANTIBIOTICI
Amoxicillina
Amoxicillina
Amoxicillina
Amoxicillina
Amoxicillina
Amoxicillina
Amoxicillina
Amoxicillina
Amoxicillina (triidrata)
Amoxicillina (triidrato)
Amoxicillina (triidrato)
Amoxicillina (triidrato)
Amoxicillina + acido clavulanico
Amoxicillina + acido clavulanico
Amoxicillina + acido clavulanico
Amoxicillina triidrato
Amoxicillina triidrato
Amoxicillina triidrato
Ampicillina
Ampicillina
Ampicillina
Ampicillina + sulbactam
Ampicillina + sulbactam
Ampicillina + sulbactam
Ampicillina + sulbactam
Azitromicina
Alfamox
Amoflux
Amox
Amoxillin
Isimoxin
Velamox
Zimox
Ibiamox
Sintopen
Mopen
Neo Ampliplus
Neo Tetranese
Augmentin
Clavulin
neoduplamox
Amoxina
Amoxipen
Hydramox
Ampicillina Recordati
Ampilisa
Amplital
Bethacil
Loricin
Unasyn
Unasyn pediatrico
Azitrocin
Penicillina
Penicillina
Penicillina
Penicillina
Penicillina
Penicillina
Penicillina
Penicillina
Penicillina
Penicillina
Penicillina
Penicillina
Penicillina + acido clavulanico
Penicillina + acido clavulanico
Penicillina + acido clavulanico
Penicillina
Penicillina
Penicillina
Pennicillina
Pennicillina
Pennicillina + sulbactam
Pennicillina + sulbactam
Pennicillina + sulbactam
Pennicillina + sulbactam
Macrolide
Macrolide
147
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Azitromicina
Azitromicina
Azitromicina
Bacampicillina
Bacampicillina
Cefacloro
Cefalexina
Cefalexina
Cefalotina
Cefamandolo
Cefazolina
Cefazolina
Cefixima
Cefixima
Cefonicid
Cefonicid bisodico
Cefonicid bisodico
Cefonicid bisodico
Cefotaxima
Cefotaxima
Cefprozil
Ceftibutene
Ceftibutene
Ceftriaxone
Cefuroxime
Cefuroxime axetil
Cefuroxime axetil
Cefuroxime axetil
Ciprofloxacina
Ciprofloxacina
Claritromicina
Claritromicina
Claritromicina
Clindamicina
Clindamicina
Doxiciclina
Eritromicina
Flucloxacillina
Josamicina
Josamicina
Lincomicina
Metronidazolo
Metronidazolo
Midecamicina
Minociclina
Miocamicina
Ofloxacina
Ofloxacina
Oxacillina
Penicillina potassica
Penicillina sodica
Penicillina V
Roxitromicina
Roxitromicina
Roxitromicina
Roxitromicina
Spiramicina
Ribotrex
Trozocina
Zitromax
Bacacil
Penglobe
Panacef
Ceporex
Keforal
Keflin Neutro
Mandokef
Cefamezin
Totacef
Cefixoral
Suprax
Monocid
Cefodie
Cefosporin
Praticef
Claforan
Zarivix
Procef
Cedax
Isocef
Rocefin
Curoxim
Oraxim
Tilexim
Zinnat
Ciproxin
Flocirpin
Klacid
Macladin
Veclam
Dalacin C
Dalacin C fosfato
Bassado
Eritromicina
Betabiotic
Iosalide
Josaxin
Lincocin
Deflamon
Flagyl
Midecin
Minocin
Miocan
Flobacin
Oflocin
Penstapho
Penicillina G potassica
Penicillina G sodica
Fenospen
Assoral
Overal
Rossitrol
Rulid
Rovamicina
Macrolide
Macrolide
Macrolide
Penicillina
Penicillina
Cefalosporina II generazione
Cefalosporina I generazione
Cefalosporina I generazione
Cefalosporina I generazione
Cefalosporina II generazione
Cefalosporina I generazione
Cefalosporina I generazione
Cefalosporina III generazione
Cefalosporina III generazione
Cefalosporina II generazione
Cefalosporina II generazione
Cefalosporina II generazione
Cefalosporina II generazione
Cefalosporina III generazione
Cefalosporina III generazione
Cefalosporina II generazione
Cefalosporina
Cefalosporina
Cefalosporine III generazione
Cefolasporina II generazione
Cefolasporina II generazione
Cefolasporina II generazione
Cefolasporina II generazione
Chinolone
Chinolone
Macrolide
Macrolide
Macrolide
Lincosamina
Lincosamina
Tetraciclina
Macrolide
Penicillina
Macrolide
Macrolide
Macrolide
Nitroimidazolici
Nitroimidazolici
Macrolide
Tetraciclina
Macrolide
Fluorochinolone
Fluorochinolone
Penicillina
Penicillina
Penicillina
Penicicllina
Macrolide
Macrolide
Macrolide
Macrolide
Macrolide
148
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
3. CHEMIOTERAPICI ANTINFETTIVI SUDDIVISI PER FAMIGLIE
La lista comprende i farmaci di più frequente utilizzazione in odontoiatria citati nel testo; non deve essere considerata esaustiva in quanto non omnicomprensiva di tutti i marchi, prodotti e dosaggi disponibili nel Prontuario Farmecutico Nazionale.
Tabella 1- Penicilline
Principio attivo
Nome
commerciale
Forma
farmaceutica
e dosaggio
Posologia
(A) adulti
(B) bambini
Note
Ampicillina
Ampicillina
Amplital
Cps 250mg
Cps 500 mg
Cps 1gr
Fl im/ev 500mg
Fl im/ev 1 gr
(A) 2-3 gr/die
bis o tds
(B) 100-200
mg/kg/die
Aminopenicillina
non betalattamasi
resistente
Basso assorbimento
per os
Bacampicillina
Bacacil
Penglobe
Cpr 800 mg
Cpr 1200 mg
(A) 1,6-2,4 gr/die
bis o tds
(B) 20-50
mg/kg/die
Aminopenicillina
Non betalattamasi resistente
Profarmaco dell’ampicillina
con miglior assorbimento orale
Amoxicillina
Amoxicillina
Mopen
Neotetranase
Velamox
Zimox
Cps 500 mg
Cpr 1 gr
sospensione
(A) 1 gr
ogni 8-12 ore
(B) 50-100
mg/kg/die
ogni 6-8 ore
Aminopenicillina
Ampio spettro d’azione
Non betalattamasi resistente.
Elevato assorbimento orale.
Velamox disponibile anche
in fl im/ev da 500 mg e da 1 gr
Ampicillina
sulbactam
Unasyn
Fl im/ev 750 mg
Fl im/ev 1 gr
(A) 1 fl ogni
12-24 ore
Aminopenicillina/inibitore
delle betalattamasi
Amoxicillina
acido
clavulanico
Augmentin
Clavulin
Neoduplamox
Sospensione
Cpr 1 gr
Bustine 1 gr
Fl ev 1200 mg
(A) 2-3 gr/die
per os bis o tds
(B) 20-40
mg/kg/die
Aminopenicillina/inibitore
delle betalattamasi
Spettro ampio
Cloxacillina
Amplium
Cps 375 mg
Fl im 600 mg
Fl im 1gr
(A) 1-2 gr /die
per os qds
(B) 50-100
mg/kg/die qds
Penicillina antistafilococcica
associata ad ampicillina
Dicloxacillina
Diclò
Cps 250 mg
Fl im 500
(A) 1-2 gr /die
per os qds
(B) 1,5-2,5
mg/kg/die qds
Penicillina antistafilococcica
Tabella 2 - Cefalosporine
Principio attivo
Nome
commerciale
Forma
farmaceutica
e dosaggio
Posologia
(A) adulti
(B) bambini
Note
Cefaclor
Panacef
Cps 500 mg
Cpr 750 mg
Sospensione
Gocce pediatriche
(A) 2-4 gr /die qds
(B) 40-100
mg/kg/die
I° generazione
Per via orale
Non betalattamasi resistente
149
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Cafadroxil
Cefadril
Cefos
Sospensione
Cps 500 mg
Cpr 1 gr
(A) 2-4 gr /die qds
I° generazione
Per via orale
Non betalattamasi resistente
Cefalessina
Ceporex
Keforal
Sospensione
Cps 500
Cpr 1gr
(A) 2-4 gr /die qds
(B) 25-50
mg/kg/die qds
I° generazione
Per via orale
Non betalattamasi resistente
Cefazolina
Acef
Fl im 500 mg
Biazolina
Fl im 1gr
Cefabiozim
Cefamezin Firmacef
Kezolin
Totacef
Zolin
Zolisint
(A) 1-4 gr /die qds
I° generazione
Parenterale
Non betalattamasi resistente
Acetilcefuroxima Oraxim
Tilexim
Zinnat
Zoref
Bustine 250 mg
Cpr 250 mg
Cpr 500 mg
sospensione
(A) 500
mg-1gr/die bis
(B) 250-500
mg/die bis
II° generazione
Orale
Betalattamasi resistente
Cefoxitina
Betacef
Cefociclin
Mefoxin
Tifox
Fl 1gr im
(A) 3-8 im o
ev/die tds o qds
II° generazione (cefamicina)
Parenterale
Betalattamasi resistente
Cefprozil
Procef
Cpr 500 mg
Sospensione orale
(A) 500 mg
ogni 12 ore
(B) 15 mg/kg/die
ogni 12 ore
II° generazione
Orale
Betalattamasi resistente
Ceftriaxone
Rocefin
Fl im/ev 500 mg
(A) 250-500 mg
im stat
(B) 50-75
mg/kg/die
III° generazione (metossimina)
Parenterale
Betalattamasi resistente
Long acting
Tabella 3 - Macrolidi
Principio attivo
Nome
commerciale
Forma
farmaceutica
e dosaggio
Posologia
(A) adulti
(B) bambini
Note
Eritromicina
Eritrocina
Cpr 600 mg
Fl im 100 mg
Sospensione
Bustine 500 mg
(A) 1,5-2 gr/die
per os bis o qid
(B) 50mg/kg/die
tres, quid
Ridotta tollerabilita
gastrointestinale
Azitromicina
Azitrocin
Ribotrex
Trozocina
Zitromax
Sospensione
1500 mg
Cpr divisibili
500 mg
(A) 500 mg/die
stat per 3 giorni
(B) 10 mg/kg/die
per tre giorni
Emivita lunga
Claritromicina
Klacid
Macladin
Veclam
Cpr 250 mg
Sospensione
Fl ev 500 mg
(A) 250-500 mg
ogni 12 ore
(B) 7,5 mg/kg/die
ogni 12 ore
Buona tollerabilità
gastrointestinale
150
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tabella 4 - Metronidazolo e clindamicina
Nome
del farmaco
Quantità della
confezione
Forma
farmaceutica
Dosaggio
Metronidazolo
Deflamon
Flagyl
Metronidazolo
Cpr 250 mg
(A) 750 mg
Nitroimidazolico
-1gr/die qds
Disponibile per via parenterale
(B) 30-40 mg/kg/die (Deflamon flebo fl ev 500 mg)
Pernyzol gel
Siringa pronta
Topico
Uso nelle tasche gengivali
Dalacin C
Cps 150 mg
Fl 600 mg
(A) 600-1200 mg
bis, tds o qds
Lincosamide
Clindamicina
Note
Tabella 5 - Tetracicline
Principio attivo
Nome
commerciale
Forma
farmaceutica
e dosaggio
Posologia
(A) adulti
(B) bambini
Note
Clortetraciclina
Aureomicina
Cps 250 mg
(A) 1-2 gr per
os tds o qds
Ridotto asorbimento
e tolleranza gastrointestinale
Tetraciclina
Actisite
Fili
Topico
Uso nelle tasche gengivali
Doxiciclina
Bassado
Doxiciclina
Doxina
Oram val
Monoxidin
Cps 100 mg
(A) 200 mg/die
bis il primo giorno;
100-200 mg
i successivi
Buon assorbimento e
tolleranza gastroenterica
Minociclina
Minocin
Cps 50 mg
Cps 100 mg
(A) 200 mg/die bis
il primo giorno;
100-200 mg
i successivi
Sovrapponibile a doxiciclina
Tabella 6 - Antimicotici
Principio attivo
Nome
commerciale
Forma
farmaceutica
e dosaggio
Posologia
(A) adulti
(B) bambini
Note
Nistatina
Mycostatin
Sospensione
100.000 U
4-6 sciacqui/die
Polienico per uso topico
Amfotericina B
Fungilin orale
Sospensione
4-6 sciacqui/die
Polienico per uso topico
Miconazolo
Micotef
Gel orale
4-6 sciacqui/die
Azolico per uso topico
Ketoconazolo
Nizoral
Cpr 200 mg
(A) 200-600 mg/die Azolico
in unica
Assumere durante i pasti
somministrazione
(B) 6mg/kg/die tid
Fluconazolo
Biozolene
Diflucan
Elazor
Cps 50 mg
Cps 100 mg
Cps 150 mg
(A) 200 mg/die
il primo giorno;
100 mg i succesivi
per 15 giorni
Itraconazolo
Itrizole
Sporanox
Triasporin
Cps 100 mg
(A) 100 mg/die stat Azolico
Assumere durante i pasti
Azolico
Buona tollerabiltà
151
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Tabella 7 - Antivirali
Principio attivo
Nome
commerciale
Forma
farmaceutica
e dosaggio
Posologia
(A) adulti
(B) bambini
Note
Acyclovir
Aciclovir
Cycloviran
Efriviral
Zovirax
Cpr 400 mg
Cpr 800 mg
Sospensione 8%
Crema
(A) (B) 200 mg
4-5 volte /die
per 5 giorni
Topico
Per via orale
Dideossiuridina
Idustatin
Pomata 3%
Tds, qds
Uso topico
Tabella 8 - Dosaggi ed indicazioni d’uso degli antibiotici betalattamici
ANTIBIOTICO
Amoxicillina + acido clavulanico
Penicilline a spettro molto ampio
Carbenicillina
Ticarcillina
Azlocillina
Mazlocillina
Piperacillina
Sulbenicillina
DOSAGGIO/KG
20-50 mg/kg
SOMMINISTRAZIONE
Per os in 2-3 dosi
50-500 mg/kg
150-300 mg/kg
100-300 mg/kg
100-300 mg/kg
200-300 mg/kg
40-200 mg/kg
e.v. in 4 dosi
e.v. in 4 dosi
e.v. in 4 dosi
e.v. in 4 dosi
e.v. in 4 dosi
e.v. in 4 dosi
NOTE
Più attiva sull’emofilo
Sono usate nel sospetto o nella
certezza di infezione da
Pseudomonas
CEFALOSPORINE
Cefalosporine di I° generazione
Cefalotina
Cefazolina
80-160 mg/kg
25-100 mg/kg
e.v. in 3-4 dosi
e.v. 3-4 dosi
Gram + , cocchi Gram - e alcuni
bacilli Gram- (E. coli, Proteus)
Spiccata attività anti-stafilococco
Cefalosporine di II° generazione
Cefuroxime
Cefamandolo
75-150 mg/kg
40-100 mg/kg
e.v. in 4 dosi
e.v. in 4 dosi
Più attive sui Gram- (Proteus
Klebsiella, Enterobacter,
Hemophilus Influenzae)
75-300 mg/kg
75-150 mg/kg
50-100 mg/kg
e.v. in 4 dosi
e.v. in 4 dosi
e.v. o i.m. in 1 dose
Ancora più attive sui Gramattive sullo Pseudomonas
Indicazione principale per la sepsi
25-50 mg/kg
25-50 mg/kg
25-50 mg/kg
30 mg/kg
20-30 mg/kg
9 mg/kg
8 mg/kg
8 mg/kg
per os in 3-4 dosi
per os in 3-4 dosi
per os in 3-4 dosi
per os in 2 dosi
per os in 2 dosi
per os in monodose
per os in monodose
per os in 2 dosi
Ampio spettro, buona stabilità alle
beta-lattamasi (II e III gen);
agiscono bene sullo stafilococco,
sull’emofilo, moraxella e alcune
enterobatteriacee I gen: batteri Gram
+ (stafiloccocco); no resistenza
alle beta-lattamasi II gen: spettro
d’azione Gram+ e Gram -. Resistenti
alle beta-lattamasi. III gen: ancora
più attivi sui Gram-. Resistenti alle
beta-lattamasi
50-100 mg/kg
(bambino)
25-75 mg/kg
(neonato)
e.v. in 3 dosi
Struttura monociclica di tipo
Beta-lattamico. Attivi solo sui
Gram- (enterobatteriacee).
Resistenti a tutte le lattamasi
40-60 mg/kg
60-120 mg/kg
e.v. in 3-4 dosi
e.v. in 3 dosi
Cefalosporine di III° generazione
Cefotaxime
Ceftazidime
Ceftriaxone
Cefalosporine orali
Cefradina (I gen)
Cefalexina (I gen)
Cefaclor (II gen)
Cefprozil (II gen)
Acetossietilcefuroxima (II gen)
Ceftibuten (III gen)
Cefixime (III gen)
Cefpodoxime proxetil (III gen)
MONOLATTAMICI
Aztreonam
e.v. in 3 dosi
CARBAPENEMICI
Imipenem
Meropenem
Spettro molto ampio, Gram + e
Gram -, compresi
Psuedomonas e anaerobi
152
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
4. ANTIBIOTICI ELENCATI IN ORDINE ALFABETICO PER
NOME COMMERCIALE
FARMACO
PRINCIPIO ATTIVO
DOSE
Alfamox, sciroppo
Alfamox, compresse 1 gr
Amoxicillina
Amoxicillina
Alfamox, capsule 500 mg
Amoxicillina
Ambramicina, capsule
Amoflux, compresse 1gr
Amox, bustine, compresse 1 gr
Amox, sciroppo
Tetraciclina
Amoxicillina
Amoxicillina
Amoxicillina
Amoxillin, compresse 1gr
Amoxillin, sciroppo
Amoxina, compresse 1 gr
Amoxina, sospensione orale 5%
Amoxipen, bustine 1gr
Amoxipen, capsule 500 mg
Ampilisa, compresse 500 mg
Amoxicillina
Amoxicillina
Amoxicillina triidrato
Amoxicillina triidrato
Amoxicillina triidrato
Amoxicillina triidrato
Ampicillina
Ampilisa, gocce 10%
Ampilisa,
fiale i.m. 250 mg, 500 mg, 1 gr
Amplital, capsule 500 mg,
compresse 1 gr
Amplital, sospensione, gocce
Amplital, iniett., fiale 500 mg, 1 gr
Ampicillina
Ampicillina
B: sciroppo 50 mg/Kg/die in tre somm.
A: 1 cps ogni 8 ore
(2-3 g/die in 3-4 somministrazioni)
A: 1 cps ogni 8 ore
(2-3 g/die in 3-4 somministrazioni)
4-6 cps/die s.p.m.
1 cpr ogni 8-12 ore s.p.m.
1 gr ogni 8-12 ore s.p.m.
B: fino a 4 aa. 1/2 cucch.no 1-2 ogni 6
ore;
B: 4-12 aa. 1 cucch.no ogni 8 h s.p.m.
1 cps ogni 8-12 h s.p.m.
B: 25-50 mg/Kg/die ogni 6-8 h s.p.m.
2-3 cpr/die s.p.m.
B: 25-50 mg/Kg/die ogni 6-8 h s.p.m.
1 bust. 2-3/die
1 cps ogni 8 h s.p.m.
1-2 cps ogni 4-6 ore, 1-2 misur. ogni 6
ore, 1 flac. Im ogni 6-8 ore s.p.m.
1-2 misur. ogni 6 ore s.p.m.
1 gr im ogni 6-8 ore s.p.m.
Assoral, compresse 150, 300 mg
Assoral compresse 500 mg
Augmentin, compresse, bustine 1 gr
Augmentin, sospensione,
bustine 312,5 mg
Augmentin, fiale iv. 1,2 gr,
fl. 2,2 gr, fiale 600 mg
Azitrocin, compresse 500,
600 mg, sospensione 1500 mg
Bacacil, compresse 1200, 800 mg
Bassado, capsule
Betabiotic, capsule 500 mg,
compresse 1 gr
Bethacil, fiale im. 1,5 gr,
Biocin, compresse 1 gr
Cedax, compresse 400 mg,
granulare 15 gr 14,4%
Cefamezin, fiale im. 250 mg,
Ampicillina
A: 2-3 g/die in 2-3 somm.
B: 250-500 mg ogni 6 ore s.p.m.
Ampicillina
B: 100 mg/Kg/die in 3 somm. s.p.m.
Ampicillina
A: 1g ogni 8 ore oppure 2 g ogni 12 ore
s.p.m.
B: 100 mg/Kg/die in 3
somministrazioni s.p.m.
Roxitromicina
A: 300 mg/die: 1 cpr ogni 12 ore s.p.m.
Roxitromicina
B: 5-10 mg/Kg/die s.p.m.
Amoxicillina +acido clavulanico A: 1 cpr o bust. x 2/die;
Amoxicillina +acido clavulanico B: 50 mg/Kg/die da dividere in due
somministrazioni s.p.m.
Amoxicillina +acido clavulanico A: 1 gr x 2/die s.p.m.;
B: 50 mg/Kg/die da dividere in due
somministrazioni s.p.m.
Azitromicina
A: 500 mg/die;
B: 10 mg/Kg/die s.p.m.
Bacampicillina
A: 1 cpr x 2/die s.p.m.;
B: 40 mg/Kg/die in 3 somministrazioni
s.p.m.
Doxociclina
1 cps 1-2/die s.p.m.
Flucoxacillina
A: 1 cps o cpr ogni 6 ore s.p.m.;
B: 1 cps o ½ cpr ogni 8 ore s.p.m.
Ampicillina + sulbactam
s.p.m.
Fosfomicina
A: 1 cpr ogni 8 ore;
B: ½ cpr ogni 12 ore s.p.m.
Ceftibufene
s.p.m.
Cefazolina
A: 1-3 g/die;
153
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
500 mg 1 gr
Cefixoral, compresse 400 mg,
granulare, 100 mg x 5 ml
Cefodie, fiale im. 500 mg, 1 gr
Cefosporin, fiale im. 0,5 gr,
1 gr, fiale iv. 1 gr
Cefotrizin, compresse 500 mg,
sospensione orale 100 ml al 5%
Ceporex, compresse 1 gr,
capsule 500 mg
Ciproxin, fiale 400 mg, fiale
100 mg, sospensione orale, bustine
10 mg, compresse 250,500,750 mg
Claforan, fiale im.,
fiale iv. 250,500 mg, 1gr
Clavulin, compresse e bustine 1 gr,
bustine 312,5 g,
sospensione orale 100 ml
Curoxim, fiale im. 250,500 mg,
1 gr, fiale iv. 1-2 gr
Dalacin C, capsule 250 mg
Dalacin C fosfato, fiale 600 mg
Deflamon, compresse 250 mg,
fiale iv. 500 mg
Eposerin, fiale im. 500 mg,
1 gr, fiale iv. 1-2 gr
Eritrocina, compresse 600 mg,
200 mg, fiale im. 100 mg,
sospensione orale, granulare bustine
Fenospen, compresse
B: _-1 cpr/die s.p.m.
Flagyl, compresse 250 mg
Flobacin, compresse 200-300 mg
Flociprin, compresse 250-500-750 mg,
fiale iv. 100 mg
Fosfocin, compresse 1 gr,
fiale im., iv. 1gr
Iosalide, compresse 500 mg,
sciroppo, granulare
Isimoxin, compresse 500 mg,
sospensione
Isocef, compresse 400 mg,
granulare 15 gr 14,4%
Josaxin, compresse 1gr, sospensione
Keflin neutro, fiale 1 gr, 2gr
Cefixima
Cefonicid bisodico
B: 50 mg/Kg/die s.p.m.
A: 400 mg/die;
B: 8 mg/Kg/Die s.p.m.
A: 1g/die im o ev;
B: 50 mg/Kg/die im s.p.m.
Cefonicid bisodico
s.p.m.
Cefatrizina
s.p.m.
Cefalexina
2-3 g/die s.p.m.
Ciprofloxacina
Cefotaxima
500 mg/die in 2 sommin. s.p.m.
A: 2 g/die in 2 iniez;
B: 50-100mg/Kg in 2-4 iniez. s.p.m.
Amoxicillina+acido clavulanico A: 1 gr x 2/die;
B. 50 mg/Kg/die da dividere
in 2 somministrazioni
Cefuroxime
A: 1.5-3 g/die;
B: 30-100 mg/Kg/die s.p.m.
Clindamicina
A: 600-1200 mg/die in 3-4
sommin.s.p.m.;
B. 10-20 mg/Kg/die in 3-4 sommin.
Clindamicina
A: 600-1200 mg/die in 3-4
sommin.s.p.m.;
B. 10-20 mg/Kg/die in 3-4 sommin.
Metronidazolo
Ceftizoxima
A: 3 cpr / die., 1 fl. x 3 die s.p.m
A: 1 gr ogni 12 ore;
B: fino a 12 aa.: 50 mg/Kg/die s.p.m.
Eritromicina
Penicillina V
A:1-2 g/die in 2-3 somministrazioni
s.p.m;
B: 40-50 mg/Kg/die in 4
somministrazioni s.p.m.
A: 1-4 cpr/die s.p.m.;
Metronidazolo
Ofloxacina
3 cpr / die s.p.m.
A: 200-900 mg/die in 2-3 somm.s.p.m.
Ciprofloxacina
250 mg x 2/die s.p.m.
Fosfomicina
Josamicina
3-4 cpr/die da sciogliere in bocca s.p.m.
A: 3-4 cpr/die s.p.m.
B: 50 mg/Kg/die s.p.m.
A: 750-1500 mg/die;
B: 15-30 mg/Kg/die s.p.m.
A: 400 mg/die;
B: 9 mg/Kg/die s.p.m.
A: 1,5-2g/die;
B: 50 mg/Kg/die s.p.m.
A: 500 mg-1 g ogni 4-6 ore;
B: 100 mg/Kg/die s.p.m.
Cefalexina
A: 1-4 g/die;
B: 25-100 mg/Kg/die in 4
somministrazioni s.p.m.
Amoxicillina
Ceftibutene
Josamicina
Cefalotina
Kefloral, compresse 500 gr, 1 gr, sospensione
154
Klacid, compresse 250-500 mg,
fiale iv. 500 mg, sospensione
Lincocin, compresse 500 mg
Lincocin, fiale im. iv., 300-600 mg
Loricin, fiale im. 1,5 gr, fiale iv. 1,5 gr
Macladin, compresse 250-500 mg,
granulare, fiale iv. 500 mg
Mandokef, fiale im. 1 gr, 500 mg,
fiale iv. 1 gr
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Claritromicina
Lincomicina
Lincomicina
Ampicillina+ sulbactam
Claritromicina
Cefamandolo
Midecin, compresse 400 mg
Midecamicina
Minocin, compresse 50-100 mg
Miocamen, compresse 600 mg,
sospensione
Monocid, fiale im. 500 mg, 1 gr
Minociclina
Miocamicina
Cefonicid
Mopen, compresse 500 mg,
1 gr, gocce, sospensione
Amoxicillina (triidrato)
Neo Ampiplus, compresse 1 gr
Amoxicillina (triidrato)
Neo Tetranase, compresse 1 gr,
sospensione
Amoxicillina (triidrato)
Neoduplamox, compresse,
bustine 1 gr, bustine 312,5 mg,
sospensione
Oflocin, compresse 200-300 mg
Amoxicillina + acido
clavulanico
Ofloxacina
Oraxim, compresse 250-500 mg,
bustine 250 mg, sospensione
Cefuroxime axetil
Overal, compresse 50-150-300 mg
Roxitromicina
Panacef, compresse 500 mg, 750 mg
Cefacloro
Panacef, bustine 375 mg gocce,
sospensione 5%
Penglobe, compresse 1200 mg
Cefacloro
Penicillina G potassica, fiale
Penicillina G sodica, fiale
Penstapho, fiale im. 1 gr
Penicillina potassica
Penicillina sodica
Oxacillina
Praticef, fiale im. 1 gr
Cefonicid bisodico
Procef, compresse 500 mg,
sospensione 5%
Ribotrex, compresse 500-600 mg,
sospensione
Rocefin, fiale im. 0,25-0,5-1 gr,
fiale iv. 1-2 gr
Rokital, compresse 400 mg, granulare
Cefprozil
Bacampicillina
Azitromicina
Ceftriaxone
Rokitamicina
A: 1 cpr/12 ore x 6-14 gg. s.p.m.
A: 1 cps ogni 6-8 h
A: 1 fiala ogni 12-24 ore;
B: 10 mg/Kg/die ogni 12-24 h
s.p.m.
A: 1 cpr da 250 mg ogni 12 h s.p.m.
A: 1 g ogni 8 ore fino a 2 gr ogni
4 h nei casi gravi;
B: 100 mg/Kg/die s.p.m.
A: 1g/die s.p.m.;
B: 30-50 mg/Kg/die in 4
somministrazioni s.p.m.
200 mg ogni 12 ore s.p.m.
A: 1-2 gr/die s.p.m.;
B. 50 mg/Kg/die s.p.m.
A: 1gr/die:
B. 50 mg/Kg/die s.p.m.
A: 1 cpr x 2/die s.pm.
B: 40-50 mg/Kg/die in 3
somministrazioni s.p.m.
1,5-3 gr/die in 3 somministrazioni
s.p.m.
A: 2-3 cpr/die s.p.m.
B: 50 mg/Kg/die in 3 somministrazioni
s.p.m.
A: 1 cpr x 2/die;
B: 50 mg/Kg/die da dividere
in 2 somministrazioni
200-900 mg/die in 2-3
somministrazioni s.p.m.
A: 250-1000 mg in 2
somministrazioni/die s.p.m.;
B: 20-30 mg/die in 2 somministrazioni
s.p.m.
A: 1 cpr ogni 12 ore s.p.m.;
B: 5-10 mg/Kg/die s.p.m.
A: 250 mg ogni 8 ore fino a un massimo di 2 g/die s.p.m.
B: 20 mg/Kg/die ogni 8 ore non
superare la dose 1 g/die s.p.m.
A e B sopra i 7 aa 1 cpr ogni 12 ore
s.p.m.
1 im ogni 6-8 ore s.p.m.
s.p.m.
A: 250-500 mg ogni 6 ore;
B: 25-50 mg/Kg/die s.p.m.
A: 1g/die;
B: 50 mg/Kg/die s.p.m.
A: 500 mg ogni 12 ore
B: 15 mg/kg/die ogni 12 ore
A: 500 mg/die s.p.m.
B: 10 mg/Kg/die s.p.m.
A: 1 g/die;
B: 20-80 mg/kg/die s.p.m.
A: 1 cpr x 2/die
B: 20 mg/Kg/die s.p.m.
155
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Rossitrol, compresse 350-500 mg
Roxitromicina
Rovamicina, compresse
Spiramicina
Rulid, compresse 50-150-300 mg
Roxitromicina
Sintopen, compresse 1 gr, granulare
Suprax, compresse 400 mg,
sospensione
Tilexim, compresse 250 mg
Amoxicillina (triidrata)
Cefixima
Cefuroxime axetil
Totacef, fiale im. 500 mg, 1 gr,
fiale iv. 1 gr
Cefazolina
Trozocina, compresse 500-600 mg,
sospensione
Unasyn, fiale iv. 1,5-1 gr,
compresse 750 mg, fiale im. 1,5 gr,
sospensione
Veclam, compresse 250-500 mg,
sospensione, fiale iv. 500 mg
Velamox, fiale 500 mg, 1 gr im., iv.
Azitromicina
Velamox, compresse 1 gr,
capsule 500 mg, sospensione 3,75%
Amoxicillina
Zariviz, fiale im., iv. 250-500 mg, 1 gr
Zimox, compresse 1 gr, 500 mg,
capsule 500 mg, gocce, sospensione
Cefotaxima
Amoxicillina
Zinnat, compresse 250-500 mg,
bustine 250 mg sospensione
Ceforoxime axetil
Zitromax, compresse 500-600 mg,
sospensione
Azitromicina
Ampicillina + sulbactam
Claritromicina
Amoxicillina
A: 300 mg/die s.p.m.
B: 5-10 mg/Kg/die in 2 somministrazioni s.p.m.
A: 2-3 cpr/die;
B: 150.000-225.000 U.I/Kg/die in 3-4
somministrazioni s.p.m.
A: 300 mg/die s.p.m.
B: 5-10 mg/Kg/die in 2 somministrazioni s.p.m.
A: 2-3 cpr/die s.p.m.
A: 400 mg/die
B: 8 mg/Kg/die s.p.m.
A: 250-1000 mg in 2 somministrazioni/die s.p.m.
B: 20-30 mg/die in 2 somministrazioni
s.p.m.
A: 1g x 2/die
B: sotto i 40 Kg 30-50 mg/Kg/die in 2
somministrazioni s.p.m.
A: 500 mg/die s.p.m.
B: 10 mg/Kg/die s.p.m.
A: 1 cpr ogni 12 ore s.p.m.
B: 50 mg/Kg/die in 2-3
somministrazioni s.p.m.
A: 1 cpr da 250-500 mg ogni 12 ore
s.p.m.
A: 2-3 fiale/die ogni 8 ore s.p.m.
B: 50-100 mg/Kg/die s.p.m.
A: 2-3 cps/die s.p.m.
B: 50-75 mg/Kg/die in 2-3
somministrazioni s.p.m.
s.p.m.
A: 500 mg ogni 6-8 ore oppure 1 g ogni
12 ore s.p.m.
B: 30-50 mg/Kg/die in 3
somministrazioni s.p.m.
A: 250-1000 mg in 2
somministrazioni/die s.p.m.
B: 20-30 mg/die in 2 somministrazioni
s.p.m.
A: 500 mg/die s.p.m.
B: 10 mg/Kg/die s.p.m.
5. ANTISETTICI DEL CAVO ORALE
FARMACO
PRINCIPIO ATTIVO
DOSE
Algol, tavolette
Cetilpiridinio cloruro
Antoral, pastiglie
Antoral collutorio
Tibezonio ioduro
Tibezonio ioduro
Antoral
Arscolloid collutorio
Tibezonio ioduro
Alcool diclorobenzilico
+argento proteinato
1 tavoletta ogni 2-3 ore da sciogliere in
bocca, non superare le 8 tavolette/die
4-5 past./die s.p.m.
1 cucch. diluito in un po’ d’acqua 12/die
2 spruzz. Per 2-3/die
10 gocce diluite in un po’ di acqua
156
Arscolloid gengivario
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Borocaina gola, tavolette
Borocaina pastiglie
Bronchenolo gola, pastiglie
Alcool diclorobenzilico
+argento proteinato
Alcool diclorobenzilico
+argento proteinato
Alcool diclorobenzilico
+argento proteinato
Cetilpiridinio cloruro
Cetilpiridinio cloruro
Cetilpiridinio cloruro
Broxodin, collutorio
Clorexidina (digluconato)
Broxodin, gel
Clorexidina (digluconato)
Cetilsan collutorio
Cetilpiridinio cloruro
Cetilsan pastiglie
Cetilpiridinio cloruro
Corsodyl, collutorio
Clorexidina (digluconato)
Corsodyl dental gel
Corsodyl, spray
Corti Arscolloid collutorio
Clorexidina (digluconato)
Clorexidina
Alcool diclorobenzilico+
desametasone+argento proteinato
Alcool diclorobenzilico+
desametasone+argento proteinato
Alcool diclorobenzilico+
desametasone+argento proteinato
Dequalinio cloruro
Arscolloid gengivario
Arcolloid pasta dentifricia
Corti Arscollid concentrato
Corti Arscollid gengivario
Dequadin pastiglie
Dequadin tintura
Decosan gola, pastiglie
Elmex gel
Farin gola, pastiglie
Farin gola, collutorio
Farin gola, spray
Ginvapast
Golacetin, compresse
Golamed, compresse
Golamed oral spray
Golasan, spray
Golasan, gocce
Golasan, pastiglie
Golasan, collutorio
Herbagola, tavolette
1-2 appl./die secondo i casi
Applicazioni locali
Usare 2/die
2-4 tavolette/die da sciogliere in bocca
2-4 tavolette/die da sciogliere in bocca
1 pastiglia ogni 2-3 ore da sciogliere in
bocca, non superare le 8 past./die
1 cucch. Diluito in un po’ d’acqua 12/die
Applicare localmente 1cm di gel e
massaggiare 1/die
1-2 cucch. In un po’ d’acqua per
gargarismi per 3-4/die
1 pastiglia ogni 3-4 ore da sciogliere in
bocca, non superare le 5 pastiglie/die
10 ml di prodotto 2/die per sciacqui del
cavo orale
Spazzolare i denti con il gel 1-2/die
2-3 spruzzi/die
10 gocce diluite in un po’ di acqua,
diversi gargarismi al dì
2-3 appl./die
2-3 appl./die
A: 6-8 past./die;
B: 3-4 past./die
Dequalinio cloruro
6-8 applicazioni/die s.p.m.
Dequalinio cloruro
A: 6-8 past./die;
B: 3-4 past./die s.p.m.
Idrofluoruro di ottadecilammina
1-2 settimana. Controindicato in
+ fluoruro sodico
bambini al di sotto dei 4aa.
Cetilpiridinio cloruro
1 pastiglia ogni 2-3 ore da sciogliere in
bocca
Cetilpiridinio cloruro
1 cucch. 4-5/die per gargarismi
Cetilpiridinio cloruro
2-3 spruzzi nel cavo oro-faringeo per 45/die
Cetilpiridinio cloruro+procaina+
Applicare una piccola quantità sulla
calcio gluconato
gengiva e massaggiare fino ad
assorbimento
Cetilpiridinio cloruro
1 cpr ogni 3 ore da sciogliere un bocca,
non superare le 8 cpr/die
Cicliomenolo
1 compressa ogni 3 ore da sciogliere in
bocca, non superare le 8 cpr/die
Monoiodoglicerolo+domifene bromuro 2-3 spruzzi in gola per 4-5/die
Clorexidina cloridrato
1-2 spruzzate nel cavo oro-faringeo per
2/die
Clorexidina cloridrato
10 gocce in un po’ d’acqua 2/die per
gargarismi
Clorexidina cloridrato
1 past. Ogni 2 ore; i bambini 1 past.
Ogni 3 ore
Clorexidina digluconato
1 cucch. non diluito per 2/die
Cetilpiridinio cloruro
6 tavolette/die da sciogliere in bocca,
nei bambini sopra i 6aa. Non superare
le 4 tavolette/die
157
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Lisomucil gola, compresse
Meridol, collutorio
Dequalinio cloruro+enoxolone
1 compressa ogni 2-3 h s.p.m.
Fluoruro amminico-fluoruro sannoso 2-3 sciacqui/die con 10 ml diluito in
acqua o puro. Non è indicato per i
bambini al di sotto dei 6 aa.
Neo borocillina, compresse
Alcool diclorobenzilico+sodio benzoato 1 cpr ogni 3 ore, non superare le 8
cpr/die
Neo borocillina balsamica,
Alcool diclorobenzilico+terpina
1 cpr ogni 3 ore, non superare le
compresse
idrata+menglitato
8 cpr/die
Neo borocillina C, compresse Alcool diclorobenzilico+acido ascorbico 1 cpr ogni 3 ore, non superare le 8
cpr/die
Neo borocillina collutorio
Alcool diclorobenzilico
2-6 gargarismi/die con un cucch. di
prodotto diluito
Neo borocillina spray
Alcool diclorobenzilico
2-3 erogaz. X 3-4/die
Neo cepacol, pastiglie
Cetilpiridinio cloruro
1 past. ogni 2-3 ore da sciogliere in
bocca, non superare le 8 past./die
Neo coricidin gola, compresse Cetilpiridinio cloruro
1 compressa ogni 2-3 ore da sciogliere
in bocca, non superare le 10 cpr/die
Neo formitrol, pastiglie
Cetilpiridinio cloruro
1 past. ogni 2 ore da sciogliere in bocca,
non superare le 8 past./die
Neo formitrol strong, pastiglie Cetilpiridinio cloruro
1 past. ogni 2 ore da sciogliere in bocca,
non superare le 8 past./die
Oraseptic spray
Esetidina
1-2 appl./die secondo i casi
Oraseptic gola, pastiglie
Cetilpiridinio cloruro+
1 past. ogni 2 ore da sciogliere in bocca,
alcool diclorobezilico
non superare le 8 past./die, nei bambini
sopra i 6 aa. Non superare le 4 past./die
Oraseptic soluzione
Esetidina
1 cucch./die senza diluire
Osagin, pastiglie
Dequalinio cloruro
1 past. Ogni 2-3 ore
Plakkontrol 15, spray
Clorexidina
2-3 spruzzi/die
Plakkontrol 15, collutorio
Clorexidina
2-3 sciacqui/die con 10 ml diluito in
acqua o puro
Plakkontrol fluoractiv, collutorio Fluoro-xilitolo-triclosan
2-3 sciacqui con 10 ml diluito in acqua
o puro
Plak out, collutorio
Clorexidina digluconato
s.p.m.
Pumilsan, caramelle
Dequalinio cloruro
1 caramella ogni 2-3 ore da sciogliere in
bocca
Sol-Jod, gocce
Iodio
10-12 gocce per 3-4/die
Traspulmina gola, pastiglie
Dequalinio cloruro + enoxolone
1 past. Ogni 3-4 ore, non superare le 6
pastiglie/die
6. ANTINFIAMMATORI TOPICI DEL CAVO ORALE
FARMACO
PRINCIPIO ATTIVO
Benzirin
Tantum verde collutorio, spray
Benzidamina
Froben, collutorio, spray
Flurbiprofene
Oki, collutorio
Ketoprofene sale di lisina
Dicloral, collutorio
Zeroflog, collutorio
Diclofenac
DOSE
2-3 sciacqui al giorno con 10-15ml
di collutorio puro o diluito (2-3
spruzzi 4-5 volte/die)
2 sciacqui al giorno con 10ml
di collutorio diluito
2-3 sciacqui al giorno con 15ml di
collutorio puro o diluito con poca acqua
Eutanasia
Il mio conto comincia a non tornare
per i vuoti tra le fila delle persona care.
Si spegne il mio corpo, si raggelano gli affetti,
rinuncio alle speranze e ai progetti.
Scorgo le Parche che tagliano il filo e ci eguagliano
mi privano dei sensi assidui testimoni di vita
mi consegnano a un inconcepibile eterna assenza
mi liberano dall’abitudine di essere qualcuno.
L’essere materiale di un corpo immagino
pallido e immobile che più io non sono
e spersa ogni traccia di parvenza umana
si ricongiunge e ritorna roccia, zolla e pianta.
La miglior morte è quella inattesa
che sorprende il giovane e il vecchio,
non punizione ma legge di natura come nascere,
maturare, crescere figli, invecchiare.
La dolce morte mi spenga tardi
persuaso del viaggio dopo la fatica
sereno e privo di interesse alla vita
con la nostalgia del sole e degli altri.
Mi sia risparmiata l’aggressione di una morte
disgustosa, di un dolore senza prospettiva
dell’agonia di un’inutile lotta per respirare
di un’attesa incupita da un pianto senza ritegno.
Non mascherate con incerte diagnosi non vere
la differenza tra l’essere infermo e il morire.
Non negate a chi soffre il diritto di decidere
quando conviene cessare di vivere.
Una volta per sempre da soli essere morti
è il destino della vita, nell’oblio emarginati
dopo un breve rimpianto di persone care
perché solo i vivi si devono amare.
Felicità
Se senza volerlo
mi chiedo
se sono felice
senza saperlo
mi sento infelice
Risono a commettere
l’enorme errore
di intendere
felicità ininterrotta
un diritto e un dovere
Il bene che è accanto
tanto mi affanno
a cercare lontano
come fosse posto in un punto
che mai è raggiunto
La gioia
equivoco
con la fantasia
di fare mia una verminaia
di mezzi e di ricchezze
Pago tributo alla stoltezza
d’ignorare
la fugace felicità che mi circonda
e vado a venare
d’inutile tristezza
i vari momenti di vera allegrezza.
PARTE H
BIBLIOGRAFIA
.
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
161
1. Abbott PV, Selective and intelligent use of antibiotics in endodontics, Aust Endod J, (2000 Apr) 26 (1) 30-9. Journal code:
100888004. ISSN: 1329-1947.
2. Aldous J.A, Engar R C, Analgesic prescribing patterns in a group of dentists, General Dentistry, (2000 Sep-Oct) 48 (5) 58690. Journal code: 7610466. ISSN: 0363-6771.
3. Al-Karaawi ZM., Lucas, VS, Gelbier M, Roberts GJ, Dental procedures in children with severe congenital heart disease: A
theoretical analysis of prophylaxis and non-prophylaxis procedures, Heart (London), (January, 2001) Vol. 85, No. 1, pp. 6668. print. ISSN: 1355-6037.
4. Anderson R, Calder L, Thomas DW, Antibiotic prescribing for dental conditions: general medical practitioners and dentists
compared, British Dental Journal, (2000 Apr 8) 188 (7) 398-400. Journal code: 7513219. ISSN: 0007-0610.
5. Barry JM, Ferguson CD, Current dental concepts in antibiotic prophylaxis for total joint replacement patients, General
Dentistry, (March April, 2000) Vol. 48, No. 2, pp. 170-172. ISSN: 0363-6771.
6. Bassetti D, Chemioterapici antinfettivi e loro impiego razionale, Intramed communications, 1994
7. Burgess BJ, Epidural abscess after dental extraction, Emergency Medicine Journal, (2001) 18/3 (231). Refs: 4 ISSN: 13510622 CODEN: EMJMB8
8. Caufield PW, Griffen AL, Dental caries. An infectious and transmissible disease, Pediatric Clinics of North America, (2000
Oct) 47 (5) 1001-19, v. Ref: 42 Journal code: 0401126. ISSN: 0031-3955.
9. Cavallo G, Gismondo MR, Terapia antibiotica in boomerang, Omnia arti grafiche MI, 1989
10. Choudhury M, Needleman I, Gillam D, Moles DR, Systemic and local antimicrobial use in periodontal therapy in England
and Wales, Journal of Clinical Periodontology, (2001 Sep) 28 (9) 833-9. Journal code: 0425123. ISSN: 0303-6979.
11. Ciancio SG, Antiseptics and antibiotics as chemotherapeutic agents for periodontitis management, Compendium of Continuing Education in Dentistry, (2000 Jan) 21 (1) 59-62, 64, 66 passim; quiz 78. Ref: 92 Journal code: 9600713.
12. Curry S, Phillips H, Joint arthroplasty, dental treatment, and antibiotics: A review, Journal of Arthroplasty, (2002) 17/1
(111-113) Refs: 37 ISSN: 0883-5403 CODEN: JOAREG
13. Dailey YM, Martin MV, Are antibiotics being used appropriately for emergency dental treatment?, British Dental Journal,
(2001 Oct 13) 191 (7) 391-3. Journal code: 7513219. ISSN: 0007-0610.
14. Delahaye F, De Gevigney G, Should we give antibiotic prophylaxis against infective endocarditis in all cardiac patients, whatever the type of dental treatment, Heart (London), (January, 2001) Vol. 85, No. 1, pp. 9-10. print. ISSN: 1355-6037.
15. Drury GI, Use and abuse of antimicrobials in periodontal therapy, Journal of the western society of Periodontology / Priodontal Abstracts, (2000) 48 (1) 4. Journal code: 7705433. ISSN: 0148-4893.
16. Epstein JB, Chong S, Le ND, A survey of antibiotic use in dentistry, Journal Of The American Dental Association, (2000
Nov) 131 (11) 1600-9. Journal code: 7503060. ISSN: 0002-8177.
17. Fosse, T, Madinier I, Hannoun L, Giraud-Morin C, Hitzig, C, Charbit Y, Ourang S, High prevalence of cfxA beta-lactamase
in aminopenicillin-resistant Prevotella strains isolated from periodontal pockets, Oral Microbiology and Immunology,
(April, 2002) Vol. 17, No. 2, pp. 85-88.
18. Friesen Lynn R, Williams Karen B, Krause Lana S, Killoy William J, Controlled local delivery of tetracycline with polymer
strips in the treatment of periodontitis, Journal of Periodontology, (January, 2002) Vol. 73, No. 1, pp. 13-19. print. ISSN:
0022-3492.
19. Garg L.C, Preventing and treating infections related to dental implant placement. Interview, Dental Implantology Update,
(2001 Oct) 12 (10) 73-7. Journal code: 9114597. ISSN: 1062-0346.
20. Graber CJ, De Almeida KNF, Atkinson JC, Javaheri D, Fukuda CD, Gill VJ, Barrett AJ, Bennett JE, Dental health and viridans streptococcal bacteremia in allogeneic hematopoietic stem cell transplant recipients, Bone Marrow Transplantation,
(March 1, 2001) Vol. 27, No. 5, pp. 537-542 print. ISSN: 0268-3369.
21. Greenstein G, Nonsurgical periodontal therapy in 2000: a literature review, Journal Of The American Dental Association,
(2000 Nov) 131 (11) 1580-92. Ref: 122 Journal code: 7503060. ISSN: 0002-8177.
22. Grossi SG, Treatment of periodontal disease and control of diabetes: an assessment of the evidence and need for future research, Annals Of Periodontology, (2001 Dec) 6 (1) 138-45. Ref: 68 Journal code: 9702874.
23. Iwamoto Y, Nishimura F, Nakagawa M, Sugimoto H, Shikata K, Makino H, Fukuda T, Tsuji T, Iwamoto M, Murayama Y, The
effect of antimicrobial periodontal treatment on circulating tumor necrosis factor-alpha and glycated hemoglobin level in patients with type 2 diabetes, Journal of Periodontology, (June, 2001) Vol. 72, No. 6, pp. 774-778. print. ISSN: 0022-3492.
24. Jaunay T, Sambrook P, Goss A, Antibiotic prescribing practices by South Australian general dental practitioners, Australian
Dental Journal, (2000 Sep) 45 (3) 179-86; quiz 214. Journal code: 0370612. ISSN: 0045-0421.
25. Jeske AH, Pharmacology at the beginning of the 21st century: implications of several new developments for dentistry and
current status of the major 20th century dental drugs, Texas Dental Journal, (2000 Feb) 117 (2) 40-7. Ref: 26 Journal code: 2984821R. ISSN: 0040-4284.
26. Jorgensen MG, Slots J, Practical antimicrobial periodontal therapy, Compendium Of Continuing Education In Dentistry,
(2000 Feb) 21
27. Jorgensen MG, Slots J, Responsible use of antimicrobials in periodontics, Journal Of The California Dental Association,
(2000 Mar) 28 (3) 185-93. Journal code: 8905668. ISSN: 1043-2256.
28. Joscelyne M, Antibiotic prescribing, British Dental Journal, (2000 Nov 11) 189 (9) 467, Journal code: 7513219. ISSN:
0007-0610.
29. Kaar TK, Bogoch ER, Devlin HR, Acute metastatic infection of a revision total hip arthroplasty with oral bacteria after noninvasive dental treatment, Journal of Arthroplasty, (2000) 15/5 (675-678). Refs: 20 ISSN: 0883-5403 Coden: Joareg
30. Khoury F, Buchmann R, Surgical therapy of peri-implant disease: a 3-year follow-up study of cases treated with 3 different
162
31.
32.
33.
34.
35.
36.
37.
38.
39.
40.
41.
42.
43.
44.
45.
46.
47.
48.
49.
50.
51.
52.
53.
54.
55.
56.
57.
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
techniques of bone regeneration, Journal of periodontology, (2001 Nov) 72 (11) 1498-508. Journal code: 8000345. ISSN:
0022-3492.
Kim J, Fortson JK, Cook HE, A fatal outcome from rhinocerebral mucormycosis after dental extractions: A case report,
Journal of Oral and Maxillofacial Surgery, (2001) 59/6 (693-697). Refs: 30 ISSN: 0278-2391 Coden: Jomsda
Kinane DF, Local antimicrobial therapies in periodontal disease, Annals Of The Royal Australasian College Of Dental Surgeons, (2000 Oct) 15 57-60. Ref: 22 Journal code: 8006208. ISSN: 0158-1570.
Laartz BW, Lezama J, Adelman HM, A man with fever, rigors, and poor oral hygiene, Hospital Practice (Office Edition),
(2000 Feb 15) 35 (2) 33, 36-7. Journal code: 8404149. ISSN: 8750-2836.
Laskin DM, Dent CD, Morris HF, Ochi S, Olson JW, The influence of preoperative antibiotics on success of endosseous
implants at 36 months, Annals Of Periodontology, (2000 Dec) 5 (1) 166-74. Journal code: 9702874.
Leistevuo J, Jarvinen H, Osterblad M, Leistevuo T, Huovinen P, Tenovuo J, Resistance to mercury and antimicrobial agents
in Streptococcus mutans isolates from human subjects in relation to exposure to dental amalgam fillings, Antimicrobial
Agents and Chemotherapy, (2000) 44/2 (456-457). Refs: 24 ISSN: 0066-4804 Coden: Amaccq
Leveque L, Turcu A, Bielefeld P, Gresset AC, Duong M, Friedel J, Besancenot J F, [Adult cutaneous periarteritis nodosa and
dental infections. Role of streptococci]. Periarterite noueuse cutanee de l’adulte et infections dentaires. Role des streptocoques, Revue De Medecine Interne, (2001 Oct) 22 (10) 992-6. Journal code: 8101383. ISSN: 0248-8663.
Longman LP, Preston AJ; Martin MV; Wilson NH, Endodontics in the adult patient: the role of antibiotics, Journal Of
Dentistry, (2000 Nov) 28 (8) 539-48. Ref: 103 Journal code: 0354422. ISSN: 0300-5712.
Manz MC, Factors associated with radiographic vertical bone loss around implants placed in a clinical study, Annals Of Periodontology, (2000 Dec) 5 (1) 137-51. Journal code: 9702874.
Mazzaglia G, Arcoraci V, Blandino G, Miragliotta G, Schito AM.; Pasquantonio, G, Nicoletti, G, Caputi AP, Antibiotic prescribing for dental conditions: A community-based study in southern Italy, Journal of Chemotherapy, (February, 2002) Vol.
14, No. 1, pp. 65-70. print. ISSN: 1120-009X.
Meinberg, Trudy A.; Barnes, Caren M.; Dunning, David G.; Reinhardt, Richard A. (1), Comparison of conventional periodontal maintenance versus scaling and root planing with subgingival minocycline, Journal of Periodontology, (February,
2002) Vol. 73, No. 2, pp. 167-172. print. ISSN: 0022-3492.
Meyle J, Gonzales JR, Influences of systemic diseases on periodontitis in children and adolescents, Periodontology 2000,
(2001) 26 92-112. Ref: 180 Journal code: 9313276. ISSN: 0906-6713.
Morelli S, Profilassi dell’endocardite infettiva, Scripta medica, vol 5, n 3, 2002: 99-118
Morris AM., Antibiotics before dental procedures for endocarditis prophylaxis: Back to the future, Heart, (2001) 86/1 (34). Refs: 17 ISSN: 1355-6037 Coden: Hearfr
Nadlacan LM, Hirst P, Infected total knee replacement following a dental procedure in a severe haemophiliac, Knee, (2001)
8/2 (159-161). Refs: 16 ISSN: 0968-0160 Coden: Kneef2
Newman M, Goodman A, Guida all’uso degli antibiotici nella pratica odontoiatrica, Scienza e tecnica dentistica ed int,,
Mi 1987
Noda M, Komatsu H, Inoue S, Sano H, Antibiotic susceptibility of bacteria detected from the root canal exudate of persistent apical periodontitis, Journal Of Endodontics, (2000 Apr) 26 (4) 221-4. Journal code: 7511484. ISSN: 0099-2399.
Norkiewicz DS, Breault LG, Wonderlich ST, Malone KH, The use of chemotherapeutic agents in localized periodontal pockets, Military Medicine, (2001) 166/11 (940-946). Refs: 37 ISSN: 0026-4075 Coden: Mmeda
Palmer NA, Dailey YM, Martin MV, Can audit improve antibiotic prescribing in general dental practice?, British Dental
Journal, (2001 Sep 8) 191 (5) 253-5. Journal code: 7513219. ISSN: 0007-0610.
Pallasch TJ, Global antibiotic resistance and its impact on the dental community, Journal Of The California Dental Association, (2000 Mar) 28 (3) 215-33. Ref: 259 Journal code: 8905668. ISSN: 1043-2256.
Palmer NA, Pealing R, Ireland RS, Martin MV, A study of therapeutic antibiotic prescribing in National Health Service general dental practice in England, British Dental Journal, (2000 May 27) 2000 (10) 554-8. Journal code: 7513219. ISSN:
0007-0610.
Palmer NO, Martin MV, Pealing R, Ireland RS, An analysis of antibiotic prescriptions from general dental practitioners in
England, Journal Of Antimicrobial Chemotherapy, (2000 Dec) 46 (6) 1033-5. Journal code: 7513617. ISSN: 0305-7453.
Palmer NO, Martin MV, Pealing R, Ireland RS, Roy K, Smith A, Bagg J, Antibiotic prescribing knowledge of National
Health Service general dental practitioners in England and Scotland, Journal Of Antimicrobial Chemotherapy, (2001 Feb)
47 (2) 233-7. Journal code: 7513617. ISSN: 0305-7453.
Palmer RM, Long term periodontal problems—the chemotherapeutic aspect, British Dental Journal, (2001 Feb 24) 190 (4)
218. Journal code: 7513219. ISSN: 0007-0610.
Randall CW, Kressin NR, Garcia RI, Sims H, Kazis L, Jones JA, Heart murmurs: Are older male dental patients aware of
their existence, Journal of the American Dental Association, (February, 2001) Vol. 132, No. 2, pp. 171-176. print. ISSN:
0002-8177.
Russo G., Dal Corso L, Biasiolo A, Berengo M, Pengo V, Simple and safe method to prepare patients with prosthetic heart
valves for surgical dental procedures, Clinical and Applied Thrombosis/Hemostasis, (2000) 6/2 (90-93). Refs: 25 ISSN:
1076-0296 Coden: Cathf
Ryan ME, Baker DM, Tetracycline treatment of periodontal disease: Antimicrobial and non-antimicrobial mechanisms,
Nelson, M.; Hillen, W.; Greenwald, R. A.. (2001) pp. 237-265 Tetracyclines in biology, chemistry and medicine. print. Publisher: Birkhaeuser Boston 675 Massachusetts Avenue, Cambridge, MA, 02139, SA. ISBN: 3-7643-6282-0 (cloth).
Scaglione F, Antibiotici, Intramed communications, 1992
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
163
58. Sculean A, Blaes A, Arweiler N, Reich E, Donos N, Brecx M, The effect of postsurgical antibiotics on the healing of intrabony defects following treatment with enamel matrix proteins, Journal Of Periodontology, (2001 Feb) 72 (2) 190-5. Journal code: 8000345. ISSN: 0022-3492.
59. Serino G, Rosling B, Ramberg P, Hellstrom MK, Socransky SS, Lindhe J, The effect of systemic antibiotics in the treatment
of patients with recurrent periodontitis, Journal Of Clinical Periodontology, (2001 May) 28 (5) 411-8. Journal code:
0425123. ISSN: 0303-6979.
60. Shand JM, Breidahl A, Hing NR, Johnstone BR, Wiesenfeld D, Ascending necrotising fasciitis as a result of odontogenic infection: a report of two cases, Australian Dental Journal, (2001 Jun) 46 (2) 134-8. Journal code: 0370612. ISSN: 00450421.
61. Shiota Y, Arikita H, Horita N, Hiyama, J, Ono T, Ohkawa S, Yamakido M, Septic pulmonary embolism associated with periodontal disease: Reports of two cases and review of the literature, Chest, (February, 2002) Vol. 121, No. 2, pp. 652-654.
print. ISSN: 0012-3692.
62. Simon C, Stille W, Manuale Menarini di Terapia antibiotica, Mediserve 1992
63. Siqueira JJF, Strategies to treat infected root canals, So Journal Of The California Dental Association, (2001 Dec) 29 (12)
825-37. Ref: 85 Journal code: 8905668. ISSN: 1043-2256.
64. Tong DC, Rothwell BR, Antibiotic prophylaxis in dentistry: A review and practice recommendations, Journal of the American Dental Association, (March, 2000) Vol. 131, No. 3, pp. 366-374. ISSN: 0002-8177.
65. Torres MC, Ramos ME, Coelho TL, Harari S, Salivary Streptococcus mutans and Lactobacillus sp levels in cardiac Children, Journal Of Clinical Pediatric Dentistry, (2001 Fall) 26 (1) 103-9. Journal code: 9100079. ISSN: 1053-4628.
66. Vergis EN, Demas PN, Vaccarello SJ, Yu VL, Topical antibiotic prophylaxis for bacteremia after dental extractions, Oral Surgery Oral Medicine Oral Pathology Oral Radiology and Endodontics, (February, 2001) Vol. 91, No. 2, pp. 162-165. print.
ISSN: 1079-2104.
67. Vezeau PJ, Dental extraction wound management: medicating postextraction sockets, Journal Of Oral And Maxillofacial
Surgery, (2000 May) 58 (5) 531-7. Ref: 88 Journal code: 8206428. ISSN: 0278-2391.
68. Vogel M, Knirsch W, Lange PE, Severe complications caused by failure to practise prophylaxis against bacterial endocarditis during dental work in adults with congenital heart disase, DMW Deutsche Medizinische Wochenschrift, (March 24,
2000) Vol. 125, No. 12, pp. 344-347. print. ISSN: 0012-0472.
69. Whitesides L, Cotto-Cumba C, Myers RA, Cervical necrotizing fasciitis of odontogenic origin: a case report and review of
12 cases, Journal Of Oral And Maxillofacial Surgery, (2000 Feb) 58 (2) 144-51; discussion 152. Ref: 42 Journal code:
8206428. ISSN: 0278-2391.
70. Zanon E, Martinelli F, Bacci C, Zerbinati P, Girolami A, Proposal of a standard approach to dental extraction in haemophilia patients. A case-control study with good results, Haemophilia, (2000) 6/5 (533-536). Refs: 17 ISSN: 1351-8216 Coden: Haemf4
71. Zeller V, Datry A, Vandamme X, Charlotte F, Carrierre J, Caumes E, Bricaire F, [Rhinocerebral mucormycosis in diabetic
patient revealed by dental extraction]. Mucormycose Rhinocerebrale Chez Un Diabetique Revelee Par Une Extraction Dentaire, Journal de Mycologie Medicale, (2001) 11/1 (50-52). Refs: 8 ISSN: 1156-5233 CODEN: JMYME5
72. Zuckerman JM, Kaye D, Prevention of endocarditis in the dental patient, Infections in Medicine, (2001) 18/2 (107-113).
Refs: 30 ISSN: 0749-6524 Coden: Inmdeg
Problema
Non so la ragione della corsa
che accade e torna a accadere come farsa
in cui rinnego il sogno raggiunto
Frutto di realtà casuale
o ricerca di patetico sogno
di evolvere in ipotetico meglio?
Paura del vuoto mascherata
abituata a ritmo serrato di vita
incapace di stare sola inattiva?
Il tempo in corsa mi concede d’essere
appena quel che mi serve essere
e non di meditare su ogni atto elementare
Attesa
Il quotidiano arranco
dove soggiorno stanco
senza il tempo d’essere
Mi lascio sorprendere
da un’ansia misteriosa
di acre senso di attesa
Cosa sto ad attendere?
Un giorno un anno un mese
sono sempre ugual cose
Avverti vita noiosa
scarto tra potenziale
personale e esser reale
Sono specie animale
Nulla è dato attendere
a chi non sa credere
Domani potrò stare
Veder la vita fluire
come acqua muore in mare
Ora è tempo d’uscire
identità cercando
propria sfidando il mondo.
PARTE I
INDICE ANALITICO
.
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Abuso di antibiotici, 28
Actinomicosi, 57
Acyclovir, 117
Agenti patogeni batterici, 28
Aggiustamenti posologici nella insufficienza epatica, 82
Aggiustamento posologico nell’insufficienza renale, 84
Allattamento, 79
Allergia alle betalattamine, 87
Alogeni, 126
Alveolite postestrattiva, 57
Amfotericina -B, 108
Aminoglicosidi
Aminopenicilline, 46, 79
Amoxicillina, 46
Anaerobi, 29, 33
Antibiogramma, 24
Antibiotici polienici, 107
Antibioticoresistenza, 25
Antibioticoterapia e chemioterapia antinfettiva
definizione, 19
Antisettici, 155
Area sotto la curva, 23
Assorbimento, 20, 37
Assorbimento gastroenterico, 77, 83
Assorbimento orale nell’insufficienza renale, 83
Attività sovrapponibile alle penicilline, 52
Audit, 13
Batteriocidia, 24
Batteriocidia lenta, 47, 49
Batteriocidia veloce, 55
Batteriostasi, 24, 54
Betalattamasi, 47
Biodisponibilità, 20
Candidosi orale, 109
Cefalosporine, 47
Cefprozil, 48
Cheilite angolare, 111
Chetoconazolo, 108
Chinoloni, 55
Ciprofloxacina, 56
Claritromicina, 53
Clearence creatinina, 83
Clindamicina, 53
Clorexidina, 126
Colite pseudomembranosa, 91
Commensali e opportunisti patogeni, 28
Concentrazione minima inibente, 23, 92
Contraccettivi orali, 40, 77
Cox, 130
Curva dose risposta, 23
Danni fetali, 78
Derivati azolici, 108
Dialisi, 85
Dialisi peritoneale, 85
Dializzabilità, 85
Diaree, 90
Differenza di prescrizione in diversi paesi, 11
167
Differenza nella frequenza delle prescrizioni
antibiotiche tra medici e odontoiatri, 13
Dismicrobismo intestinale, 90
Distribuzione, 22
Diverse categorie di tossicità dei farmaci in gravidanza, 78
Dosaggi pediatrici, 76
Doxiciclina, 55
Drenaggio, 37
Durata della somministrazione, 37
Efficacia della profilassi nell’endocardite infettiva, 92
Eliminazione, 22
Eliminazione renale, 22
Emitiva plasmatica, 23, 77, 81
Emodialisi, 85
Empirica terapia
Endocardite infettiva, 92
Enterocoliti aspecifiche, 90
Entità dell’insufficienza renale
Epatotossicità, 81
Escrezione mammaria, 79
Esetidina, 126
Famciclovir, 118
Famiglie di antimicotici, 107
Famiglie di antivirali, 117
Fans, 129
Farmacocinetica nozioni generali, 20
Farmacodinamica nozioni generali, 24
Farmacosorveglianza, 139
Fattori predisponenti locali, micosi, 109
Fenoli, 126
First pass effect, 81
Flora batterica orale nel neonato, 76
Flora del cavo orale, 30, 79
Flora orale commensale, 28
Fluconazolo, 108
Formazione, 13
Frequenza delle prescrizioni in odontoiatria, 12
Genetic exchange, 26
Gengivite necrotizzante, 57
Gengivostomatite erpetica, 118
Gentamicina, 55
Gerodontoiatria, 79
Gestione e monitoraggio della terapia antibiotica, 36
Gram-, resistenza, 27
Gram+, resistenza, 27
Gravidanza, 76
Herpes simplex labiale e intraorale, 118
Herpes zoster, 121
I generazione cefalosporine, 48
Idoxiuridina, 119
II generazione cefalosporine, 48
III generazione cefalosporine, 49
In agendo, in omittendo, colpa, 137
Inattivazione enzimatica intra o extra cellulare, 27
Incompatibilità, 40
Indicazioni alla profilassi nelle infezioni
postchirurgiche, 101
168
Infezione, 92
Infezioni odontogene localizzate, 58
Infezioni odontogene profonde, 62
Infezioni post-chirurgiche, 101
Inibitori delle batalattamasi, 47
Insuccessi della contraccezione orale, 77
Insuccesso terapeutico, 38
Insufficienza epatica, 81
Insufficienza renale, 83
Interazioni farmacologiche, 40
Interazioni tra antibiotici, 40
Intolleranza gastrointestinale, 89
IV generazione cefalosporine, 51
Lincosamidi, 53
Linee guida nell’endocardite infettiva, 95
Localizzazione d’organo, 39
Longacting cefalosporine, 52
Macrolidi, 52
Mancata risposta alla terapia, 76
Meccanismi di resistenza batterica, 26
Meccanismo d’azione antimicotici, 107
Meccanismo diretto o indiretto della resistenza, 25
Metabolizzazione, 22, 77, 82, 83
Metronidazolo, 55
MIC (vedi concentrazione minima inibente), 92
Miconazolo, 107, 108
Micosi superficiali, 107
Minimal bactericidal concentration, 25
Minimal inhibitory concentration, 25
Mirata terapia, 19
Misure preventive nella EI, 95
Modificazioni farmacocinetiche in gerodontoiatria, 80
Modificazioni farmacocinetiche in gravidanza, 77
Modificazioni farmacocinetiche nell’insufficienza
epatica, 81
Modificazioni farmacocinetiche nell’insufficienza
renale, 83
Nefropatia da fans, 132
Nesso di causalità materiale, 138
Nesso di causalità psicologico, 138
Nistatina, 108
Nitroimidazoli, 55
Nomi commerciali di chemioterapici antinfettivi, 152
Note compilazione scheda di segnalazione, 140
Orticaria, 87
Ospite compromesso, 85
Osteolielite, 64
Parodontiti croniche, 68
Parotite batterica, 72
Patogenesi, 39
Pedodonzia, 76
Penicilline, 46
Perimplantite, 71
Perossidi, 126
Plasmidi, 25
Prelievi microbiologici, 33
Prima scelta, 33
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
Profilassi, 92
Profilassi antibiotica, 92
Profilassi antibiotica in chirurgia orale, 103
Profilassi antibiotica nell’endocardite infettiva,
difformità dai protocolli, 95, 138
Profilasi dell’ulcera peptica, 132
Profilassi nell’endocardite batterica, 95
Profilassi per protesi articolari ortopediche, 97
Programmi di formazione, 13
Protesi ortopediche, 97
Protesi sistemiche, 99
Pulito-contaminato, intervento chirurgico, 102
Ragionata terapia, 19, 32
Razionale di terapia antibiotica in gerodontoiatria, 80
Razionale di terapia antibiotica in gravidanza, 78
Razionale di terapia antibiotica nell’insufficienza
epatica, 82
Razionale di terapia antibiotica nell’insufficienza
renale, 83
Reazioni allergiche ai macrolidi, 88
Reazioni allergiche alle penicilline, 87
Reazioni allergiche crociate tra betalattamine, 87
Reazioni avverse, 39
Reazioni avverse agli antimicotici, 108
Reazioni avverse in gravidanza, 78
Resistenza acquisita, 25
Resistenza innata, 25
Responsabilità professionale in antibioticoterapia, 137
Responsabilità professionale in profilassi, 137
Sali di ammonio quaternario, 126
Sanguinaria, 126
Scelta del chemioterapico antibatterico, 32
Scelta eccezionale, 33, 55, 56
Schemi posologici nella profilassi delle infezioni
postchirurgiche, 103
Seconda scelta, 33
Short team, 103
Sinusite odontogena, 74
Stima del rischio di sviluppare l’EI infettiva, 94
Stomatite da protesi mobile, 113
Streptococchi, 28, 33
Terapia delle micosi, 107
Terapia delle virosi, 118
Terapia ragionata, 19, 32
Terapia sistemica, micosi, 108
Terapia topica, micosi, 107, 109, 113
Tetracicline, 53
Tipo cromosomico resistenza, 25
Tipo extracromosomico resistenza, 25
Trasporto, 22, 83
Ultra short team, 103
VAD (vedi volume apparente di distribuzione)
Valaciclovir, 118
Via di somministrazione, 19
Volume apparente di distribuzione, 22
Volume di distribuzione, 77, 83
Volume di distribuzione nell’insufficienza renale, 83
.
Cascata
Bianca schiuma che s’allarga,
cade, rimbalza e s’infrange
tra il verde muschio e il lichene.
In rivo si ricompone
e al lago si ricongiunge
nel verde azzurro dell’alga.
A un tuffo ardito in cascata,
freddo impatto che colpisce
i sensi, mi scopro incline.
Sto a mirar la mia immagine
dal guizzo aureo d’un pesce
in acqua ondeggiar tagliata.
Pura acqua materia e forza
senza alcun fine e intenzione,
sino a pensiero a te estraneo
stimoli l’intelligenza
del gioco immaginazione,
tu perenne e io temporaneo.
Tra ruderi deserti e rovine antiche
La ragione con gli occhi ciechi
proni all’autorità degli antichi
visita preda di nostalgie e teologie
bianche, erbose archeologie.
Perlustro la quieta grandezza
e miro muto la nobile bellezza
di fori, anfiteatri, basiliche
acquedotti, terme di città antiche.
Antica e perfetta integrità
che dimentica la quotidianità
dell’affettuosa vita familiare
e della corruzione volgare.
Immagino e affollo le rovine con vite
perenne archivio di forme svanite
di cose e persone ricche e cenciose
nel quotidiano logorate e polverose.
Cardi decumani postriboli
domus urbes empori enopoli
lane sbiancate con le urine
dagli schiavi nelle officine.
Evocare sentimenti è delle pietre
il magico indissolto perenne potere
come le cose che nascono muoiono
si trasformano e ancor sopravvivono.
La nostra vita
La nostra vita è emozione
senza una grande idea epica
stemperata abitudine
in attesa di lirica.
La nostra vita baratta
con il quotidiano agire
nella sua continua fretta
un pien profondo sentire
La nostra vita ci ha unito
con quanto abbiamo costruito
nel tempo sino a credere
che divisi è non vivere.
La nostra vita affollata
senza aver mai un solo attimo
per dirti o mia adorata
quanto a fondo e tanto ti amo.
Segreto
Ho intuito e m’infiamma
un frammento di banale verità.
A chi la dico? Con chi la condivido?
Non con chi ha fretta, non si soffermerebbe.
Non con un estraneo, non la capirebbe.
Ho intuito un’altra verità:
la tengo per me!
Rimane in bocca l’amaro
dell’infantile soffocata pulsione
che battuta ancor sopravvive
e vuole raccontare al mondo
l’ultima affascinante scoperta.
Ricordi
Ricordo di aver già ricordato
questa scena che avvenne vera una volta
e improvvisa torna e avviene di nuovo
nella mente innumerevoli volte
Persecuzione di atti passati
che si ripete come un patetico grido
e ripropone un volto inviso
uno dei miei volti antichi
Che titolo per il ricordo?
Io che non riesco a ricordare
senza errore un nome o un volto
La colpa sta nell’infausta interpretazione
negli atti passati che pur non furono misfatti
o nella chimica azione di un momentaneo ormone?
Istrione
In un delirio controllato
che contrapponeva
mondo irreale a mondo ordinario
s’addestrò a essere qualcuno
perché non si scoprisse
che non era nessuno
La felicità singolare del recitare
si spense sul palco con l’eco
dell’ultimo rima acclamata
Uno dei due
Condividiamo gli stessi oggetti ideali
i paradossi della vita e la logica degli scacchi
in un anelito ironico di chiarezze essenziali
Uno si lascia vivere per essere se stesso
per il tempo sempre più breve rimasto
L’altro quasi fosse eterno trama per soggiogare
il primo al servizio della sua vanità d’apparire
Quale dei due il giusto rinchiuse?
Quale dei due questo verso stese?
Sogni sfumati di volti diversi
destinati a confondersi e perdersi
consapevoli di comune destino
di sopravvivere da soli non un solo secondo.
Fine settimana
Lascio l’orologio e mi ritiro
per riposare trai libri in giardino
in isolamento amato con forza
per scongiurare la malinconia
della solitudine
Spettatore di me stesso
della vita che mi cambia
da solo non sono così solo
L’isolamento è una situazione
la solitudine un sentimento
Un disilluso torpore gli chiese
in quale idea o in quale cosa
fosse l’arido testamento
Non vi era piacere o sostanza
nelle sue parole ridondanti
solo un freddo sogno che nessuno sognava
S’accorse d’essere un patetico niente
che mescolato agli altri era solo
tanto inaridito che non sapeva stare solo
Tornava inorridito al villaggio natale
per porre rimedio al suo male
e guariva col vivere concreto il malato
Surreale
Cielo azzurro su un mare blu
Cielo di zaffiro su mare di lapislazzuli
Cielo di mela su mare d’erba
Cielo di limone su mare d’arancio
Cielo di piombo su mare di mercurio
Si guarda solo una volta nell’infanzia
Il resto è sogno o memoria.
STAMPATO NEL MAGGIO 2003
DA CIERRE GRAFICA
via Ciro Ferrari, 5 - Caselle di Sommacampagna (Verona)
tel. 045 8580900 - fax 045 8580907
www.cierrenet.it
67100 - l’aquila - via campo di pile
Centr. Tel. Elettronico 0862/33.81- 25 linee r.a.
Fax 0862/31.81.08 - 0862/33.82.19 - 0862/33.82.01
Dompé s.p.a.
Uffici di: 20122 - milano - via san martino, 12 - 12/a
Centr. Tel. Elettronico 02/5.83.83. 1 - - 40 linee r.a.
Fax 02/58.30.05.90 - 02/58.30.87.14
Internet: http://www.dompe.it - E-mail: [email protected]
Tele-Video Conferenza Auditorium
SACRA EST MEDICINA VETUSQUE DEORUM INVENTUM
Centro Servizi Medico Ospedalieri con Farmacovigilanza norme CEE
CHEMIOTERAPIA
ANTINFETTIVA
IN ODONTOIATRIA
FABRIZIO MONTAGNA
CHEMIOTERAPIA ANTINFETTIVA IN ODONTOIATRIA
FABRIZIO MONTAGNA
Dompé
Dompé