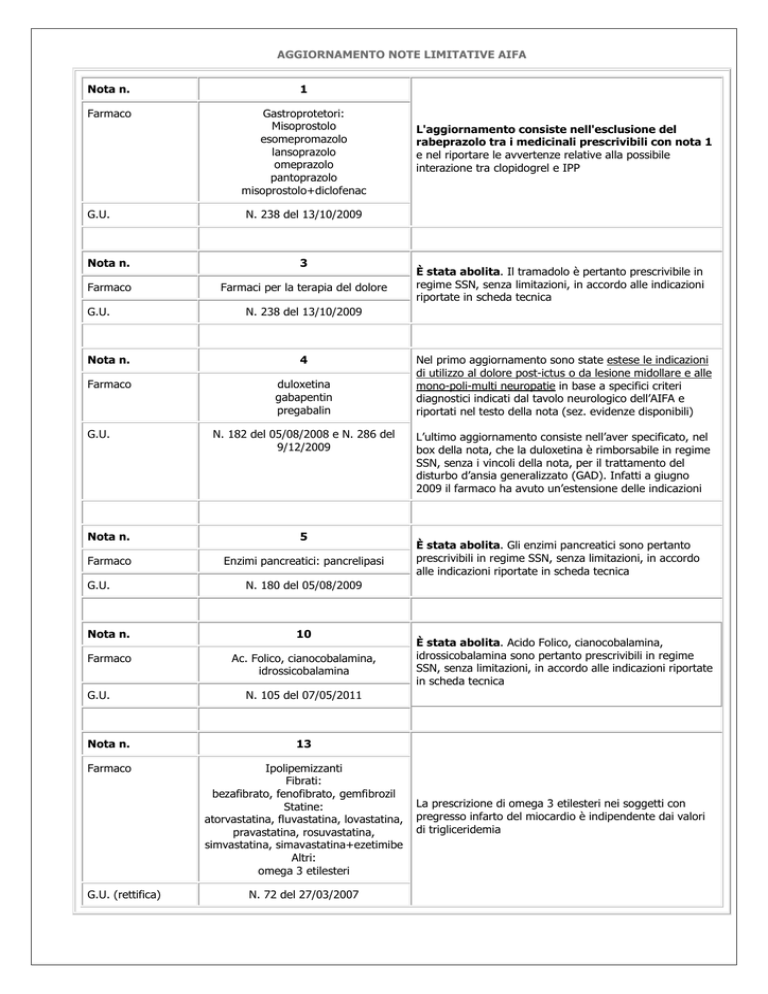
AGGIORNAMENTO NOTE LIMITATIVE AIFA
Nota n.
1
Farmaco
Gastroprotetori:
Misoprostolo
esomepromazolo
lansoprazolo
omeprazolo
pantoprazolo
misoprostolo+diclofenac
G.U.
N. 238 del 13/10/2009
Nota n.
3
Farmaco
Farmaci per la terapia del dolore
G.U.
4
Farmaco
duloxetina
gabapentin
pregabalin
N. 182 del 05/08/2008 e N. 286 del
9/12/2009
Nota n.
5
Farmaco
Enzimi pancreatici: pancrelipasi
G.U.
10
Farmaco
Ac. Folico, cianocobalamina,
idrossicobalamina
L’ultimo aggiornamento consiste nell’aver specificato, nel
box della nota, che la duloxetina è rimborsabile in regime
SSN, senza i vincoli della nota, per il trattamento del
disturbo d’ansia generalizzato (GAD). Infatti a giugno
2009 il farmaco ha avuto un’estensione delle indicazioni
È stata abolita. Gli enzimi pancreatici sono pertanto
prescrivibili in regime SSN, senza limitazioni, in accordo
alle indicazioni riportate in scheda tecnica
È stata abolita. Acido Folico, cianocobalamina,
idrossicobalamina sono pertanto prescrivibili in regime
SSN, senza limitazioni, in accordo alle indicazioni riportate
in scheda tecnica
N. 105 del 07/05/2011
Nota n.
13
Farmaco
Ipolipemizzanti
Fibrati:
bezafibrato, fenofibrato, gemfibrozil
Statine:
atorvastatina, fluvastatina, lovastatina,
pravastatina, rosuvastatina,
simvastatina, simavastatina+ezetimibe
Altri:
omega 3 etilesteri
G.U. (rettifica)
Nel primo aggiornamento sono state estese le indicazioni
di utilizzo al dolore post-ictus o da lesione midollare e alle
mono-poli-multi neuropatie in base a specifici criteri
diagnostici indicati dal tavolo neurologico dell’AIFA e
riportati nel testo della nota (sez. evidenze disponibili)
N. 180 del 05/08/2009
Nota n.
G.U.
È stata abolita. Il tramadolo è pertanto prescrivibile in
regime SSN, senza limitazioni, in accordo alle indicazioni
riportate in scheda tecnica
N. 238 del 13/10/2009
Nota n.
G.U.
L'aggiornamento consiste nell'esclusione del
rabeprazolo tra i medicinali prescrivibili con nota 1
e nel riportare le avvertenze relative alla possibile
interazione tra clopidogrel e IPP
N. 72 del 27/03/2007
La prescrizione di omega 3 etilesteri nei soggetti con
pregresso infarto del miocardio è indipendente dai valori
di trigliceridemia
N del 163 del 15/07/2001
Nota n.
Farmaco
36
Testosterone
G.U.
N. 270 del 22/11/2010
Nota n.
Farmaco
39
Ormone della crescita (somatropina)
G.U.
N. 238 del 13/10/2009
N. 286 del 9/12/2009
N. 270 del 18/11/2010
Nota n.
42
Farmaco
Bifosfonati:
acido etidronico
acido clodronico
G.U.
N. 238 del 13/10/2009
Con questo provvedimento sono state apportate
significative modifiche:
- le statine vengono suddivise in 1° e di 2° livello, con
indicazioni ben precise sulla loro utilizzazione in funzione
del rischio individuale del paziente e dei valori target di
LDL da raggiungere;
- viene introdotta l'ezetimibe come farmaco singolo;
- le nuove indicazioni all'impiego sono: ipercolesterolemia
poligenica, dislipidemie familiari, iperlipidemie in pazienti
con IRC e iperlipidemie indotte da farmaci;
- scompaiono le Carte di Rischio del Progetto Cuore e
sono utilizzati i criteri delle LG AHA/ACCe, ESC/EASD che
stratificano il rischio cardiovascolare individuale in base
alla presenza o meno di alcune patologie e/o di fattori di
rischio.
- Eliminato il principio attivo metiltestosterone
- Specificata la tipologia di ipogonadismi primitivi e
secondari che devono essere caratterizzati da “ridotte
concentrazioni di testosterone totale (< 12 nmoli/L o 350
mg/dl), in presenza di sintomi tipici (riduzione desiderio e
potenza sessuale, osteoporosi, riduzione forza muscolare,
obesità viscerale, alterazioni del tono dell’umore)”
- Eliminata la condizione di pubertà ritardata
Nella prima revisione sono state estese le indicazioni
dell’età evolutiva includendo i bambini nati piccoli per l’età
gestazionale (GSA) con età ≥ a 4 anni (autorizzazione al
trattamento per 2 anni e relativo monitoraggio) ed è stata
introdotta l’età di transizione
Nella seconda revisione sono state riportate modifiche al
testo in riferimento al trattamento dei soggetti prepuberi
affetti dalla sindrome di Prader Willi (PWS).
Nella terza revisione è stat inserita l’età neonatale, in
individui con evidenza neuroradiologica di
malformazioni/lesioni ipotalamo-ipofisarie e segni clinici
laboratoristici compatibili con la diagnosi di
panipopituitarismo congenito
L’aggiornamento consiste nell’aver aggiunto, nella sezione
particolari avvertenze, la seguente frase: “Di recente,
l’Advisory Committee dell’FDA ha pubblicato un warning
circa l’eventuale insorgenza di dolore severo, talora
disabilitante, a livello osseo, articolare o muscolare
associato alla assunzione di bifosfonati. Tale
sintomatologia differisce dalla sindrome acuta similinfluenzale (acute-phase reaction APR) caratterizzata da
febbre, raffreddore, dolore osseo, artralgia e mialgia che
comunemente si osserva in seguito a somministrazione
endovenosa dei bifosfonati iniettabili"
Nota n.
55
Farmaco
Antibiotici iniettabili per uso extraospedaliero:
ceftazidime
cefepime
mezlocillina
piperacillina
ampicillina-sulbactam
piperacillina+tazobactam
amikacina
gentamicina
netilmicina
tobramicina
G.U.
56
Farmaco
Antibiotici per continuità
ospedale-territorio
Aztreonam
imipinem+ cilastatina
rifabutina
teicoplanina
Nota n.
Farmaco
N. 268 del 17/11/2009
N. 150 del 30/06/2011
La variazione è di tipo formale; nella sezione "evidenze
disponibili" al punto 2) è stato riportato:
monobattami (aztreonam); efficaci verso i soli gramnegativi “difficili”
anzichè
farmaci efficaci verso i soli gram-negativi “difficili", simili,
nei riguardi di questi, alle cefalosporine di III e IV
generazione (aztreonam)
La seconda variazione ha riguardato:
•
l'esclusione dalla nota dei principi attivi ertapenem e
meropenem
•
la possibilità per il MMG di iniziare il trattamento con
gli antibiotici, senza che questo sia iniziato in
ospedale. La nota specifica che la decisione da parte
del MMG di intraprendere il trattamento debba
essere sostenuta da un'adeguata indagine
microbiologica, documentata efficacia del farmaco e
assenza di alternative terapeutiche
57
Antiemetici (antagonisti dei recettori
serotoninegici)
G.U. n.
N.180 del 05/08/2009
Nota n.
59
Farmaco
Lattilolo, lattulosio
G.U. n.
La prescrizione a carico del SSN è limitata alle seguenti
condizioni:
-trattamento iniettivo di infezioni gravi delle vie
respiratorie, delle vie urinarie, dei tessuti molli, intraaddominali, ostetrico-ginecologiche, ossee e articolari;
-trattamento iniettivo delle infezioni causate da
microrganismi resistenti ai più comuni antibiotici,
particolarmente nei pazienti immunocompromessi
N. 238 del 13/10/2009
Nota n.
G.U.
Sono state tolte tutte le cefalosporine di II generazione e
tra quelle di III/IV sono rimaste solo ceftazidime e
cefepime
N.104 del 07/05/2011
È stata abolita. Gli antagonisti dei recettori
serotoninergici sono pertanto prescrivibili in regime SSN ,
senza limitazioni, in accordo alle indicazioni riportate in
scheda tecnica
È stata abolita. Lattulosio e lattilolo sono pertanto
prescrivibili in regime SSN , senza limitazioni, in accordo
alle indicazioni riportate in scheda tecnica
Nota n.
65
Farmaco
Farmaci per la sclerosi multipla:
glatiramer acetato
interferoni beta 1a e beta 1b
ricombinanti
Fingolimod cloridrato
G.U.
Nota n.
Farmaco
G.U.
N. 182 del 05/08/2008
N. 75 del 31/03/2009
N. 194 del 22/08/2012
66
Antinfiammatori non steroidei
N. 194 del 21/08/2012
Nota n.
74
Farmaco
Farmaci per l’infertilità femminile e
maschile:
follitropina α ricombinante
follitropina β ricombinante
lutropina α
menotropina
urofollitropina
follitropina α + lutropina α
coriogonadotropina α
G.U.
Nota n.
Farmaco
G.U.
N. 81 del 05/04/2008,
N. 156 del 08/07/2009,
N.113 del 17/05/2010
75
Farmaci per la disfunzione erettile:
alprostadil
sildenafil
vardenafil
tadalafil
N. 279 del 29/11/2010
Nota n.
76
Farmaco
Ferrico gluconato, ferromaltoso,
ferroso gluconato, ferroglicinalsolfato
G.U.
N. 106 del 09/05/2011
Nella prima revisione è stato specificato che la sclerosi
multipla recidivante-remittente è diagnosticata secondo
i criteri di Polman (Polman, 2005) con punteggio
sull’Expanded Disability Status Scale (EDSS) tra 1.0 e 5.5
Nella seconda revisione sono state apportate delle
modifiche alle sezioni evidenze disponibili e bibliografia.
Nella terza revisione è stato introdotto il farmaco
fingolimod per i pazienti con sclerosi multipla recidivante
- remittente (SMRR) grave ad evoluzione rapida, definita
da due o più recidive disabilitanti in un anno, e con 1 o
più lesioni captanti gadolinio alla RM cerebrale o con un
aumento significativo del carico lesionale in T2 rispetto ad
una precedente RM recentemente effettuata
La prescrizione della sola nimesulide è limitata al
trattamento di breve durata del dolore acuto
nell'ambito delle seguenti patologie:
•
Artropatie su base connettivitica;
•
Osteoartrosi;
•
Dolore neoplastico;
•
Attacco acuto di gotta
Rispetto alla nota originaria, sono soggetti alla nota 74
anche l’associazione follitropina α + lutropina α
(Pergoveris) entrata in commercio nel 2008 e la
coriogonadotropina α (Ovitrelle) che è stata riclassificata
in fascia A a luglio 2009
L’ultima modifica riguarda l'integrazione dell'indicazione
all'utilizzo dei farmaci per il trattamento dell'infertilità
maschile. Nella nota è specificato che il trattamento va
effettuato " in maschi con ipogonadismo-ipogonadotropo
con livelli di gonadotropine bassi o normali o comunque
con FSH non superiore a 8 mUI/ml."
La prescrizione di alprostadil a carico del SSN è limitata ai
pazienti con disfunzione erettile da lesioni permanenti e
complete del midollo spinale o del plesso pelvico
iatrogene, traumatiche o infiammatorie/degenerative.
La prescrizione di inibitori della PDE5 (sildenafil, tadalafil,
vardenafil) a carico del SSN è limitata ai pazienti con
disfunzione erettile da danno transitorio o parziale del
midollo spinale o del plesso pelvico secondo un piano
terapeutico specialistico (andrologo, endocrinologo,
neurologo o urologo)
È stata abolita. Ferrico gluconato, ferromaltoso, ferroso
gluconato, ferroglicinalsolfato sono pertanto prescrivibili in
regime SSN , senza limitazioni, in accordo alle indicazioni
riportate in scheda tecnica
Nota n.
G.U.
78
N.284 del 04/12/2010
Nota n.
79
Farmaco
Bifosfonati:
ac. alendronico
ac. risedronico
ac. ibandronico
ac. Alendronico vitamina D3
ac. zoledronico
raloxifene
bazedoxifene
ranelato di stronzio
teriparatide
ormone paratiroideo
G.U.
N. 150 del 01/07/2009
N. 180 del 05/08/2009
N. 137 del 15/06/2011
Nota n.
83
Farmaco
Sostituti lacrimali
G.U.
N. 286 del 09/12/2009
Nota n.
85
Farmaco
Inibitori dell'acetilcolinesterasi:
donezepil
galantamina
rivastigmina
Antagonisti del recettore per il
glutammato:
memantina
G.U.
N. 65 del 19/03/2009 e N. 238 del
13.10.2009
Nota n.
90
Farmaco
Metilnaltrexone
G.U.
N. 141 del 20/06/2009
Abolita dal 5/12/2010
I colliri antiglaucoma di cui alla ex nota 78 sono pertanto
prescrivibili in regime SSN , senza limitazioni, in accordo
alle indicazioni riportate in scheda tecnica
Nella prima revisione sono state estese le indicazioni della
teriparatide:
Soggetti di età superiore a 50 anni in trattamento da più
di 12 mesi con dosi > 5 mg/die di prednisone o dosi
equivalenti di altri corticosteroidi e che si presentano con
una frattura vertebrale severa o due fratture vertebrali
moderate.
La nota si applica su diagnosi e piano terapeutico, della
durata di 6 mesi prolungabile di ulteriori periodi di 6 mesi
per non più di altre due volte (per un totale complessivo
di 18 mesi), di centri specializzati, Universitari o delle
Aziende Sanitarie, individuate dalle Regioni e dalle
Province autonome di Trento e Bolzano
Nella seconda revisione è stato eliminato l'acido
zolendronico dall'elenco dei principi attivi, erroneamente
inserito nella precedente versione
Nella terza revisione è stato introdotto il principio attivo
bazedoxifene ed è stata prolungata la durata della terapia
con teripararatide ed ormone tiroideo a due anni (il PT
può essere rinnovato 3 volte anziché solo 2)
È stata aggiunta, nella sezione background, la frase:
"Il carbopol è un polimero che ha dimostrato una certa
efficacia nel trattamento della xeroftalmia di pazienti
affetti da malattia di Sjögren”
Nella prima revisione è stata introdotta la memantina tra
i farmaci rimborsabili per la terapia della malattia di
Alzheimer limitandola al trattamento della malattia di
Alzheimer di grado moderato con MMSE tra 10 e 20.
Donezepil, rivastigmina, galantamina rimangono
prescrivibili nei pazienti con malattia di Alzheimer di grado
lieve, ma sono specificati i valori di MMSE (tra 21 e 26) e
di grado moderato con MMSE tra 10 e 20
La seconda revisione è di tipo formale in quanto hanno
aggiunto la classe farmacologica di appartenenza della
memantina ovvero gli antagonisti del recettore del
glutammato
La prescrizione di metilnaltrexone a carico del SSN è
limitata alle seguenti condizioni:
Costipazione indotta da oppiacei in soggetti con malattia
in stato terminale che rispondano contemporaneamente
alle seguenti caratteristiche:
- terapia continuativa con oppiacei della durata di almeno
di 2 settimane;
- resistenza al trattamento con lassativi ad azione
osmotica per più 3 giorni.
Nota n.
91
Farmaco
Febuxostat
G.U.
N. 265 del 12/11/2010
La prescrizione di febuxostat a carico del SSN è limitata
alla seguente condizione:
trattamento dell’iperuricemia cronica con anamnesi o
presenza di tofi e/o di artrite gottosa in soggetti che non
siano adeguatamente controllati con allopurinolo o siano
ad esso intolleranti
[ultimo aggiornamento agosto 2012, le ultime revisioni sono riportate in rosso]










