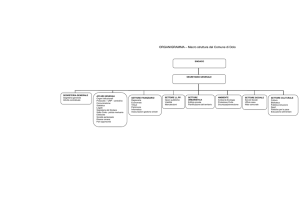
55. Regolamento esecutivo della sezione medicinali del Comitato di
controllo dell’Istituto dell’autodisciplina pubblicitaria
Il testo qui pubblicato è quello in vigore dal 20 settembre 1996 ed è tratto dal sito dello IAP www.iap. it
1 All’interno del Comitato di controllo viene creata una Sezione medicinali per il vaglio preventivo della pubblicità dei prodotti farmaceutici da
banco.
2 La Sezione è costituita da tre membri appartenenti al Comitato di controllo, fra cui il presidente dello stesso, più supplenti. La Sezione si avvale
della collaborazione del consulente medico del Comitato di controllo e della consulenza d i esperti, che coprono le seguenti aree professionali:
farmacologia, clinica medica, farmacia. Tre esperti vengono di volta in vo lta prescelti a rotazione da una più ampia rosa di nomi segnalati da
Assosalute, in relazione alle prefissate singole riunioni della Sezione. Detti esperti collaborano partecipando alle riunioni della Sezione o
comunicando per iscritto i loro pareri.
La Sezione si avvale inoltre della collaborazione del direttore di Federchimica-Assosalute e della Segreteria dell’Istituto dell’Autodisciplina.
3 La Sezione presieduta del presidente del Comitato di controllo o, in caso di sua assenza, da un membro designato dal presidente del Comitato fra i
componenti della Sezione.
4 La Sezione si riunisce ogni mese (salvo l’insorgere di diverse necessità), senza obbligo di formale convocazione. I membri della Sezione, o gli
esperti quando convocati, che per eccezionali ragioni non possono intervenire alla riunione della Sezione, devono darne tempestiva comunicazione
alla Segreteria alfine di provvedere alla sostituzione.
Una reiterata assenza dalle riunioni può essere motivo di decadenza dall’incarico.
5 Il parere rilasciato dalla Sezione assume la denominazione tecnica di “parere preventivo di approvazione” (d’ora in poi citato con p.p.a.).
6 Le fonti normative, in base alle quali la Sezione rilascia il proprio parere, sono:
a) art. 25 del Codice di Autodisciplina Pubblicitaria;
b) decreto legislativo 30 dicembre 1992, n. 541;
c) norme dicomportamento predisposte dall’Ufficio pubblicità della Direzione Generale del servizio farmaceutico delministero della sanità;
il complesso di norme e di elaborazioni giurisprudenziali della autodisciplina pubblicitaria.
7 La Sezione, alla richiesta del p.p.a., può così deliberare:
a) approvazione dell’annuncio;
b) non approvazione dell’annuncio, con motivazione tecnica redatta dal relatore;
c) approvazione con riserva, cioè a condizione che vengano modificati e/o integrati specifici punti esplicitamente indicati dalla Sezione.
In quest’ultimo caso, ad accertamento avvenuto nel rispetto delle condizioni richieste il rilascio del p.p.a. può essere direttamente concesso dal
presidente della Sezione.
8 Le decisioni vengono prese, sentito e valutato il parere dei consulenti tecnici, con l’unanimità dei membri della sezione, in caso contrario la
decisione viene demandata al Comitato di Controllo in sessione plenaria.
9 Le decisioni vengono assunte dalla Segreteria dell’Istituto che provvede a portarle a conoscenza dell’azienda richiedente (v. art. 14).
10 Il p.p.a. viene espresso sotto riserva della validità e completezza dei dati e delle informazioni fornite dalla parte richiedente.
11 Un p.p.a. favorevole esclude la possibilità di un ricorso di ufficio al Giurì da parte del Comitato avverso l’annuncio pubblicitario approvato.
12 Le richieste debbono pervenire almeno 15 giorni prima della seduta della sezione; al ricevimento ogni richiesta viene registrata dalla Segreteria
con l’indicazione della data di arrivo e del relativo numero di protocollo. Per le richieste presentate al di sotto del termine indicato, la Sezione si
riserva il loro esame alla successiva seduta.
13 Le richieste e la relativa documentazione vengono inviate agli esperti relatori al fine di svolgere una adeguata istruttoria tecnica sulla base della
quale relazionare la sezione.
14 Il carico di lavoro è distribuito fra gli esperti relatori dalla Segreteria dell’Istituto secondo le competenze richieste dallo specifico annuncio
pubblicitario. È compito della Segreteria intervenire alle sedute, collaborando allo svolgimento e alla verbalizzazione dei lavori.
15 I membri della Sezione e gli esperti relatori sono tenuti a segnalare eventuali situazioni esistenti tra loro e le aziende richiedenti, che possano
costituire incompatibilità professionali tali da comportare una loro possibile esclusione dal partecipare alla formazione del parere. Dette
incompatibilità debbono avere carattere di eccezionalità.
16 L’ammontare del diritto amministrativo da versare alla Segreteria dell’Istituto, contestualmente alla richiesta di p.p.a., è fissato in L. 350.000 più
IVA per le aziende associate Assosalute e in L. 500.000 + IVA per le aziende non associate.
Nel caso in cui la richiesta riguardi la contemporanea presentazione di varianti rispetto al testo principale, e queste siano lievi e marginali,
l’ulteriore diritto amministrativo è ridotto a L. 200.000 + IVA per ogni variante per le aziende associate Assosalute e a L. 250.000 + IVA per le
aziende non associate.
17 La richiesta di p.p.a. deve essere corredata da cinque copie del testo pubblicitario e del bozzetto ; da cinque copie dell’etichetta e del foglio
illustrativo, autorizzati dal ministero della sanità relativi al medicinale oggetto dell’annuncio pubblicitario, nonché dall’assegno a copertura del diritto
amministrativo.
Nel caso in cui la richiesta riguardi un prodotto per il quale la pubblicità è stata in precedenza approvata dal ministero della sanità va allegata anche
una copia dell’ultimo annuncio – testo e bozzetto – approvato dalministero.
18 Sulla richiesta di p.p.a. che ha avuto esito positivo viene apposto in ogn i pagina il timbro di approvazione della Sezione, con il relativo numero di
pratica, per l’opportuno inoltro da parte dell’azienda al ministero della sanità.
La Segreteria dell’Istituto provvede periodicamente a comunicare al ministero della sanità i testi degli annunci pubblicitari approvati e non
approvati dalla Sezione.