CONSENSOALLOSCREENINGGENETICOPREIMPIANTO
AisensidellaLegge40/2004“Normeinmateriadiprocreazionemedicalmenteassistita”pubblicatainG.U.n.45delfebbraio2004,
del Decreto 1 Luglio 2015 “Linee guida contenenti le indicazioni delle procedure e delle tecniche di procreazione medicalmente
assistita”pubblicatoinG.U.n.161del14Luglio2015,dellaSent.CorteCostituzionalen.151/2009,pubblicatainG.U.il13Maggio
2009,edellaSent.CorteCostituzionale96/2015,pubblicatainG.U.il10Giugno2015.
La PGS (Pre Implantation Genetic Screening) é una metodica diagnostica che si esegue sull’embrione prima del suo
trasferimentoinutero.Perlecoppieadaumentatorischioditrasmettereall’embrionealterazionicromosomiche,la
PGS,informasullostatodisalutediciascunembrioneepermettediindividuaregliembrioninonaffettidaanomalie
cromosomicheprimadellorotrasferimentoinutero.
LatecnicadellaPGSèilrisultatodellacombinazionedi:
1.
fecondazione“invitro”coniniezioneintracitoplasmaticadellospermatozoonellacellulauovo
2.
biopsiadicelluleembrionalimediantemicromanipolazione,e
3.
tecniche diagnostiche molecolari specifiche eseguite nelle coppie per le quali sia indicata un’analisi
cromosomica in cui, la diagnosi molecolare (PGS per anomalie cromosomiche) permette di identificare gli embrioni
chepresentanounnormalenumerodicromosomi(44piùduecromosomisessuali).
Ilsottoscritto………………….……………………………………….Natoa…………………………………….il……………………………………
Lasottoscritta………………………………….……………………..Nataa……………………………………….il…………………………………
PREMESSO
•
che in data __ / __ / __ abbiamo richiesto di essere sottoposti ad un ciclo di concepimento assistito
denominato“fecondazioneinvitroetrasferimentoinuterodegliembrioni”,comedaconsensosottoscritto
•
cheaisensidell’art.14c.5dellaL.40/2004,abbiamorichiestodiavereinformazionisullostatodisalutedegli
zigotiedegliembrioniformatisineltrattamentoindicato.
Siamostatiinformatidelleseguenticircostanze:
§
il ricorso allo screening preimpianto, legittima il medico/biologo, se necessario, ad iniettare tutti gli ovociti
ottenuti(purchérisultatiidoneicomedapianoterapeuticoconVoiconcordato);
§
chesarànecessarioprocederealcongelamentodegliembrioniinattesadell’esitodelladiagnosigeneticaeal
trasferimentodifferito;
§
il numero di embrioni che subiranno la biopsia e l’analisi in oggetto non può essere concordato a priori
perché dipendente dal numero di ovociti recuperati, dal numero di ovociti fecondati, dal numero di embrioni che
giungeràallaformazionediblastocisti;
LaPGSsiavvaleprincipalmentedell’utilizzodiquattrotecnichemolecolari:
PCR (Polymerase Chain Reaction) che permette di evidenziare tratti molto piccoli dei cromosomi (sequenze di geni,
singoli geni o pezzi di un singolo gene), attraverso un sofisticato sistema di amplificazione del DNA. E’ indicata
principalmenteperladiagnosidimalattiemonogeniche;
Array CGH (Array Comparative Genomic Hybridization) che è una tecnica indicata principalmente per la valutazione
dell’intero assetto cromosomico e si ottiene dall’amplificazione dell’intero genoma mediante la variante della PCR,
conosciuta come WGA (Whole Genomic Amplification). Il prodotto così ottenuto è analizzato per tutti i cromosomi
questa metodica, che è in grado di fornire un’informazione completa sull’assetto cromosomico. L’impiego di
MicroarraysnotiancheconilterminediMicrochips,èunadellepossibilivariantidiquestatecnica,checonsentedi
effettuare, assieme all’analisi cromosomica, anche la ricerca di una serie di geni implicati in alcune patologie, che
tuttaviadevonoesseredefiniteprimadellaprocedura.
Next Generation Sequencing anche in questo caso vi é una amplificazione dell’intero genoma (WGA).
Successivamente il DNA embrionale viene sequenziato e controllato mediante una sofisticata analisi bioinformatica,
checonsentediindividuarelapresenzadieventualimalattiegeneticheoaneuploidiecromosomiche.
IRCCS Istituto Clinico Humanitas
Unità Operativa di Ginecologia e Medicina della Riproduzione
Responsabile: Prof. Paolo Emanuele Levi Setti
GIN 2 Consenso allo screening preimpianto 01/01/2016 pagina 1
qPCR(quantitativePolymeraseChianReaction)incuisianalizzanoleanomalienumerichedellatotalitàdeicromosomi
checompongonoilnostrogenoma.L’interoassettocromosomicodell’embrionevieneesaminatotramiteunatecnica
basata su real time PCR e la metodica analizza il numero delle copie di ogni singolo cromosoma. Tale procedura
permettediidentificareanomaliecromosomicheditiponumerico(aneuploidie)acaricodei22autosomi(cromosomi
dalnr.1alnr.22)edeicromosomisessuali(XeY),manonvariazionidelcontenutodipiccoleporzionideicromosomi,
comeamplificazioni(duplicazioni),delezionietraslocazionisbilanciatecheesulanodalloscopodellaPGSechequanto
potrebberoesseredidubbiainterpretazione.
AttualmentelametodicautilizzataélaqPCR,sebbenesianoincorsodivalidazionealtremetodichediagnostiche.
Quando è indicato il prelievo di cellule embrionali per l’identificazione di anomalie numeriche del cariotipo
embrionale(PGS)?
Loscreeningotestdelleanomaliecromosomiche(PreImplantationGeneticScreeningoTest)èindicato,serichiesto
dallacoppiastessa,quandosianopresentileseguenticondizionichesiassocianoaunaumentatorischiodisviluppare
embrioniconanomalienumerichedeicromosomi:
Etàriproduttivadelladonnaavanzata(generalmentedefinitacome>38anni);
Ripetutiabortispontanei(definiticome>2aborticonsecutivi);
Ripetuti fallimenti d’impianto embrionale (RIF) durante precedenti cicli di fecondazione assistita
(generalmentedefiniticomeassenzad’impiantoinseguitoatrasferimentodialmeno6embrioniin
dueopiùtrasferimentidiembrioni).
Per la prima e più frequente indicazione è ben noto che con l’avanzare dell’età della donna aumentano
progressivamenteleanomalienumerichedeicromosomi.Lapiùnota,quantoanchelamenograve,èlasindromedi
Down, o trisomia del cromosoma 21, che si osserva quando sono presenti 3 copie del cromosoma 21, invece che 2
come normalmente succede per tutti i cromosomi autosomici. Questa causa è alla base anche dell’indicazione alla
diagnosigeneticaprenatale(villocentesioamniocentesi).Tuttavia,almomentodell’amniocentesi(15-16settimanedi
epocagestazionale)ilrischiodiavereunfetoaffettodaanomaliacromosomicaèrelativamentebasso,mediamente
dell’ordinedigrandezzadi1a200/300,proprioperchélamaggiorpartedegliembrioniconanomaliecromosomiche
esitano in fallimento di impianto o aborto nelle prime 12 settimane. Al contrario, le anomalie cromosomiche sono
moltopiùfrequentinellafasedisviluppodell’embrioneprimadell’impianto,proprioperchéinquestiprimigiornidi
crescita dell’embrione è avvenuta solo una parziale selezione naturale. Le anomalie cromosomiche avvengono più
frequentementenegliovociticheneglispermatozoiesonopoiereditatedall’embrione.Questospiegaildecadimento
dellacapacitàriproduttivadelladonnachesiosservaconl’avanzaredell’etàeinmanieraprogressivadurantetuttoil
periodoriproduttivoel’aumentatorischiodigravidanzeconfetiaffettidasindromicromosomiche.Inunadonnadi40
anni,laprobabilitàchegliembrioniprodottiabbianounaanomaliacromosomicasiattestaintornoal70/80%.Anche
quandogliembrionisonoprodottiinvitrodopoaccurataselezionemorfologicadegliovociti,deglispermatozoiedegli
embrionifinoallostadiodiblastocisti(5/7giornidisviluppodopolafecondazione)questorischiorimaneelevatissimo.
Il trasferimento inconsapevole di questi embrioni affetti può, quindi, risultare in fallimento dell’impianto o in
gravidanzachepoiterminaconunabortooinunagravidanzaincuiilfetoèportatorediun’anomaliacromosomica
allanascita.Perquantoriguardalapoliabortività,èbennotochecircai2/3degliabortispontaneisonodovutiacause
di anomalie cromosomiche insorte de novo nell’embrione e in assenza di evidenti patologie a carico della coppia.
Questofenomenoètantopiùmarcatoquandogliabortisiosservanonelleprimesettimanedigravidanza.Inquesti
casi,l’analisipermetteditrasferireembrioniprividellamaggiorpartedelleanomaliecromosomichechedeterminano
l’aborto,aumentandosignificativamentelapercentualedigravidanzecheportanoaunanascita.
Il ripetuto fallimento d’impianto può essere esso stesso conseguenza di un’aumentata incidenza di anomalie
cromosomiche che spiegano il mancato successo in precedenti cicli di PMA. Tassi elevati di embrioni con anomalie
cromosomichesonostatiriportatiincoppiecheavevanoeseguitounciclodiPGSdopoprecedentitentativifallitidi
fecondazione in vitro convenzionale (Fragouli et al., 2010). In questo caso l’analisi cromosomica degli embrioni
permette sia di individuare quelli cromosomicamente normali per il trasferimento aumentando le probabilità di
gravidanza per trasferimento, sia di avere una valutazione di natura diagnostica sulle caratteristiche degli embrioni
prodottidallaspecificacoppia.
Efficienzaebeneficidell’analisidianomalienumerichedelcariotipoembrionale:
Inconsiderazionediquestifattori,moltisforzisonostatifattinegliultimi20annipersvilupparenuovetecnologiein
grado di individuare le anomalie cromosomiche prima che l’embrione sia trasferito in utero durante i cicli di
fecondazioneassistita.Oggiquestemetodicherappresentanounastrategiaefficaceperindividuareleanomalie
IRCCS Istituto Clinico Humanitas
Unità Operativa di Ginecologia e Medicina della Riproduzione
Responsabile: Prof. Paolo Emanuele Levi Setti
GIN 2 Consenso allo screening preimpianto 01/01/2016 pagina 2
numerichecromosomichemediantel’analisimolecolarediuncampionebiopticodell’embrioneaunostadioavanzato
(blastocisti)inmanieranoninvasivaperlecelluledell’embrione.Datipresentiinletteraturasuggerisconochequando
l’embrione cromosomicamente normale è trasferito allo stadio di blastocisti (fresco e/o dopo congelamento), la
probabilità di impiantarsi aumenta di due/tre volte e la probabilità di aborto si riduce dal 30/40%, generalmente
osservatoindonnedi40anni,apercentualiinferiorial10%(Scottetal.,2013;Formanetal.,2012;Schoolcraftetal.,
2010).Nellapopolazionedipazienticheeseguonol’analisi,circail35%deicasinonhaembrioninormalidaunpunto
divistacromosomicoinquellospecificociclo.Inquestocasolacoppiapuòrichiederedinontrasferiregliembrionicon
anomaliecromosomiche,evitandodiesporsialrischiodiabortoqualoragiunganoaunimpianto.Inoltrenontrasferire
embrioniaffettidaanomaliecromosomichepermettedievitareiripetutitrasferimentidiembrionisenzapossibilitàdi
portare a una gravidanza e che avrebbero dilazionato nel tempo il raggiungimento di un risultato positivo con le
implicazioni psicologiche e di prognosi evidenti soprattutto per le coppie meno giovani. Trovare tutti embrioni con
anomaliecromosomichenonprecludelapossibilitàchecisianoembrioninonaffettidaanomaliecromosomicheinun
ciclodifecondazioneassistitasuccessivoepermettecosìdiaccedereintempibrevioveindicatoadunnuovociclodi
terapia(Pgidasetal.,JAssistReprodGenet.2008).
Considerato l’elevato tasso d’impianto degli embrioni dopo PGS, un altro possibile beneficio è la possibilità di
trasferire un solo embrione anche in donne con età riproduttiva avanzata, evitando così gravidanze multiple e le
severecomplicanzeostetricheeneonataliaesseassociate.
Procedimento
1.
Ottenimento di embrioni. Si tratta di ottenere gli embrioni che saranno oggetto della diagnosi. Si devono
produrre«inVitro»medianteconvenzionalitecnichediriproduzioneassistitadisecondolivello.
Per effettuare la diagnosi sarà necessario, in particolare, ricorrere ad una iniezione intracitoplasmatica dei gameti
(ICSI)alfinediridurreilrischiodicontaminazionedelcampione.
2.
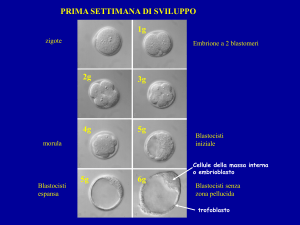
Biopsiadeltrofoectodermaallostadiodiblastocisti(giorno5-7)
Inbasealleevidenzescientifiche,ilmigliorstadioevolutivosulqualeèpossibilifareun’analisigeneticapreimpiantoè
rappresentatodallablastocistichesiformainquinta–settimagiornatadisviluppoembrionale.Ilprelievodicellulein
questafaseèpotenzialmentemoltoutilealladiagnostica,poichéèpossibileprelevareundiscretonumerodicellule
senzacreareproblemiallosvilupposuccessivodell’embrionecheinquestostadioècresciutofinoa200/300cellule.
Inoltre,labiopsiaèeffettuatasucelluleesclusivamentedeltrofoectodermachedarannooriginedopol’impiantoagli
annessiplacentari.Lamassadellecelluleinterne(innercellmass)chedaràorigineall’embrionenellefasisuccessive
all’impianto,nonècoinvoltadallabiopsia,riducendoinquestomodopotenzialirischiperlosviluppodell’embrione.La
tecnicadiprelievo(biopsia)consistenelpraticareunforonellazonapellucida,paretecheavvolgel’embrionefinoallo
stadio di blastocisti. L’apertura della zona pellucida è effettuata mediante l’azione di un raggio laser, di cui è stata
comprovatalabiosicurezzasiainmodellianimalicheumani(Rienzietal.,2001).Lecelluleembrionalidautilizzareper
ladiagnosisonoprelevatemedianteaspirazioneconunapipettadabiopsiaoprovocandoun’erniazionedellecellule
del trofoectoderma all’esterno. Tali cellule vengono, quindi, poste all’interno di una provetta analitica per eseguire
l’analisigenetica.Leblastocistidopobiopsiavengonocrioconservate.
Uno studio condotto recentemente ha evidenziato che l’analisi allo stadio di blastocisti rappresenta oggi un gold
standard per queste analisi nei centri specializzati in questa pratica (Capalbo et al., Human Reproduction 2013),
principalmenteperiseguentiimportantivantaggi:
Affidabilitàdeirisultatidell’analisigenetica;
Riduzionesignificativadelrischiodimosaicismocromosomico(vedisotto);
Assenzadicompromissionedellosviluppoembrionaledovutodallabiopsia.
3.
Diagnosigenetica.Ilcampioneottenutoèprocessatoperl’analisimolecolare.
4.
Trasferimentoembrionale.Conilrisultatodell’analisimolecolare,lacoppiaconsultantevieneinformatasul
risultato dell’analisi molecolare dall’équipe medica e viene programmato il trasferimento in funzione anche delle
caratteristiche di vitalità embrionale. Il trasferimento degli embrioni crioconservati dopo biopsia viene eseguito,
generalmente, nel ciclo seguente a quello in cui è avvenuto il prelievo ovocitario (o nel minor tempo possibile non
appenalecondizionipsicofisichedelladonnalopermettano).Posticipareiltrasferimentoènecessariosiapermotivi
tecnicilegatialletempistichedell’analisimolecolaresiapermotiviclinici.
IRCCS Istituto Clinico Humanitas
Unità Operativa di Ginecologia e Medicina della Riproduzione
Responsabile: Prof. Paolo Emanuele Levi Setti
GIN 2 Consenso allo screening preimpianto 01/01/2016 pagina 3
Ladecisionediquandoèpiùopportunotrasferiregliembrionièsoggetta,comunque,avalutazionefinaledelmedico
einparticolaricasipuòesserepossibileiltrasferimentodegliembrioniinassenzadicongelamentodopolabiopsia.
RisultatiottenuticonlaPGS
L’efficacia dello screening preimpianto dipende, da un lato, dal numero di embrioni disponibili e dal loro grado di
sviluppoe,dall’altrodalmetododiagnosticomolecolareimpiegato.Irisultatiottenutiindiversistudicliniciprospettici
randomizzati dimostrano in modo consistente che il trasferimento di embrioni normali all’analisi cromosomica si
traduce in un aumento della probabilità d’impianto e sviluppo a termine del singolo embrione con una significativa
diminuzionedelleprobabilitàdiabortoclinico(Formanetal.,2013;Scottetal.,2013).
Dal Registro Europeo ESHRE (Desmyttere et al., Human Reproduction 2012), non viene riportato un aumento delle
anomalie alla nascita in relazione all’uso della tecnica di biopsia embrionale, dimostrando l’efficacia e sicurezza del
procedimento.
LimitidellaPGS
•
Icosiddetti“embrioninoninformativi”:datalanaturaelaquantitàdelcampionecellulareusatoesisteuna
percentualevariabilediembrionidaiqualinonèpossibilericavarenessunrisultatoinformativochesiattestaconla
metodicaqPCRacircail2%deicampionianalizzati.Nelcasodiunadiagnosicromosomicapuòsuccederechenonsi
ottenganorisultatiperuno,varioaddiritturaperlatotalitàdeicromosomianalizzati.Inquesticasil'équipemedica
raccomandachegliembrionisianorianalizzati.Tuttavia,secondoilcromosomadicuisitrattaedellasituazionedella
donna ricevente, si potrebbe arrivare al transfer in determinati casi specifici, con il consenso dei pazienti senza la
pienaconoscenzadelrisultatodell’analisi.
•
Mosaicismocromosomico:Èaltresìpossibilechelecelluleesaminatenonpresentinoalterazionimachealtre
celluledell’embrionesottopostoabiopsiacontenganodelleanomaliegenetiche.Questofenomenoprendeilnomedi
mosaicismo,cioèquandodiverselineecellularisonopresentinellostessoembrione.Questofenomenobiologicopuò
limitarel’accuratezzadiagnosticael’efficaciaclinicadellatecnica.Ilfenomenodelmosaicismoènotevolmentemeno
incidentequandol’analisièeseguitasultrofoectodermaallostadiodiblastocistirispettoall’analisiinterzagiornatadi
sviluppoembrionaleeallostadioattualedelleconoscenze,interessacircail2/3%degliembrionianalizzati(Fragouliet
al.,2008;Northropetal.,2010;Capalboetal.,2013).
•
Errorediagnostico:cometuttelemetodicheanaliticheanchel’analisimolecolaremedianteqPCRpuòessere
soggetta ad errori diagnostici che possono risultare in falsi positivi e falsi negativi diagnostici nell’assegnazione del
numerodeicromosomi.L’accuratezzadiagnosticadellaqPCRètuttaviariportataesseresuperioreal99%(Treffetal.,
FertilityandSterility2012).
•
Possibilitàdicontaminazione:èpossibilechenelcorsodellafaseanaliticapossanoverificarsicontaminazioni
di materiale genetico che falsino l’analisi molecolare. Tuttavia con le moderne tecnologie e con la buona pratica
laboratoristicaquestorischioèstimatoessereinferioreall’1%deicasiinbaseaidatiriportatidalregistroeuropeodi
PGD(Harperetal.,HumanReproduction2008).
•
Limiti di risoluzione dell’analisi di anomalie del cariotipo embrionale mediante qPCR: l’analisi cromosomica
mediante qPCR è finalizzata prettamente a determinare il numero di copie cromosomiche presenti nel cariotipo
embrionale per la totalità dei cromosomi che compongono il nostro genoma (22 coppie di autosomi + cromosomi
sessuali) essendo queste le anomalie cromosomiche preponderanti negli embrioni umani preimpianto come anche
nellegravidanzeconanomaliegenetiche.Nonsonoinvecerilevabilileseguentiminorianomaliecromosomicheche
comunqueavrebberoundubbiosignificatointerpretativoinconsiderazionedellanaturaequantitàcellularesucuiè
condottal’analisipreimpianto:
Riarrangiamenticromosomicibilanciatiesbilanciati;
Mutazionipuntiformiedepigenetiche;
Duplicazioni/delezionidiporzionicromosomiche;
Disomieuniparentali;
Mosaicismicromosomiciinferiorial50%;
Poliploidie;
L’incidenza di queste alterazioni genetiche con significato patologico è stimata essere inferiore all’1% in gravidanze
cheevolvanosinoallanascita(Faasetal.,JournalofMedicalGenetics,2010;Wapneretal.,NewEnglandJournalof
Medicine, 2012) e alcune di queste non sarebbero diagnosticabili con sufficiente accuratezza diagnostica anche con
altrimetodid’indaginemolecolaresull’embrionedatalanaturaelaquantitàdimaterialecellularechesiutilizza.
IRCCS Istituto Clinico Humanitas
Unità Operativa di Ginecologia e Medicina della Riproduzione
Responsabile: Prof. Paolo Emanuele Levi Setti
GIN 2 Consenso allo screening preimpianto 01/01/2016 pagina 4
L’incidenza di anomalie non evidenziabili con qPCR è in ogni caso molto inferiore al rischio riproduttivo generale di
avereunfiglioconanomaliecongeniteallanascitachenellanostraspecieècircadel3%echerimanecomunquenon
diagnosticabilesull’embrionepreimpiantocomeinmolticasianchedopodiagnosiprenatalemediantevillocentesio
amniocentesiostudiomorfologicoecograficoopostnatale.
Si suggerisce comunque di discutere degli eventuali approfondimenti e accertamenti da effettuare nel corso della
gravidanzaconl’ausiliodispecialistinelladiagnosiprenatale.
§
Il tasso di errore della diagnosi preimpianto non è attualmente noto, di conseguenza nel caso di una
gravidanzadeveesserecomunqueconsiderataeconsigliataun’analisicitogeneticaprenataleperstabilireilcariotipo
fetale.L’obiettivodell’analisièdiindividuareaneuploidiechecomportinolaperditaoilguadagnodigrandipezzidi
cromosomi o cromosomi interi. Anomalie cromosomiche che coinvolgono pezzi più piccoli potrebbero non essere
rilevate.Inoltrealcunicasidimosaicismocromosomicopossonopassareinosservati.
Siamoconsapevoliche:
§
per l’esecuzione e/o controllo dei test di PGS l’Humanitas Fertility Center si potrà avvalere di strutture
esterneNazionalioInternazionalicertificateperl’attivitàdiagnosticainquestosettorespecifico.Incasodiesecuzione
deitestpressostruttureesternel’HumanitasFertilityCenterèresponsabileesclusivamentedellosviluppodiembrioni
mediante tecniche di Procreazione Medicalmente Assistita e non ha alcuna responsabilità circa l’operato del
LaboratoriodiDiagnosimolecolarecheeffettuaitestgeneticieffettuatisullecellule.
§
l’esecuzione dei test presso terzi prevede un trasporto del materiale da analizzare tramite un vettore
specializzatoechetaletrasportononétotalmenteprivodirischi.
§
L’HumanitasFertilityCenternonsiassumelaresponsabilitàperlaperditadicampioniduranteiltrasporto.
§
IlServizioSanitarioNazionale(SSN)nonsifacaricodellespesedellapredettaprocedura,pertantoicosti
perlagestionediquestatecnicasonoacompletocaricodeipazienti.
AlternativeallatecnicaPGS
•
GestazionenaturaleomedianteIVFinassenzadiPGSseguita,eventualmente,dadiagnosiprenatale.
•
Adozionelegale.
DICHIARIAMO
Diaverlettoilpresentemodulonellasuatotalità,diavernecompresocompletamenteilcontenuto,ediaverricevuto
tutteleinformazioniinmaniera dettagliata,siasuimetodichesullepercentualidisuccessoedierrorediagnostico.
Dichiariamodiaveravutouncolloquiopreliminareconilpersonaledelcentro,duranteilqualesonostatesoddisfatte
tuttelenostredomandeesonostatichiaritiinostridubbi.
Diesserestatidebitamenteinformati:
•
•
•
•
•
Sulle indicazioni, la procedura, le probabilità di successo, le limitazioni, i rischi e le complicazioni del
programmadidiagnosipreimpiantoproposto.
Che le procedure possono essere interrotte in qualunque momento della loro realizzazione, sia per motivi
medici che su richiesta dei pazienti, purché ciò non comporti alcun danno agli stessi o agli embrioni vitali
prodotti.
Sulcostoeconomicodeltrattamento.
Sulla disponibilità del personale sanitario di questo centro ad approfondire qualunque aspetto delle
informazionichenonsiasufficientementechiaro.
Che la donna potrà in ogni caso decidere di procedere al trasferimento anche in presenza di un’anomalia
cromosomicaembrionaledopoconsulenzaconglispecialistidellaStrutturaefirmadiunospecificoconsenso.
Di essere favorevoli allo scongelamento, analisi cromosomica e ricongelamento di embrioni che sono risultati
senzarisultatoochenecessitanodiunasuccessivavalutazione.
Rischiparticolarilegatialcasospecificodellapaziente/coppia:
____________________________________________________________________________________________
IRCCS Istituto Clinico Humanitas
Unità Operativa di Ginecologia e Medicina della Riproduzione
Responsabile: Prof. Paolo Emanuele Levi Setti
GIN 2 Consenso allo screening preimpianto 01/01/2016 pagina 5
CHIEDIAMO
diesseresottopostiadunciclodiconcepimentoassistitodenominato:FecondazioneinVitroeTrasferimentoinutero
degliEmbrionicontecnicadiScreeninge/oDiagnosiPreimpiantosucelluledelTrofoectoderma.
Firmadellapaziente
Firmadieventualeinterprete
_____________________________
__________________________________
Firmadieventualeinterprete
_____________________________
_________________________________
FirmadellospecialistadelFertilityCenter Sottoscrittoindata
_______________________________________
_________________________________
FirmadelPartner
IRCCS Istituto Clinico Humanitas
Unità Operativa di Ginecologia e Medicina della Riproduzione
Responsabile: Prof. Paolo Emanuele Levi Setti
GIN 2 Consenso allo screening preimpianto 01/01/2016 pagina 6