SPETTROSCOPIA INFRAROSSA
APPLICATA ALLE GOMME
IDENTIFICAZIONE E DETERMINAZIONE DELLA STRUTTURA DI ELASTOMERI
MEDIANTE L’IMPIEGO DELLA SPETTROSCOPIA A RAGGI INFRAROSSI
Rosina Flueckiger
Liceo cantonale di Mendrisio
“Lavoro di maturità di chimica 2013 “Le gomme”
Docente responsabile Federico Imbesi
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
In copertina: rappresentazione grafica delle vibrazioni molecolari, la base della spettroscopia infrarossa.
INDICE
1
MOTIVAZIONE _____________________________________________________________________ 4
2
INTRODUZIONE ____________________________________________________________________ 5
3
POLIMERI _________________________________________________________________________ 6
3.1.1 DEFINIZIONE _________________________________________________________________ 6
3.1.2 CLASSIFICAZIONE PER STRUTTURA________________________________________________ 7
3.1.3 POLIMERI CHE CI CIRCONDANO __________________________________________________ 8
3.1.4 POLIMERIZZAZIONE ___________________________________________________________ 8
3.2
ELASTOMERI __________________________________________________________________ 10
3.2.1 CAUCCIÙ ___________________________________________________________________ 11
3.2.2 GOMMA NATURALE __________________________________________________________ 13
3.2.3 GOMMA SINTETICA __________________________________________________________ 13
3.2.4 CLASSIFICAZIONE ____________________________________________________________ 14
3.2.5 ACCENNI STORICI ____________________________________________________________ 14
3.2.6 FABBRICAZIONE _____________________________________________________________ 15
3.2.6.1 COMPOUNDING _________________________________________________________ 15
3.2.6.2 PROCESSING ____________________________________________________________ 17
3.2.6.3 CURING ________________________________________________________________ 20
3.2.7 IMPATTO AMBIENTALE________________________________________________________ 21
3.2.8 UNO SGUARDO AL FUTURO ____________________________________________________ 22
4
INTRODUZIONE ALLE TECNICHE SPETTROSCOPICHE ______________________________________ 23
4.1
4.2
5
RADIAZIONI ELETTROMAGNETICHE ________________________________________________ 23
TECNICHE SPETTROSCOPICHE ____________________________________________________ 24
SPETTROSCOPIA IR _________________________________________________________________ 27
5.1
INTRODUZIONE ________________________________________________________________ 27
5.1.1 SCOPERTA DELLA TECNICA _____________________________________________________ 27
5.1.2 UTILIZZO ___________________________________________________________________ 27
5.1.2.1 UTILIZZO QUANTITATIVO __________________________________________________ 28
5.1.2.2 UTILIZZO QUALITATIVO ___________________________________________________ 28
5.1.3 IMPORTANZA INDUSTRIALE ____________________________________________________ 28
5.2
TEORIA ______________________________________________________________________ 29
5.2.1 RAGGI INFRAROSSI ___________________________________________________________ 29
5.2.2 VIBRAZIONI MOLECOLARI E ASSORBIMENTO INFRAROSSO____________________________ 29
5.2.3 TRANSIZIONI ENERGETICHE E REGOLE DI SELEZIONE ________________________________ 32
5.2.4 SPETTRO ___________________________________________________________________ 34
5.3
STRUMENTAZIONE _____________________________________________________________ 35
5.3.1 SORGENTI __________________________________________________________________ 35
5.3.2 INTERFEROMETRO ___________________________________________________________ 35
2
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
5.3.3 RILEVATORI _________________________________________________________________ 36
5.3.4 CAMPIONI __________________________________________________________________ 36
5.4
INTERPRETAZIONE _____________________________________________________________ 37
5.4.1 DETERMINAZIONE DELLA STRUTTURA ____________________________________________ 38
5.4.2 IDENTIFICAZIONE ____________________________________________________________ 40
6
PARTE SPERIMENTALE ______________________________________________________________ 42
6.1
RACCOLTA DEGLI SPETTRI ________________________________________________________ 42
6.2
MANIPOLAZIONE DEGLI SPETTRI __________________________________________________ 43
6.3
SPETTRI E INTERPRETAZIONI______________________________________________________ 43
6.3.1 SPETTRI E INTERPRETAZIONE DI GOMME NOTE ____________________________________ 44
6.3.1.1 GOMMA NATURALE (NR) __________________________________________________ 45
6.3.1.2 GOMMA ISOBUTENE ISOPRENE (IIR) _________________________________________ 47
6.3.1.3 GOMMA POLICLOROPRENE (CR) ____________________________________________ 49
6.3.1.4 GOMMA BUTADIENE ACRILONIRILE (NBR)_____________________________________ 51
6.3.1.5 GOMMA BUTADIENE ACRILONITRILE IDROGENATA (HNBR) _______________________ 53
6.3.1.6 GOMMA BUTADIENE STIRENE (SBR) _________________________________________ 55
6.3.1.7 GOMMA ETILENE PROPILENE DIENE (EPDM) ___________________________________ 57
6.3.1.8 CONCLUSIONE GENERALE _________________________________________________ 59
6.3.2 SPETTRI E INTERPRETAZIONE DI GOMME IGNOTE ___________________________________ 60
6.3.2.1 GOMMA INCOGNITA UNO _________________________________________________ 60
6.3.2.2 GOMMA INCOGNITA DUE _________________________________________________ 63
7
CONCLUSIONE ____________________________________________________________________ 66
8
RINGRAZIAMENTI _________________________________________________________________ 67
9
GLOSSARIO _______________________________________________________________________ 68
9.1
ELENCO DELLE ABBREVIAZIONI____________________________________________________ 68
10 FONTI ___________________________________________________________________________ 69
10.1 BIBLIOGRAFIA _________________________________________________________________ 69
10.2 SITOGRAFIA __________________________________________________________________ 69
10.3 FONTI DELLE IMMAGINI _________________________________________________________ 70
10.3.1 FIGURE __________________________________________________________________ 70
10.3.2 FOTO ____________________________________________________________________ 71
10.4 FONTI DELLE TAVOLE DI CORRELAZIONE ____________________________________________ 71
11 ALLEGATI ________________________________________________________________________ 72
11.1 SPETTRI ______________________________________________________________________ 72
11.2 SPETTRI INTERPRETATI __________________________________________________________ 72
11.3 SPETTRI SU CARTA LUCIDA _______________________________________________________ 72
11.4 TAVOLE DI CORRELAZIONE _______________________________________________________ 72
11.4.1 TAVOLA DI CORRELAZIONE 1 _________________________________________________ 72
11.4.2 TAVOLA DI CORRELAZIONE 2 (ordinata per numeri d’onda discendenti) _______________ 72
11.4.3 TAVOLA DI CORRELAZIONE 3 (con le posizioni delle bande di disturbo più frequenti) _____ 72
11.4.4 TAVOLA DI CORRELAZIONE 4 _________________________________________________ 72
3
Spettroscopia infrarossa applicata alle gomme
1
R. Flueckiger
MOTIVAZIONE
Due anni fa, scegliendo come opzione specifica “fisica e applicazione della matematica”, ho letteralmente
scartato la chimica dal mio piano di studi. Ho avuto modo di pentirmi di questa scelta, poiché questa
materia mi aveva sempre entusiasmata.
In vista della scelta del lavoro di maturità, l’anno scorso, ho dunque sviluppato un po’ di speranza riguardo
alla possibilità di riavvicinarmi alla chimica.
La lettura delle proposte dei lavori di maturità 2013 ha però suscitato interesse in due direzioni: chimica,
che oltretutto prometteva anche una parte sperimentale in laboratorio (l’ambito della materia che più mi
interessa) e musica (ciò che vorrei in futuro studiare). Infine ho scelto musica, soprattutto per la questione
della comodità.
Capitando invece nel LAM di chimica l’impatto non è stato dunque particolarmente traumatico, se non per
il fatto che avevo dimenticato quasi tutte le basi teoriche (cosa che inizialmente mi ha fatto scoraggiare).
Il lavoro di chimica offriva, come detto in precedenza, la possibilità di effettuare una parte sperimentale, in
particolare di analisi sulle gomme. Oltre a questo però, dava un’occasione speciale di collaborazione con
una ditta specializzata per la produzione di articoli in gomma: la REX Articoli Tecnici SA.
Dopo diverse lezioni introduttive sugli elastomeri, il professore Imbesi mi ha prestato un fascicolo di
relazioni di analisi sperimentali sulle gomme (Rapra Rewiew Reports), grazie al quale ho avuto modo di
venire a conoscenza, oltre a diversi interessanti tipi di analisi (sugli antidegradanti e sulla contaminazione),
di due particolari tecniche di analisi: la spettroscopia infrarossa e la spettroscopia UV. Devo ammettere che
inizialmente non avevo idea di cosa si trattassero, semplicemente vedevo in esse l’opportunità di unire la
chimica alla fisica (delle radiazioni infrarosse e ultraviolette). Scoprendo che a scuola siamo dotati di uno
spettrometro a trasformata di Fourier, per le analisi della spettroscopia infrarossa, ho dunque scelto tra le
due l’analisi spettroscopica a raggi infrarossi.
Con il professore mi sono messa d’accordo per lo svolgimento del lavoro: inizialmente avrei creato una
“libreria” di spettri di gomme note (in pratica delle gomme NR, NBR, HNBR, SBR, IIR, EPDM, CR) da
confrontare successivamente con gli spettri di due gomme incognite, in modo da identificarle.
Le gomme, note e ignote, sono state gentilmente messe a disposizione dalla ditta REX Articoli Tecnici SA.
4
Spettroscopia infrarossa applicata alle gomme
2
R. Flueckiger
INTRODUZIONE
In questo lavoro di maturità viene anzitutto presentata una classe di materiali polimerici: gli elastomeri
(ovvero le gomme vulcanizzate). In seguito viene introdotta la tecnica spettroscopica a raggi infrarossi, che
può essere utilizzata per analizzare qualitativamente gli elastomeri.
L’obiettivo principale di questo lavoro di maturità è l’estendere la teoria dell’analisi spettroscopica
all’applicazione pratica dell’interpretazione di particolari gomme: anzitutto con la creazione di una
“libreria” di spettri di gomme note (sono state analizzate la gomma naturale [NR], la gomma isobutene
isoprene [IIR], la gomma policloroprene [CR], la gomma butadiene acrilonitrile [NBR], la gomma butadiene
acrilonitrile idrogenata [HNBR], la gomma butadiene stirene [SBR], e la gomma etilene propilene diene
[EPDM]), in seguito con l’identificazione di due composti ignoti di diverse gomme della suddetta libreria.
5
Spettroscopia infrarossa applicata alle gomme
3
R. Flueckiger
POLIMERI
3.1.1 DEFINIZIONE
Un polimero1 è una macromolecola (molecola di grandi dimensioni) costituita da una lunga catena di unità
strutturali semplici che si ripetono (per cui è caratterizzato da un elevato peso molecolare). Queste unità
strutturali ripetitive sono molecole di piccole dimensioni chiamate monomeri2 (Figura 1).
La definizione standardizzata (secondo la norma ISO 4723) di polimero è:
‘Un polimero è un prodotto composto da molecole, caratterizzato da un gran numero di ripetizioni di uno o
più tipi di unità costituzionali legate l’una all’altra in quantità sufficiente per fornire un insieme di proprietà
che non variano significativamente con l’addizione o la sottrazione di poche unità costituzionali.’
Figura 1: il monomero (propilene), l’unità ripetitiva e il polimero (polipropilene). Si può rappresentare la
formula molecolare di un polimero come n-volte il monomero; infatti in genere “n” è talmente grande che
si possono tralasciare dalla formula molecolare i gruppi terminali, poiché non sono di grande importanza
rispetto a una molecola così lunga.
I polimeri presentano solo pochi elementi atomici, quali evidentemente il carbonio e l’idrogeno e talvolta
l’ossigeno, il cloro e l’azoto. I monomeri presentano caratteristiche fisiche differenti, in base alle molecole
contenute, che poi vengono conferite al polimero che vanno a costituire.
Si possono suddividere i polimeri a seconda della natura dei monomeri in:
Omopolimeri: costituiti da un determinato monomero ricorrente.
Copolimeri: costituiti da monomeri strutturalmente differenti. I copolimeri sono a loro volta
suddivisi, a dipendenza della disposizione dei loro monomeri, in:
- Copolimeri alternati: i monomeri si alternano regolarmente.
- Copolimeri random: i monomeri si aggregano senza un ordine preciso.
- Copolimeri a blocchi: i monomeri si alternano a gruppi regolari.
1
Polimero: poli (dal greco “polus”: molto) – mero (dal greco “meros”: unità): molte unità.
Monomero: dal greco “una parte”.
3
ISO 472: norme tecniche nell’ambito specifico dei polimeri.
2
6
Spettroscopia infrarossa applicata alle gomme
-
-
R. Flueckiger
Copolimeri innestati: monomeri dello stesso tipo si aggregano formando una lunga catena
principale; monomeri di un secondo tipo formano a loro volta delle catene più corte, agganciate
senza ordine alla catena principale.
Copolimeri a reticolo: monomeri dello stesso tipo si aggregano formando delle lunghe catene;
monomeri di un secondo tipo formano a loro volta delle catene più corte, agganciate a intervalli
regolari alle suddette catene, formando dei ponti tra esse.
I copolimeri sono di grande importanza industriale in quanto, variando la quantità di un monomero rispetto
a un altro, si possono ottenere le determinate proprietà meccaniche desiderate (oppure semplicemente,
nel caso di due monomeri, mantenendo al 50% la presenza di entrambi, si ottiene un polimero avente
proprietà intermedie tra quelle dei rispettivi monomeri). Altrettanto influsso sulle caratteristiche
meccaniche può avere la disposizione delle specie monomeriche (elencate precedentemente); questa può
essere controllata tramite adeguati catalizzatori4. Questo margine di scelta che si ha grazie alle varietà di
copolimerizzazione (polimerizzazione di copolimeri) può essere sfruttato anche per quanto riguarda il
rendimento economico del copolimero prodotto, in quanto si può unire, per esempio, un polimero a basso
costo (come il polietilene) con uno che ha le proprietà fisiche desiderate, per ottenere un copolimero poco
costoso ma dotato di buone caratteristiche meccaniche.
I copolimeri in genere non superano i due tipi di unità monomeriche. Tuttavia, si trovano in commercio
alcuni terpolimeri, ovvero polimeri costituiti da tre monomeri strutturalmente differenti (nella parte
sperimentale verrà utilizzato un particolare terpolimero: la gomma etilene propilene diene [EPDM]).
3.1.2 CLASSIFICAZIONE PER STRUTTURA
Le catene polimeriche presentano differenti tipi di struttura, che può essere lineare, ramificata o reticolata.
Figura 2: i tre tipi di struttura delle catene polimeriche.
In base a questi tre tipi di struttura si possono classificare i polimeri in
1. Plastomeri (o termoplastici): le catene possono essere lineari o poco ramificate.
Plastomero significa composto plastico, ovvero composto che può essere modellato in una
determinata forma, senza necessitare di un processo di vulcanizzazione.
A dipendenza dello sforzo a cui vengono sottoposti assumono un comportamento inizialmente
elastico, poi con l’aumentare dello sforzo assumono un comportamento plastico, fino al limite della
rottura.
4
Catalizzatori: specie chimiche che abbassano l’energia di una reazione (in questo caso, di polimerizzazione).
7
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
2. Elastomeri (Capitolo 3.2): le catene sono poco reticolate (ovvero presentano solo un limitato
numero di legami trasversali).
Elastomero significa composto elastico, ovvero composto che può essere deformato sotto sforzo,
ma che poi riprende la sua forma originaria non appena cessa lo sforzo.
Gli elastomeri sono, come si può dedurre dal nome, elastici.
3. Elastomeri termoplastici (o gomme termoplastiche): le catene sono ramificate o reticolate.
Gli elastomeri termoplastici sono, come gli elastomeri, elastici, e al contempo non necessitano di
un processo di vulcanizzazione (da qui l’aggettivo “termoplastici”).
4. Termoindurenti: le catene sono molto reticolate.
I termoindurenti sono duri e fragili.
3.1.3 POLIMERI CHE CI CIRCONDANO
I polimeri possono essere di origine naturale, i cosiddetti biopolimeri, o di sintesi artificiale, i cosiddetti
polimeri sintetici. Infatti, nel corso della storia i chimici hanno sviluppato un elevato numero di polimeri
sintetizzati in laboratorio, che hanno preso sopravvento nell’attuale quotidianità (la nostra epoca è definita,
non a caso, “era della plastica”). Sia biopolimeri che polimeri sintetici sono diffusi in ogni ambito della vita.
Esempi rilevanti di biopolimeri possono essere:
-
Le proteine (come monomeri hanno gli amminoacidi)
Gli acidi nucleici (come monomeri hanno i nucleotidi)
La cellulosa (come monomeri ha le molecole di glucosio)
Esempi rilevanti di polimeri invece sintetici possono essere:
-
Le plastiche in generale
Gli elastomeri in generale
3.1.4 POLIMERIZZAZIONE
Per assemblare i monomeri, formando le catene polimeriche, vi sono due tipi di reazione chimica: la
poliaddizione e la policondensazione.
Il primo tipo di polimerizzazione, la polimerizzazione per addizione (o polimerizzazione per reazione a
catena), è in sostanza la combinazione per addizione di un elevato numero di monomeri, che si legano
grazie ad un catalizzatore (che in questo caso abbassa l’energia della polimerizzazione). I monomeri che
formano i polimeri di addizione devono essere di natura alchenica, ovvero devono presentare nella loro
struttura molecolare almeno un doppio legame, per poter permettere la reazione.
Figura 3: schema esemplificativo di una reazione di addizione. Evidentemente i vari polimeri di addizione si
distinguono a seconda del sostituente “–R” .
8
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
La reazione a catena deve essere interrotta non appena si ha raggiunto la massa molecolare desiderata (per
il determinato uso per cui verrà in seguito impiegato il polimero). Il produttore ha un grande influsso anche
per quanto riguarda il grado di ramificazione della catena: può infatti controllarne lo sviluppo tramite la
scelta di un determinato catalizzatore e la preparazione di determinate condizioni (nelle quali deve
avvenire la polimerizzazione), tali che abbiano l’effetto desiderato sulla crescita della macromolecola.
La poliaddizione si divide a seconda della natura dell’iniziatore (o catalizzatore) della reazione a catena, il
quale può essere un catione (ovvero uno ione con carica positiva), un anione (ovvero uno ione con carica
negativa) o un radicale libero.
Polimerizzazione cationica: l’iniziatore è un catione.
Figura 4: reazione di polimerizzazione cationica (come catione: l’acido di Lewis BF3).
Polimerizzazione anionica: l’iniziatore è un anione.
Figura 5: reazione di polimerizzazione anionica (come anione: la base di Lewis R’O-).
Polimerizzazione radicalica: l’iniziatore è in genere un perossido (organico o metallico) che contiene
un legame debole R-O-O-R. Questo legame si spezza facilmente quando viene riscaldato, con la
conseguente formazione di due radicali liberi R-O* (ovvero due molecole estremamente reattive).
Figura 6: reazione di polimerizzazione radicalica (come radicale libero: C6H5).
Il secondo tipo di polimerizzazione, la polimerizzazione per condensazione (o polimerizzazione con crescita
a stadi – poiché ogni legame si forma in uno stadio, ovvero in un passaggio, indipendente dal resto dei
legami del polimero), è la reazione tra i gruppi funzionali di due monomeri. I monomeri che formano i
polimeri di condensazione devono essere polifunzionali (ovvero devono contenere più di un gruppo
funzionale) e strutturalmente differenti tra loro.
La reazione di policondensazione unisce due monomeri che tra loro formano un legame covalente,
producendo sia catene polimeriche che un “condensato” (ovvero un composto a basso peso molecolare), in
genere una molecola d’acqua (ma possono essere anche sali, alcol o acidi) che viene eliminata.
9
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
I polimeri ottenuti con la policondensazione possono essere lineari o tridimensionali a seconda della natura
nei monomeri, che sono rispettivamente bifunzionali o trifunzionali.
3.2 ELASTOMERI
L’elasticità è una proprietà per la quale un materiale deformato è capace di assumere sua forma originaria,
non appena viene rimossa la causa che ha provocato la deformazione.
Come già accennato nel Capitolo 3.1.2, i particolari polimeri aventi caratteristiche elastiche vengono
denominati elastomeri. Infatti, quando le catene elastomeriche vengono deformate sotto l'effetto di una
forza esterna, si allineano parallelamente alla direzione dell'allungamento, senza però compattarsi (per via
dei legami trasversali tra esse); rimovendo la forza esterna che ha causato la deformazione, le catene
recuperano la loro forma originaria. Questa proprietà spiega la forza di richiamo (nella stessa direzione, ma
in verso opposto) che manifesta dopo una deformazione degli elastomeri.
Figura 7: catene polimeriche della gomma naturale, unite dai ponti di zolfo, rispettivamente in assenza (a
sinistra) e in presenza (a destra) di uno siramento.
Gli elastomeri vulcanizzati sopportano, a differenza di vetri e metalli, deformazioni anche molto grandi
senza subire danneggiamenti, ritornando poi alla loro forma iniziale.
I materiali polimerici mostrano proprietà elastiche se soddisfano le seguenti condizioni:
Le catene polimeriche devono essere lunghe e flessibili: in pratica devono poter modificare
posizione ed estensione quando vengono sottoposte ad uno sforzo (modificando gli angoli di
legame tra gli atomi di carbonio costituenti la molecola).
Le attrazioni intermolecolari (forze di van der Waals) devono essere piuttosto deboli fra le catene
(affinché esse siano relativamente libere di muoversi).
Le catene polimeriche devono essere unite da vincoli permanenti (il termine tecnico è “cross-links”,
in italiano: reticolazioni), formando una struttura a reticolo (il termine tecnico è “network”, in
italiano: rete) tridimensionale che sia capace di sopportare grandi deformazioni. I vincoli
permanenti sono legami chimici derivanti dal processo di vulcanizzazione (Capitolo 3.2.6.3).
10
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
Figura 8: curva sforzo-deformazione di un elastomero vulcanizzato: per aumentare la deformazione viene
richiesto sempre più sforzo.
Gli elastomeri possono essere sia omopolimeri, come la gomma naturale, che copolimeri, come quasi tutti i
tipi di gomma sintetica. Inoltre, vengono prodotti a base di gomma naturale (Capitolo 3.2.2) o sintetica
(Capitolo 3.2.3) vulcanizzata.
3.2.1 CAUCCIÙ
Il caucciù5 è una macromolecola che si ricava dal lattice prodotto da moltissime piante (più di 400, tra
euforbiacee, moracee e apocinacee) africane, asiatiche, centro- e sudamericane.
La percentuale di caucciù varia da lattice a lattice, e dunque da pianta a pianta. Il lattice, infatti, è composto
da diverse sostanze in soluzione nel siero (liquido organico). Sono contenuti in media:
-
55 % di caucciù
35 % di siero
4,5 % di proteine
3,9 % di acidi grassi
0,4 % di sali minerali
0,2 % di lipidi
0,1 % di zuccheri
Il restante 0,9 % sono impurezze presenti nella pianta
Il lattice si può formare in cellule disperse lungo la pianta, oppure in cellule appartenenti ad una rete diffusa
lungo la pianta (i cosiddetti vasi laticiferi). Questi vasi laticiferi sono collocati direttamente dietro la
corteccia di piante come l’Hevea brasiliensis (il cosiddetto albero della gomma).
L’Hevea brasiliensis è una pianta nativa dell’America meridionale, ed è la pianta che più comunemente
viene utilizzata per estrarre il caucciù.
5
Il nome originale (dato dai nativi sud- e centroamericani) è ”cau'uchu”, letteralmente: albero che piange.
11
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
Facendo un taglio obliquo nella corteccia dell'albero della gomma (Foto 1), si provoca la fuoriuscita di gocce
di gomma greggia (una dispersione acquosa del lattice) allo stato semifluido.
La raccolta di caucciù viene svolta al mattino, poiché in quel momento del giorno la pressione nel tronco
dell’Hevea raggiunge il suo massimo, rendendo più veloce la fuoriuscita del lattice (che si ferma circa dopo
quattro ore, non appena si coagula, trasformandosi in una sostanza semisolida).
La gomma greggia viene poi raccolta in secchi (contenenti soluzioni di ammoniaca, per evitare inizialmente
la coagulazione), liberata da ogni tipo di corpo estraneo (foglie, insetti,… ), diluita in acqua sino ad ottenere
un liquido omogeneo contenente circa il 15% di caucciù. Questo liquido viene fatto coagulare con dell’acido
formico o acetico, per poi venire schiacciato e tagliato fino ad ottenere diverse fini lastre (chiamate nel
linguaggio tecnico “crépe sheet”, in italiano: foglio increspato). Queste specie di fogli vengono fatti
essiccare per riscaldamento.
Foto 1: Estrazione del lattice nella provincia di Missiones, in Argentina
In termini chimici il caucciù rappresenta l’isoprene (2-metil-1,3-butadiene) altamente polimerizzato
(raggiunge le 8000 unità monomeriche). Il monomero si trova nella forma “cis-“ formando, se
polimerizzato, il policisisoprene (il lattice di alcune piante asiatiche presenta un polimero analogo al
caucciù, ovvero la guttaperca, i cui monomeri sono però in forma “trans-“).
Figura 9: struttura del policisisoprene
12
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
Caratteristiche del caucciù:
-
Impermeabile ad acqua e gas
Non è conduttore di elettricità
A bassa temperatura può essere estremamente elastico
Fonde a 180 °C
È solubile in tutti i solventi organici
Si deteriora all’aria (per l’azione dell’ossigeno sui doppi legami)
3.2.2 GOMMA NATURALE
La gomma naturale è un idrocarburo polimerico insaturo, prodotto dalla coagulazione del lattice.
Al giorno d’oggi la gomma naturale è ottenuta prevalentemente dal caucciù di piante geneticamente
modificate, che presentano una composizione di sostanze, e dunque anche proprietà meccaniche, più
costanti (e oltretutto sono più redditizie, infatti le piante OGM hanno una produttività maggiore rispetto
alle piante a crescita spontanea). Tuttavia, nonostante i vari accorgimenti per omogeneizzarla, la gomma
naturale rimane un miscuglio di caucciù e altre sostanze provenienti dal lattice, e dunque le sue proprietà
sono comunque variabili.
La gomma naturale ha ottime prestazioni meccaniche, e viene pertanto impiegata per la produzione di
svariati prodotti come gli pneumatici, le guarnizioni, le suole per le scarpe e i collanti. Nonostante lo
sviluppo di moltissime gomme sintetiche, l’uso della gomma naturale rappresenta tuttora all’incirca il 44%
dell’uso totale di elastomeri.
Un particolare tipo di gomma naturale è, per esempio, la gomma arabica; essa deriva dalla secrezione delle
acacie che crescono, a differenza di quanto ci si potrebbe aspettare dal nome, soprattutto nell’Africa
subsahariana. La gomma arabica viene utilizzata, per esempio, per la fabbricazione di colle, caramelle e per
rendere lucidi i pani speziati.
3.2.3 GOMMA SINTETICA
Negli ultimi decenni, la richiesta di gomma ha avuto un aumento drastico, dovuto al forte sviluppo di suoi
impieghi industriali. Per rispondere a tale aumento, sono stati introdotti sul mercato diversi tipi di gomme
sintetiche.
Al giorno d’oggi si può sintetizzare una gomma strutturalmente identica alla gomma naturale: il
policisisoprene (o polimetilbutadiene) sintetico, che deriva dalla polimerizzazione per addizione
dell’isoprene. Inoltre, anche altri tipi di gomme sintetiche, come la CR, la NBR, la SBR, e la IIR (alcune delle
gomme utilizzate per questo lavoro di maturità), contengono lo stesso monomero della gomma naturale
(l’isoprene).
13
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
I polimeri idrocarburici delle gomme sintetiche vengono ricavati attraverso processi petrolchimici6, ovvero
derivano da oli minerali estratti dal petrolio greggio. Così, il policisisoprene sintetico è un prodotto
dell’industria petrolchimica, e così pure gli altri polimeri utilizzati per la sintesi di gomme artificiali.
Le gomme sintetiche vengono fabbricate secondo le caratteristiche che deve avere il prodotto finale:
possono infatti venire selezionati i monomeri in base alle singole molecole (con le rispettive peculiarità).
Questo fatto spiega l’enorme varietà di elastomeri sintetici cosiddetti “specializzati” sul mercato.
3.2.4 CLASSIFICAZIONE
Gli elastomeri possono essere classificati (secondo la norma ASTM7: D 1418-79), in base alla struttura della
catena principale delle macromolecole, in:
-
Gruppo M: catene polimeriche sature contenenti polietilene
In questo gruppo si trova per esempio la gomma EPDM (utilizzata per questo lavoro di maturità),
come anche le gomme ACM, CSM, FEPM, FFPM, FPM
-
Gruppo O: catene polimeriche contenenti ossigeno
In questo gruppo si trovano le gomme CO, ECO
-
Gruppo Q: catene polimeriche contenenti ossigeno e silicio
In questo gruppo si trovano le gomme FMQ, MQ, PMQ, PVMQ, VMQ
-
Gruppo R: catene polimeriche insature contenenti policisisoprene
In questo gruppo si trovano per esempio le gomme IIR, NBR, HNBR (che però presenta catene
sature), SBR, CR, e ovviamente la gomma NR (gomme utilizzate per questo lavoro di maturità),
come anche le gomme BIIR, BR, IR
-
Gruppo U: catene polimeriche contenenti ossigeno e azoto
In questo gruppo si trovano le gomme AU, EU
3.2.5 ACCENNI STORICI
Dopo essere giunto nel Nuovo Mondo, Cristoforo Colombo riferì di aver visto gli indigeni utilizzare il
precipitato del lattice degli alberi della gomma per vari scopi (come ad esempio per proteggersi dalla
pioggia, per coprire recipienti e anche semplicemente per giocare con palline rimbalzanti).
Tuttavia, il caucciù giunse in Europa solo anni dopo, grazie a Charles Marie de La Condamine8, dopo i suoi
viaggi di esplorazione nell’Amazzonia (1743-1744).
6
Processi petrolchimici: vari passaggi di raffinazione attraverso cui il petrolio greggio viene trasformato in diversi
materiali utili all’uomo, come la benzina, il cherosene, il gasolio, l’olio combustibile, il bitume, e il paraffine.
7
ASTM: “American Society for Testing and Materials”, società che definisce le norme delle proprietà fisiche e chimiche
degli elastomeri.
8
Charles Marie de La Condamine (1701-1774): matematico, astronomo e geografo francese.
14
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
Nel giro di pochi decenni iniziò una lunga serie di indagini sul caucciù e sulle sue interessanti proprietà, che
con l’aiuto di alcune eccezionali scoperte casuali, permisero l’avvento di una nuova e importante industria:
l’industria della gomma. Qui di seguito vengono riportati gli avvenimenti più importanti:
-
-
-
Nel 1770 Joseph Priestley9 scoprì l'utilità della gomma naturale per cancellare la scrittura attraverso
il "rubbing" (in italiano: sfregamento); da qui nasce il termine "rubber".
Nel 1823 Charles Macintosh10 brevettò l'utilizzo della gomma naturale per rendere impermeabili i
tessuti.
Nel 1830 Thomas Hancock11 scoprì la facoltà della gomma di divenire, quando viene sollecitata
meccanicamente (tramite un processo chiamato “masticazione”) un materiale meno elastico e più
adattabile a stampi.
Nel 1839 Charles Goodyear12 scoprì per caso che scaldando la gomma con dello zolfo e dell'ossido
di piombo, la si rende più elastica e più resistente ai solventi.
Questo processo di preparazione della gomma venne denominato “vulcanizzazione” e brevettato
da Thomas Hancock, che lo sfrutto, assieme al processo di masticazione, per fabbricare della
gomma elastica insolubile e adattabile a stampi (la vulcanizzazione permetteva di fissare la forma
conferita alla gomma in seguito alla masticazione), dando inizio all’industria della gomma.
Nel 1908 Wilhelm Ostwald13 e il figlio Wolfang Ostwald14 scoprirono che aggiungendo ammine
aromatiche alla gomma, la si protegge dall'ossidazione.
Gli scienziati cercavano, in contemporanea alla ricerca di miglioramenti nella lavorazione della gomma
naturale, di scoprirne la natura e di riprodurne una versione sintetica in laboratorio (la prima gomma
sintetica venne prodotta in Germania: si trattò della gomma metilisoprenica). La produzione di gomma
sintetica però acquistò importanza solamente dall'inizio della Prima Guerra Mondiale, per via dei conflitti
post-coloniali sulla produzione della gomma. Al giorno d’oggi la gomma sintetica ha superato la gomma
naturale in termini di utilizzo totale (di elastomeri in generale).
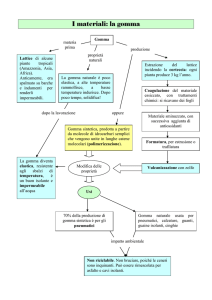
3.2.6 FABBRICAZIONE
La produzione industriale di un elastomero a partire dal lattice naturale o sintetico segue in genere tre
passaggi ben distinti, ma necessari; in termini tecnici il “compounding”, il “processing” e il “curing”.
3.2.6.1 COMPOUNDING
Il primo stadio di lavorazione della gomma è denominato "compounding" (termine tecnico, in italiano:
ricettazione). Il “compounding” è la formulazione della “ricetta” della mescola, ovvero l’individuazione degli
ingredienti e dei metodi di preparazione necessari per ottenere il prodotto finale con le proprietà
desiderate.
9
Joseph Priestley (1733-1804): chimico e filosofo inglese.
Charles Macintosh (1766-1843): chimico scozzese.
11
Thomas Hancock (1786-1865): industriale britannico.
12
Charles Goodyear (1800-1860): chimico statunitense.
13
Wilhelm Ostwald (1853-1932): chimico e filosofo tedesco.
14
Wolfgang Ostwald (1883-1943): biologo, fisico e chimico tedesco; figlio di Wilhelm Ostwald.
10
15
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
L’unità di misura ponderale15 utilizzata per definire la quantità di additivi è il “phr” (per hundred rubber),
ovvero la quantità di sostanza aggiunta a 100 “parti di gomma” (intesa è la gomma di base della mescola).
La mescola (nel linguaggio tecnico “compound”) è composta da diverse sostanze che permettono sia il
processo in sé che l’ottimizzazione (in termini di produzione –e dunque costi e qualità) della trasformazione
del prodotto. In genere, i materiali utilizzati sono: la gomma di base, agenti di reticolazione, agenti chimici,
agenti di riempimento, plastificanti, anti invecchianti, peptizzanti, agenti di rilascio e stabilizzanti.
Gli ingredienti principali sono riportati, insieme al loro effetto, in questo elenco:
L’ingrediente principale della mescola è, evidentemente la gomma di base (nel linguaggio tecnico
“raw elastomer”, in italiano: gomma greggia), che può essere: la gomma naturale o una gomma
sintetica.
Gli agenti di reticolazione, o vulcanizzanti permettono di generare il reticolo tridimensionale nel
polimero di base, per cui conferiscono all’elastomero finito determinate proprietà fisiche (Capitolo
3.2.6.3). Il vulcanizzante più utilizzato è lo zolfo (quantità compresa tra 0,5 e 3 phr), che può venire
aggiunto puro o per mezzo di molecole che lo liberano quando vengono scaldate (e dunque
direttamente durante il processo di vulcanizzazione, comportandosi come “donatori di zolfo”). Al
posto dello zolfo si può ricorrere all’utilizzo di perossidi (necessari per la vulcanizzazione di polimeri
con macromolecole sature).
Gli agenti chimici permettono di controllare e velocizzare la produzione. I più utilizzati sono:
- Acceleranti: accelerano la vulcanizzazione (quantità compresa tra 0,5 e 1,5 phr).
- Attivatori: possono modificare la velocità di vulcanizzazione (uniti agli acceleranti) e la densità di
reticolazione, ovvero l’ammontare di legami tra le catene polimeriche (quantità compresa tra 2 e 3
phr).
- Ritardanti di vulcanizzazione: permettono di determinare l’inizio del processo di vulcanizzazione,
per evitare pre-vulcanizzazioni (quantità compresa tra 0,1 e 0,3 phr).
- Acidi organici: servono per legare gli attivatori agli acceleranti (quantità compresa tra 1 e 3 phr).
Gli agenti di riempimento (nel linguaggio tecnico “filler”, in italiano: riempitivi) conferiscono
all’elastomero determinate caratteristiche fisiche (come la durezza, la resistenza allo strappo e
all’abrasione), che dipendono dalla natura della carica16:
- Cariche inattive: determinano caratteristiche come la densità, la durezza e le proprietà elettriche.
- Cariche rinforzanti: rendono la gomma meccanicamente resistente e dura. Vengono utilizzati il nero
di carbonio17 (per le gomme nere), e le silici (per le gomme bianche, o colorate a partire dalla
gomma bianca).
I plastificanti facilitano la lavorabilità delle gomme vulcanizzate (rendendole meno dure) e le
rendono più resistenti all’invecchiamento.
15
Ponderale: unità di peso.
Cariche: additivi in forma solida.
17
Nero di carbonio: forma allotropica del carbonio sotto forma di nanoparticelle, ottenute con il cracking del metano
(processo con cui vengono spezzate le macromolecole idrocarburiche del metano in molecole a minor peso
molecolare, ovvero con minore apporto di carbonio).
16
16
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
Gli anti invecchianti proteggono la gomma dall’invecchiamento dovuto a diversi fattori, come
l’azione sull’elastomero da parte di ossigeno (O2) e ozono (O3), che possono modificare la struttura
della catena polimerica (per esempio rendendola satura) e conseguentemente le sue proprietà
meccaniche (l’elasticità in primo luogo).
I peptizzanti facilitano l’assorbimento degli altri additivi, da parte della gomma.
Gli agenti di rilascio facilitano il distacco dell’elastomero dallo stampo.
Gli stabilizzanti impediscono la formazione di doppi legami.
Sostanze secondarie, che non appaiono sempre nelle ricette delle mescole, possono essere per esempio:
I coloranti, sotto forma di pigmenti per colorare l’elastomero ottenuto. I coloranti devono essere
aggiunti in una mescola in cui le cariche rafforzanti siano bianche, poiché evidentemente in una
mescola contenente nero di carbonio i colori risulterebbero invisibili.
I rigonfianti, che rendono il tutto spugnoso tramite la formazione di bolle di gas, permettendo la
produzione per esempio di espansi. Come rigonfianti vengono utilizzate diverse sostanze che,
sottoposte a calore, formano del gas (per esempio l’urea).
Come si può dedurre dall’ampia scelta di ricette possibili (ottenute variando l’ammontare dei diversi
ingredienti, e dunque del loro effetto sull’intera macromolecola), si possono produrre una grande varietà di
elastomeri a partire dai polimeri grezzi.
3.2.6.2 PROCESSING
Il secondo stadio di lavorazione è denominato “processing” (termine tecnico, in italiano: lavorazione), e
riguarda sia le operazioni di miscelazione della gomma di base e degli additivi (dunque dell’intera mescola),
che i processi di formatura, per dare all’elastomero ottenuto la forma desiderata.
La miscelazione si divide in tre momenti che si succedono:
-
L’incorporamento: consiste nell’incorporare i vari ingredienti della mescola
La dispersione: consiste nel disperdere omogeneamente le cariche, mediante l’uso di plastificanti e
oli
La distribuzione: consiste nell’omogeneizzare tutta la miscela
Per la miscelazione viene solitamente utilizzato un mescolatore interno (Figura 10).
17
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
Figura 10: rappresentazione di un mescolatore interno. Quando il pistone viene alzato, la mescola entra nel
mescolatore, dove avviene la miscelazione mediante i due rotori che girano in verso opposto.
Per quanto riguarda la gomma naturale, prima della miscelazione deve subire un processo di
“masticazione”, che la rende plastica e malleabile. In questo modo la gomma naturale può oltretutto
assorbire facilmente i vari additivi e può dunque venire miscelata.
La massa omogenea ottenuta dalla miscelazione può passare poi alla formatura. Esistono diverse tecniche
di stampaggio:
-
Lo stampaggio a compressione: consiste nell’inserire la mescola in stampi (aventi la forma che
deve raggiungere l’elastomero finito) e comprimerli, di modo che la mescola si adatti alla forma.
Questo tipo di stampaggio viene attuato per esempio per gli pneumatici.
La tecnica è utilizzata soprattutto per i materiali termoindurenti.
Figura 11: schema dello stampaggio per compressione
18
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
-
Lo stampaggio a trasferimento: consiste, come nel caso del semplice stampaggio a compressione,
nel comprimere la mescola negli stampi. Tuttavia differisce dalla precedente tecnica in quanto la
mescola, prima di passare allo stampo, deve passare per una camera di trasferimento dove viene
riscaldata e viene resa più molle, e dalla quale viene poi spinta a pressione elevata nello stampo.
-
Lo stampaggio a iniezione: consiste nell’“iniettare” la mescola in stampi, che in questo caso
rappresentano il contorno di ciò che sarà la forma finale.
La tecnica è utilizzata soprattutto per gli elastomeri termoplastici.
Figura 12: schema dello stampaggio per iniezione
-
La formatura per estrusione: consiste nello spingere, con l’ausilio di un estrusore, la mescola
attraverso un ugello avente la sagoma di quella che sarà la forma finale della mescola. Questa
tecnica viene utilizzata per esempio per la fabbricazione di tubi.
La tecnica è utilizzata sia per gli elastomeri termoplastici che per i materiali termoindurenti.
Figura 13: schema dello stampaggio per estrusione
La formatura può avvenire contemporaneamente o separatamente dal terzo stadio di lavorazione (la
vulcanizzazione, Capitolo 3.2.6.3); nel primo caso la formatura della gomma ad alta temperatura fa iniziare
automaticamente il processo di vulcanizzazione; questo accade negli stampaggi a compressione e a
iniezione.
19
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
3.2.6.3 CURING
Il terzo stadio di lavorazione della gomma è denominato "curing" (termine tecnico, in italiano:
vulcanizzazione). Il “curing” è un processo nel quale si genera un reticolo molecolare stabile, grazie
all’unione delle catene polimeriche attraverso ponti di zolfo, atto a rendere costanti le caratteristiche
dimensionali (ovvero la forma) e aumentare quelle meccaniche (prima di tutte l’elasticità) dell’elastomero
ottenuto dal “processing”.
Come accennato in precedenza, l’elasticità del caucciù (e dei lattici in generale), è compromessa al contatto
con l’ossigeno (e dunque al contatto con l’aria). Infatti, quest’ultimo “attacca” i doppi legami (C=C),
formando ponti di ossigeno che legano trasversalmente le macromolecole e le portano alla rottura.
Per ovviare questo inconveniente, si riscalda (tra i 20° e i 180°C) il caucciù con l’aggiunta di zolfo. Lo zolfo si
lega ai doppi legami delle catene polimeriche, creando dei ponti tra le macromolecole (che invece non le
portano alla rottura), riducendo le probabilità del caucciù di legarsi in modo incrociato con l’ossigeno.
L’aggiunta dello zolfo crea così un reticolo tridimensionale di legami trasversali tra le catene polimeriche,
che modifica alcune proprietà fisiche dell’elastomero, che è reso:
-
Meno plastico e più elastico (e soprattutto è reso quasi permanentemente elastico)
Più duro
Più resistente ad agenti atmosferici e ad abrasione
L’elastomero ottenuto con la vulcanizzazione del caucciù è la gomma naturale.
Figura 14: schema della vulcanizzazione; tra le macromolecole della gomma si formano dei ponti di zolfo
Figura 15: risultato della vulcanizzazione; tra le catene polimeriche si sono create delle reticolazioni
tridimensionali.
Questa tecnica si deve alla scoperta di Charles Goodyear, che mescolò casualmente dello zolfo al caucciù,
ottenendo una massa ribollente (a causa dello sviluppo di H2S) che pareva un vulcano.
20
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
La vulcanizzazione è dunque un processo chimico che forma un reticolo tridimensionale di legami chimici
trasversali tra le macromolecole, andando a creare un solido viscoelastico18, l’elastomero vulcanizzato. La
vulcanizzazione appena presentata, con l’aggiunta solo dello zolfo, risulta lenta e poco efficiente, per
ovviare questo inconveniente si ricorre (come citato nel Capitolo 3.2.6.1) ad acceleranti.
Le proprietà elastiche e meccaniche di un elastomero dipendono dal suo grado di vulcanizzazione, ovvero
dalla densità del reticolo (e dunque dalla quantità di zolfo nella mescola). A dipendenza del risultato che si
desidera ottenere si può variare il grado di vulcanizzazione, ottenendo un materiale più tenero o più duro
(come l'ebanite per le palle da bowling).
Le proprietà generali degli elastomeri rimangono comunque: l’elasticità, la resistenza a trazione, abrasione,
invecchiamento e a lacerazione, e la durezza. Oltretutto, le gomme vulcanizzate sono allungabili oltre il
100% della loro lunghezza originale con sforzo minimo, hanno una bassa resistenza al taglio e una bassa
dipendenza della temperatura (per quanto riguarda soprattutto le loro proprietà meccaniche).
3.2.7 IMPATTO AMBIENTALE
Oggetti di gomma e di plastica caratterizzano la società attuale, e ne rappresentano la modernità. Non si
può dire che rappresentino il lusso, poiché vengono considerati materiali di scarso pregio (in quanto sono
poco costosi e appunto, presenti dovunque). Per questo motivo, vengono cestinate giornalmente grandi
quantità di questi materiali. Lo spreco è enorme, infatti le gomme e le plastiche usate potrebbero venire
riciclate semplicemente riducendole a dimensioni minime (chiamate “granuli”), tramite una macinazione,
per poi poter venire riutilizzate. Gran parte di questi materiali cestinati finiscono nelle acque (gli oceani
sono ormai diventati le grandi spazzature dell’uomo, che in un anno si sbarazza in media di 10'000 milioni di
tonnellate di gomme e plastiche in acqua), dove necessitano centinaia di anni per degradarsi e dove
rilasciano tossine a scapito della flora e della fauna marina.
In seguito all’introduzione al mondo della gomma nei capitoli precedenti, si potrebbe a ragione concludere
che la gomma rappresenti un materiale geniale, e che le sue tipologie e applicazioni lo siano altrettanto.
Tuttavia, al giorno d’oggi questo aspetto della gomma non è particolarmente valorizzato anzi, come detto
in precedenza, essa viene spesso poco considerata e di conseguenza sprecata. È quindi pure possibile
vedere la gomma come simbolo della decadenza della società.
Dal punto di vista dell’impatto negativo che ha l’utilizzo della gomma sull’ambiente è rilevante anche
l’aspetto legato alla produzione della gomma naturale. Infatti, per la produzione in coltivazioni di
monocultura del caucciù, vengono disboscate grandi aree delle foreste tropicali19, e per cui compromesse le
vite di migliaia di specie vegetali e animali (e, da non dimenticare: diverse popolazioni indigene che vivono
in armonia con la foresta). Essendo monoculture viene compromessa pure la biodiversità delle aree
circostanti. Oltretutto, le foreste vengono in genere disboscate semplicemente appiccando il fuoco che,
oltre a generare immense quantità di CO2, non è facilmente domabile e distrugge tutto ciò che incontra.
18
Solido viscoelastico: solido che, quando viene sottoposto a sollecitazioni, subisce deformazioni sia viscose che
elastiche
19
Foreste tropicali: biotopi (area naturale in cui si instaura un ecosistema) naturali situati nelle zone equatoriali, di cui
al giorno d’oggi rimane solo la metà.
21
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
3.2.8 UNO SGUARDO AL FUTURO
Per il futuro, oltre a ricerche in ambito “sportivo” (definizione piuttosto scadente per la aggettivare la
formula uno e gli altri “sport” a motore) e in termini di produttività senza limiti, sono in atto diverse
ricerche per una produzione più sostenibile della gomma naturale (per esempio la produzione di gomma
naturale a partire dall’estrazione del lattice dai “denti di leone”; un progetto nato dalla collaborazione
dell’Istituto Fraunhofer –istituto di ricerca applicata- e della Continental -tra i più grandi produttori di
pneumatici al mondo ).
22
Spettroscopia infrarossa applicata alle gomme
4
R. Flueckiger
INTRODUZIONE ALLE TECNICHE SPETTROSCOPICHE
4.1 RADIAZIONI ELETTROMAGNETICHE
La radiazione elettromagnetica è l’energia di un campo elettromagnetico (insieme di un campo elettrico e
un campo magnetico) che si propaga alla velocità della luce20 nello spazio vuoto, sotto forma di onde
elettromagnetiche.
Figura 16: rappresentazione di un’onda elettromagnetica. La figura mostra sia la componente
elettrica che la componente magnetica dell’onda, E e M, che sono in fase (quando l’intensità di E è
massima lo è pure quella di M; questa relazione vale per tutti i valori di intensità) e perpendicolari
tra loro, così come perpendicolari alla direzione di propagazione.
Le onde elettromagnetiche, oltre alle ovvie proprietà ondulatorie dell’andamento oscillante del campo
elettromagnetico (Figura 17), possiedono anche proprietà corpuscolari quale l’emissione discreta (ovvero
emessa solo per valori discreti: i quanti) di energia radiante: questo comportamento di duplice natura viene
chiamato “dualismo onda-particella”. Il corpuscolo in questione è il fotone, una particella elementare21 con
massa nulla, che rappresenta il quanto di luce della radiazione elettromagnetica.
Il “dualismo onda-particella” determina comportamenti differenti in situazioni diverse: le radiazioni si
comportano come onde durante la loro propagazione nello spazio, mentre quando interagiscono con altre
particelle elementari si comportano come un fascio di fotoni.
20
Velocità della luce (nel vuoto): 𝒸=299'792’458 m/s
Particelle elementari: particelle indivisibili che sono i costituenti elementari della materia, come per esempio gli
elettroni, i fotoni, il recentemente provato Bosone di Higgs.
21
23
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
Figura 17: mostra le caratteristiche ondulatorie delle radiazioni elettromagnetiche; lunghezza
d’onda, ampiezza e oscillazione.
I differenti tipi di radiazione elettromagnetica (raggi gamma, raggi x, radiazione ultravioletta, luce visibile,
radiazione infrarossa, onde radio) divergono a dipendenza della loro frequenza (rispettivamente dalla loro
lunghezza d’onda), come mostrato nella Figura 18.
Figura 18: rappresentazione dello spettro elettromagnetico, ovvero l’insieme delle frequenze delle diverse
radiazioni elettromagnetiche (le frequenze di onde elettromagnetiche possono teoricamente assumere
qualsiasi valore positivo).
4.2 TECNICHE SPETTROSCOPICHE
Sin dall’antichità i chimici cercarono di determinare la struttura delle molecole di sostanze incognite. Il
metodo tradizionale per questa determinazione consisteva nel trasformare la sostanza incognita fino a
ottenerne una conosciuta, per mezzo di reazioni a decorso noto (ovvero reazioni in cui è noto sia il
meccanismo che i prodotti). Oltre ad essere estremamente laboriosa, questa tecnica permetteva di
identificare solamente la struttura molecolare di composti noti (risultanti dalle trasformazioni).
Con l’introduzione delle tecniche spettroscopiche si poterono finalmente identificare anche composti
ignoti, e la procedura di determinazione della struttura venne enormemente semplificata; riducendo il
24
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
tempo e la quantità di sostanza necessari all’identificazione, così come vari tipi di errore dovuti alle perdite
durante i processi di trasformazione.
Le origini della spettroscopia risalgono agli esperimenti di Sir Newton22: nel 1666 egli interpretò la gamma
di colori (dal rosso al viola) ottenuti dalla dispersione della luce solare attraverso un prisma di vetro, come
la separazione della luce solare nei vari colori di cui è composta. La banda luminosa che ottenne viene
chiamata spettro23 ottico della luce solare.
Figura 19: la luce bianca (come viene chiamata anche la luce solare) che attraversa un prisma si
separa nei suoi componenti.
Al posto dell’osservazione diretta dello spettro attuata da Newton, il fisico Fraunhofer24 posizionò un
teodolite25 lungo la rifrazione delle radiazioni, ottenendo ciò che si può definire l’antenato dello
spettroscopio moderno; infatti, riuscì ad individuare in questo modo diverse righe scure nello spettro
solare.
La spettroscopia come analisi chimica di una sostanza nacque dalle ricerche di Kirchhoff26 e Bunsen27 nel
1859, che portarono alla deduzione fondamentale: lo spettro rispecchia le caratteristiche strutturali del
campione analizzato, poiché a ogni elemento chimico di cui è composto, sono associate delle determinate
righe spettrali.
Il termine spettro ottico indica in generale l’insieme delle radiazioni elettromagnetiche emesse o assorbite
da una sostanza eccitata (le cui molecole vengono messe in oscillazione per mezzo di un impulso di energia
–la radiazione).
22
Sir Isaac Newton (1642-1727): matematico, fisico e filosofo (secondo la connotazione di quell’epoca, ove non vi era
distinzione tra scienziato, teologo e filofoso della natura) inglese.
23
Spettro: dal latino “spectrum”, immagine.
24
Joseph von Fraunhofer (1787-1826): fisico e ottico tedesco.
25
Teodolite: strumento ottico utilizzato per la misurazione di angoli azimutali e zenitali (rispettivamente gli angoli nel
piano orizzontale e verticale).
26
Gustav Robert Kirchhoff (1824-1887): fisico tedesco. Kirchoff fu, oltre a un grande ricercatore nell’ambito della
spettroscopia in generale, il costruttore del primo spettroscopio.
27
Robert Wilhelm Eberhard Bunsen (1811-1899): chimico tedesco.
25
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
Le tecniche spettroscopiche sono tecniche chimico-fisiche, basate sullo studio degli spettri delle radiazioni
elettromagnetiche emesse o assorbite dalla sostanza analizzata (ad eccezione della spettroscopia di massa,
che si basa, evidentemente, sulla massa della sostanza analizzata).
I metodi spettroscopici si dividono a seconda del processo chimico-fisico implicato nell’ottenimento di uno
spettro (in questo lavoro di maturità è stata attuata solamente la tecnica spettroscopica di assorbimento
infrarosso, dunque viene approfondito solo il metodo di assorbimento):
Spettroscopia di assorbimento: il campione di materiale incognito deve essere posto in modo
tale da venire colpito dalla radiazione elettromagnetica di una determinata sorgente.
Il materiale assorbe l’energia delle radiazioni elettromagnetiche (la quantità assorbita varia a
dipendenza della lunghezza d’onda).
Lo spettroscopio permette di determinare la quantità assorbita in funzione della lunghezza
d’onda: semplicemente sottraendo l’intensità non assorbita dal campione (misurata dal
rivelatore) dopo il suo attraversamento, dall’intensità iniziale della radiazione.
Questo processo viene poi ripetuto a differenti lunghezze d’onda, ottenendo uno spettro delle
radiazioni assorbite in funzione della lunghezza d’onda (che può poi venire convertito in numeri
d’onda).
In questa categoria si collocano: la spettroscopia di assorbimento atomico, la spettroscopia
infrarossa (IR), la spettroscopia ultravioletta e visibile (UV), e la spettroscopia a raggi X (XAS).
Spettroscopia di emissione ottica: consiste nell’eccitare, grazie a scariche elettriche, gli atomi
delle molecole. Per tornare alle condizioni originarie (ovvero allo stato non eccitato) gli atomi
emettono radiazioni elettromagnetiche, che vengono successivamente misurate dal rivelatore.
In questa categoria si trovano per esempio la spettroscopia di emissione atomica (AES) e la
spettroscopia di fluorescenza.
Spettroscopia di diffusione: consiste nell’eccitare i livelli vibrazionali delle molecole tramite
radiazioni elettromagnetiche.
A differenza della spettroscopia infrarossa classica, il rilevatore misura la radiazione diffusa a
90° o 180° dal cammino ottico.
In questa categoria si trova la spettroscopia Raman.
Altri tipi di spettroscopia possono essere per esempio la spettroscopia di risonanza magnetica
nucleare (NMR), la spettroscopia di fotoemissione o la spettroscopia di massa.
I metodi spettroscopici vengono utilizzati in diversi ambiti. Oltre che, ovviamente, in laboratori chimici e
fisici, possono venire utilizzati anche in ambiti come l’arte e il restauro per identificare i materiali di cui
sono fatte le antiche opere d’arte (col fine di sviluppare le tecniche di conservazione), o per puro interesse
alla natura dei materiali impiegati nell’arte nel corso della storia.
Anche nell’ambito dell’astronomia hanno avuto un ruolo di grande importanza (in primo luogo per studiare
la composizione chimica del sole, dei pianeti e delle stelle) in quanto applicabili anche distanza elevate,
poiché la distanza dalla sorgente di radiazione è irrilevante.
26
Spettroscopia infrarossa applicata alle gomme
5
R. Flueckiger
SPETTROSCOPIA IR
5.1 INTRODUZIONE
La spettroscopia a raggi infrarossi si basa sull’interpretazione di spettri, ottenuti dall’interazione dei modi
vibrazionali (Capitolo 5.2.2) di una molecola con delle radiazioni elettromagnetiche aventi lunghezza d’onda
compresa tra 1000 e 0.7 µm (radiazioni infrarosse).
5.1.1 SCOPERTA DELLA TECNICA
Nel 1800, durante i suoi studi sullo spettro della luce visibile, Herschel28 scoprì l’esistenza di una nuova
banda di radiazioni. Con l’intenzione di misurare la distribuzione termica dello spettro di luce bianca,
collocò dei termometri a mercurio laddove cadevano i diversi colori dello spettro, ottenuto dalla deviazione
della luce solare tramite un prisma di vetro (Figura 19). Notò che il massimo della temperatura si instaurava
in prossimità del limite del visibile dalla parte del colore rosso, per cui dedusse la presenza di onde
elettromagnetiche invisibili (aventi energia minore della luce visibile) al di là del rosso, che poi chiamò raggi
infrarossi29.
Nel 1890 Michelson30 sviluppò un congegno fatto di specchi (chiamato poi interferometro di Michelson) dal
quale si ottiene, facendovi passare delle radiazioni, una figura d’interferenza (ovvero una sovrapposizione
di due o più onde); questo apparecchio divenne poi il cuore dello spettroscopio a trasformata di Fourier31
(vedi capitolo 5.3.2).
5.1.2 UTILIZZO
La tecnica viene utilizzata soprattutto per:
-
-
-
l’identificazione di sostanze incognite e l’ottenimento di indicazioni strutturali di un
sostanze note o incognite. Queste due tipologie di utilizzo rappresentano gli
argomenti principali di questo lavoro di maturità.
il controllo del decorso di una reazione. Questo processo è correlato al primo;
infatti, conoscendo le bande di assorbimento della sostanza di partenza e del
complesso finale si può capire, facendo degli spettri durante il decorso della
reazione, quando essa è giunta al termine (prefissato).
valutare la purezza di un composto. Evidentemente se il composto in analisi
presenta uno spettro differente da quello del composto di riferimento (puro), vuole
dire che presenta impurezze.
La spettroscopia infrarossa ha diverse applicazioni concrete, che si possono suddividere in due categorie: le
applicazioni per cui si necessita di un’analisi rispettivamente quantitativa (Capitolo 5.1.2.1) o qualitativa
(Capitolo 5.1.2.2).
28
Sir Frederick William Herschel (1738-1822): astronomo, fisico e musicista britannico.
Infrarosso: da “infra” (= sotto in latino) e rosso (colore visibile avente la frequenza più bassa); letteralmente “sotto il
rosso”.
30
Albert Abraham Michelson (1852-1931): fisico statunitense.
31
Jean Baptiste Joseph Fourier (1768-1830): matematico e fisico francese.
29
27
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
5.1.2.1 UTILIZZO QUANTITATIVO
È possibile determinare quantitativamente la presenza di un determinato composto in una miscela senza il
bisogno di separarlo preliminarmente.
Questa tecnica è utile soprattutto per individuare inquinanti gassosi nell’atmosfera o nei prodotti
fabbricati, dove gli inquinanti derivano dalla lavorazione industriale. Al giorno d’oggi questa tecnica è molto
importante per via della continua stesura di nuove leggi governative sugli inquinanti atmosferici,
necessariamente introdotte per combattere il problema dell’inquinamento atmosferico, che è in aumento.
Le analisi quantitative sono incentrate prevalentemente nella regione del medio e del vicino infrarosso
(definizione vedi Capitolo 5.2.1).
5.1.2.2 UTILIZZO QUALITATIVO
Come già menzionato precedentemente la spettroscopia infrarossa ha come primo fine l’identificazione di
sostanze incognite. Questo obiettivo è raggiungibile confrontando lo spettro della sostanza incognita con
quello di una sostanza conosciuta (con la speranza di attingere ad una correlazione picco per picco, ovvero
all’equivalenza tra le sostanze), oppure attraverso la ricostruzione della struttura della sostanza incognita
tramite il riconoscimento di bande di assorbimento caratteristiche (assorbimenti da parte dei gruppi
funzionali contenuti nel campione) .
In generale vengono utilizzati per identificare una sostanza, in concomitanza con gli spettri IR, altri spettri
derivanti da metodi spettroscopici differenti, poiché spesso l’utilizzo di una sola tecnica spettroscopica non
garantisce la determinazione univoca della natura della sostanza esaminata. In questo lavoro di maturità
l’identificazione non ha presentato questo tipo di problemi, poiché avevo a disposizione un numero limitato
(7) di spettri di confronto delle sostanze contenute.
La spettroscopia infrarossa qualitativa viene utilizzata per esempio per uno studio non invasivo (ovvero che
non arreca danni) dei beni culturali. Infatti è possibile studiare lo stato di conservazione, identificare la
presenza di inquinanti atmosferici e altri tipi di cause di degradamento in manufatti artistici o costruzioni
antiche. Tramite una pratica strumentazione portatile è oltretutto possibile analizzare questi beni culturali
direttamente sul posto.
Un altro ambito in cui viene utilizzata la tecnica è quello del rilevamento, attraverso l’analisi degli inchiostri,
di contraffazioni fraudolente di documenti ufficiali.
Per quanto riguarda le analisi qualitative dei composti organici, ci si basa principalmente sulla regione del
medio infrarosso (poiché gli assorbimenti di vibrazione dei legami di molecole organiche si manifestano in
genere a frequenze comprese tra 4000 e 400 cm-1), mentre per i composti inorganici ci si basa soprattutto
sulla regione del lontano infrarosso (poiché gli assorbimenti di vibrazione dei legami di molecole
inorganiche si manifestano in genere a frequenze minori di 600 cm-1).
5.1.3 IMPORTANZA INDUSTRIALE
A livello industriale la spettroscopia infrarossa permette un’analisi veloce e semplice per identificare
ossidazioni e in generale degradazioni (che avvengono principalmente sulle superfici esposte all’aria, e
dunque agli agenti atmosferici e alla radiazione solare) dei prodotti fabbricati. In questo modo si possono
28
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
migliorare le caratteristiche fisiche del prodotto da vendere, e al contempo si può fornire all’acquirente
informazioni più precise riguardo la qualità dell’oggetto.
5.2 TEORIA
5.2.1 RAGGI INFRAROSSI
I raggi infrarossi (IR) sono radiazioni elettromagnetiche emesse spontaneamente dai corpi caldi (e dunque
da ogni corpo, allo stato liquido o solido, avente temperatura maggiore allo zero assoluto32). Per questa
loro peculiarità (e per il fatto che quando vengono assorbite da un corpo tramite irraggiamento33, ne
causano un aumento di temperatura) vengono anche chiamati radiazioni termiche.
Le radiazioni infrarosse sono invisibili all’occhio umano (ma possono per esempio essere viste da animali
come le “vipere delle fossette”, che sfruttano questa loro peculiarità per intravedere le radiazioni termiche
emanate dalle prede), poiché la loro lunghezza d’onda varia approssimativamente da 1 mm (≅ 3x1011 Hz;
limite inferiore dello spettro delle onde radio - microonde) e 0,7 µm (≅ 4x1014 Hz; limite superiore dello
spettro visibile - corrispondente al colore rosso), come si può vedere nella Figura 18. Si possono suddividere
in tre categorie:
Vicino IR: lunghezza d’onda da 0,7 a 3 µm (quindi da ca. 14286 cm-1 a 3333 cm-1)
Medio IR: lunghezza d’onda da 3 a 20 µm (quindi da ca. 3333 cm-1 a 500 cm-1)
Lontano IR: lunghezza d’onda da 20 a 1000 µm (quindi da ca. 500 cm-1 a 10 cm-1)
5.2.2 VIBRAZIONI MOLECOLARI E ASSORBIMENTO INFRAROSSO
Ogni atomo di una molecola ha tre gradi di libertà34 che corrispondono alle coordinate cartesiane (x,y,z),
che descrivono la posizione del determinato atomo nello spazio. Una molecola formata da n atomi ha
dunque 3n gradi di libertà. Per descrivere il movimento di una molecola occorre tener conto del:
-
-
-
32
Movimento dell’intera molecola nello spazio (che corrisponde al movimento di traslazione
del suo centro di gravità): per descrivere tale movimento si necessitano tre coordinate, e
dunque 3 gradi di libertà.
Movimento rotazionale dell’intera molecola (che corrisponde al movimento di rotazionale
attorno al suo centro di gravità): per questo movimento si necessitano due coordinate (e
dunque 2 gradi di libertà) per descrivere la rotazione nel caso di una molecola lineare; tre
coordinate (e perciò 3 gradi di libertà) nel caso di una molecola non lineare.
Movimento interatomico (dei singoli atomi rispetto agli altri), ovvero della vibrazione
individuale di ciascuno degli atomi contenuti nella molecola: per descrivere i movimenti
interatomici rimangono dunque (3n-5) gradi di libertà per una molecola lineare, (3n-6)
gradi di libertà per una molecola non lineare.
°
Zero assoluto: -273,15 C = 0 K (kelvin)
Irraggiamento: trasmissione di calore tra due corpi (non necessariamente a contatto tra loro), che rispettivamente
emettono e assorbono onde elettromagnetiche.
34
Gradi di libertà: numero di coordinate che determinano la posizione di un punto (in questo caso dell’atomo nello
spazio).
33
29
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
Questi restanti gradi di libertà costituiscono il numero teorico di possibili vibrazioni fondamentali all’interno
della molecola.
Gli atomi sono in continuo movimento; esistono pertanto due tipi di vibrazioni molecolari fondamentali
(evidentemente per molecole aventi più di due atomi) causate dal loro movimento:
La vibrazione di stiramento (dall’inglese “streching”: s): movimento regolare lungo l’asse di
legame, da cui si ottiene una variazione (dunque un aumento e una diminuzione) periodica
della distanza interatomica.
Lo stiramento può essere
- simmetrico: nel caso in cui i due atomi coinvolti si avvicinano al centro (tra i due atomi) o si
allontanano allo stesso tempo
- asimmetrico: nel caso in cui, mentre un atomo si avvicina, l’altro si allontana, e viceversa.
La vibrazione di piegamento (dall’inglese “bending“: b): variazione dell’angolo tra due legami.
Questa deformazione può essere
- simmetrica lungo il piano sul quale si trova l’angolo di legame (dall’inglese “scissoring”:
sforbiciata, ovvero che segue il movimento di apertura e chiusura di una forbice)
- asimmetrica lungo il piano (dall’inglese “rocking”: oscillazione, nel piano)
- simmetrica fuori dal piano sul quale si trova l’angolo di legame (dall’inglese “ twisting”:
torsione)
- asimmetrica fuori dal piano (dall’inglese “wagging”: scuotimento)
Figura 20: mostra i differenti tipi di vibrazioni molecolari fondamentali.
La spettroscopia infrarossa si basa sull’assorbimento dell’energia radiante da parte delle suddette
vibrazioni di legame; questo assorbimento, per ogni legame, può essere identificato negli spettri infrarossi
sotto la forma di un picco d’assorbimento.
30
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
A partire dall’applicazionne della legge di Hooke35 dell’oscillatore armonico semplice, e in seguito a una
serie di calcoli, si può arrivare ad approssimare il numero d’onda dell’assorbimento in cm-1:
𝟏
𝐤
̅= × √
𝝂
𝟐𝛑𝓬
𝐌
Formula 1: approssimazione del numero d’onda di un assorbimento
-
-
Con M = (mAmB) / (mA+mB) = massa ridotta degli atomi
La massa ridotta assume importanza quando si ricorre ad una sostituzione isotopica36, in
quanto è l’unica componente a destra della Formula 1 che cambia in maniera rilevante da
un elemento al suo isotopo.
mA = massa (in grammi) dell’atomo A
mB = massa (in grammi) dell’atomo B
k = costante di forza del legame chimico (in questo caso il legame tra gli atomi A e B)
K vale approssimativamente 5x105 dine / cm per i legami singoli, circa il doppio e il triplo
rispettivamente per legami doppi o tripli (1 dine = 10-5 Newton).
Con questa approssimazione si considerano due atomi (A e B) e il legame covalente tra essi come un
oscillatore armonico semplice, raffigurato da due masse collegate da una molla. Lo stiramento del legame,
infatti, descrive un moto ondulatorio con l’andare del tempo, così come la molla nell’oscillatore.
Dalla Formula 1 deriva che: maggiore è k, maggiore è il numero d’onda al quale la molecola vibra, e dunque
maggiore è l’energia (dalla relazione E = h𝜈̅ 𝒸) richiesta per provocare lo stiramento del legame tra due
atomi. Inoltre, si nota che i numeri d’onda vibrazionali dipendono dalle masse dei singoli atomi e dalla forza
dei legami tra essi. In generale i fattori che determinano la posizione di un picco di assorbimento sono:
-
la costante di forza del legame a cui è assegnato il picco
la massa degli atomi coinvolti nella vibrazione
il tipo di vibrazione del legame
Dal momento che i numeri d’onda di vibrazione dipendono anche dai legami covalenti, si possono eccitare
tutti i gruppi funzionali variando i numeri d’onda della radiazione.
I risultati sperimentalmente ottenuti, per quanto riguarda i numeri d’onda degli assorbimenti, non sempre
corrispondono ai valori ottenuti con la Formula 1; il margine di errore è dovuto al fatto che la Formula 1
non tiene conto degli effetti dovuti all’influenza, sull’assorbimento di un determinato legame, da parte del
resto della molecola.
35
Robert Hooke (1635-1703): fisico, biologo, geologo e architetto inglese.
Sostituzione isotopica: sostituzione di un elemento con un suo isotopo, atta a risolvere il problema
dell’interpretazione dello spettro nel caso in cui si ha una sovrapposizione di bande a frequenze simili.
36
31
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
Un altro fattore che determina una divergenza tra valori teorici dei numeri d’onda e valori effettivi è il
cosiddetto accoppiamento meccanico. Se due oscillatori di legame hanno un atomo o un legame in
comune, si crea tra loro, o meglio tra le vibrazioni rispettivamente di streching o bending, un’interazione di
accoppiamento meccanico (portando a due numeri d’onda di assorbimento risultanti differenti da quelli
degli oscillatori separati), qualora
-
le rispettive vibrazioni presentano lo stesso tipo di simmetria (simmetriche o asimmetriche)
e non sono perpendicolari tra loro
i rispettivi numeri d’onda di oscillazione non siano troppo divergenti
i due oscillatori abbiano una distanza minore o uguale ai due legami covalenti (a distanza
maggiore l’interazione ovviamente si annulla)
Per ottenere un accoppiamento tra vibrazioni di streching e di bending, il legame nel quale avviene lo
stiramento deve essere al contempo anche un lato dell’angolo nel quale avviene la deformazione. Inoltre, si
può verificare un’interazione pure tra vibrazioni fondamentali e sovratoni37 o vibrazioni di combinazione
(risultanti dalla somma di due vibrazioni, ottenute dall’eccitazione causata contemporaneamente dallo
stesso fotone): la cosiddetta “risonanza di Fermi”.
Così come per l’approssimazione dei numeri d’onda, pure il precedentemente calcolato numero di
vibrazioni fondamentali di una molecola non corrisponde sempre al numero di vibrazioni fondamentali
effettive. Infatti queste dipendono anche da fattori che
-
Aumentano i picchi:
i sovratoni
le vibrazioni di combinazione
Riducono i picchi:
le vibrazioni fondamentali troppo deboli o situate al di fuori dell’intervallo 4000-400 cm-1
le vibrazioni fondamentali vicine a tal punto da confondersi (dando luogo al fenomeno della
coalescenza, ovvero unendosi in un solo picco di dimensioni maggiori)
la mancanza della variazione del dipolo molecolare, che rende le rispettive vibrazioni
fondamentali invisibili allo spettroscopio (capitolo 5.2.3)
5.2.3 TRANSIZIONI ENERGETICHE E REGOLE DI SELEZIONE
La molecola colpita dalla radiazione infrarossa assorbe energia da quest’ultima e passa conseguentemente
a uno stato eccitato, ovvero subisce una transizione energetica. Tuttavia, la molecola si comporta in modo
differente a dipendenza della frequenza della radiazione, infatti la molecola assorbe l’energia (E = h𝜈) della
radiazione e la trasforma in:
-
Energia rotazionale38: quando la frequenza è inferiore a 100 cm-1. In questo modo avviene
una transizione rotazionale (la molecola cambia di livello energetico rotazionale).
Gli spettri che si ottengono a questi valori di frequenza presentano una serie di linee
separate.
37
Sovratoni: (dall’inglese “overtones”) multipli di un determinato numero d’onda, che provocano la presenza di bande
situate a valori doppi o tripli del numero d’onda della banda fondamentale.
38
Energia rotazionale: energia cinetica (ovvero energia associata al moto) di rotazione della molecola. L’energia
rotazionale è quantizzata.
32
Spettroscopia infrarossa applicata alle gomme
-
R. Flueckiger
Energia vibrazionale39: quando la frequenza è compresa tra 10'000 e 100 cm-1. In questo
modo avviene una transizione vibrazionale (la molecola cambia di livello energetico
vibrazionale).
Gli spettri che si ottengono a queste condizioni presentano invece una serie di bande
vibrazionali.
Poiché i livelli rotazionali e vibrazionali sono quantizzati, lo è di conseguenza anche l’assorbimento, ovvero
la radiazione elettromagnetica può venire assorbita solo a valori discreti (multipli del quanto dunque in
questo caso, poiché si tratta di una radiazione elettromagnetica, del fotone): infatti i diversi legami
assorbono energia solamente se la frequenza della radiazione è la medesima (o un multiplo di essa – una
cosiddetta armonica superiore) della frequenza della vibrazione. Non appena viene raggiunta questa
coincidenza si verifica un assorbimento di energia da parte della vibrazione del legame, che ne provoca un
aumento temporaneo dell’intensità e della frequenza (che raddoppia). L’assorbimento avviene però
soltanto se l’interazione tra la radiazione e le molecole segue le seguenti regole, le cosiddette regole di
selezione:
1. La transizione può avvenire solamente se l’interazione comporta una variazione del numero
quantico di ∆v=±1 (ovvero l’assorbimento è possibile solo per molecole aventi, tra un livello
energetico e un altro, piccole differenze di energia).
Come si può dedurre dalla prima regola di selezione, la transizione da un livello energetico all’altro
può avvenire in due direzioni: il segno positivo corrisponde ad un passaggio dal livello energetico
fondamentale a uno eccitato, il contrario vale per il segno negativo. La direzione verso cui si muove
la transizione dipende dalla “quantità di popolazione” (ovvero dal numero di molecole situate al
determinato livello) dei livelli, in quanto si sposta da livelli “più popolati” a livelli “meno popolati”.
Questa regola di selezione è in realtà spesso “violata” attraverso la formazione di sovratoni (che
corrispondono a transizioni di ∆v=±2 o ∆v=±3), aventi intensità di assorbimento minore della
transizione fondamentale.
2. L’assorbimento infrarosso avviene solamente in modi vibrazionali che causano una variazione
periodica del momento dipolare della molecola.
Questa variazione di distribuzione della carica, infatti, rende possibile l’instaurarsi di un campo
elettrico oscillante associato al dipolo molecolare, capace di interagire con il campo elettrico
(altrettanto oscillante) della radiazione elettromagnetica (interazione che causa appunto un
cambiamento dell’ampiezza della vibrazione molecolare), non appena le frequenze dei due campi
elettrici oscillanti coincidono.
Maggiore è il cambiamento del momento di dipolo, maggiore è l’intensità dell’assorbimento
infrarosso. Il momento dipolare dipende dal valore della differenza di carica e dalla distanza dei
centri di carica (gli atomi). La variazione del momento dipolare risulta maggiore quando il
legame interatomico è polare mentre è minore quando il legame interatomico è apolare
(ovvero in cui le cariche sono così deboli per cui il cambiamento del momento di dipolo risulta
minimo, e conseguentemente pure l’assorbimento è basso).
L’assorbimento della radiazione infrarossa incrementa l’energia totale della molecola, l’energia in eccesso
accumulata in questo modo viene dissipata in secondo luogo sotto forma di calore, lasciando la molecola
intatta. In questo modo pure i legami tornano alle loro vibrazioni normali (fondamentali).
39
Energia vibrazionale: energia cinetica associata alle vibrazioni a cui sono soggetti gli atomi delle molecole. Pure
l’energia vibrazionale è una grandezza quantizzata.
33
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
5.2.4 SPETTRO
Un composto assorbe l’energia della radiazione elettromagnetica a determinati numeri d’onda, mentre si
lascia attraversare dall’energia ad altri numeri d’onda (“trasmettendola”).
L’intensità di assorbimento dell’energia può essere espressa in due modi:
-
-
Percentuale di trasmittanza: rapporto tra l’intensità della radiazione trasmessa attraverso
il campione e l’intensità di quella incidente, T = I1/I0 (con I0 = radiazione incidente,
I1 = radiazione trasmessa).
Assorbanza (può assumere qualsiasi valore positivo): intensità assorbita da parte del
campione, legata alla trasmittanza dalla relazione log10(1/T).
Lo spettro di assorbimento di un composto organico è un grafico che mostra la quantità di radiazione
trasmessa o assorbita da esso, in seguito all’irradiazione della radiazione elettromagnetica, in funzione della
lunghezza d’onda o dei numeri d’onda (che determinano la posizione delle bande di assorbimento nello
spettro) della radiazione incidente. In generale è preferibile utilizzare i numeri d’onda come ascisse, per via
della diretta proporzionalità con la frequenza e l’energia (della radiazione).
In uno spettro misurato in trasmittanza, il 100% significa che l’assorbimento è nullo. La linea
corrispondente all’assorbimento nullo per ogni numero d’onda è chiamata linea di base. Da essa si
distinguono dei picchi discendenti che riferiscono l’intensità dell’assorbimento di energia al loro
determinato numero d’onda.
Per esprimere l’intensità dei picchi vengono spesso utilizzati i termini:
-
vs (very strong): molto forte
s (strong): forte
m (medium): moderato
w (weak): debole
L’intensità di un assorbimento infrarosso dipende, come già accennato, dalla variazione del momento
dipolare provocato dalla vibrazione di un legame (un legame che presenta una variazione forte assorbirà
molta radiazione, e ne risulterà un picco maggiore sullo spettro).
Per quanto riguarda la forma (ovvero la larghezza) dei picchi vengono usati i termini:
-
s (sharp): stretto
b (broad): largo
Se un picco risulta stretto significa che il determinato gruppo funzionale responsabile dell’assorbimento è
relativamente isolato dal resto della struttura molecolare, mentre se risulta largo significa che ha forti
interazioni con gli altri legami.
Di interesse per la rivelazione della struttura di un composto è la parte compresa tra 4000 e 400 cm-1,
dunque tra 2,5 e 25 µm, prevalentemente nella regione del medio infrarosso (come verrà approfondito nel
Capitolo 5.4).
Per ottenere spettri in cui le bande siano registrate a numeri d’onda esatti, occorre prima calibrare lo
spettroscopio con uno standard di riferimento (in genere questo tipo di calibrazione viene effettuato con
un film di polistirene).
34
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
5.3 STRUMENTAZIONE
In commercio si trovano quattro tipi di strumenti atti a misurare gli assorbimenti infrarossi:
-
spettrofotometri a reticolo di dispersione: per analisi qualitative
Spettrometri a trasformata di Fourier: per analisi qualitative e quantitative
fotometri a non dispersione: per analisi quantitative
fotometri a riflettanza: per analisi qualitative
Per le analisi qualitative contenute in questo lavoro di maturità è stato utilizzato uno spettrometro a
trasformata di Fourier, per cui saranno illustrate solamente le particolari caratteristiche strumentali
riguardanti gli strumenti FTIR (dall’inglese “Fourier transform infrared spectrometer”), in particolare la
macchina utilizzata: "Agilent Cary 640 FTIR Spectrometer".
Foto 2: "Agilent Cary 640 FTIR Spectrometer", la macchina utilizzata per questo lavoro di maturità.
5.3.1 SORGENTI
Gli strumenti spettroscopici necessitano di una sorgente di radiazione infrarossa continua. Questa sorgente
è costituita da un solido inerte che, quando viene riscaldato elettricamente fino a raggiungere temperature
comprese tra 1500 e 2200 K, produce una radiazione continua.
La sorgente incorporata nella macchina utilizzata per questo lavoro di maturità è una sorgente a filo
incandescente di materiale ceramico40, che viene scaldato fino a raggiungere i 1500 K (ca. 1227 °C);
temperatura alla quale emette radiazione infrarossa. Per ottenere un maggiore rendimento viene posto un
retroriflettore dietro alla sorgente, il quale riflette la radiazione, raddoppiandola.
5.3.2 INTERFEROMETRO
Le radiazioni emesse dalla sorgente, contenenti tutte le lunghezze d’onda IR, vengono divise in due fasci
attraverso il divisore di fascio (nella “Cary 640” viene utilizzato a tale scopo un solido trasparente
contenente bromuro di potassio KBr, che ha un indice di rifrazione tale da dividere la radiazione in due).
Il fascio di raggi A, corrispondente al 50% della radiazione iniziale, percorre una distanza fissa per essere
poi riflessa dallo specchio A; il 25% torna alla sorgente, mentre il rimanente 25% è deviato verso la cella del
campione. Il fascio di raggi B viene invece deviato perpendicolarmente dal divisore dei raggi verso lo
specchio B; pure dal quale il 25% torna alla sorgente, mentre l’altro 25% è deviato verso la cella del
campione, formando quindi con il 25% del fascio A un raggio combinato.
40
Materiale ceramico: composto chimico tra metalli e non metalli
35
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
I fasci differiscono per la lunghezza del percorso poiché lo specchio B viene mosso dal pistone, variando di
conseguenza periodicamente la lunghezza del percorso del fascio B. Queste diverse lunghezze dei percorsi
producono così una serie di interferenze costruttive e distruttive (ovvero aventi lunghezze d’onda
rispettivamente uguali o differenti), che vengono rilevate dal rilevatore (Capitolo 5.3.3), che crea un
interferogramma (ovvero un grafico che misura l’interferenza tra le onde dei due fasci di radiazione).
L’interferogramma ottenuto viene poi convertito da un algoritmo chiamato “trasformata di Fourier”: da
grafico intensità-tempo a grafico intensità-frequenza.
Figura 21: schema di un interferometro
5.3.3 RILEVATORI
Per rilevare la radiazione si necessita un rivelatore (o trasduttore). Vi sono tre tipi di rivelatore:
-
rivelatori termici
rivelatori piroelettrici (particolari tipi di rivelatori termici)
rivelatori a fotoconducibiltà
Negli spettrometri a trasformata di Fourier vengono utilizzati rivelatori piroelettrici o rivelatori a
fotoconducibilità; nel particolare spettrometro “Cary 640” viene utilizzato come rilevatore piroelettrico un
cristallo di solfato di triglicerina e l-alanina deuterata.
5.3.4 CAMPIONI
La spettroscopia infrarossa è applicabile a composti allo stato gassoso, liquido o solido. Dal momento che in
questo lavoro di maturità le analisi spettroscopiche infrarosse sono state effettuate sulle gomme (composti
36
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
evidentemente solidi), non verranno approfondite le complicate tecniche di preparazione dei campioni
liquidi o gassosi.
Per quanto riguarda i solidi vi sono tecniche altrettanto complicate (per esempio la preparazione di
emulsioni, soluzioni, film trasparenti o pasticche di bromuro di potassio) tuttavia, per questo lavoro di
maturità non sono state utilizzate tecniche speciali.
Le gomme che sono state inserite nella macchina presentavano dimensioni relativamente grandi:
approssimativamente 3 mm di spessore e 1x1 cm di superficie (lo spessore è stato comunque alterato con
una rotellina che le ha compresse sul cristallo, grazie al fatto che si trattava di elastomeri).
Per analisi di solidi di questo tipo viene utilizzata una tecnica piuttosto semplice: la spettroscopia a
riflessione interna, o spettroscopia a riflessione totale attenuata (ATR, dall’inglese “attenuated total
reflectance”). Questa tecnica permette di analizzare campioni solidi a prescindere dal loro spessore. Infatti,
prima che avvenga la riflessione41, la radiazione penetra per un breve tratto nel materiale –che deve avere
densità minore-; se questo materiale assorbe la radiazione, si produce il desiderato spettro di
assorbimento. A questo punto la radiazione, invece di avviarsi direttamente verso il rivelatore, viene riflessa
più volte dal cristallo al campione.
Per la misurazione della riflessione interna si pone il campione su un materiale trasparente e cristallino42
(nella macchina “Cary 640” viene utilizzato un cristallo di selenurio di zinco ZnSe) ad alto indice di rifrazione
(ovvero attraverso il quale la velocità di propagazione della radiazione diminuisce parecchio), e si sceglie un
angolo di incidenza tale per cui la radiazione incidente subisca diverse riflessioni interne al cristallo, per cui
vada a incidere diverse volte sul campione (e dunque permetta una serie di assorbimenti), prima di passare
al rivelatore.
5.4 INTERPRETAZIONE
Per questo lavoro di maturità sono state utilizzate due modalità di analisi qualitativa, per raggiungere due
obiettivi differenti: la determinazione
della struttura di un composto noto (ovvero di cui si conosce la composizione)
della composizione di un composto ignoto
Innanzitutto si può, per comodità, suddividere l’intervallo (approssimativo per le radiazioni dell’infrarosso
utili all’interpretazione) di numeri d’onda dello spettro in cinque regioni principali:
1. Da 4000 a 2500 cm-1: in questo intervallo si osservano gli assorbimenti caratteristici dei moti di
stiramento dei legami C-H, N-H e O-H.
Picchi deboli in questa regione potrebbero essere dovuti a sovratoni o a vibrazioni di combinazione
di picchi più intensi a metà del loro numero d’onda; nel caso in cui si verifica una risonanza di Fermi
si notano invece picchi più marcati in questa regione.
41
Riflessione: fenomeno dovuto al passaggio di una radiazione da un materiale avente densità maggiore a uno con
densità minore.
42
Cristallino: (solido) avente atomi e molecole disposti in modo regolare geometricamente
37
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
2. Da 2500 a 2000 cm-1: in questa regione si osservano gli assorbimenti caratteristici dei moti di
stiramento dei legami tripli, come C≡N, C≡C (tuttavia si riscontrano anche assorbimenti di
vibrazioni di legami doppi, come O=C=O del diossido di carbonio).
3. Da 2000 a 1600 cm-1: in questo intervallo si osservano gli assorbimenti caratteristici dei moti di
stiramento dei legami doppi, come C=C, C=N e C=O, così come dei moti di piegamento dei legami CH.
4. Da 1600 a 1200 cm-1: in questa regione si osservano gli assorbimenti caratteristici dei moti di
piegamento dei legami C-H, N-H.
5. Da 1200 a 400 cm-1: in questo intervallo si ottiene la cosiddetta “impronta digitale”, unica e
caratteristica del composto organico. Essa infatti presenta assorbimenti di moti sia di stiramento
che di piegamento dei diversi legami semplici C-H, C-C, C-N, C-Cl e C-O, che caratterizzano il
determinato composto. Spesso questi picchi sono il risultato delle interazioni tra legami vicini,
poiché in genere hanno energie simili, e dunque nel complesso rappresentano l’insieme di
interazioni dei legami che dipendono dalla struttura dell’intera molecola (per cui gli assorbimenti di
questa zona derivano dall’eccitazione vibro-rotazionale della molecola intera). Da qui deriva che
ogni dettaglio della struttura della molecola ha un effetto sull’aspetto (forma, intensità e
distribuzione) delle bande di assorbimento in questa regione. Proprio per questa dipendenza dalla
struttura della determinata molecola, la regione dell’impronta digitale è unica e caratteristica.
5.4.1 DETERMINAZIONE DELLA STRUTTURA
Per quanto riguarda la determinazione della struttura si procede, sia per i composti noti che per quelli
ignoti, all’assegnazione picco-legame (ovvero all’associazione dei picchi ai rispettivi moti vibrazionali di
determinati legami).
Tramite il riconoscimento del numero d’onda preciso dei vari picchi, attuata con il computer attraverso la
funzione “peak pick” (in italiano: rivela picchi), si possono assegnare le rispettive vibrazioni (sia di streching
che di bending) dei diversi legami interatomici. Allo stesso modo si possono assegnare i loro “richiami”,
ovvero la ripetizione della vibrazione dello stesso legame, dovuto all’assorbimento di radiazione a numeri
d’onda differenti (fenomeno che può anche essere considerato come una conferma della presenza del dato
legame nella molecola analizzata).
Per l’assegnazione dei picchi occorre consultare tabelle che presentano gli assorbimenti caratteristici dei
gruppi funzionali, le cosiddette tavole di correlazione (vedi Tabella 22 e Allegati 11.4).
38
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
Tabella 22: tavola di correlazione
Analogamente si possono utilizzare gli spettri dei gruppi funzionali come confronto: essi presentano infatti
tutte le bande di assorbimento caratteristiche del singolo gruppo funzionale (Figura 23), che devono essere
riscontrabili nello spettro analizzato (si deve comunque tenere conto di eventuali sovrapposizioni con picchi
caratteristici di altri legami). Vi sono in commercio utili cataloghi di spettri sia in versione cartacea (per
esempio le vecchie librerie di spettri della “Aldrich Chemical Company”), che in versione digitale (per
esempio il sistema “Bio-Rad”, che dispone di 175'000 spettri infrarossi). Questi cataloghi permettono un
confronto tra spettri di composti puri e lo spettro analizzato.
Figura 23: spettro di confronto dei legami C-H di un alcano. Si possono distinguere i modi vibrazionali del
legame: streching e bending.
Si possono ottenere informazioni strutturali anche procedendo inversamente, ovvero considerando gli
assorbimenti non presenti. In tal modo si possono escludere dalla struttura della molecola diversi legami
che presentano assorbimenti caratteristici evidenti (per esempio un’assenza di assorbimento nell’intervallo
tra 2260 e 2222 cm-1 esclude la presenza del legame C≡N nella molecola). Procedendo in questo modo si
deve però tenere conto che in certi casi una banda può essere talmente larga che potrebbe passare
inosservata, come pure può accadere che la vibrazione di un determinato legame non produca un
39
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
cambiamento del momento dipolare, e dunque non assorba l’energia infrarossa, rimanendo pertanto
invisibile sullo spettro.
In ogni caso, né le tavole di correlazione né gli spettri di confronto rendono definitiva l’assegnazione della
struttura di un composto; infatti, non tengono conto della possibile sovrapposizione delle frequenze dei
gruppi funzionali, che potrebbe far variare i numeri d’onda ai quali si trovano i diversi assorbimenti.
Evidentemente la regione spettrale più complessa da interpretare è la regione dell’impronta digitale.
Essendo così complessa rende difficile, se non impossibile, un’interpretazione univoca ed inequivocabile
dello spettro nel suo intervallo di numeri d’onda. Perciò solitamente non vengono interpretati in dettaglio
gli assorbimenti di questa regione, poiché l’assegnazione di tutti i picchi presenti è resa difficile dal
momento che la maggior parte di essi deriva dalla combinazione di più tipi di moti vibrazionali (che
dipendono appunto dalla struttura dell’intera molecola). L’assegnazione di alcuni picchi in questa regione
può tuttavia essere utile per ottenere una conferma dell’assegnazione dei picchi compresi nella regione tra
4000 e 1200 cm-1 (come nel caso degli assorbimenti delle vibrazioni di piegamento del legame C-H di un
anello aromatico, che possono essere viste come “conferma” dell’assorbimento della vibrazione di
streching del suo doppio legame C=C).
In generale è quasi impossibile definire con sicurezza la natura di tutti i picchi di assorbimento, e dunque la
struttura esatta di una molecola a partire dal solo spettro IR, se non si fa uso contemporaneamente di altri
metodi di spettroscopia (per esempio la spettroscopia di massa o la spettroscopia di risonanza magnetica
nucleare [NMR]).
5.4.2 IDENTIFICAZIONE
L’identificazione di un composto organico a partire dal suo spettro avviene in genere in due momenti:
1. Inizialmente si osserva la cosiddetta zona delle frequenze di gruppo, compresa
approssimativamente tra 4000 e 1200 cm-1. Come per la semplice determinazione della struttura,
anche in questo caso si devono individuare, con l’ausilio di una tavola di correlazione, i gruppi
funzionali contenuti in questa regione dello spettro (tenendo comunque conto che, nonostante la
maggior parte degli assorbimenti caratteristici dei gruppi funzionali siano riscontrabili tra 4000 e
1200 cm-1, alcuni cadono tra 1200 e 600 cm-1).
2. In seguito si confronta lo spettro del composto incognito con lo spettro di un composto noto che
contiene tutti i gruppi funzionali individuati nel punto 1. Il confronto tiene conto della zona
dell’impronta digitale (poiché la zona delle frequenze di gruppo evidentemente è la medesima nei
due composti) che, come detto in precedenza, è compresa approssimativamente tra 1200 e 600
cm-1 e rappresenta l’unicità della struttura del dato composto.
Se con il paragono si ottiene una correlazione picco per picco tra le due zone delle impronte digitali
(ovvero se i due spettri sono perfettamente sovrapponibili), il composto incognito e il composto
noto sono sicuramente i medesimi. Tuttavia è difficile ottenere due spettri identici, a meno che non
siano stati effettuati con la medesima macchina e nelle medesime condizioni.
Si può procedere anche interamente a livello di assegnazione dei picchi, con la speranza di intuire in
maniera corretta la natura dei gruppi funzionali contenuti, oppure tramite la ricerca su elaboratore. Il
sistema di ricerca determina la posizione e l’intensità delle bande dello spettro del composto incognito.
40
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
Questi dati (ordinati in funzione della posizione della banda più intensa) vengono poi confrontati con quelli
dei composti puri archiviati nella biblioteca virtuale del sistema di ricerca, in modo da scegliere tra i tanti
spettri quelli più simili allo spettro del composto incognito (ordinati in ordine decrescente di probabilità di
corrispondenza), fornendo il loro rapporto di sovrapponibilità.
Nel caso in cui si hanno a disposizione gli spettri delle sostanze di cui è composto (o è probabile che sia
composto) il campione incognito, come lo è stato in questo lavoro di maturità, basta un semplice confronto
tra gli spettri (tralasciando l’assegnazione picco – legame).
41
Spettroscopia infrarossa applicata alle gomme
6
R. Flueckiger
PARTE SPERIMENTALE
6.1 RACCOLTA DEGLI SPETTRI
Ho tagliato relativamente a caso i campioni di gomma da analizzare (approssimativamente 3 mm di
spessore, e 1x1 cm di superficie), con l’ausilio di forbici e di un coltello affilato.
Prima di inserire il singolo campione nella macchina ho dovuto ottenere uno spettro del background
(mediante la funzione “collect background”), ovvero della linea di base che rivela unicamente l’emissione di
radiazione dalla sorgente e gli assorbimenti avvenuti lungo il percorso della radiazione. Questo è servito poi
per distinguere lo spettro del solo campione dallo spettro realmente ottenuto (Figura 24).
In seguito ho inserito il campione di gomma sull’apposito piano di metallo, avvitando la rotellina per
comprimerlo contro il cristallo di ZnSe. Successivamente ho scelto la funzione “collect sample”
impostandola a
-
4 scansioni
Sensibilità 4, ovvero a una risoluzione di 4 cm-1 (il che significa che lo spettrometro ha
misurato un punto per ogni 4 cm-1, dunque tra 4000 e 400 cm-1 ha misurato 900 punti)
Ho così ottenuto lo spettro del campione, misurato in percentuale di trasmittanza in funzione dei numeri
d’onda.
Figura 24: mostra l’utilità del background. Il primo spettro è lo spettro che si ottiene inserendo nella
macchina il campione. Il secondo spettro mostra invece la linea di base (indipendente dal campione). Il
terzo spettro è lo spettro ottenuto tramite la sottrazione (attuata dal computer) dello spettro del
background dallo spettro del campione: il risultato è dunque lo spettro del solo campione.
42
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
6.2 MANIPOLAZIONE DEGLI SPETTRI
L’intervallo spettrale è impostabile in un secondo momento (ovvero quando si ha già ottenuto lo spettro).
Ho adattato la scala dei numeri d’onda all’intervallo compreso tra 3800 cm-1 e 600 cm-1, non avendo
ottenuto picchi di assorbimento rilevanti al di fuori di questa regione.
Per quanto riguarda la l’asse delle percentuali di trasmittanza delle intensità, ho modificato gli spettri in
due modi:
Spettri normali (Allegati 11.1) e spettri interpretati (Allegati 11.2): a dipendenza dell’altezza dei
picchi ho allungato o accorciato la scala delle ordinate, avvicinando il picco più intenso allo 0%
di trasmittanza (ovvero alla scala delle ascisse), rendendo di conseguenza visibili anche i picchi
più deboli.
Spettri su carta lucida (Allegati 11.3): per facilitare il confronto, ho adattato ogni spettro
all’intervallo compreso tra 50 e 110%. Ho scelto il 110% come limite superiore, poiché alcuni
spettri presentano picchi aventi intensità di trasmittanza superiori al 100%, ovvero
assorbimenti inferiori allo 0% (da ricondurre probabilmente a un errore dello spettrometro).
Tramite la funzione “peak picking” il computer ha reso noti i valori in numeri d’onda delle posizioni dei
picchi più visibili (Allegati 11.2). Ho in seguito approssimato i valori all’unità per poi riportarli come risultati
(nei capitoli seguenti).
6.3 SPETTRI E INTERPRETAZIONI
Le analisi fatte per questo lavoro di maturità si dividono in due blocchi:
L’ottenimento degli spettri e le relative interpretazioni di sette tipi di gomme note. Le gomme
utilizzate sono:
- La gomma naturale NR (viene utilizzata soprattutto per la produzione di pneumatici)
- La gomma isobutene isoprene IIR (viene utilizzata soprattutto per la produzione di tubi e
camere d’aria)
- La gomma policloroprene CR (viene utilizzata soprattutto per la produzione di suole per
scarpe e adesivi)
- La gomma butadiene acrilonitrile NBR (viene utilizzata soprattutto per la produzione di
tubature e pavimentazioni)
- La gomma butadiene acrilonitrile idrogenata HNBR (viene utilizzata soprattutto per la
produzione di guarnizioni)
- La gomma butadiene stirene SBR (viene utilizzata soprattutto per la produzione di
pneumatici)
- La gomma etilene propilene diene EPDM (viene utilizzata soprattutto per la produzione di
guarnizioni)
L’ottenimento degli spettri e le relative interpretazioni di due gomme ignote. La natura
incognita di queste due gomme è relativa giacché sono entrambe dei composti di un certo
numero di gomme appartenenti alle sette gomme note.
Gli spettri sono riportati sia nei risultati dei seguenti capitoli che, in versione A4, negli Allegati 11.1, 11.2,
11.3.
43
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
6.3.1 SPETTRI E INTERPRETAZIONE DI GOMME NOTE
L’anno scorso, durante le lezioni di chimica del lavoro di maturità, ho cominciato ad utilizzare lo
spettrometro presente a scuola. Ho ottenuto gli spettri di tutte le gomme note, misurati in assorbanza in
funzione dei numeri d’onda. L’unico ed essenziale problema è stato l’erronea modalità con cui ho fatto gli
spettri. L’aspirazione era, infatti, di ottenere spettri con il minor numero possibile di picchi rilevanti, i quali
però dovevano essere particolarmente intensi. Gli spettri ottenuti secondo questo criterio in certi casi
presentavano effettivamente le bande di assorbimento più rilevanti della determinata gomma (Spettro
della gomma NBR), altri erano invece inutilizzabili per un’interpretazione corretta e per un eventuale
confronto con altri spettri (Spettro della gomma HNBR).
Spettro della gomma NBR [28.5.2013]. Si nota il picco tipico della gomma NBR (del legame C≡N a
2237 cm-1) e un marcato picco a 2360 cm-1, che corrisponde ad un assorbimento del legame CO2 presente
sulla gomma.
Spettro della gomma HNBR [21.5.1013], il primo spettro che ho effettuato. Gli unici due picchi marcati
corrispondono ad assorbimenti indesiderati del legame CO2 presente sulla gomma.
Grazie ai consigli dell’esperto Giuliano Bruno (REX Articoli Tecnici SA) ho infine compreso la tecnica e sono
conseguentemente riuscita ad ottenere spettri di qualità migliore, così come a formulare interpretazioni
(spero) adeguate.
44
Spettroscopia infrarossa applicata alle gomme
6.3.1.1
R. Flueckiger
GOMMA NATURALE (NR)
Figura 25: unità ripetitiva della macromolecola polimerica della gomma NR
PREVISIONE
Conoscendo la macromolecola polimerica della gomma NR (Figura 25), mi aspetto di vedere picchi
corrispondenti alle vibrazioni dei legami C-H, C-C e C=C. Dalle tavole di correlazione risulta che le vibrazioni
C-H degli alcani saranno piuttosto marcate, mentre le vibrazioni C-C sempre degli alcani saranno pressoché
invisibili.
RISULTATI
Spettro della gomma NR [1.10.2013]
45
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
Tramite la funzione “peak picking” attuata dal computer, sono distinguibili nello spettro le posizioni precise
dei picchi più visibili (Allegati 11.2), riportati (in ordine discendente di numeri d’onda) nella tabella:
Posizione (cm-1)
3036
2960
2913
2852
2725
1806
1663
1446
1375
1308
1246
1126
1086
1038
1009
982
928
888
842
763
740
INTERPRETAZIONE
Si possono selezionare i picchi più significativi e riassumerli in questo modo:
-
A 2960, 2913 e 2852 cm-1: vibrazioni di streching, e a 1446, 1375, 740 cm-1: vibrazione di bending
del legame C-H di un alcano
A 3036 cm-1: vibrazione di streching, e a 842 e 763 cm-1: vibrazioni di bending del legame C-H di un
alchene
A 1663 cm-1: vibrazione di streching del legame C=C di un alchene
46
Spettroscopia infrarossa applicata alle gomme
6.3.1.2
R. Flueckiger
GOMMA ISOBUTENE ISOPRENE (IIR)
Figura 26: unità ripetitiva della macromolecola polimerica della gomma IIR
PREVISIONE
Conoscendo la macromolecola polimerica della gomma IIR (Figura 26), mi aspetto di vedere picchi
corrispondenti alle vibrazioni dei legami C-H, C-C e C=C. Dalle tavole di correlazione risulta che le vibrazioni
C-H degli alcani saranno piuttosto marcate, mentre le vibrazioni C-C sempre degli alcani saranno pressoché
invisibili.
RISULTATI
Spettro della gomma IIR [14.10.2013]
47
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
Tramite la funzione “peak picking” attuata dal computer, sono distinguibili nello spettro le posizioni precise
dei picchi più visibili (Allegati 11.2), riportati (in ordine discendente di numeri d’onda) nella tabella:
Posizione (cm-1)
2949
2917
2893
2397
1745
1541
1470
1389
1365
1229
1163
1013
949
923
853
INTERPRETAZIONE
Si possono selezionare i picchi più significativi e riassumerli in questo modo:
-
A 2949, 2917 e 2893 cm-1: vibrazione di streching, e a 1470, 1389 e 1365 cm-1: vibrazione di
bending del legame C-H di un alcano
A 949 e 923 cm-1: vibrazione di bending del legame C-H di un alchene
Nello spettro non si notano tuttavia i caratteristici assorbimenti delle vibrazioni di streching dei legami C-H
degli alcheni (intorno a 3000 cm-1), mentre gli assorbimenti delle vibrazioni di streching dei legami C=C degli
alcheni (intorno a 1650 cm-1) sono poco marcati.
Il marcato assorbimento a 1229 cm-1 potrebbe essere dovuto alla vibrazione di streching del legame C-O
conseguente all’invecchiamento della gomma.
48
Spettroscopia infrarossa applicata alle gomme
6.3.1.3
R. Flueckiger
GOMMA POLICLOROPRENE (CR)
Figura 27: unità ripetitiva della macromolecola polimerica della gomma CR
PREVISIONE
Conoscendo la macromolecola polimerica della gomma CR (Figura 27), mi aspetto di vedere picchi
corrispondenti alle vibrazioni dei legami C-H, C-C, C=C e del particolare legame C-Cl. Dalle tavole di
correlazione risulta che le vibrazioni C-H degli alcani saranno piuttosto marcate, mentre le vibrazioni C-C
sempre degli alcani saranno pressoché invisibili.
RISULTATI
Spettro della gomma CR [14.10.2013]
49
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
Tramite la funzione “peak picking“ attuata dal computer, sono distinguibili nello spettro le posizioni precise
dei picchi più visibili (Allegati 11.2), riportati (in ordine discendente di numeri d’onda) nella tabella:
posizione (cm-1)
3022
2916
2855
2358
1739
1694
1658
1444
1430
1343
1302
1227
1171
1117
1085
1045
1016
957
927
886
824
778
707
667
637
613
601
INTERPRETAZIONE
Si possono selezionare i picchi più significativi e riassumerli in questo modo:
-
A 2916 e 2855 cm-1: vibrazioni di streching, e a 1444 e 1430 cm-1: vibrazioni di bending del legame
C-H di un alcano
A 3022 cm-1: vibrazioni di streching, e a 778 e 667 cm-1: vibrazione di bending del legame C-H di un
alchene
A 1694 e 1658 cm-1: vibrazioni di streching del legame C=C di un alchene
A 1117 e 824 cm-1: vibrazione di streching del legame C-Cl
50
Spettroscopia infrarossa applicata alle gomme
6.3.1.4
R. Flueckiger
GOMMA BUTADIENE ACRILONIRILE (NBR)
Figura 28: unità ripetitiva della macromolecola polimerica della gomma NBR
PREVISIONE
Conoscendo la macromolecola polimerica della gomma NBR (Figura 28), mi aspetto di vedere picchi
corrispondenti alle vibrazioni dei legami C-H, C-C, C=C e del particolare legame C≡N. Dalle tavole di
correlazione risulta che le vibrazioni C-H degli alcani saranno piuttosto marcate, mentre le vibrazioni C-C
sempre degli alcani saranno pressoché invisibili.
RISULTATI
Spettro della gomma NBR [14.10.2013]
51
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
Tramite la funzione “peak picking” attuata dal computer, sono distinguibili nello spettro le posizioni precise
dei picchi più visibili (Allegati 11.2), riportati (in ordine discendente di numeri d’onda) nella tabella:
Posizione (cm-1)
3075
2919
2849
2237
1735
1667
1640
1605
1440
1354
1307
1208
1172
1084
1034
966
915
885
818
720
686
629
INTERPRETAZIONE
Si possono selezionare i picchi più significativi e riassumerli in questo modo:
-
A 2919 e 2849 cm-1 : vibrazioni di streching, e a 1440 e 1354 cm-1: vibrazioni di bending del legame
C-H di un alcano
A 2237 cm-1: vibrazione di streching del legame C≡N di un nitrile
A 1640 cm-1: vibrazione di streching del legame C=C di un alchene
A 966, 915 e 686 cm-1: vibrazione di bending del legame C-H di un alchene
Il caratteristico assorbimento della vibrazione di streching dei legami C-H degli alcheni è poco pronunciato a
3075 cm-1.
52
Spettroscopia infrarossa applicata alle gomme
6.3.1.5
R. Flueckiger
GOMMA BUTADIENE ACRILONITRILE IDROGENATA (HNBR)
Figura 29: unità ripetitiva della macromolecola polimerica della gomma HNBR
PREVISIONE
Conoscendo la macromolecola polimerica della gomma HNBR (Figura 29), mi aspetto di vedere picchi
corrispondenti alle vibrazioni dei legami C-H, C-C e del particolare legame C≡N. Dalle tavole di correlazione
risulta che le vibrazioni C-H degli alcani saranno piuttosto marcate, mentre le vibrazioni C-C sempre degli
alcani saranno pressoché invisibili.
Dal momento che la gomma HNBR è l’equivalente della gomma NBR che ha subito un’idrogenazione dei
doppi legami contenuti, non mi aspetto picchi corrispondenti alla vibrazione del legame C=C.
RISULTATI
Spettro della gomma HNBR [14.10.2013]
53
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
Tramite la funzione “peak picking” attuata dal computer, sono distinguibili nello spettro le posizioni precise
dei picchi più visibili (Allegati 11.2), riportati (in ordine discendente di numeri d’onda) nella tabella:
Posizione (cm-1)
2924
2855
2236
1462
1372
1348
1307
1117
1072
1051
969
723
INTERPRETAZIONE
Si possono selezionare i picchi più significativi e riassumerli in questo modo:
-
A 2924 e 2855 cm-1: vibrazioni di streching, e a 1462, 1372, 1348, 969 e 723 cm-1: vibrazioni di
bending del legame C-H di un alcano
A 2236 cm-1: vibrazione di streching del legame C≡N di un nitrile
54
Spettroscopia infrarossa applicata alle gomme
6.3.1.6
R. Flueckiger
GOMMA BUTADIENE STIRENE (SBR)
Figura 30: unità ripetitiva della macromolecola polimerica della gomma SBR
PREVISIONE
Conoscendo la macromolecola polimerica della gomma SBR (Figura 30), mi aspetto di vedere picchi
corrispondenti alle vibrazioni dei legami C-H, C-C, C=C e del particolare legame C=C di un aromatico. Dalle
tavole di correlazione risulta che le vibrazioni C-H degli alcani saranno piuttosto marcate, mentre le
vibrazioni C-C sempre degli alcani saranno pressoché invisibili.
RISULTATI
Spettro della gomma SBR [1.10.2013]
55
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
Tramite la funzione “peak picking”, attuata dal computer, sono distinguibili nello spettro le posizioni precise
dei picchi più visibili (Allegati 11.2), riportati (in ordine discendente di numeri d’onda) nella tabella:
Posizione (cm-1)
3074
3025
2981
2915
2846
1703
1639
1602
1494
1450
1436
1350
1298
1076
1030
994
964
910
758
728
699
INTERPRETAZIONE
Si possono selezionare i picchi più significativi e riassumerli in questo modo:
-
2915 e 2846 cm-1: vibrazione di streching, e a 1450, 1436 e 1350 cm-1: vibrazione di bending del
legame C-H di un alcano
A 1639 cm-1: vibrazione di streching del legame C=C dell’alchene
A 1602 e 1494 cm-1: vibrazione di streching del legame C=C dell’alchene ciclico
A 3074 e 3025 cm-1: vibrazione di streching, e a 994, 964 e 910 cm-1: vibrazione di bending del
legame C-H di un alchene.
A 1703, 758 e 699 cm-1: vibrazione di bending del legame C-H dell’alchene ciclico
56
Spettroscopia infrarossa applicata alle gomme
6.3.1.7
R. Flueckiger
GOMMA ETILENE PROPILENE DIENE (EPDM)
Figura 31: unità ripetitiva della macromolecola polimerica della gomma EPDM
PREVISIONE
Conoscendo la macromolecola polimerica della gomma EPDM (Figura 31), mi aspetto di vedere picchi
corrispondenti alle vibrazioni dei legami C-H, C-C e C=C. Dalle tavole di correlazione risulta che le vibrazioni
C-H degli alcani saranno piuttosto marcate, mentre le vibrazioni C-C sempre degli alcani saranno pressoché
invisibili.
RISULTATI
Spettro della gomma EPDM [14.10.2013]
57
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
Tramite la funzione “peak picking” attuata dal computer, sono distinguibili nello spettro le posizioni precise
dei picchi più visibili (Allegati 11.2), riportati (in ordine discendente di numeri d’onda) nella tabella:
Posizione (cm-1)
2920
2851
2359
2341
1982
1742
1461
1376
1302
1156
939
806
721
INTERPRETAZIONE
Si possono selezionare i picchi più significativi e riassumerli in questo modo:
-
A 2920 e 2851 cm-1: vibrazioni di streching, e a 1461 e 1376 cm-1: vibrazioni di bending del legame
C-H di un alcano
A 721 cm-1: vibrazione di bending del legame C-H di un alchene
I picchi di assorbimento osservati a 2359 e 2341 cm-1 sono i caratteristici assorbimenti della vibrazione di
streching del legame O=C=O. Il diossido di carbonio è probabilmente risultato dal contatto tra il polimero e
la CO2 presente nell’aria. In questo caso, le bande in questione non ostacolano l’interpretazione, poiché
non sono previsti picchi caratteristici della struttura dell’EPDM a questi numeri d’onda.
La presenza di doppi legami è confermata solamente dall’assorbimento della vibrazione di bending del
legame C-H degli alcheni; questo fatto potrebbe essere spiegato dalla bassa percentuale di doppi legami
contenuti nella gomma EPDM.
58
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
6.3.1.8 CONCLUSIONE GENERALE
Con questo lavoro ho dunque ottenuto una specie di libreria personale di spettri di sette tipi di gomme, che
potranno servirmi per identificare i due composti sconosciuti.
Evidentemente non ho potuto assegnare a ogni picco la specifica vibrazione di un determinato legame;
posso comunque supporre che alcuni picchi non identificati potrebbero essere frutto di processi di
degradazione del polimero a contatto con l’aria. Un fattore determinante potrebbero infatti essere le
reazioni di ozonolisi o di ossidazione di doppi e tripli legami del carbonio contenuti nelle varie
macromolecole (ad eccezione della gomma HNBR): spesso infatti si riscontrano delle bande a numeri
d’onda compresi approssimativamente tra 1750 e 1550 cm-1 e tra 1300 e 1050 cm-1, a cui corrispondono le
vibrazioni di streching rispettivamente dei legami C=O e C-O.
In diversi spettri la radiazione trasmessa da parte delle gomme risulta maggiore al 100 %, risultato
teoricamente impossibile, e per cui riconducibile a un probabile errore dovuto alla macchina.
59
Spettroscopia infrarossa applicata alle gomme
6.3.2
R. Flueckiger
SPETTRI E INTERPRETAZIONE DI GOMME IGNOTE
6.3.2.1 GOMMA INCOGNITA UNO
Dal momento che ho la certezza (data dal produttore: REX articoli tecnici SA) che la gomma in questione è il
risultato di un composto di gomme tra le sette analizzate in precedenza (e per il fatto che la macchina e la
procedura di analisi saranno gli stessi), posso utilizzare alcune loro caratteristiche fisiche (colore e odore) e i
loro spettri come confronto empirico.
Innanzitutto mi sono soffermata su alcune caratteristiche fisiche evidenti:
-
Il colore è bianco sporco: da qui si potrebbe dedurre la presenza della gomma IIR e CR ed EPDM
L’odore è dolciastro e potrebbe somigliare all’odore della gomma EPDM e SBR (eventualmente alla
gomma CR, HNBR e IIR, che hanno poco odore)
In seguito ho effettuato uno spettro, e ho riportato in una tabella i numeri d’onda ai quali si hanno gli
assorbimenti più importanti:
Spettro della gomma incognita uno [25.10.2013]
60
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
Posizione (cm-1)
2920
2850
2237
1639
1576
1539
1451
1376
1352
1306
1078
1048
966
912
758
721
699
Posizioni dei picchi più visibili.
Ho poi confrontato lo spettro della gomma incognita 1 con tutti gli spettri della mia libreria (Allegati 11.3). Il
criterio di ricerca è stato quello di associare i picchi principali delle singole gomme della libreria a quelli
della gomma incognita (ovvero, vedere se la gomma incognita presenta tutti i picchi principali della
determinata gomma conosciuta). Con questa “selezione” sono state scartate subito la gomma NR, IR e CR,
e rimanevano dunque le seguenti gomme:
SBR: poiché nella gomma incognita si riscontrano le caratteristiche bande di assorbimento degli
anelli aromatici
NBR e HNBR: poiché a 2237 cm-1 nello spettro della gomma incognita si osserva il caratteristico
picco di assorbimento del legame C≡N
EPDM: poiché la gomma incognita presenta tutte le (poche) bande di assorbimento
caratteristiche dell’EPDM
Di queste gomme ho scartato la HNBR, poiché comparando la gomma incognita contemporaneamente alla
gomma HNBR e alla gomma NBR si nota maggiore similitudine con la seconda delle gomme note, per via
della presenza di assorbimenti degli alcheni (che comunque sono dovuti anche alle gomme SBR ed EPDM):
-
a 1639 cm-1 l’assorbimento della vibrazione di streching del legame C=C di un alchene
a 966 e 912 cm-1 l’assorbimento della vibrazione di bending del legame C-H di un alchene
Dal confronto con gli spettri della mia libreria ho dunque concluso che la gomma incognita è un composto
delle gomme SBR, NBR ed EPDM.
61
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
Questa conclusione si può verificare anche con l’assegnazione delle vibrazioni dei legami ai rispettivi picchi
di assorbimento più evidenti, osservabili nello spettro della gomma incognita. Una gomma composta da
SBR, NBR ed EPDM deve presentare: doppi legami di cui anche alcuni appartenenti ad anelli aromatici, il
gruppo nitrile, ed evidentemente legami semplici.
Dall’interpretazione dello spettro risultano tutti i suddetti gruppi:
-
A 2920 e 2850 cm-1: vibrazione di streching, e a 1451, 1376 e 1352 cm-1: vibrazione di bending del
legame C-H di un alcano
A 2237 cm-1: vibrazione di streching del legame C≡N di un nitrile
A 1639 cm-1: vibrazione di streching del legame C=C di un alchene
A966 e 912 cm-1: vibrazione di bending del legame C-H di un alchene
A 1576 e 1539 cm-1: vibrazione di streching del legame C=C dell’alchene ciclico
A 758 e 699 cm-1: vibrazione di bending del legame C-H dell’alchene ciclico
Il caratteristico assorbimento della vibrazione di streching dei legami C-H degli alcheni è poco pronunciato
intorno a 3080 cm-1 (non ne viene neppure rivelato il valore esatto in numeri d’onda con la funzione “peak
picking”).
Un’altra conferma potrebbe essere data tramite la ricerca nella libreria multimediale del sistema, tuttavia i
risultati sono parzialmente differenti; il sistema ha rilevato correttamente solo la gomma NBR e la gomma
SBR, come si può vedere dai risultati della ricerca (posti in ordine discendente di sovrapponibilità degli
spettri):
-
Gomma butadiene acrilonitrile
Gomma polibutadiene
Gomma butadiene stirene
Gomma polietilenica clorinata
Gomma poliisoprene
Gomma policloroprene
CONCLUSIONE
Posso infine concludere di avere individuato tre componenti in questo composto: la gomma butadiene
stirene, la gomma butadiene acrilonitrile e la gomma etilene propilene diene.
Grazie all’osservazione delle caratteristiche fisiche dell’elastomero incognito posso supporre che vi è una
maggiore concentrazione di EPDM (conferisce al composto sia colore che odore).
62
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
6.3.2.2 GOMMA INCOGNITA DUE
Dal momento che ho la certezza (data dal produttore: REX articoli tecnici SA) che la gomma in questione è il
risultato di un composto di gomme tra le sette analizzate in precedenza (e per il fatto che la macchina e la
procedura di analisi saranno gli stessi) posso utilizzare alcune loro caratteristiche fisiche (colore e odore) e i
loro spettri come confronto empirico.
Innanzitutto mi sono soffermata su alcune caratteristiche fisiche evidenti:
-
Il colore è giallo scuro: da qui si potrebbe dedurre la presenza della gomma SBR e NBR
L’odore è molto dolce e potrebbe somigliare all’odore della gomma SBR (eventualmente alla
gomma CR, HNBR e IIR, che hanno poco odore)
In seguito ho effettuato uno spettro, e ho riportato in una tabella i numeri d’onda ai quali si hanno gli
assorbimenti più importanti:
Spettro della gomma incognita due [25.10.2013]
63
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
Posizione (cm-1)
3036
2959
2922
2852
2725
2365
2164
1746
1663
1538
1452
1376
1308
1241
1128
1089
1038
976
927
889
838
737
652
620
Posizioni dei picchi più visibili.
Ho poi confrontato lo spettro della gomma incognita 2 con tutti gli spettri della mia libreria (Allegati 11.3). Il
criterio di ricerca è stato quello di associare i picchi principali delle singole gomme della libreria a quelli
della gomma incognita (ovvero, vedere se la gomma incognita presenta tutti i picchi principali della
determinata gomma conosciuta). Con questa “selezione” sono state scartate subito le gomme NBR e HNBR,
IIR, SBR e CR, e rimanevano dunque le seguenti gomme:
NR: poiché la gomma incognita presenta quasi le stesse bande di assorbimento della gomma
naturale
EPDM: poiché la gomma incognita presenta tutte le (poche) bande di assorbimento
caratteristiche dell’EPDM
Dal confronto con gli spettri della mia libreria ho dunque concluso che la gomma incognita è un composto
delle gomme NR e EPDM.
64
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
Questa conclusione si può verificare anche con l’assegnazione delle vibrazioni dei legami ai rispettivi picchi
di assorbimento più evidenti, osservabili nello spettro della gomma incognita. Una gomma composta da NR
ed EPDM deve presentare solamente doppi legami e legami semplici.
Dall’interpretazione dello spettro risultano tutti i suddetti legami:
-
A 3036 cm-1: vibrazione di streching, e a 838 cm-1: vibrazione di bending del legame C-H di un
alchene
A 2959, 2922 e 2852 cm-1: vibrazione di streching, e a 1452 e 1376 cm-1: vibrazione di bending del
legame C-H di un alcano
A 1663 cm-1: vibrazione di streching del legame C=C di un alchene
Un’altra conferma potrebbe essere data tramite la ricerca nella libreria multimediale del sistema; il sistema
ha effettivamente rilevato le due gomme di cui è composta la gomma incognita, tuttavia la gomma EPDM è
solamente al quinto posto in termini di sovrapponibilità dello spettro.
-
Gomma poliisoprene
Gomma stirene isoprene
Gomma poli n-butano
Gomma etilene propilene butadiene
Gomma etilene propilene diene
Gomma polietilenica clorinata
CONCLUSIONE
Posso infine concludere di avere individuato due componenti in questo composto: la gomma naturale e
nuovamente la gomma etilene propilene diene.
In questo caso l’osservazione delle caratteristiche fisiche dell’elastomero incognito mi ha portata su una
“strada sbagliata”: non una delle gomme contenute è risultata da questa analisi preliminare. Per spiegare la
causa del colore giallo sporco si potrebbe dedurre che esso sia il frutto della combinazione della gomma NR
(marrone scura) con la gomma EPDM (bianca); mentre non riesco a spiegare il forte odore dolciastro.
65
Spettroscopia infrarossa applicata alle gomme
7
R. Flueckiger
CONCLUSIONE
Posso concludere che ho raggiunto gli obbiettivi che mi sono prefissata: ho creato una libreria di spettri
personalizzata e ho identificato due composti di gomme tramite l’analisi spettroscopica.
Oltretutto posso affermare di essere venuta a conoscenza di un nuovo mondo: il mondo delle gomme.
Infatti, prima di iniziare il lavoro di maturità non badavo minimamente all’utilità delle gomme in ambito
industriale e nella vita quotidiana, nonostante io vivessi in un mondo che ormai non può più farne a meno.
Ho scoperto dunque l’importanza di questi particolari materiali, come pure della chimica nella tecnologia in
generale, sulla quale poggiano tutte le industrie e dunque tutta la nostra quotidianità (che è basata sui
prodotti delle industrie). Di questo mi ha affascinato soprattutto il grande margine di scelta che si ha per
quanto riguarda la produzione di un prodotto; per esempio la libera scelta dei monomeri per formare un
polimero avente le caratteristiche (in termini di prestazioni fisiche e di costi) desiderate.
Con la classe di chimica del lavoro di maturità abbiamo visitato la fabbrica della ditta REX Articoli Tecnici SA;
grazie a questa visita ho potuto pure sfatare la mia convinzione che tutte le fabbriche fossero ormai
collocate nei paesi asiatici.
Durante la stesura dello scritto ho consultato parecchi libri (provenienti anche dalle biblioteche dei due
politecnici nazionali), di cui alcuni davvero eccezionali. Questo fatto mi ha permesso di imparare ad
apprezzare le biblioteche (pure quella cantonale situata al liceo di Mendrisio, che offre alcuni libri molto
utili) per la grande offerta di sapienza che presenta. Contemporaneamente ho scoperto diversi siti
importanti e utili (cito il sito dell’enciclopedia Treccani, grazie al quale ho appreso gran parte delle nozioni
contenute in questo lavoro). Durante il lavoro svolto nella consultazione di libri e siti mi sono però anche
resa conto del fattore della “fiducia” che si dà alle diverse fonti; evidentemente si dà meno fiducia a un
qualunque sito, però si deve considerare pure la relatività dell’affidabilità dei vari libri (ho per esempio
trovato differenze piuttosto rilevanti da libro a libro per quanto riguarda le reazioni di polimerizzazione,
così come per le tavole di correlazione).
Interpretando gli spettri ho avuto pure modo di conoscere anche meglio il mio carattere: l’interpretazione è
infatti piuttosto logica e al contempo lascia un margine di intuizione, cosa che mi ha spesso resa insicura
poiché io di natura mi aspetto che tutto debba avere sempre una ragione chiara e sicura (mentre negli
spettri rimanevano sempre alcune bande senza un’assegnazione definitiva).
Concludendo, posso affermare che la cosa più importante che ho potuto trarre dal lavoro è stata la
scoperta di un’alternativa valida allo studio che vorrei intraprendere dopo il liceo (pianoforte e direzione
d’orchestra): la facoltà di scienza dei materiali al politecnico di Zurigo (prima di svolgere il lavoro, infatti,
non sapevo nemmeno dell’esistenza di questa facoltà).
66
Spettroscopia infrarossa applicata alle gomme
8
R. Flueckiger
RINGRAZIAMENTI
Ringrazio innanzitutto il professore Imbesi per la sua costante disponibilità.
Ringrazio l’esperto Giuliano Bruno della REX Articoli Tecnici SA per avermi aiutato a comprendere il
funzionamento corretto dello spettrometro e delle interpretazioni.
Ringrazio la mia famiglia per il supporto (e la sopportazione, soprattutto in questi ultimi giorni); in
particolare mio padre Federico per l’aiuto in ambito informatico e per avermi fatto conoscere il sistema
Nebis (che offre la possibilità di prendere in prestito i libri dai politecnici e dalle principali università
svizzere), mio fratello Georg e mia madre Eveline per la continua sollecitazione e i consigli, mio fratello
Francesco per il supporto morale a distanza.
Ringrazio Lorenzo Costa, che più di tutti mi ha sollecitata a lavorare; Emma Tognola e Mara Valsecchi per un
continuo sostegno morale.
67
Spettroscopia infrarossa applicata alle gomme
9
R. Flueckiger
GLOSSARIO
-
-
-
-
-
Campo: regione nella quale è definita una grandezza fisica.
Campo elettrico E: forza esercitata per unità di carica (in un determinato punto nello spazio).
Campo magnetico M: campo di forza che agisce su cariche elettriche in moto (corrente).
I due campi sono legati dalla relazione: E/B = c.
Quanto: valore più piccolo e indivisibile (essendo la quantità più piccola fisicamente possibile) di
una grandezza fisica quantistica (che varia per multipli del rispettivo quanto).
Lunghezza d’onda λ: distanza tra due creste (massimi) o due ventri (minimi) di un’onda;
solitamente misurata in micrometri 1µm = 10-6 m.
Frequenza 𝝂: numero di oscillazioni descritte nell’unità di tempo in un determinato punto, misurate
in hertz Hz = s-1 (ovvero numero di oscillazioni al secondo).
Da notare la relazione inversa tra lunghezza d’onda e frequenza: 𝜈 = 𝒸/λ.
La frequenza è invece direttamente proporzionale all’energia: E = h𝜈 (con h=6,62606957x10-34 Jxs =
costante di Planck), misurata in J.
̅ : numero di oscillazioni complete descritte nell’unità di lunghezza, misurate in m-1
Numero d’onda 𝝂
dal SI (o più comunemente in cm-1, ovvero il numero di onde complete in un centimetro).
Anche i numeri d’onda sono in relazione inversa alla lunghezza d’onda: 𝜈̅ = 1/λ, e sono dunque
proporzionali alla frequenza: 𝜈̅ = 𝜈𝒸, per cui anche all’energia: E = h𝜈̅ 𝒸.
Oscillatore armonico semplice: modello fisico che stabilisce la proporzionalità tra deformazione
elastica di un corpo e sforzo.
La legge di Hooke per un oscillatore armonico semplice è data dalla formula: F =-ks (con k =
costante elastica della molla, s = allungamento della molla).
Rifrazione: deviazione di un’onda dopo il suo passaggio da un mezzo a un altro avente una velocità
di propagazione differente.
Dipolo molecolare: distribuzione non uniforme di cariche elettriche (positive e negative) all’interno
di una molecola.
Legame polare: legame tra due atomi che presentano una differenza di elettronegatività
9.1 ELENCO DELLE ABBREVIAZIONI
-
IR: infrared radiation (radiazione infrarossa)
FT-IR: Fourier transform infrared spectrometer (spettrometro infrarosso a trasformata di Fourier)
NR: natural rubber (gomma naturale)
IIR: isobutylene isoprene rubber, chiamato più spesso “butyl rubber” (gomma isobutene isoprene o
gomma butile)
CR: chloroprene rubber, chiamato più spesso “neoprene rubber” (gomma policloroprene o gomma
neoprene)
NBR: (acrylo)nitrile butadiene rubber, chiamato più spesso “nitrile rubber” (gomma butadiene
acrilonitrile o gomma nitrile)
HNBR: hydrogenated (acrylo)nitrile butadiene rubber (gomma butadiene acrilonitrile idrogenata)
SBR: styrene butadiene rubber (gomma butadiene stirene)
EPDM: ethylene propylene diene monomer (gomma etilene propilene diene)
S: streching (vibrazione di stiramento)
B: bending (vibrazione di piegamento)
SI: Système International d’unités (sistema internazionale di unità di misura)
68
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
10 FONTI
10.1 BIBLIOGRAFIA
-
Günzler, H., Gremlich, H. 2002. IR spectroscopy – An introduction. Weinheim: WILEY-VCH
Roberts, R. M., Gilbert, J.C., Martin, S.F. 1999. Chimica organica sperimentale. Bologna: Zanichelli
Koenig, J.L. 2001. Infrared and Raman Spectroscopy of Polymers. Rapra Rewiew Reports, Volume
12, Numero 2
Brady, J.E., Senese, F. 2008. Chimica – La materia e le sue trasformazioni. Bologna: Zanichelli
Silverstein, R.M., Bassler, G.C., Morrill, T.C. 1991. Spectrometric identification of organic
compounds, 5.ed. New York: John Wiley & Sons, INC
Walker, J. 2010. Corso di fisica, Volume 3, 4.ed. Milano: Pearson Italia
Stocchi, E. 1993. Chimica organica, applicata e industriale. Milano: Masson
Bertoni, F., Hart, H. 1987. Chimica applicata: la chimica del carbonio e la chimica nell’industria.
Bologna: Zanichelli
Bhowmick, A.K., Stephens, H.L.2001. Handbook of elastomers, 2.ed. New York: Marcel Dekker, Inc
Skoog, D.A., Leary, J.L. 1995. Chimica analitica strumentale. Napoli: EdiSES
Simpson, R.B. 2002. Rubber Basics. Shawbury: Rapra Technology Limited
McMurry, J. 1999. Fondamenti di chimica organica, 2 ed. Bologna: Zanichelli
Amandola, G., Terreni, V. 1989. Analisi chimica strumentale e tecnica, 5 ed. Milano: Masson.
10.2 SITOGRAFIA
-
www.treccani.it
www.wikipedia.it
www.sapere.it
www.unimi.it
www.ptli.com/default.asp
http://www.radionicacallegari.com
www.edises.it
www.varianftirchem.com
http://www.ctssp.com
http://spettroscopia.uai.it
http://www.lati.com/it
http://www.forinst.it/SPF.pdf
http://www.istitutofermiverona.it
www.chimica-online.it
http://ctntes.arpa.piemonte.it
http://docenti.unicam.it
http://chimicibicocca.altervista.org
http://www.katooki.com
http://www.grandidizionari.it
http://www.ecoage.it
http://www.uniroma2.it
http://people.unica.it
69
Spettroscopia infrarossa applicata alle gomme
-
R. Flueckiger
http://www.gm.fh-koeln.de
www.greenpeace.ch
10.3 FONTI DELLE IMMAGINI
10.3.1 FIGURE
1. Tratta da: Brady, J.E., Senese, F. 2008. Chimica – La materia e le sue trasformazioni.
Bologna: Zanichelli.
2. Tratta da: http://www.globalspec.com/reference/64225/203279/1-2-polymerstructure-and-synthesis
3. Tratta da: Stocchi, E. 1993. Chimica organica, applicata e industriale. Milano: Masson.
4. Tratta da: Stocchi, E. 1993. Chimica organica, applicata e industriale. Milano: Masson.
5. Tratta da: Stocchi, E. 1993. Chimica organica, applicata e industriale. Milano: Masson.
6. Tratta da: Stocchi, E. 1993. Chimica organica, applicata e industriale. Milano: Masson.
7. Tratta da: McMurry, J. 1999. Fondamenti di chimica organica, 2 ed. Bologna: Zanichelli.
8. Tratta da: www.treccani.it
9. Tratta da: http://shelf3d.com/i/isoprene
10. Tratta da: www.treccani.it
11. Tratta da: Bertoni, F., Hart, H. 1987. Chimica applicata: la chimica del carbonio e la
chimica nell’industria. Bologna: Zanichelli.
12. Tratta da: Bertoni, F., Hart, H. 1987. Chimica applicata: la chimica del carbonio e la
chimica nell’industria. Bologna: Zanichelli.
13. Tratta da: Bertoni, F., Hart, H. 1987. Chimica applicata: la chimica del carbonio e la
chimica nell’industria. Bologna: Zanichelli.
14. Tratta da: Bertoni, F., Hart, H. 1987. Chimica applicata: la chimica del carbonio e la
chimica nell’industria. Bologna: Zanichelli.
15. Tratta da: Bertoni, F., Hart, H. 1987. Chimica applicata: la chimica del carbonio e la
chimica nell’industria. Bologna: Zanichelli.
16. Tratta da:
‘http://www.las.provincia.venezia.it/discscien/chimica/lucecoloriipert1/ondeelettroma
gn.htm
17. Tratta da: http://www.elemania.altervista.org/filtri/fourier/fourie8.html
18. Tratta da:http://www.nikonschool.it/experience/colore-melis.php
19. Tratta da: ‘http://www.delfo.forlicesena.it/dirdisei/ipertesti/ipersito/in%20viaggio%20fra%20le%20stelle/i_colori_della_
luce.htm
20. Tratta da: Skoog, D.A., Leary, J.L. 1995. Chimica analitica strumentale. Napoli: EdiSES
21. Tratta da: Silverstein, R.M., Bassler, G.C., Morrill, T.C. 1991. Spectrometric identification
of organic compounds, 5.ed. New York: John Wiley & Sons, INC
22. Tratta da
http://www.pianetachimica.it/didattica/documenti/IR_Guida_Interpretazione_Spettri.
pdf
70
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
23. Tratta da
http://www.pianetachimica.it/didattica/documenti/IR_Guida_Interpretazione_Spettri.
pdf
24. Tratta da: http://www.tsfgomma.com/
25. Tratta da: Simpson, R.B. 2002. Rubber Basics. Shawbury: Rapra Technology Limited
26. Tratta da: Simpson, R.B. 2002. Rubber Basics. Shawbury: Rapra Technology Limited
27. Tratta da: Simpson, R.B. 2002. Rubber Basics. Shawbury: Rapra Technology Limited
28. Tratta da: Simpson, R.B. 2002. Rubber Basics. Shawbury: Rapra Technology Limited
29. Tratta da: www.wikipedia.com
30. Tratta da: Simpson, R.B. 2002. Rubber Basics. Shawbury: Rapra Technology Limited
31. Tratta da: Simpson, R.B. 2002. Rubber Basics. Shawbury: Rapra Technology Limited
10.3.2 FOTO
1. Foto scattata da mia madre nel 1987.
2. Tratta da: http://www.labcompare.com/116-Infrared-Spectrophotometer-IR-FTIRSpectrometer/1111-640-IR-FT-IR-Spectrometer/
10.4 FONTI DELLE TAVOLE DI CORRELAZIONE
-
Tavola di correlazione 1: Silverstein, R.M., Bassler, G.C., Morrill, T.C. 1991. Spectrometric
identification of organic compounds, 5.ed. New York: John Wiley & Sons, INC
Tavola di correlazione 2: www.ochemonline.com
Tavola di correlazione 3: Günzler, H., Gremlich, H. 2002. IR spectroscopy – An introduction.
Weinheim: WILEY-VCH
Tavola di correlazione 4: www.wikipedia.org
71
Spettroscopia infrarossa applicata alle gomme
R. Flueckiger
11 ALLEGATI
11.1 SPETTRI
11.2 SPETTRI INTERPRETATI
11.3 SPETTRI SU CARTA LUCIDA
11.4 TAVOLE DI CORRELAZIONE
11.4.1 TAVOLA DI CORRELAZIONE 1
11.4.2 TAVOLA DI CORRELAZIONE 2 (ordinata per numeri d’onda discendenti)
11.4.3 TAVOLA DI CORRELAZIONE 3 (con le posizioni delle bande di disturbo più frequenti)
11.4.4 TAVOLA DI CORRELAZIONE 4
72