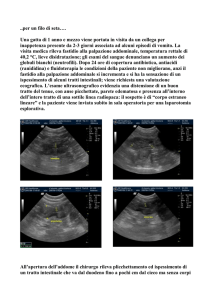
1
CARDIOPATIA ISCHEMICA
Principi
Il modello segmentario
Quando affrontiamo le problematiche relative all’ischemia miocardica utilizzando
l’ecocardiografia andiamo a valutare la funzione
La funzione di pompa del cuore:
meccanica fondamentale del cuore, ossia il suo
l’ispessimento sistolico
ispessimento sistolico (figura 1). Questo è il
DIASTOLE
SISTOLE
meccanismo fondamentale attraverso cui il cuore riduce
la sua volumetria in sistole, adempiendo alla sua
funzione di pompa. Poiché le alterazioni ischemiche
dipendono da deficit di flusso che può riguardare un
singolo o più rami coronarici che si distribuiscono ad
alcuni specifici territori del cuore, ne consegue che le
alterazioni di meccanica cardiaca di natura ischemia Figura 1
sono spesso segmentarie, interessano cioè solo alcuni
segmenti del ventricolo. In quest’ottica e opportuno sottolineare ancora una volta che
l’ecocardiografia è una tecnica tomografica, che ricostruisce sottili “fette” del viscere
cardiaco. Tali sezioni topografiche che noi utilizziamo per lo studio della cinetica devono
permetterci di esplorare la totalità del ventricolo, se vogliamo avere un’adeguata
valutazione dell’effetto dell’ischemia sulla funzione ventricolare. Una dei problemi che a
volte non ci consentono un’adeguata valutazione della cinetica regionale è, ad esempio, la
difficoltà di ottenere un’adeguato approccio apicale che ci consenta di ben valutare la
cinetica a tale livello. Un altro inconveniente che è utile ricordare è legato ai movimenti
estrinseci del cuore, che possono far si che la parete che noi analizziamo in diastole non
sia esattamente la stessa che entra nel nostro raggio di esplorazione in sistole.
Poiché le alterazioni conseguenti all’ischemia sono tipicamente regionali, è
necessario ricorrere ad un modello ventricolare suddiviso in segmenti per poter descrive la
funzione regionale. Un modello ideale
per la valutazione della cardiopatia
ischemica dovrebbe corrispondere alle
Schema per l’analisi segmentaria del
seguenti caratteristiche:
ventricolo sinistro: 16 segmenti
1) • Reperi anatomici per una
facile identificazione dei
segmenti
2) • Contributo percentuale alla
massa totale ventricolare
sovrapponibile per i singoli
egmenti
3) • Correlazione con la
distribuzione coronarica
4) • Clinicamente utile (es.
prognosi)
Figura 2: AS=antero-settale, IS=infero-settale, A=anteriore,
AL=antero-laterale, IL=infero-laterale, I=inferiore,
S=settale, I=inferiore.,
Il modello attualmente attualmente
più utilizzato è quello a 16 segmenti
(figura 2), anche se recentemente l’American Society of Echocardiography ha proposto un
modello a 17 segmenti, da adottarsi in tutti le metodiche che analizzano funzione e/o
2
flusso nella cardiopatia ischemica. Questo modello soddisfa abbastanza bene le
caratteristiche sopraviste.
1) La suddivisione è basata su reperi anatomici facilmente identificabili
2) I singoli segmenti sono abbastanza omogenei in termini di massa ventricolare
3) Vi è una buona concordanza con la distribuzione coronaria (Figura 3)
Schema di segmentazione ventricolare e
relativa distribuzione coronarica
discendente anteriore
circonflessa
destra
Figura 3
3
Le anomalie di cinetica
Le anomalie della cinetica ventricolare (figura 4) sono suddivise a seconda della
loro gravità in: ipocinesia, acinesia,
Gradi di anomalie del movimento (e ispessimento) sistolico
discinesia. Sommando il punteggio di ogni
segmento e dividendolo il risultato per il
Normocinesia (ispessimento normale
numero di segmenti si ottiene un punteggio di
>30%)
1
asirgia che è espressione della funzione
Ipocinesia (ridotto ispessimento
ventricolare globale. E’ da sottolineare che, in
<30%)
2
caso di infarto miocardio, mentre l’acinesia è
Acinesia (assente ispessimento)
3
spesso associata a necrosi (transmurale o
non), e la normocinesia e molto spesso
Discinesia (assottigliamento)
4
espressione di assenza di necrosi o di
Punteggio di asinergia
punteggio di ogni singolo segmento
necrosi non transmurali, l’ipocinesi può
N° di segmenti (16)
essere presente in ugual misura in segmenti
normali o con necrosi non transmurale (figura Figura 4
5). L’ipocinesia pertanto è meno specifica
come anomalia di cinetica espressione di necrosi.
Per queste ragioni, e per altre che
Relazione tra anomali di cinetica all’ECO e
vedremo
in
seguito,
la
valutazione
transmuralità dell’infarto (anatomia patologica)
ecocardiografico dell’area infartuate (intesa come
estensione delle anomalie di cinetica) sovrastima
100
una stima anatomopatologica dell’area infartuate.
80
Ciononostante, il punteggio di asinergia ricavato
60
dall’analisi della cinetica segmentarla ha
40
certamente un rilevante ruolo di stratificazione
20
0
prognostica.
Normocinesi
Ipocinesia
Acinesia
Weiss - Circulation 1991
Normali
Figura 5
IMA subendocardici
IMA transmurali
4
La frazione di eiezione
2C
4C
Sempre più frequentemente la frazione di eiezione del ventricolo sinistro è utilizzata
negli studi dei pazienti con cardiopatia ischemica per caratterizzarne la funzione sistolica.
Il metodo più utilizzato è quello di Simpson
Diastole
Sistole
FE
FE
biplanare (figura 6). Certamente le moderne
monoplana
biplana
tecnologie permettono una sua quantizzazione
FE = 61%
nella maggioranza dei pazienti. Tuttavia è
importante ricordare che per una stima adeguata
è necessaria una corretta massimalizzazione
FE = 54 %
della cavità ventricolare dall’approccio apicale
con un idoneo riconoscimento dell’endocardio di
FE = 43%
tutta
la
superficie
ventricolare.
Voglio
sottolineare che un occhio ben allenato è in
grado di stimare la frazione di eiezione
visivamente con ottima approssimazione e che Figura 6
in caso di discordanza tra ciò che il nostro occhio
stima e quanto la digitizzazione dell’immagine
fornisce, è meglio privilegiare l’impressione visiva.
Il metodo di elezione per il calcolo della frazione di eiezione è il Simpson biplano
dall’approccio apica 4 camere e 2 camere (che per convenzione, ma a mio parere non per
realtà, si considerano sezioni ortogonali). La frazione di eiezione e i volumi ventricolari
sono potenti predittori prognostici nel paziente infartuato.
Il Doppler transmitralico
Il Doppler transmitralico ci fornisce
parametri
legati
alle
pressioni
di
riempimento ventricolari. Nei pazienti con
infarto miocardio un aspetto di tipo
“restrittivo” della morfologia del Doppler
transmitralico è associato ad una prognosi
sfavorevole (figura 7).
Curve di sopravvivenza in relazione al tipo di
riempimento ventricolare
Restrittivo = rapporto E/A > 2 or E/A between 1 and 2 and DT >140 ms
Nijland F, J Am Coll Cardiol 1997
Figura 7
5
Utilizzo e limiti delle anomalie di cinetica nella diagnosi di ischemia
Abbiamo visto che l’applicazione dell’ecocardiografia allo studio della cardiopatia
ischemica vede l’ispessimento sistolico come principale marker di ischemia (vuoi acuta o
cronica). Bisogna tuttavia ricordare che anomalie dlla cinetica regionale non sono
patognomoniche della cardiopatia ischemica, ma possono ritrovarsi in altre situazioni
cliniche, quali ad esempio, le miocarditi (Balloning left ventricle) o le cardiomiopatie
dilatative.
D’altro
Indications for Echocardiography in Patients With Chest Pain
Class
canto in pazienti con
cardiopatia ischemica,
1. Diagnosis of underlying cardiac disease in patients with chest
I
anomalie di cinetica a
pain and clinical evidence of valvular, pericardial, or primary
riposo possono essere
myocardial disease.
presenti
anche
in
assenza di necrosi
I
2. Evaluation of chest pain in patients with suspected acute myocardial
miocardica
e
con
ischemia, when baseline ECG is nondiagnostic and when study can be
obtained during pain or soon after its abatement.
quadri
ECG
non
significativamente
3. Evaluation of chest pain in patients with suspected aortic dissection.
I
alterati.
Pertanto, nonostante
4. Chest pain in patients with severe hemodynamic instability.
I
la
mancanza
di
un’assoluta specificità,
III
la
valutazione
5. Evaluation of chest pain for which a noncardiac etiology is apparent.
ecocardiografica delle
III
anomalie di cinetica
6. Diagnosis of chest pain in a patient with electrocardiographic changes
trova indicazione nella
diagnostic of myocardial ischemia/infarction
valutazione
del
Tabella 1: Classe di indicazione I indica la provata efficacia dell’utilizzo
paziente con sospetta
dell’esame nell’ambito specifico; la classe III indica non indicato o dannoso
sindrome
ischemica
l’utilizzo dell’esame nell’ambito specificato
acuta, specie quando
l’ECG non è diagnostico (tabella 1).
Alcuni limiti dell’utilizzo della anomalie di cinetica nella diagnosi di ischemia acuta,
oltre alla succitata possibilità di anomalie di cinetica in altre patologie, vanno considerati.
1) Le anomalie di cinetica difficilmente possono essere valutate in termini temporali in
relazione al tempo della loro insorgenza e non è possibile differenziare un’anomalia di
cinetica di vecchia data da una di recente insorgenza;
2) Necrosi non transmurali o parcellari possono non provocare evidenti anomalie di
cinetica;
3) La presenza di un blocco di branca sinistra genera un’asincronia di contrazione settale
che ostacola la valutazione dell’ispessimento sistolico.
6
L’ischemia acuta
Studi sperimentali hanno mostrato che la relazione tra flusso ematico e
ispessimento sistolico è lineare, con un
progressiva riduzione dll’ispessimento sistolico
Relazione
parietale al ridursi del flusso ematico sotto i
flusso miocardico/ispessimento sistolico
valori di normalità (figura 10).
Ispessimento sistolico (%)
60 -
• •
•
45 -
•
60 15 0 -15 -
•
• •
• •
•
• |
•
0.3
•
•
•
• •
•
•
|
0.6
|
|
0.9 1.0
|
1.2
-30 -
Flusso sanguigno transmurale (ml/min/gr)
Figura 8
Flusso coronarico (1=flusso basale)
D’altro canto la relazione tra grado di stenosi coronaria e flusso ematico non è
lineare, poiché il flusso, in condizioni basali,
Relazione grado di stenosi coronarica e flusso miocardicoin
si mantiene invariato anche a livelli elevati di
condizioni di base (•) e durante vasodilazione massimale (•)
stenosi.Quello che è compromesso in
presenza di stenosi coronaria è la riserva
5• • •
coronaria, cioè la possibilità di aumentare il
• • •
4• •
flusso coronario in conseguenza di un
••
•
aumentata
richiesta
(o
di
una
3•
vasodilatazione del letto coronario ottenuta
2•
sperimentalmente) (figura 11).
1 -•
0 -|
0
• • • • • • • • • •
|
25
|
50
•
|
75
•
••
•|
100
Grado di stenosi coronarica (%)
Gould, Am J Cardiol 1974
Figura 9
Ispessimento sistolico (%)
Durante esercizio fisico la relazione tra flusso ematico e ispessimento sistolico
cambia, divenendo molto meno ripida, a
significare che per mantenere un normale
Relazione flusso miocardico/ispessimento sistolico
ispessimento ispessimento sistolico durante
in condizioni di base (•) e durante esercizio (•)
sforzo il flusso di sangue deve aumentare di
40 più volte rispetto alla base. Ciò è possibile se
••
la riserva coronaria è normale, ma essa è
30 • ••
•
•
•
•
• • •
•
ridotta, a causa della presenza di una stenosi
20 • • •
•
•
coronaria, non si potrà avere aumento di flusso
•
•
•
10 e, di conseguenza, l’ispessimento sistolico si
• •
•
•
ridurra
(figura
12).
Questa
riduzione
0|
|
|
|
• 1.0
2.0
3.0
4.0
dell’ispessimento sistolico è il marker di
Flusso sanguigno transmurale (ml/min/gr)
ischemia
utilizzato
dall’ecocardiografia
eseguita durante stress.
Figura 10
Gallagher, Circ Res 1983
7
La necrosi miocardica
Ispes simento sis tolico (%)
A differenza di quanto visto per l’ischemia, la relazione tra transmuralità della
necrosi e ispessimento sistolico non è
Rapporto tra transmuralità della necrosi e
lineare:
l’ispessimento
si
azzera
ispessimento sistolico parietale
bruscamente quando la necrosi interessa
Da: Lieberman AN Circulation 1981
50
più di un certo spessore dello spessore
40
della parete (figura 13). Di conseguenza
30
in zone che presentano un mancato
20
ispessimento sistolico, vi può essere
10
necrosi transmurale, ma vi può anche
0
essere una cospicua quantità di miocardio
-10
-20
vitale. Questo è uno dei fondamentali
aspetti che provocano una dissociazione
tra anomalie di cinetica e necrosi, ma non
Necrosi:
assente
< 20%
> 20%
100%
il solo.
Figura 11
Cambiamenti nell’ispessimento sistolico durante
l’occlusione coronarica e dopo la riperfusione:
zona ischemica (•), zona non ischemica (•)
Ispes s im ento sis tolico
(% ris pe tto alla base)
125
100
\\
\\
\\
\\
75
\\
50
25
In conseguenza di un’ischemia
acuta, il miocardio può permanere in una
situazione di alterata funzione per un certo
periodo di tempo (figura 14). Questa
condizione è nota come miocardio stordito.
\\
0
-25
Occl 30’ 1 h 2 h 3 h 4 h 1 g 2 g 3 g 7 g
Riperfusione
Charlat, JACC 1989
Figura 12
In condizioni di ipoperfusione cronica il
miocardio può ridurre la sua funzione, e
quindi le sue necessità metaboliche, in
modo tale da mantenersi vitale, pur se
ipoperfuso
(down
regulation):
tale
condizione è detta ibernazione miocardia,
ed è reversibile dopo rivascolarizzazione
(figura 15).
Hibernating Myocardium
PRE-OPERATIVE
Single vessel disease - Occluded
L.A.D.
CONTROL
LVEDV = 128
EF = 0.37
POST NTG
LVEDV = 101
EF = 0.51
8 MONTHS
POST-OPERATIVE
Patient Coronary Bypass
Graft to L.A.D.
LVEDV = 104
EF = 0.76
End-Diastole
End-Systole
From Rahimtoola, S.H., et al., Circ 1992;65:225.
Figura 13
E’ di fondamentale importanza ricordare che in clinica tali diverse situazioni alla
base della disfunzione ventricolare non sono alternative, ma anzi coesistono nello stesso
soggetto e anche nello stesso segmento miocardio.
8
Evoluzione delle anomalie di cinetica dopo l’infarto
L’infarto miocardio non è una malattia che si esaurisce nella fase acuta, nei pochi
giorni della degenza ospedaliera. Ii destino della zona infartuata, e del ventricolo sinistro
nella sua globalità, può essere diverso, influenzato da molteplici fattori (tabella 2).
Patterns of change in LV size and function after myocardial
infarction detected by echocardiography
INFARCT EXPANSION
An increase in infarct area without extension of the infarct or increase
in the area of normally functioning myocardium; the enlargement or stretching
of LV segments is localized to the infarct zone
VENTRICULAR DILATATION
Symmetric enlargement of both normal and abnormal LV segments
resulting in an increase in the size of the LV without a change in the relative
LV involvement in wall abnormality
INFARCT EXTENSION
An increase in the area of abnormal wall motion because of extension
of wall motion abnormality into a previously uninvolved segment of the LV
NO SIGNIFICANT CHANGE
No change in absolute area of abnormal wall motion
INFARCT REGRESSION
Decrease in absolute extent of abnormal wall motion
Tabella 2
Le alterazioni geometriche ventricolari, sia locali che globali, che conseguono
all’infarto
miocardio
hanno nel tempo sempre
Myocardial Infarction
più attirato l’attenzione
Infarct size, Infarct site, Transmurality, Loading condition, Treatment
del cardiologo clinico,
per la loro provata
Elongation of infarct segment
Loss of contractile function
(Infarct expansion)
rilevanza prognostica. La
↓ Systolic ejection and SV
prima conseguenza dopo
↑ ESV
Restored SV
un infarto miocardio è la
Sympahetic response
perdita di ispessimento
sistolico e lo stiramento
↑ Contractility
↑ EDP
sistolico del segmento
Frank Starling
↑
Ventricular
volume
infartuato,
con
conseguente espansione
↑ Wall stress
HEART FAILURE
del segmento infartuato.
Hypertrophy:
Angiotensin release
Apoptosis
Successivamente,
- Physiological:
adequate (normalized wall stress)
l’aumento
della
inadequate (wall stress remained increased)
pressione
diastolica
- Pathological
intraventricolare genera
un aumentato stress Figura 14: processo di rimodellamento ventricolare dopo infarto miocardio
acuto.
anche sulle zone sae,
con
conseguente
ipertrofia e dilatazione ventricolare. Tale processo è influenzato da numero fattori, tra cui
soprattutto il grado di transmuralità della necrosi e lo stato dell’albero coronario.