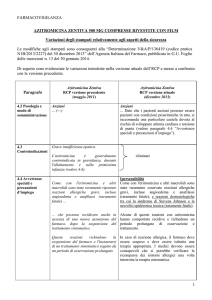
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
1. DENOMINAZIONE DEL MEDICINALE
Azitromicina ratiopharm 500 mg compresse rivestite con film
2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Una compressa rivestita contiene azitromicina monoidrato equivalente a 500 mg di azitromicina
Per la lista completa degli eccipienti vedere il paragrafo 6.1.
3. FORMA FARMACEUTICA
Compressa rivestita con film
Compressa rivestita, ovale e biconvessa di colore bianco o biancastro, con una linea di frattura su
entrambi i lati.
Le compresse rivestite con film possono essere divise in due parti uguali.
4. INFORMAZIONI CLINICHE
4.1 Indicazioni terapeutiche
L’azitromicina è indicata per il trattamento delle seguenti infezioni causate da microrganismi sensibili
all’azitromicina:
-
infezioni delle basse vie respiratorie come bronchite e polmonite acquisita in comunità di
grado da lieve a moderatamente grave.
infezioni delle alte vie respiratorie, tra cui sinusite, faringite e tonsillite (vedi par. 4.4)
otite media acuta
infezioni della cute e dei tessuti molli
uretrite e cervicite non complicate causate da Clamydia trachomatis.
Per quanto riguarda il trattamento antibiotico si tengano presenti la resistenza agli antibiotici e le
istruzioni ufficiali/locali relative all’uso appropriato del trattamento antibiotico.
4.2
Posologia e modo di somministrazione
Modo di somministrazione
Le compresse rivestite con film di Azitromicina ratiopharm 500 mg devono essere somministrate in
dose singola e possono essere assunte con o senza cibo. Di seguito viene indicata la durata del
trattamento in corrispondenza ad ogni malattia infettiva.
Adulti, adolescenti e bambini con peso superiore ai 45 Kg
La dose totale dell‘azitromicina corrisponde a 1500 mg da somministrare nell’arco di 3 giorni (500 mg
una volta al giorno). In alternativa è possibile somministrare la dose nell’arco di 5 giorni (500 mg
come dose singola da somministrare il primo giorno e dosi successive da 250 mg/die).
Per il trattamento delle uretriti e cerviciti non complicate causate da Chlamydia thrachomatis si usi un
dosaggio di 1000 mg in dose singola.
Adolescenti e bambini con peso inferiore ai 45 Kg
Le compresse non sono indicate per questi pazienti. Si utilizzino altre forme farmaceutiche
dell’azitromicina come ad esempio le sospensioni.
Pazienti anziani
Per quanto riguarda i pazienti anziani non è necessario alcun aggiustamento della dose.
Pazienti con insufficienza renale:
Non è richiesto un aggiustamento posologico in pazienti con danno renale da lieve a moderato (GFR
10-80 ml/min). Il farmaco deve essere usato con attenzione in pazienti con grave insufficienza renale
(GFR < 10 ml/min) a causa di un possibile aumento dell’esposizione sistemica (vedi par. 5.2)
Insufficienza epatica
Non è richiesto un aggiustamento posologico in pazienti con danno epatico da lieve (Child Pough A) a
moderato (Child Pough B) (vedi Par. 4.4).
4.3 Controindicazioni
Ipersensibilità verso l’azitromicina, altri antibiotici del gruppo dei macrolidi o ad uno qualsiasi degli
eccipienti.
4.4 Speciali avvertenze e opportune precauzioni per l’uso
Reazioni allergiche
A seguito dell’utilizzo dell’azitromicina sono state raramente segnalate reazioni allergiche gravi
(raramente fatali), tra cui edema angioneurotico e anafilassi. Alcune di queste reazioni hanno causato
sintomi ripetuti e richiesto un periodo di osservazione e un trattamento prolungati nel tempo.
Utilizzo in caso di insufficienza renale
Non è richiesto un aggiustamento posologico in pazienti con danno renale da lieve a moderato (GFR
10-80 ml/min). Il farmaco deve essere usato con attenzione in pazienti con grave insufficienza renale
(GFR < 10 ml/min) a causa di un possibile aumento dell’esposizione sistemica (vedi par. 5.2).
Insufficienza epatica
Dato che l’azitromicina viene metabolizzata nel fegato e viene escreta attraverso la bile, il farmaco non
deve essere somministrato a pazienti affetti da grave danno epatico (Child Pough C). Non sono stati
condotti studi relativamente al trattamento di tali pazienti.
In caso di insorgenza di grave insufficienza epatica è necessario interrompere la terapia con
l’azitromicina. Se la somministrazione è inevitabile è necessario monitorare la funzionalità epatica.
Ergotamina
Lo sviluppo di ergotismo è teoricamente possibile a seguito di uso concomitante di ergotamina e
azitromicina, il cui contemporaneo utilizzo è pertanto sconsigliato (vedi anche par. 4.5)
Prolungamento QT
Durante il trattamento con altri macrolidi è stato osservato un prolungamento della ripolarizzazione
cardiaca e dell’intervallo QT. Non è possibile escludere un effetto simile con l’azitromicina in pazienti
ad alto rischio per effetti cardiaci. Pertanto:
-
-
Azitromicina ratiopharm 500 mg compresse rivestite con film non deve essere impiegata in
pazienti con prolungamento QT congenito o acquisito e documentato.
Azitromicina ratiopharm 500 mg compresse rivestite con film non deve essere utilizzato
contemporaneamente ad altre sostanze attive che prolungano l’intervallo QT come gli
antiaritmici delle classi IA e III, cisapride e terfenadina.
Azitromicina ratiopharm 500 mg compresse rivestite con film non deve essere impiegata in
pazienti con disturbi elettrolitici, soprattutto in caso di ipopotassiemia e ipomagnesiemia.
Si eviti di utilizzare Azitromicina ratiopharm 500 mg compresse con film in pazienti con
bradicardia clinicamente rilevante, aritmia cardiaca o grave insufficienza cardiaca.
Faringite/tonsillite
L’azitromicina non è la sostanza di prima scelta per il trattamento di faringite e tonsillite causate da
Streptococcus piogenes, il cui trattamento di elezione è rappresentato dalla penicillina, utilizzata anche
per la profilassi della febbre reumatica acuta.
L’azitromicina non è indicata per il trattamento di ustioni infette.
In caso di malattie sessualmente trasmesse è necessario escludere una concomitante infezione da
Treponema palladium.
Superinfezioni
Si raccomanda una particolare osservazione dei possibili sintomi di superinfezioni causate da
microrganismi non sensibili inclusi i funghi. A causa di una superinfezione può essere necessario
interrompere il trattamento con l’azitromicina ed adottare misure appropriate.
Disturbi neurologici o psichiatrici
L’azitromicina deve essere somministrata con cautela a pazienti affetti da disturbi neurologici o
psichiatrici.
Colite pseudomembranosa
E’ stata segnalata la comparsa di colite pseudomembranosa a seguito dell’utilizzo di antibiotici
macrolidi. Si tenga pertanto presente questa diagnosi per pazienti che manifestano diarrea dopo l’inizio
del trattamento a base di azitromicina. Nel caso in cui la colite pseudomembranosa sia indotta
dall’azitromicina non devono essere usati antiperistaltici.
Utilizzo a lungo termine
Non vi è esperienza circa la sicurezza e l’efficacia di un utilizzo a lungo termine con l’azitromicina per
il trattamento delle indicazioni sopra indicate. In caso di infezioni a rapida ricorrenza si consideri
l’adozione di un altro tipo di antibiotico per il trattamento.
Le compresse di azitromicina non sono adatte per il trattamento di infezioni gravi che necessitano una
rapida concentrazione di alte quantità di antibiotico nel sangue.
Si rimanda al paragrafo 5.1 per quanto riguarda la possibile resistenza crociata con altri macrolidi.
4.5 Interazioni con altri medicinali e altre forme di interazione
Antiacidi: nell’ambito dello studio dell’effetto della contemporanea assunzione di antiacidi sulla
farmacocinetica dell’azitromicina non è stato osservato alcun cambiamento complessivo nella
biodisponibilità, nonostante la concentrazione sierica di picco dell’azitromicina sia diminuito del 30%.
L’azitromicina e gli antiacidi non devono essere somministrati contemporaneamente. Si raccomanda di
assumere l’azitromicina almeno un’ora prima o due ore dopo la somministrazione degli antiacidi.
Alcaloidi dell’ergotamina: è stato riscontrato che la somministrazione concomitante di alcaloidi
dell’ergotamina e degli antibiotici macrolidi può accelerare lo sviluppo di ergotismo. Non sono state
studiate le interazioni tra gli alcaloidi dell’ergotamina e l’azitromicina. Lo sviluppo di ergotismo è
comunque possibile, tanto che non si raccomanda la somministrazione contemporanea
dell’azitromicina e derivati dell’ergotamina.
Anticoagulanti orali di tipo cumarinico: sono stati segnalati casi di aumentata tendenza al
sanguinamento a seguito della somministrazione concomitante dell’azitromicina e del warfarin o degli
anticoagulanti orali di tipo cumarinico. Si consiglia di rivalutare la frequenza con cui monitorare il
tempo di protrombina.
Digossina: si ritiene che alcuni macrolidi riducano il metabolismo della digossina nell’intestino in
alcuni pazienti. E’ quindi opportuno considerare la possibilità che pazienti trattati simultaneamente
con l’azitromicina e la digossina manifestino un incremento delle concentrazioni di digossina.
Zidovudina: la somministrazione di dosi singole da 1000 mg e di dosi ripetute da 1200 mg o 600 mg
dell’azitromicina ha modificato solo leggermente la farmacocinetica plasmatica o l’escrezione urinaria
della zidovudina o del suo metabolita glucuronide. Tuttavia, la somministrazione dell’azitromicina ha
determinato un aumento delle concentrazioni della zidovudina fosforilata, suo metabolita clinicamente
attivo, nelle cellule periferiche mononucleate. L’importanza clinica di questo dato non è chiara, ma
può comunque costituire un beneficio per il paziente.
Didanosina: dosaggi giornalieri di 1200 mg dell’azitromicina somministrati contemporaneamente alla
didanosina in 6 volontari non hanno influenzato la farmacocinetica della didanosina in comparazione
al placebo.
Rifabutina: la somministrazione concomitante dell’azitromicina e della rifabutina può modificare le
concentrazioni sieriche dei due farmaci. E’ stata osservata neutropenia in pazienti trattati
contemporaneamente con l’azitromicina e la rifabutina.
Teofillina: l’azitromicina non ha influenzato la farmacocinetica della teofillina quando le due sostanze
sono state somministrate contemporaneamente in volontari sani. E’ possibile un aumento dei livelli
della teofillina in pazienti trattati con l’azitromicina. E’ pertanto necessario monitorare attentamente i
livelli plasmatici della teofillina nei pazienti che ricevono l’azitromicina e la teofillina
simultaneamente.
Benché l’azitromicina non sembri in grado di inibire l’enzima CYP3A4 si richiede cautela quando il
farmaco viene associato a chinidina, ciclosporina, cisapride, astemizolo, terfenadina, alcaloidi
dell’ergotamina, pimozide o altri farmaci con stretto indice terapeutico che vengono prevalentemente
metabolizzati dal CYP3A4.
Ciclosporina: non sono stati svolti studi clinici o farmacocinetici su possibili interazioni tra
l’azitromicina e la ciclosporina; Alcune segnalazioni descrivono un marcato aumento dei livelli della
ciclosporina durante l’uso concomitante di questi due farmaci. Pertanto, prima che questi farmaci
siano somministrati in associazione è necessario valutare attentamente la situazione. Se la cosomministrazione viene ritenuta opportuna, si consiglia un attento monitoraggio delle concentrazioni
sieriche della ciclosporina e un adeguato aggiustamento del dosaggio.
Terfenadina: gli studi di farmacocinetica non hanno evidenziato interazioni tra l’azitromicina e la
terfenadina. Sono stati segnalati casi in cui la possibilità di una tale interazione non poteva essere
completamente esclusa, ma non è stata stabilita alcuna specifica evidenza a riprova dell’avvenuta
interazione. La combinazione dell’azitromicina e della terfenadina deve avvenire con cautela.
Cisapride: il cisapride viene metabolizzato nel fegato dall’enzima CYP3A4. Dato che i macrolidi
inibiscono questo enzima la somministrazione concomitante di cisapride può comportare un aumento
del prolungamento dell’intervallo QT, delle aritmie ventricolari e delle torsioni di punta.
Astemizolo, triazolam, midazolam, alfentanil:
Non sono disponibili dati circa le interazioni con astemizolo, triazolam, midazolam e alfentanil. Si
richiede cautela durante l’uso concomitante di queste sostanze e l’azitromicina a causa del
documentato potenziamento del suo effetto durante l’uso contemporaneo dell’antibiotico macrolide
eritromicina.
4.6
Gravidanza ed allattamento
Non sono disponibili dati adeguati relativamente all’uso dell’azitromicina in donne in gravidanza.
Studi di riproduzione animale hanno dimostrato che l’azitromicina attraversa la placenta, ma non sono
stati osservati effetti teratogeni (vedi par. 5.3). Non è stata confermata la sicurezza d’impiego del
principio attivo durante la gravidanza. L’utilizzo di azitromicina durante la gravidanza deve essere
riservato ai casi a rischio per la vita.
L’azitromicina viene escreta nel latte materno. Non è noto se l’azitromicina può causare effetti avversi
nel bambino allattato al seno. Si consiglia pertanto di sospendere l’allattamento durante il trattamento.
Il bambino allattato al seno può manifestare tra l’altro diarrea, infezioni micotiche delle mucose e
sensibilizzazione. Si raccomanda di non allattare durante e fino a due giorni dopo la sospensione del
trattamento. Dopodiché è possibile ricominciare ad allattare.
4.7 Effetti sulla capacità di guidare e sull’uso di macchinari
Non sono stati condotti studi per quanto riguarda gli effetti sulla capacità di guidare e usare
macchinari. Si deve comunque tenere presente la possibilità che possano manifestarsi vertigini e
convulsioni durante lo svolgimento di queste attività.
4.8 Effetti indesiderati
Nell’ambito degli studi clinici circa il 13% dei pazienti ha sperimentato effetti indesiderati. I disturbi
gastrointestinali (approssimativamente 10%) si sono manifestati con maggiore frequenza.
Patologie del sistema emolinfopoietico
Rari (≥1/10.000, <1/1000)
Trombocitopenia, anemia emolitica, in studi clinici sono stati riscontrati episodi transitori di lieve
neutropenia, sebbene non sia stata accertata una relazione causale con l’azitromicina.
Disturbi psichiatrici
Rari (≥1/10.000, <1/1000)
Comportamento aggressivo, agitazione, ansia, nervosismo, depersonalizzazione, nei pazienti anziani
può manifestarsi delirio.
Patologie del sistema nervoso
Non comuni ((≥1/1000, <1/100)
Capogiri/vertigini, sonnolenza, cefalea, convulsioni, alterazione del senso dell’odorato e del gusto
Rari (≥1/10.000, <1/1000)
Parestesia, sincope e astenia, insonnia, iperattività.
Patologie dell’orecchio e del labirinto
Rari (≥1/10.000, <1/1000)
Con i macrolidi sono stati riportati casi di alterazione della funzionalità uditiva. In seguito
all’assunzione dell’azitromicina sono stati osservati alcuni episodi di alterazione della funzionalità
uditiva, inclusi sordità e tinnito, che nella gran parte dei casi si sono verificati nel corso di studi
sperimentali condotti con dosi molto elevate e per periodi prolungati. In base alle informazioni relative
al decorso dei pazienti è stato comunque constatato che nella maggior parte dei casi si è trattato di
episodi reversibili.
Patologie cardiache
Rari (≥1/10.000, <1/1000)
Palpitazioni, aritmia inclusa tachicardia ventricolare. Sussiste un rischio potenziale di prolungamento
QT e torsione di punta, soprattutto in pazienti soggetti a queste condizioni.
Patologie gastrointestinali
Comuni (≥1/100, <1/10)
Nausea/vomito, diarrea, disturbi addominali (dolore/crampi)
Non comuni (≥1/1000, <1/100)
Feci molli (conseguenti a disidratazione infrequente), flatulenza, anoressia, disturbi digestivi.
Rari (≥1/10.000, <1/1000)
Stipsi, scolorimento della lingua, pancreatite, scolorimento dei denti, colite pseudomembranosa.
Patologie epatobiliari
Rari (≥1/10.000, <1/1000)
Alterazione dei valori dei test di funzionalità epatica, epatite, ittero colestatico, rari casi di necrosi
epatica e disturbi della funzionalità epatica, che hanno in rari casi causato la morte del paziente.
Patologie della cute e del tessuto sottocutaneo
Non comuni (≥1/1000, <1/100)
Reazioni allergiche, tra cui prurito e rash.
Rari (≥1/10.000, <1/1000)
Reazioni allergiche, tra cui edema angioneurotico, orticaria e fotosensibilità; gravi reazioni cutanee, tra
cui eritema multiforme, sindrome di Stevens-Johnson e necrolisi epidermica tossica
Patologie del sistema muscoloscheletrico e del tessuto connettivo
Non comuni (≥1/1000, <1/100)
Artralgia
Patologie renali e urinarie
Rari (≥1/10.000, <1/1000)
Nefrite interstiziale, insufficienza renale acuta.
Patologie dell’apparato riproduttivo e della mammella
Non comuni (≥1/1000, <1/100)
Vaginite
Patologie sistemiche e condizioni relative alla sede di somministrazione
Rari (≥1/10.000, <1/1000)
Anafilassi, incluso edema (raramente fatale), astenia, candidiasi.
4.9 Sovradosaggio
Gli eventi avversi verificatisi con dosi superiori a quelle consigliate sono stati simili a quelli registrati
con dosi normali. I sintomi tipici di un sovradosaggio con antibiotici macrolidi includono una perdita
reversibile dell’udito, nausea grave, vomito e diarrea. In caso di sovradosaggio, sono indicate, in caso
di necessità, le appropriate misure generali sintomatiche e di supporto delle funzioni vitali, nonché la
somministrazione di carbone attivo.
5. PROPRIETÀ FARMACOLOGICHE
5.1 Proprietà farmacodinamiche
Categoria farmacoterapeutica: agenti antibatterici per uso sistemico, macrolidi
Codice ATC: J01FA10
L’azitromicina è il primo antibiotico macrolide della classe degli azalidi. La molecola si ottiene
dall'inserimento di un atomo di azoto nell'anello lattonico dell'eritromicina A. La sua denominazione
chimica è: 9-deossi-9a-aza-9a-metil-9a-omoeritromicina A. Il peso molecolare equivale a 749,0.
L’azitromicina esplica la sua attività inibendo la sintesi proteica batterica mediante legame con la
subunità ribosomiale 50 S e prevenendo così la traslocazione peptidica.
Breakpoints
Il breakpoint di sensibilità dell’azitromicina per i più comuni patogeni batterici:
NCCLS:
• sensibile 2 mg/l; intermedio 4 mg/l; resistente 8 mg/l
• Haemophilus spp.: sensibile 4 mg/l
• Streptococcus pneumoniae e Streptococcus pyogenes:
sensibile 0,5 mg/l;
intermedio 1 mg/l;
resistente 2 mg/l
Si tenga presente che i breakpoint nazionali possono differire da quelli raccomandati dal NCCLS
Al momento non sono disponibili breakpoint raccomandati dal NCCLS relativi all’azitromicina nei
confronti di Neisseria gonorrhoeae e Moraxella catarrhalis.
Al momento non sono disponibili breakpoint raccomandati da NCCLS per i patogeni atipici nei
confronti dei quali l’azitromicina ha dimostrato un’attività clinicamente significativa, come Chlamydia
spp., Mycobacterium avium Complex, Mycoplasma spp., Borrelia spp. e Helicobacter pylori.
La prevalenza di resistenza può variare geograficamente e nel tempo per specie selezionate ed è
auspicabile disporre di informazioni locali sulla resistenza, soprattutto quando si stanno trattando
infezioni gravi. Questa informazione fornisce solo una guida approssimativa sulla probabilità che un
organismo sia sensibile all’azitromicina.
Specie
Gamma
di
resistenza
acquisita (%)
Specie comunemente sensibili
Batteri aerobi gram-positivi
Corynebacterium diphteriae
0-19
Staphylococcus aureus – sensibile alla meticillina .
Staphylococcus coagulase-negativo – sensibili alla meticillina
5-37
Streptococcus pneumoniae
Sensibile alla eritromicina
Sensibile alla penicillina
3-23
0-43
Streptococcus pyogenes
Sensibile alla eritromicina
21
20-32
Streptococcus del gruppo viridans
Batteri aerobi gram-negativi
Bordetella pertussis
Escherichia coli – ETEC
Escherichia coli – EAEC
0-2
Haemophilus influenzae
Haemophilus ducreyi
Legionella spp.
0-2
Moraxella catarrhalis
Sensibile alla eritromicina
Sensibile in modo intermedio all’eritromicina 0
Neisseria gonorrhoeae
Pasteurella mutocida
Batteri anaerobi
Clostridium perfringens
Fusobacterium nucleatum
Fusobacterium necrophorum
Prevotella spp.
Porphyromonas spp.
Propionibacterium spp.
Altri microrganismi
Borrelia burgdorferi
Chlamydia pneumoniae
Chlamydia trachomatis
Helicobacter pylori
Listeria spp.
Mycobacterium avium Complex
Mycoplasma pneumoniae
Ureaplasma urelyticum
Specie per cui la resistenza acquista può costituire un problema
Batteri aerobi gram-positivi
Streptococcus pneumoniae
Sensibile in modo intermedio alla penicillina 20-62
Resistente alla penicillina
23-78
Sensibile in modo intermedio all’eritromicina Streptococcus pyogenes
Sensibile in modo intermedio all’eritromicina -
Streptococcus del gruppo viridans
Sensibile in modo intermedio alla penicillina
Batteri aerobi gram-negativi
Moraxella catarrhalis – resistente all’eritromicina
Batteri anaerobi
Peptostreptococcus spp.
Organismi resistenti
Batteri aerobi gram-positivi
Corynebacterium spp.
Enterococcus spp.
Staphylococcus MRSA, MRSE
Streptococcus pneumoniae
Resistente all’eritromicina
Resistente alla penicillina ed all’eritromicina
Streptococcus pyogenes
Resistente all’eritromicina
Streptococcus del gruppo viridans
Resistente alla penicillina
Resistente all’eritromicina
Batteri aerobi gram-negativi
Pseudomonas aeruginosa
Batteri anaerobici
Bacteriodi del gruppo fragilis
-
-
Resistente
-
-
Altre informazioni
Resistenza (crociata)
Sussiste una completa resistenza crociata tra l’eritromicina, l’azitromicina, altri macrolidi e le
lincosamidi per Streptococcus pneumoniae, streptococcus beta-emolitici del gruppo A, Enterococcus
spp. e Staphylococcus aureus, incluso S. aureus resistente alla meticillina (MRSA).
Si ritiene che gli S.pneumoniae sensibili alla penicillina siano più sensibili all’azitromicina rispetto ai
ceppi di S.pneumoniae resistenti alla penicillina. L’S.aureus resistente alla meticillina (MRSA) sembra
meno sensibile all’azitromicina rispetto all’S.aureus sensibile alla meticillina (MSSA).
L’induzione di resistenza significativa in modelli sia in vitro che in vivo è <1 aumento di diluizione in
MIC per S.pyogenes, H.influenzae, e Enterobacterciae dopo nove passaggi sub-letali del principio
attivo e tre aumenti di diluizione per S.aureus . Lo sviluppo di resistenza in vitro a causa di mutazione
avviene raramente.
5.2 Proprietà farmacocinetiche
Assorbimento:
Dopo somministrazione orale, la biodisponibilità dell’azitromicina equivale a circa 37%. I livelli di
picco plasmatici vengono raggiunti 2-3 ore dopo la somministrazione.
Distribuzione:
L’azitromicina somministrata oralmente si distribuisce ampiamente in tutto l'organismo.
Studi di farmacocinetica hanno dimostrato livelli tissutali di azitromicina considerevolmente più
elevati rispetto a quelli plasmatici (fino a 50 volte la massima concentrazione osservata in plasma),
indicando così che la sostanza è altamente legata ai tessuti (volume di distribuzione allo stato
stazionario approssimativamente 31 l/kg). La concentrazione massima media (Cmax) osservata dopo
una singola dose di 500 mg equivale ad approssimativamente 0,4 g/ml, 2-3 ore dopo la
somministrazione. Alle dosi raccomandate non si verifica alcun accumulo in siero/plasma. Il farmaco
si accumula nei tessuti dove i livelli sono molto maggiori che in siero/plasma. Tre giorni dopo la
somministrazione di 500 mg in dose singola o suddivisa le concentrazioni di 1,3-4,8 g/g, 0,6-2,3
g/g, 2,0-2,8 g/g e 0-0,3 g/ml sono state rispettivamente riscontrate nel polmone, nella prostata,
nelle tonsille e nel siero. Le concentrazioni medie di picco misurate nei leucociti periferici sono
maggiori rispetto alla MIC90 dei più comuni patogeni.
In studi sperimentali in-vitro ed in-vivo l’azitromicina si accumula nei fagociti ed il suo rilascio
avviene per mezzo di fagociti attivati. Nei modelli animali questo processo sembra contribuire
all’accumulo dell’azitromicina nei tessuti. Il legame dell’azitromicina alle proteine plasmatiche può
variare dal 52% a 0.05 g/ml fino al 18% a 0.5 g/ml a seconda della concentrazione sierica.
Metabolismo ed eliminazione
Il tempo di emivita plasmatica terminale riflette il tempo di emivita di deplezione tissutale (da 2 a 4
giorni).In volontari anziani (>65 anni), sono stati sempre osservati dopo un ciclo di 5 giorni valori di
AUC più alti (29%) rispetto ai volontari più giovani (<45 anni). Queste differenze non sono comunque
considerate clinicamente rilevanti e non si raccomanda pertanto alcun aggiustamento posologico. Circa
il 12% di una dose di azitromicina somministrata per via intravenosa viene eliminata nelle urine come
farmaco immodificato nei 3 giorni successivi; per la maggior parte nelle prime 24 ore. 2 giorni dopo
un ciclo di 5 giorni concentrazioni fino a 237 g/ml di azitromicina sono state trovate nella bile umana
insieme a 10 metaboliti (formati mediante processi di N- e O-demetilazione, mediante idrossilazione
della desosamina e degli anelli agliconici e mediante scissione dei cladinosio-coniugati). La
comparazione tra HPLC e misurazioni microbiologiche suggerisce che i metaboliti non sono partecipi
all’attività microbiologica dell’azitromicina.
Farmacocinetica in popolazioni speciali
Insufficienza renale
A seguito della somministrazione di una singola dose orale di 1 g di azitromicina, i valori medi di Cmax
e AUC0-120 sono aumentati rispettivamente di 5.1% e 4.2% in soggetti con compromissione renale lieve
e moderata (velocità di filtrazione glomerulare di 10-80 ml/min) rispetto a pazienti con funzione renale
normale (GFR>80ml/min). In soggetti con grave compromissione renale i valori medi di Cmax e AUC0120 sono aumentati rispettivamente di 61% e 35% rispetto al normale.
Insufficienza epatica
In pazienti con compromissione epatica da lieve a moderata non vi è evidenza di marcata alterazione
della farmacocinetica sierica dell’azitromicina rispetto ai pazienti con funzione epatica normale. In
questi pazienti il recupero dell’azitromicina nelle urine sembra aumentare, forse a compensazione
della ridotta clearance epatica.
Pazienti anziani
La farmacocinetica dell’azitromicina negli uomini anziani era simile a quella degli adulti giovani;
nelle pazienti anziane non si è comunque verificato nessun accumulo significativo, nonostante siano
state osservate concentrazioni di picco più alte (con aumenti del 30-50%).
Lattanti, bambini ai primi passi, bambini e adolescenti
È stata studiata la farmacocinetica in bambini dai 4 mesi ai 15 anni che assumevano capsule, granulati
o sospensioni. La somministrazione di 10 mg/kg al primo giorno, seguita da 5 mg/kg nei 4 giorni
successivi ha determinato una Cmax leggermente più bassa rispetto a quella degli adulti con 224g/l in
bambini di età tra 0.6 e 5 anni dopo tre giorni di dosaggio e 383 g/l in quelli di età tra i 6 e i 15 anni.
La T12 di 36h nei bambini più grandi si collocava nella gamma attesa per gli adulti.
5.3 Dati preclinici di sicurezza
E’ stato trovato in sperimentazioni su animali che l’azitromicina somministrata a dosi 40 volte
maggiori rispetto alle dosi cliniche causa fosfolipidosi reversibili. Di norma non è stato ad esse
correlato nessun reale effetto tossicologico. Non si sa se questi dati siano rilevanti nell’uomo in caso di
assunzione dell’azitromicina in accordo con quanto raccomandato.
Le indagini elettrofisiologiche hanno dimostrato che l’azitromicina prolunga l’intervallo QT.
Cancerogenicità:
Non sono stati condotti studi su animali a lungo termine volti a stabilire la possibile cancerogenicità
del prodotto.
Mutagenicità:
In modelli in vivo e in vitro non sono stati osservati effetti di mutazione genetica o cromosomica.
Tossicità riproduttiva:
Dopo somministrazione orale dell’azitromicina non sono stati osservati effetti teratogeni in ratti
nell’ambito di esperimenti eseguiti con l’intento di stabilire i possibili effetti embriotossici del
prodotto. La somministrazione di 100-200 mg/kg di peso corporeo/die di azitromicina nei ratti ha
leggermente ritardato l’ossificazione dell’embrione e l’aumento di peso della madre. Studi pre- e postnatali sui ratti hanno dimostrato che la somministrazione di 50 mg/kg/die di azitromicina determina un
leggero ritardo dell’ossificazione nell’embrione e aumento di peso della madre.
6
PARTICOLARI FARMACEUTICI
6.1 Elenco degli eccipienti
Nucleo della compressa: Calcio fosfato acido anidro, Cellulosa microcristallina, Idrossipropilcellulosa,
Sodio laurilsolfato, Amido di sodio glicollato (Tipo A), Sodio stearilfumarato
Rivestimento: Ipromellosa, Macrogol 6000, Talco, Titanio biossido (E171)
6.2
Incompatibilità
Non pertinente
6.3 Validità
3 anni
6.4
Precauzioni particolari per la conservazione
Non sono richieste particolari precauzioni per la conservazione di questo prodotto.
6.5 Natura e contenuto del contenitore
Blister in PVC/Al e blister in PVC/PVDC/Al
Confezioni da: 2, 3, 6, 30, 30 x1, e 150 compresse
E’ possibile che non tutte le confezioni siano commercializzate.
6.6
Speciali precauzioni per lo smaltimento e la manipolazione
Nessuna istruzione particolare.
7
TITOLARE DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
ratiopharm GmbH – Graf-Arco Strasse, 3 – 89079 Ulm (Germania)
8
NUMERO DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
500 mg compresse rivestite con film – 3 compresse in blister PVC/PVDC/Al
AIC 037463080/M
9
DATA DELLA PRIMA AUTORIZZAZIONE /RINNOVO DELL’AUTORIZZAZIONE
Determinazione n. 1193/2009 del 15 maggio 2009 – GU n. 130 del 8 giugno 2009
10
DATA DI REVISIONE DEL TESTO