Corso di Aggiornamento
19 – 20 – 21 Giugno 2012
CRA – Centro Riproduzione Assistita - Catania
www.cragroup.it
La Vitrificazione
Dott.ssa Giovanna Tomasi
La crioconservazione
È una branca della criobiologia che consente il mantenimento
della vitalità cellulare per un tempo prolungato, tramite
congelamento a temperatura di –196°C in azoto liquido.
Il principio fondamentale è quello di interrompere i processi
biochimici del metabolismo cellulare.
Gardner et al. 2004
Crioconservazione Embrionale – Cenni storici
Gli embrioni dei mammiferi furono congelati e
conservati la prima volta con successo nel 1972
quando Whittingham ottenne cuccioli di topo dopo il
trasferimento di una morula scongelata.
La prima gravidanza da embrione umano - ottenuto
con IVF e congelato allo stadio di 8 cellule - fu
ottenuta in Australia nel 1983 da Trounson e Mohr,
ma esitò in aborto clinico.
Nel 1986 Cohen ottenne il primo nato da embrione
crioconservato allo stadio di blastocisti ed ottenuta
con IVF.
Nel 1994 Van der Elst pubblicò la prima gravidanza
da embrione crioconservato da ICSI.
Crioconservazione degli Ovociti – Cenni storici
Wittingham 1977
Carroll 1989
congelamento di ovociti di topo
Bassa percentuale di fertilizzazione
Alterazione del processo di fecondazione
Gli ovociti sono una specie
cellulare scarsamente resistente
alla crioconservazione
Crioconservazione degli Ovociti – Cenni storici
Chen
Hunter
Porcu
1986 prima
gravidanza
da
ovocita
congelato
1995 vitrificazione di ovociti umani
1997 primo bambino nato da un ovocita
congelato con il congelamento lento
Kuleshova 1999 primo bambino nato da un ovocita
vitrificato
Yoon
2003 il primo a pubblicare uno studio su un
gran numero di ovociti vitrificati
Regolamentazione Legislativa
La L. 40/2004 consente oggi la crioconservazione di GAMETI
ed EMBRIONI.
La Sentenza n.151 del 2009 della Corte Costituzionale ha
dato una deroga al divieto di congelamento.
TUTELA
ESCLUSIVA
DELL’EMBRIONE
SCIENZA E
COSCIENZA
DEL MEDICO
TUTELA DELLA
SALUTE DELLA
DONNA
Indicazioni alla Crioconservazione
È possibile crioconservare:
Spermatozoi
Tessuto testicolare
Ovociti
Tessuto ovarico
Zigoti
Embrioni
Blastocisti
PRESERVARE LA FERTILITA’
OTTIMIZZARE I RISULTATI
DELLA PMA
Vantaggio nei programmi di PMA
CONGELAMENTO DEGLI OVOCITI
Preserva la fertilità
della donna quando la
funzionalità del suo
apparato riproduttore è
compromessa
Per le donne che
rimandano la maternità
per ragioni “sociali”
(carriera o mancanza di
un partner)
POF: Fallimento Ovarico Precoce
Patologie pelviche
Gravi malattie infiammatorie del colon
Malattie autoimmuni
Trattamenti radioterapici
Crioconservazione Embrionale
Transfer degli embrioni con la morfologia ottimale
Congelamento degli embrioni con morfologia “discreta”
Percentuale di gravidanza cumulativa maggiore del singolo
trasferimento di embrioni freschi
Strategia cost-effective per aumentare la percentuale di gravidanza per
pick-up.
Ridurre il rischio di iperstimolazione ovarica nelle pazienti iper-responsive e
PCO.
T. Mardešić, 2010
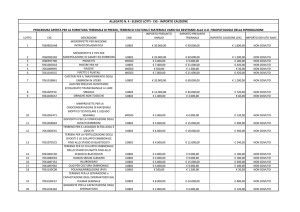
La crioconservazione
Fondamenti della
crioconservazione
QUOTA DI
RAFFREDDAMENTO
H2O
CONTROLLO
QUOTA DI
RISCALDAMENTO
CRIOPROTETTORE
Gardner et al. 2004
PROTEZIONE
DISIDRATAZIONE
PREVENZIONE
GHIACCIO
INTRACELLULARE
EQUILIBRIO
OSMOTICO E
TERMICO
INTEGRITA’
CELLULARE
La crioconservazione
Punti critici
Esposizione al
CRIOPROTETTORE
Citotossicità
Riduzione / Aumento
della
TEMPERATURA
Sensibilità
cellulare
STOCCAGGIO
Ripristino del
MICROAMBIENTE
Gardner et al. 2004
Mantenimento nel
TEMPO
Ripresa del
METABOLISMO
La crioconservazione
riduzione delle attività enzimatiche
modificazioni della
conformazione
della membrana
cellulare
RAFFREDDAMENTO
un progressivo aumento
della solubilità dei gas con
aumento delle pressioni
parziali di CO2 , O2, N2.
Gardner et al. 2004
riduzione dei
meccanismi di
trasporto attivo
La crioconservazione
La curva di raffreddamento è specifica ed
ottimale per ogni tipo di cellula.
I fattori che devono essere tenuti presenti sono:
• Contenuto intracellulare di acqua
• Permeabilità della membrana
• Rapporto Superficie/Volume della cellula
Gardner et al. 2004
Crioprotettori
Si dividono in due categorie:
Permeanti o Intracellulari: molecole che diffondono attraverso la membrana
Non Permeanti o Extracellulari: molecole che producono una condizione di
disidratazione cellulare
abbassano
il
punto
di
congelamento della soluzione
azione diretta sulla membrana
cellulare
modificano l’ambiente intra ed
extra
cellulare
sostituendosi
all’acqua
e
diminuendo
la
formazione di cristalli di ghiaccio
Permeanti o Intracellulari: alcoli (PROH –
Etilen Glicole) o DMSO
Non Permeanti o Extracellulari: disaccaridi
CRIOPROTETTORI
tempo di esposizione all’agente chimico
temperatura a cui avviene l’esposizione
Gardner et al. 2004
Tecniche di Crioconservazione
È possibile crioconservare:
Spermatozoi
Tessuto testicolare
Ovociti
Tessuto ovarico
Zigoti
Embrioni
Blastocisti
Congelamento Lento
Vitrificazione
Congelamento Lento
Gli ovociti o gli embrioni trattati con il crioprotettore sono trasferiti in un congelatore
biologico che gradualmente li porta dalla temperatura corporea di 37°C alla
temperatura -40°C .
Il seeding, formazione del primo nucleo di ghiaccio, si verifica tra -5° e -15°C
Mentre la temperatura diminuisce si crea un gradiente osmotico per mezzo del quale
l’acqua si sposta dal citoplasma nell’ambiente extra cellulare.
1.
2.
3.
Bassi livelli di crioprotettori
Lento freezing rate
Lenta disidratazione della cellula per minimizzare la formazione di cristalli di ghiaccio
CONGELAMENTO LENTO
Controlled Freezing Rate
CONGELAMENTO LENTO
Durata: 2 ore
oppure
cryotube
paillettes
can
PLANER
tank
azoto liquido
Vitrificazione
Ice Free Cryoconservation
Il congelamento ultrarapido di una soluzione acquosa provoca un
aumento della viscosità della soluzione ed il conseguente
passaggio di fase da uno stato liquido ad uno stato vetroso senza
formazione di cristalli di ghiaccio.
Rall & Fahy, 1985
Vitrification is a revolution
Van der Elst, 2007
«Crystallization is incompatible with living system and should be
avoided whenever possible»
Luyet, 1937
La vitrificazione è un valido protocollo alternativo al congelamento lento
P. Vanderzwalmen, 2007
In laboratorio: la vitrificazione oggi
Il protocollo migliore è il «Cryotop Method»
Consente di velocizzare molto l’intera procedura
esponendo la cellula ad un contatto diretto con
la soluzione per la vitrificazione per un periodo
brevissimo. Le cellule vengono collocate su un
supporto molto sottile, in modo da ridurre al
minimo la quantità di crioprotettore.
Successivamente gli ovociti vengono coperti da
una capsula di plastica e immerse nell’azoto
liquido.
1.
2.
3.
Elevati livelli di crioprottettori
Elevato cooling rate
Non si formano cristalli di ghiaccio
«Cryotop Method»
Vitrificazione
Durata: circa 10 minuti
paillettes
tank
azoto liquido
Vitrificazione
1. Elevati livelli di crioprotettori
2. Elevato cooling rate
3. Non si formano cristalli di ghiaccio
Elevato “cooling rate” 15.000 - 30.000°C/min
Elevate concentrazioni di crioprotettori = tossicità
Contatto diretto con N2 liquido = possibile contaminazione virale
E. Van den Abbeel, 2007
Punti critici della
vitrificazione
Vitrificazione
Vantaggi:
È una procedura semplice
Costi ridotti
Facile addestramento dell’operatore
La percentuale di sopravvivenza è più alta in tutti gli stadi di
sviluppo embrionale
La vitrificazione nella letteratura scientifica
140
120
100
80
60
40
20
0
1990
R. Ciriminna, 2010
1992
1994
1996
1998
2000
2002
2004
2006
Congelamento lento: clinical outcome
A. Borini, 2007
Vitrificazione: clinical outcome
Congelamento Lento VS Vitrificazione
Danni intracellulari
Congelamento Lento
Vitrificazione
Perdita di microtubuli
Danneggiamento dei
microtubuli
Aneuploidie
Aneuploidie
Congelamento Lento VS Vitrificazione
Crioconservazione degli embrioni
Sospensione delle attività biologiche
-196°C
Destino dell’acqua cellulare
Formazione di ghiaccio intracellulare
Raffreddamento in equilibrio
Congelamento Lento
E. Van den Abbeel, 2007
Raffreddamento non in equilibrio
Vitrificazione
Nessuna differenza tra ovociti freschi e
vitrificati?
600
pazienti
riceventi
Ana Cobo, 2010
300 ovociti
freschi
300 ovociti
vitrificati
Gravidanze
evolutive
41,7%
Gravidanze
evolutive
43,7%
Il gamete femminile
Metafase II
Elevato rapporto
superficie/volume
La sopravvivenza cellulare allo scongelamento e
l’assenza di degenerazione non sono sempre
garanzia di funzionalità ed integrità dell’ovocita
Possibili danni alla cellula durante la
crioconsevazione
indurimento
della zona
pellucida
permeabilità
della
membrana
degenerazione del
PB
depolimerizzazione
del fuso
danni al
citoscheletro
e al
citoplasma
impatto sulla fisiologia dell’ovocita
Efficienza
La crioconservazione degli ovociti è stata considerata
una tecnica a bassa efficienza a causa della bassa
sopravvivenza, fertilizzazione e capacità di divisione
dell’embrione.
Il miglioramento dei protocolli di congelamento ha
reso la tecnica più soddisfacente sopravvivenza degli
ovociti allo scongelamento.
Con l’introduzione dell’ICSI sono migliorati i risultati
anche in termini di fecondazione, di formazione degli
embrioni e di impianto.
Sopravvivenza ovocitaria
Porcu et al., 2000
Fabbri et al., 2001
Fosas et al., 2003
Chen et al., Borini et al. 2005
sopravvivenza 54%
sopravvivenza 82%
sopravvivenza 89%
sopravvivenza 75-80%
La sopravvivenza deve coincidere con la
conservazione dei fattori morfo-funzionali
essenziali verificabili oggettivamente
Considerazioni
• Bambini sani, cromosomicamente normali, sono nati
da ovociti congelati (300)
• Il congelamento degli ovociti dovrebbe esser
considerata una tecnica di routine nei programmi di
PMA
• La vitrificazione sembra essere una tecnica molto
promettente (economica, semplice e di facile
acquisizione)
• L’efficienza clinica della vitrificazione dovrebbe essere
misurata come percentuale di gravidanza,
riproducibilità e gestibilità della tecnica
L. De Santis, 2010
Ovocita Pronucleato - 2PN
Vantaggi
motivi etici e legali
massimizzare le possibilità di gravidanza da un singolo
ciclo di stimolazione
unicellularità
migliore resistenza, rispetto all’ovocita, poiché i
cromosomi non sono disposti in piastra metafasica ma
sono protetti all’interno di ciascun pronucleo
maggiore tasso di sopravvivenza allo scongelamento
basso impatto sulla competenza cellulare
semplicità nel valutare il successo tramite il passaggio
dalla singamia alla prima divisione
G.M. Jones, 2009
Ovocita pronucleato - 2PN
Svantaggi
Crioconservazione di un gran numero di unità con un basso
potenziale di sviluppo ; ma ciò può essere migliorato
congelando solo ovociti fecondati con un buon PN score
Ridotta possibilità di selezione morfologica cellulare
embrionale
Aumentare il numero di cicli prima di ottenere una gravidanza
Ottima organizzazione del personale del IVF lab
G.M. Jones, 2009
Timing del congelamento - 2PN
• La crioconservazione deve avvenire tra le
16-20h post-inseminazione, cioè durante la
fase G2 del ciclo cellulare.
• Non è possibile congelare durante la
singamia, cioè 23-26h post inseminazione,
allo stadio di una cellula.
G.M. Jones, 2009
Congelamento Lento VS Vitrificazione
2PN
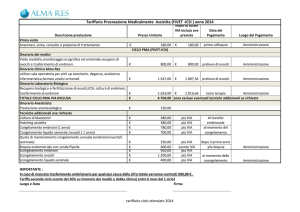
Metodo
N° 2PN
Sopravvivenza
(%)
Divisione
(%)
IR %
cong.
Hoover et al., 1997
C
761
718(94)
647 (85)
7%
Damario et al., 1999
C
724
657 (91)
650 (90)
20 %
Kattera et al., 1999
C
701
452 (64)
369 (53)
5%
Senn et al., 2000
C
1000
804 (80)
750 (75)
11 %
Selman et al., 2002
V
27
17 (67)
14 (52)
18 %
Isachenko et al., 2003
V
59
42 (71)
35 (59)
15 %
Veeck, 2004
C
1441
1101 (76)
997 (69)
17 %
Al-Hasani et al., 2007
V
339
302 (89)
243 (72)
16 %
Pubblicazione
C = Congelamento Lento;
V = Vitrificazione
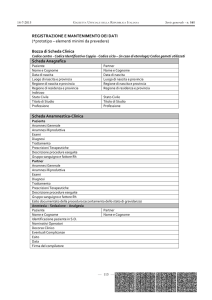
Fresh vs Frozen
2PN
N° 2PN
Frozen
%
Sopravvivenza
%
Divisione
% IR
Frozen
% IR
Fresh
Fugger et al.
1988
82
93 %
76 %
5%
3%
Miller et al.
1995
239
87 %
82 %
11 %
13 %
Damario et al.
2000
398
91 %
90 %
22 %
25 %
Pubblicazione
Selezione ovocitaria per la
crioconservazione embrionale
Valutazione dell’ovocita
Caratteristiche dell’ovocita
pronucleato / 2PN
K. Lundin, 2007
morfologia
assetto nucleare
PN score
Selezione embrionale per la
crioconservazione
Clivaggio
Early Cleavage 25-27h
Numero di cellule 40-44 h
Morfologia
percentuale di frammenti
dimensione dei blastomeri
Numero di nuclei
no MNB
Stato Metabolico e Genetico
PGD
K. Lundin, 2007
Qualità cellulare
Caratteristiche
morfologiche,
nucleari,
metaboliche e genetiche dell’embrione
crioconservato
Sviluppo embrionale
Potenziale di impianto
Bambini in braccio
K. Lundin, 2007
Frozen Embryo Transfer (FET)
VS
Fresh Embryo Transfer (ET)
L’andamento delle gravidanze da FET è sovrapponibile alle
gravidanze da ET
Il tasso di gravidanze multiple è più basso per i FET
Il principale fattore che influenza il successo dei FET è l’età della
paziente al momento del prelievo ovocitario
Bassa incidenza di complicanze durante gravidanze singole
sovrapponibile alle gravidanze con embrioni freschi ( placenta
previa, rottura prematura delle membrane, morte endouterina)
D. Royère, 2007
Frozen Embryo Transfer (FET)
VS
Fresh Embryo Transfer (ET)
Il FET di embrioni di buona qualità, determina un notevole
aumento del tasso di gravidanza cumulativo.
Sebbene vi sia una diminuzione delle percentuali di gravidanza e
dell’I.R. nei FET, sintomo di qualità embrionale compromessa dal
congelamento, il successo complessivo di transfer con embrione
di buona qualità è paragonabile al ET
D. Royère, 2007
Crioconservazione della blastocisti
La blastocisti contiene un elevato numero di
piccole cellule
Selezione di embrioni al più alto potenziale di
impianto
Vantaggio criobiologico e citogenetico
Case report
Età 38 anni
Trombofilia
Partner normozoospermico
Inseminati 7 ovociti
Fertilizzati 5/7
Transfer DAY 3
Top Quality embryo
2 embrioni residui
crioconservati in DAY 5
Scongelati 6 mesi dopo
1 CG 1 BHF
Sometimes
nature needs a
little help
Grazie per
l’attenzione!