Corso di Laurea Specialistica in Biologia Molecolare
Chimica Bioorganica
Prova scritta – 11/7/2006
A
B
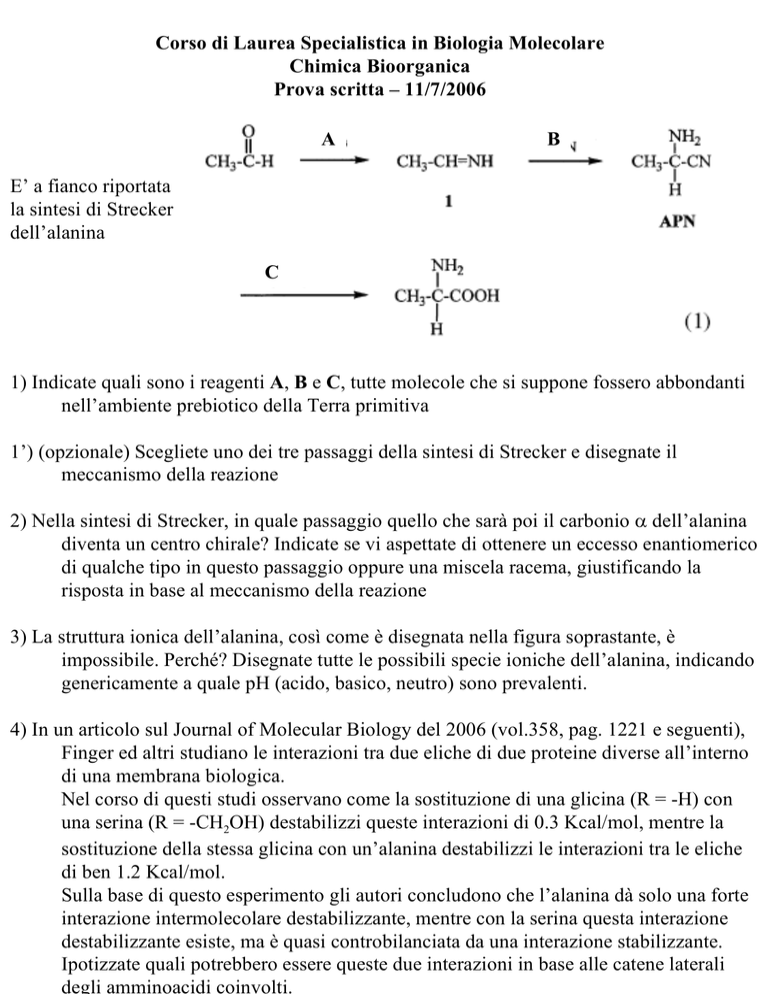
E’ a fianco riportata
la sintesi di Strecker
dell’alanina
C
1) Indicate quali sono i reagenti A, B e C, tutte molecole che si suppone fossero abbondanti
nell’ambiente prebiotico della Terra primitiva
1’) (opzionale) Scegliete uno dei tre passaggi della sintesi di Strecker e disegnate il
meccanismo della reazione
2) Nella sintesi di Strecker, in quale passaggio quello che sarà poi il carbonio α dell’alanina
diventa un centro chirale? Indicate se vi aspettate di ottenere un eccesso enantiomerico
di qualche tipo in questo passaggio oppure una miscela racema, giustificando la
risposta in base al meccanismo della reazione
3) La struttura ionica dell’alanina, così come è disegnata nella figura soprastante, è
impossibile. Perché? Disegnate tutte le possibili specie ioniche dell’alanina, indicando
genericamente a quale pH (acido, basico, neutro) sono prevalenti.
4) In un articolo sul Journal of Molecular Biology del 2006 (vol.358, pag. 1221 e seguenti),
Finger ed altri studiano le interazioni tra due eliche di due proteine diverse all’interno
di una membrana biologica.
Nel corso di questi studi osservano come la sostituzione di una glicina (R = -H) con
una serina (R = -CH2OH) destabilizzi queste interazioni di 0.3 Kcal/mol, mentre la
sostituzione della stessa glicina con un’alanina destabilizzi le interazioni tra le eliche
di ben 1.2 Kcal/mol.
Sulla base di questo esperimento gli autori concludono che l’alanina dà solo una forte
interazione intermolecolare destabilizzante, mentre con la serina questa interazione
destabilizzante esiste, ma è quasi controbilanciata da una interazione stabilizzante.
Ipotizzate quali potrebbero essere queste due interazioni in base alle catene laterali
degli amminoacidi coinvolti.
I fruttani sono polimeri del fruttosio presenti in tutti i vegetali, in cui le unità di D-fruttosio,
in forma furanosidica, sono generalmente legate tra loro mediante legame glicosidico β(2>1)
5) Disegnate la generica struttura di un fruttano, sapendo che il D-fruttosio è il chetoesoso
con i centri chirali aventi la stessa configurazione del D-glucosio
6) Quali sono le tutte le possibili strutture che assume il D-fruttosio libero in soluzione?
Qual è quella prevalente?
7 ) Il D-fruttosio libero, nonostante che sia un chetoso, è reattivo ai saggi per gli zuccheri
riducenti, che richiedono la presenza del gruppo aldeidico. Spiegate in quali condizioni
avviene la reazione di riarrangiamento che trasforma il D-fruttosio in un aldoso, in quali
aldosi si trasforma e (7’-opzionale) scrivete il meccanismo della reazione.
La thiotepa è un potente agente anticancro che
esplica la sua azione tramite l’alchilazione del
DNA
Il meccanismo con cui reagisce questa
molecola è rappresentato nella figura a
fianco, con un nucleofilo generico Nu
che rappresenta una base del DNA:
S
S
N
P
N
N
P
N
N
N
u
N
+
N
u
8) Qual è la base del DNA più sensibile a processi di alchilazione? Su quale/i atomi?
9) Quali sono gli effetti di un’alchilazione sul DNA e perché secondo voi agenti alchilanti,
ed in generale molecole in grado di danneggiare il DNA, possono essere usati come agenti
anticancro?
10) La Ciclofosfammide è un farmaco anticancro che agisce con un meccanismo
praticamente identico alla Thiotepa, ma è più efficace perché più reattiva con il DNA.
La specie reattiva con il DNA non è direttamente la Ciclofosfammide, ma un suo derivato.
Cl
H
N
+
O P R N
O
Derivato reattivo
In base al meccanismo della reazione
come è rappresentato sopra, e
considerando la struttura del derivato
reattivo, perché secondo voi la
Ciclofosfammide è un farmaco più
efficace della Thiotepa?
10’) (opzionale) Scrivete il meccanismo che porta dalla ciclofosfammide alla specie reattiva
con il DNA.


![mutazioni genetiche [al DNA] effetti evolutivi [fetali] effetti tardivi](http://s1.studylibit.com/store/data/004205334_1-d8ada56ee9f5184276979f04a9a248a9-300x300.png)
![ESTRAZIONE DNA DI BANANA [modalità compatibilità]](http://s1.studylibit.com/store/data/004790261_1-44f24ac2746d75210371d06017fe0828-300x300.png)






![(Microsoft PowerPoint - PCR.ppt [modalit\340 compatibilit\340])](http://s1.studylibit.com/store/data/001402582_1-53c8daabdc15032b8943ee23f0a14a13-300x300.png)

