1
Influenza aviaria
L’Influenza aviare (AI) è un’infezione e/o malattia virale sostenuta da virus influenzali di tipo A, membri della
famiglia Orthomyxoviridae. L’infezione causa sindromi variabili da un’infezione asintomatica ad una malattia
respiratoria e calo dell’ovodeposizione, fino ad una grave forma sistemica, con il 100% di mortalità.
Eziologia
Famiglia Orthomyxoviridae, Genere Influenzavirus A, specie influenza A virus.
Nelle specie aviarie sono stati isolati solo virus influenzali di tipo A.
Struttura del virus
Presenta un envelope con proiezioni superficiali o peplomeri (lunghezza 10-14 nm, diametro 4-6 nm),
rappresentate dalle glicoproteine emoagglutinina (HA o H) e neuraminidasi (NA o N). Il genoma è costituito da un
ssRNA a polarità negativa diviso in 8 segmenti veicolanti 10 geni codificanti per 10 proteine virali, di cui 8 strutturali
(NP, PB1, PB2, PA, M1, M2, HA, NA) e 2 non strutturali (NS1 e NS2).
Classificazione dei ceppi
Genere o tipo: si identifica con reazioni sierologiche delle proteine NP e M1 nel test AGID → Influenzavirus tipo
A.
Sottotipo: si identifica con reazioni sierologiche delle glicoproteine HA e NA nei test HI e NI → 17 sottotipi HA
(H1 → H17) e 10 sottotipi NA (N1 → N10). Tutti i virus ad alta patogenicità appartengono ai sottotipi H5 e H7. Nei
pipistrelli è stata identificata H17N10.
Uomo
Cavallo
Suino
Volatili
Uomo
Cavallo
Suino
Volatili
1
+
2
+
+
+
+
1
+
2
+
+
+
+
+
3
+
+
+
+
4
5
+
6
+
+
+
3
4
5
6
+
+
+
+
Emoagglutinina
7
8
9
+
+
+
+
+
+
Neuraminidasi
7
8
9
+
+
+
+
10
11
12
13
14
15
16
+
+
+
+
+
+
+
+
Variabilità antigenica
La variabilità è data da:
1. “Shift” antigenico (salto antigenico) → riassortimento genetico tra geni di due virus influenzali che infettano la
stessa cellula, con l’acquisizione di nuovi antigeni HA e NA (ma non solo) che porta alla comparsa di un nuovo
sottotipo;
2. “Drift” antigenico (deriva antigenica) → mutazione puntiforme dei geni codificanti le glicoproteine HA e NA, che
porta alla comparsa di una variante antigenica.
http://quizmedicinaveterinaria.altervista.org/index.html
2
Patogenicità dei virus influenzali aviari
Possiamo dividere i virus dell’Influenza aviare in:
1. a bassa patogenicità (LPAI) → malattia di modesta gravità, caratterizzata da sintomatologia prevalentemente
respiratoria e lesioni a carico dell’apparato respiratorio e riproduttivo; tutti i sottotipi (H1 - H16);
2. ad alta patogenicità (HPAI) → malattia estremamente grave, caratterizzata da un’infezione generalizzata, che
provoca il 100% di mortalità in pochi giorni (entro 48 h); solo sottotipi H5 e H7.
Le basi molecolari della patogenicità risiedono nella proteina H, il cui precursore glicoproteico H0 mediante
“cleavage” viene scisso in H1 ed H2 con la mediazione di proteasi (tripsina) della cellula ospite con produzione di
particelle virali infettanti. Avremo quindi che:
1. virus a bassa patogenicità → “cleavage” da parte di proteasi che riconoscono un singolo aminoacido basico al
terminale carbossilico dell’HA1 (arginina) e un sito di glicosilazione al residuo aa 13 (es. enzimi tripsina-like).
L’infezione avviene solo nel tratto respiratorio e intestinale. I virus a bassa patogenicità possiedono un solo
aminoacido basico nel sito di “cleavage” (sequenze aminoacidiche H7: -PEIPKGR*GLF-, -PENPKGR*GLF;
2. virus ad alta patogenicità → “cleavage” da parte di proteasi (furina-like) ubiquitarie presenti in una grande varietà
di cellule e tessuti, compreso il sistema nervoso e cardiovascolare; l’Infezione è perciò sistemica e fatale. I virus
ad alta patogenicità possiedono più aminoacidi basici nel sito di “cleavage” (sequenze aminoacidiche H7:
-PEIPKKKKR*GLF-, -PETPKRKRKR*GLF-, -PEIPKKREKR*GLF-, -PETPKRRRR*GLF-).
*K = lisina; R = arginina
Recentemente è stato dimostrato che alla base della scindibilità dell’HA non concorre solo la sequenza del sito di
“cleavage”, ma anche la presenza di carboidrati nelle sue vicinanze (catena glucidica laterale che influenza la
sensibilità dell’HA a proteasi ubiquitarie nei ceppi a bassa patogenicità).
Genesi dei virus ad alta patogenicità
http://quizmedicinaveterinaria.altervista.org/index.html
3
Sensibilità ad agenti fisico-chimici
Viene inattivata a 56°C in 3 h, a 60°C in 30 min e dal pH acido. Non sopravvive ad alcuni agenti chimici:
sodidodecilsolfate desossicolato, aldeidi (formaldeide e glutaraldeide), β-propiolattone, etilenamina, fenoli, ioni
ammonio (ammonio quaternario), agenti ossidanti (ipoclorito di sodio), acidi diluiti ed idrossilammina.
Rimane vitale per lunghi periodi nei tessuti, feci (7 gg. a 20°C; 30-35 gg. a 4°C; 105 gg. in inverno in feci liquide),
acqua (4 gg. a 22°C; 30 gg. e piu a 0°C), materiale organico(11 gg. a temperatura ambiente).
Patogenesi
La Direttiva 2005/94/CEE del 20 dicembre 2005 relativa a misure comunitarie di lotta contro l’influenza aviaria e
che abroga la direttiva 92/40/CEE ci dà le Definizioni UE:
1. per “Influenza aviare” si intende un’infezione del pollame e di altri volatili in cattività causata da un virus
influenzale A dei sottotipi H5 e H7, oppure avente un indice di patogenicità intravenosa (IVPI) maggiore di 1,2
nei pulcini di 6 settimane;
2. per “Influenza aviare ad alta patogenicità” si intende un’infezione del pollame e di altri volatili in cattività causata
da un virus dell’influenza aviaria dei sottotipi H5 e H7 con una sequenza genomica che codifica per molteplici
amminoacidi basici a livello del sito di clivaggio dell’emoagglutinina, analoga a quella osservata per altri virus
dell’HPAI, indicativa del fatto che l’emoagglutinina può essere clivata da una proteasi ubiquitaria dell’ospite,
oppure un virus dell’influenza aviaria avente un indice di patogenicità intravenosa superiore a 1,2 nei pulcini di
sei settimane.
3. per “Influenza aviare a bassa patogenicità” si intende un’infezione del pollame e di altri volatili in cattività
causata da virus dell’influenza aviaria dei sottotipi H5 H7, non rientrante nella definizione di cui al punto
precedente.
La patogenesi prevede:
1. replicazione primaria nell’apparato respiratorio e digerente;
2. infezione per inalazione ingestione;
3. invasione della sottomucosa e penetrazione nei capillari;
4. replicazione nelle cellule endoteliali e diffusione per via ematica linfatica;
5. infezione e replicazione sistemica.
I primi 2 punti sono comuni sia per LPAI che per HPAI; gli ultimi tre sono esclusivi di HPAI.
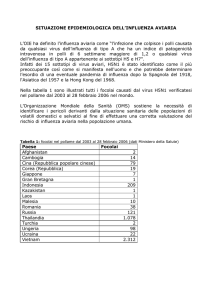
Epidemiologia
Incidenza e distribuzione
L’incidenza e la distribuzione dei virus AI varia a seconda della regione geografica, specie, età, periodo dell’anno,
sistemi ambientali ed sistemi di allevamenti. AI è endemica in molti Paesi in via di sviluppo (ad es. H9N2 ed H5N1 in
Asia). I virus AI hanno una distribuzione mondiale (Africa, Asia, Australia, Europa, Nord e Sud America, Antartide).
Epidemie di IA in Italia nel 2007-2011
Possibili connessioni:
1. vendita di animali (es. galline a fine ciclo contro sessi);
http://quizmedicinaveterinaria.altervista.org/index.html
4
2. approvvigionamento di mangime da stessi rivenditori (camion come fonte di diffusione);
3. personale del settore industriale che detiene volatili “rurali” (Bonfanti et al., 2009);
4. altri…non legali?
Spettro d’ospite
I virus AI sono stati isolati da oltre 150 specie di uccelli selvatici (18 ordini). La più frequente fonte di virus sono
gli uccelli acquatici, appartenenti agli ordini Anseriformes (anatre tuffatrici e di superficie) e Charadriiformes
(gabbiani e limicoli), che sono considerati i “reservoir” asintomatici di tutti i virus AI perché presentano:
1. elevato numero di isolamenti segnalati in tutto il mondo;
2. elevata resistenza verso ceppi patogeni per altre specie (tacchino e pollo);
3. elevata frequenza di infezioni virali miste (riassortimento genetico);
4. lungo periodo di eliminazione virale (oltre un mese);
5. replicazione virale, soprattutto a livello intestinale, da cui deriva una elevata carica infettante delle feci (oltre 100
milioni di particelle virali in un solo grammo di feci);
6. comportamento gregario;
7. animali socievoli (condividono il territorio con altre specie);
8. migratori (diffusione dell’infezione);
9. molti (germano reale) vivono in aree antropizzate (contatti con animali allevati).
Trasmissione
La trasmissione avviene per via orizzontale per contatto diretto (da animale infetto ad animale sensibile) o per
contatto indiretto tramite aerosol-feci e vettori contaminati (uomo, attrezzature, acqua). La via verticale non è stata
dimostrata.
Introduzione e diffusione
L’introduzione primaria avviene con gli uccelli selvatici, la secondaria con l’uomo; tra le due ci sono connessioni
dovute alla circolazione dell’agente trasportato da: uomo stesso, altri uccelli, altri animali, acqua.
La diffusione è in funzione di:
1. ecologia del virus e consistenza delle specie selvatiche;
2. densità di allevamenti avicoli;
3. aspetti economici e gestionali dell’industria avicola → integrazione;
4. livelli di biosicurezza negli allevamenti industriali, rurali, free-range;
5. misure di sorveglianza e controllo: sorveglianza e movimenti di animali e prodotti (legale e illegale).
Diagnosi
Periodo di incubazione
Il periodo di incubazione varia da poche ore a 14 giorni (in media 3-5 gg.). La gravità della malattia e la comparsa
dei sintomi, delle lesioni anatomo- ed istopatologiche dipendono da:
1. ceppo virale;
2. specie, età, sesso e stato immunitario dell’ospite;
3. infezioni concomitanti da altri microrganismi;
4. condizioni ambientali (eccesso di ammoniaca e polvere);
5. via e dose di esposizione.
Morbilità e Mortalità
I tassi di morbilità e mortalità presentano un ampio range di variabilità
1. LPAI: morbilità elevata - mortalità bassa;
2. HPAI: morbilità e mortalità molto alte (fino al 100%).
http://quizmedicinaveterinaria.altervista.org/index.html
5
Sintomatologia
Influenza aviare ad alta patogenicità
Forma fulminante con morte improvvisa, preceduta da pochi o nessun segno clinico oppure da sintomi:
1. generalizzati: diminuita attività motoria, depressione, riduzione della vocalizzazione, diminuito consumo di acqua
e mangime;
2. respiratori: rantoli, eccessiva lacrimazione, sinusite;
3. nervosi: tremori della testa e del collo, incapacità di tenere la stazione eretta, torcicollo, opistotono ed altre
posizioni anomale di testa ed appendici;
4. altri: edema della testa e della faccia; emorragie sottocutanee con cianosi della cute, soprattutto della testa e dei
bargigli; diarrea; repentino calo dell’ovodeposizione (arresto in 6 gg.).
Influenza aviare a bassa patogenicità
Forma lieve addirittura inapparente con sintomi:
1. generalizzati: tendenza ad accalcarsi, penne arruffate, depressione, diminuita attività motoria, diminuito consumo
di acqua e mangime, raramente diarrea ed emaciazione;
2. respiratori lievi o gravi: tosse, starnuti, rantoli, eccessiva lacrimazione, sinusite;
3. altri: calo dell’ovodeposizione.
Quando sono presenti altri agenti (es. Metapneumovirus, NDV ed altri paramyxovirus aviari, Escherichia coli,
Pasteurella spp. micoplasmi) condizioni ambientali stressanti, la mortalità può aumentare fino al 60-70% e i segni
clinici diventare più gravi
Lesioni anatomo-patologiche
Influenza aviare ad alta patogenicità
Lesioni edematose, emorragiche e necrotiche agli organi e alla pelle. Quando la malattia è iperacuta, non si
osservano lesioni macroscopiche; in altri casi le lesioni consistono in gonfiore della testa, faccia, collo e zampe, per
edema sottocutaneo accompagnato da emorragie petecchiali ecchimotiche; edema periorbitale; emorragie, focolai
necrotici e cianosi delle zone prive di penne, soprattutto cresta e bargigli.
Le lesioni a carico degli organi sono rappresentate da emorragie sulle sierose mucose e focolai di necrosi nel
parenchima, soprattutto a livello di epicardio, muscoli pettorali, mucosa del pro ventricolo e ventriglio; focolai di
necrosi al pancreas, milza e cuore, occasionalmente al fegato ed ai reni; polmonite interstiziale focale diffusa con
edema oppure congestione emorragie; atrofia di timo e borsa di Fabrizio.
Influenza aviare a bassa patogenicità
Edema della mucosa tracheale, con congestione e occasionalmente emorragie (presenza di essudato da sierosa
caseoso, con occasionale occlusione delle vie respiratorie e conseguente asfissia); aerosacculite fibrinosa fibrino
purulenta (accompagnata da infezioni batteriche secondarie); gonfiore dei seni infraorbitali, con scolo nasale da
mucoso a muco-purulento; broncopolmonite fibrino-purulenta dovuta a patogeni secondari, quali Pasteurella
multocida ed Escherichia coli.
Peritonite catarrale fibrinosa ed “ovaro-peritonite”; enterite catarrale fibrinosa (ciechi intestino); ovidutto
edematoso, con essudato catarrale fibrinoso, prima di andare incontro all’involuzione, riduzione nella % di
deposizione del calcio nel guscio, uova deformi e fragili con perdita della pigmentazione; regressione dell’ovario, che
inizia con emorragie nei follicoli più grandi fino alla colliquazione; reni gonfi, con presenza di urati ai visceri;
pancreas indurito, con screziature pallide ed emorragie.
Diagnosi di laboratorio
http://quizmedicinaveterinaria.altervista.org/index.html
6
Decisione della Commissione 2006/437/CE che approva un manuale diagnostico per l’influenza aviaria
secondquantprevistdalla direttiva 2005/94/CE del Consiglio: la conferma dell’IA nel pollame e in altri volatili in
cattività deve avvenire conformemente alle procedure, ai metodi di campionamento e ai criteri di valutazione dei
risultati degli esami di laboratorio di cui al presente manuale diagnostico e deve basarsi su uno o più dei criteri
enunciati alle seguenti lettere a), b) e c):
a) riconoscimento del virus infettante, dell’antigene di materiale genetico specifico nei campioni di tessuti, organi,
sangue escreti di pollame altri volatili;
b) riconoscimento dei segni clinici della malattia e delle relative lesioni post-mortem nei volatili;
c) dimostrazione di una risposta anticorpale specifica nei campioni ematici di tali volatili.
Schema delle fasi diagnostiche dell’AI Manuale diagnostico (Decisione 2006/437/CE)
1.
2.
1.
2.
3.
Test molecolari
RT-PCR tradizionale → permette un riconoscimento rapido e l’identificazione del tipo (NP M) e sottotipo (H5 e
H7) in campioni clinici;
rRT-PCR → consente una diagnosi più rapida e sensibile (risultati in meno di 3 ore).
Sierologia:
immunodiffusione in gel di agar (AGID) → identifica gli anticorpi tipo-specifici (NP e M);
inibizione dell’emoagglutinazione (HI) → identifica gli anticorpi sottotipo-specifici (HA);
ELISA:
a. risposta anticorpale umorale, sistemica e mucosale (poco studiata), a seguito di infezione o vaccinazione;
b. risposta sistemica con IgM dopo 5 gg. p.i., seguita dalla risposta con IgG;
c. anticorpi verso le glicoproteine HA e NA neutralizzanti e protettive (anti-HA > anti-NA) - durata della
protezione sconosciuta (30 settimane in ovaiole);
d. cross-protezione nell’ambito dello stesso sottotipo HA e NA, no cross-protezione fra sottotipi HA e NA
differenti;
e. risposta immunitaria verso le proteine interne NP e M non protettiva (ma si pensa che esse siano coinvolte
nell’immunità cellulo-mediata, prima protezione p.i.);
f. immunità passiva sconosciuta.
Strategie di diagnosi dell’AI
http://quizmedicinaveterinaria.altervista.org/index.html
7
Caratterizzazione del virus
Indice di patogenicità intravenosa (IPIV)
Inoculazione di 0,1 di virus diluito (diluizione 1:10 di liquido allantoideo con titolo HA >1:16) in 10 polli SPF o
sieronegativi di 6 settimane. Un IPIV superiore a 1,2 indica la presenza di un virus HPAI.
Sequenziamento nucleotidico dell’HA
Determina se sono presenti aminoacidi basici multipli a livello del sito di cleavage della proteina precursore
dell’emoagglutinina.
Controllo
Occorre fare il controllo su:
1. volatili selvatici → monitoraggio e sorveglianza attiva/passiva (tecniche di biosicurezza);
2. allevamenti avicoli:
a. misure di biosicurezza;
b. sorveglianza;
c. identificazione precoce di focolai di malattia;
d. predisposizione piani di emergenza;
e. densità allevamenti;
http://quizmedicinaveterinaria.altervista.org/index.html
8
f. vaccinazione.
I piani di monitoraggio dell’IA in Europa sono programmi annuali e obbligatori che vengono presentati dai singoli
Stati membri alla Commissione che, previa valutazione, li approva mediante “Decisione”. Sono cofinanziati dalla
Comunità europea. Dal 2002 gli Stati membri predispongono e realizzano specifiche attività di sorveglianza
obbligatorie sull’influenza aviaria nel pollame domestico e, in accordo con la Direttiva 2005/94/CE, anche
nell’avifauna selvatica.
Finalità dei piani di sorveglianza
1.
2.
Sorveglianza attiva volta a rilevare:
virus dell’influenza aviaria a bassa patogenicità (LPAI) dei sottotipi H5 e H7 nei gallinacei (polli, tacchini,
faraone, fagiani, pernici e quaglie) e nei ratiti, integrandaltri sistemi di individuazione precoce esistenti;
virus della LPAI, sottotipi H5 e H7 e virus dell’influenza aviaria ad alta patogenicità (HPAI) negli uccelli
acquatici domestici (anatre, oche e germani reali per la fornitura di selvaggina da ripopolamento). Ora solo H5N1
HPAI
Decisione 2010/367/UE:
sorveglianza basata sul campionamento rappresentativo;
sorveglianza basata sui rischi.
1.
2.
Monitoraggio dei volatili domestici
Allevamenti bersaglio:
1. sono sottoposti al piano gli allevamenti industriali, gli allevamenti di svezzamento, quelli di selvaggina, comprese
aziende faunistico-venatorie e agri-faunistiche;
2. in base alla valutazione del rischio vengono individuati anche allevamenti rurali da sottoporre a controlli
sierologici in concomitanza con le fasi migratorie.
Specie bersaglio:
1. sono soggette a campionamento tutte le specie di volatili d’allevamento, comprese oche e anatre, testando sia i
riproduttori che gli animali da carne, oltre alle ovaiole per uova da consumo;
2. sono esclusi dal piano di monitoraggio per la breve vita produttiva i broiler e le quaglie da carne;
3. gli allevamenti di tacchini da carne e di oche e anatre possono essere monitorati anche pressi macelli.
Sorveglianza basata sul rischio
Intensificazione controlli nelle Regioni Veneto, Lombardia, Emilia-Romagna e Piemonte:
1. tacchini da carne: prelievo sierologico di 5 animali per capannone (10 nel caso in cui l’allevamento fosse
costituito da un unico capannone) preferibilmente prima del carico verso il macello sia per i maschi che per le
femmine;
2. anatre e oche da riproduzione: prelievo virologico di 40/50 animali per allevamento con cadenza almeno
quadrimestrale;
3. anatre e oche da ingrasso: prelievo sierologico preferibilmente al macello in azienda di 40/50 animali per
allevamento garantendo un controllo per ciclo produttivo;
4. allevamenti da riproduzione e di ovaiole per la produzione di uova da consumo: prelievo di 5 campioni di sangue
per capannone (10 nel caso l’allevamento sia costituito da un unico capannone) con cadenza quadrimestrale,
possibilmente in prossimità delle eventuali movimentazioni (accasamenti di pollastre per la deposizione e carico
al macello);
5. struzzi: prelievo sierologico in allevamento o al macello di almeno 5 animali per allevamento con cadenza
semestrale tenendo conto dei fattori di rischio di introduzione (allevamenti free-range);
6. altri volatili da carne (eccetti broiler e le quaglie): prelievo sierologico preferibilmente al macello o in azienda di
almen10 animali per allevamento e per ciascun ciclo produttivo;
7. selvaggina: prelievo di 5 campioni di sangue per voliera (10 nel caso l’allevamento sia costituito da una unica
voliera) con cadenza trimestrale.
Altre regioni a minor rischio su base campionaria: anatre e oche da ingrasso e da riproduzione, tacchini da carne e
da riproduzione, polli riproduttori, galline ovaiole sia allevate al chiuso che free-range, riproduttori selvaggina.
Campionamento delle aziende
Numero di aziende di pollame da campionare (esclusi gli allevamenti di tacchini, anatre, oche e quaglie
riproduttori):
http://quizmedicinaveterinaria.altervista.org/index.html
9
Numero di aziende di tacchini, anatre, oche e riproduttori di quaglie da sottoporre a campionamento
Allevamenti rurali e free-range
Sulla base del rischio dovranno essere individuati allevamenti all’aperto che a cadenza semestrale (in primavera e
in autunno in concomitanza con le fasi migratorie) verranno sottoposti a campionamento. Le numerosità e le tipologie
di animali da campionare saranno definite sulla base delle specie allevate e delle tipologie produttive.
Svezzatori/commercianti
Il campionamento dovrà essere stabilito in base alle specie allevate e alle caratteristiche dei flussi commerciali. A
tal riguardo il Ministero della Salute ha emanato un provvedimento definito sulla base del rischio
Sorveglianza “sindromica”- sospetto di AI
Il sospetto si basa su:
1. segni clinici variabili: ceppo virale, specie animale, età, sesso…;
2. una mortalità improvvisa ed elevata del pollame.
“Dato che una diagnosi rapida dell’HPAI dell’LPAI provocata dai sottotipi H5 e H7 è estremamente importante
nelle prime fasi di lotta e di eradicazione, in presenza di problemi respiratori, problemi nella deposizione delle uova e
a fronte di un’elevata mortalità del pollame è necessario prendere sempre in considerazione l’IA nella diagnosi
differenziale; occorre inoltre sottoporre ad accertamenti di laboratorio campioni appropriati.” (da Manuale
Diagnostico, decisione 2006/437/CE).
La responsabilità è del veterinario aziendale.
Struttura del sistema di sorveglianza
Il monitoraggio dei volatili selvatici si basa sulla sorveglianza:
1. passiva → rivolta ad identificare la presenza di virus HPAI H5N1 (ceppo asiatico e sue varianti);
2. attiva → volta a rilevare la presenza di virus LPAI.
Occorre determinare la prevalenza e le caratteristiche biologiche dei virus influenzali isolati nelle popolazioni
campionate.
La sorveglianza passiva su animali morti o malati dei volatili selvatici si attua in funzione di:
1. aree con aumenti dell’incidenza di morbilità e mortalità dei volatili;
2. aree in prossimità di coste, zone umide, allevamenti di pollame;
3. segnalazioni di mortalità anomale;
4. identificazione specie ad “alto rischio”.
L’intensità della sorveglianza passiva è sempre in funzione della situazione epidemiologica internazionale. Viene
intensificata qualora nei Paesi confinanti sia stata accertata la presenza di H5N1. La Commissione fornisce una lista
aggiornata delle specie rinvenute positive al virus H5N1 negli Stati Membri.
Non appena possibile, tutti i campioni raccolti nel quadro della sorveglianza dell’influenza aviaria nei volatili
selvatici devono essere analizzati mediante metodiche molecolari.
PCR gene M → test rapido dei positivi all’H5 (da eseguire comunque entro due settimane) → l’analisi del sito di
clivaggio → Se HPAI H5 devono essere rapidamente effettuate ulteriori analisi per determinare il tipo N
http://quizmedicinaveterinaria.altervista.org/index.html
10
H5N1 HPAI in volatili selvatici in Italia nel 2006 è stato ritrovato in: 16 cigni selvatici, 1 poiana, 1 gallo sultano, 1
germano reale.
Comune
Bruzzano
Zeffiro
Vernole
Rodi
Garganico
Giovinazzo
Catania
Mineo
Catania
Catania
Manduria
Manduria
Ugento
Pizzo
Riposto
Mascali
Melilli
Panicale
Provincia
Reggio
Calabria
Lecce
Specie
N volatili
Data sospetto Data conferma
Latitudine
Longitudine
Cigni
1
14/02/2006
22/02/2006
+38° 02’’ 00’’ +16° 05’’ 00’’
Cigni
1
12/02/2006
14/02/2006
+40° 17’’ 00’’ +18° 18’’ 00’’
Foggia
Cigni
1
13/02/2006
14/02/2006
+41° 55’’ 00’’ +15° 53’’ 00’’
Bari
Catania
Catania
Catania
Catania
taranto
Taranto
Lecce
Vibo valentia
Catania
Catania
Siracusa
Perugia
Cigni
Cigni
Cigni
Gallo sultano
Poiana
Cigni
Cigni
Cigni
Cigni
Cigni
Cigni
Cigni
Germano
1
1
4
1
1
1
1
1
1
1
1
1
1
04/02/2006
10/02/2006
12/02/2006
10/02/2006
10/02/2006
18/02/2006
05/02/2006
07/02/2006
07/02/2006
02/02/2006
02/02/2006
02/02/2006
13/02/2006
17/02/2006
22/02/2006
19/02/2006
19/02/2006
19/02/2006
25/02/2006
11/02/2006
12/02/2006
11/02/2006
11/02/2006
11/02/2006
11/02/2006
19/02/2006
+41° 11’’ 00’’
+37° 30’’ 00’’
+37° 16’’ 00’’
+37° 30’’ 00’’
+37° 30’’ 00’’
+40° 24’’ 00’’
+40° 24’’ 00’’
+39° 56’’ 00’’
+38° 44’’ 00’’
+37° 44’’ 00’’
+37° 45’’ 00’’
+37° 11’’ 00’’
+43° 04’’ 00’’
+16° 40’’ 00’’
+15° 06’’ 00’’
+14° 42’’ 00’’
+15° 06’’ 00’’
+15° 06’’ 00’’
+17° 38’’ 00’’
+17° 38’’ 00’’
+18° 10’’ 00’’
+16° 10’’ 00’’
+15° 12’’ 00’’
+15° 12’’ 00’’
+15° 07’’ 00’’
+12° 03’’ 00’’
Nuova direttiva comunitaria per il controllo e l’eradicazione dell’influenza aviaria direttiva 2005/94/CE del 20
dicembre 2005, relativa a misure comunitarie di lotta contro l’influenza aviaria e che abroga la direttiva 92/40/CEE:
1. gestione del sospetto/focolaio confermato;
2. misure da applicare nelle aziende a contatto e zone di protezione/sorveglianza;
3. operazioni di pulizia e disinfezione e ripopolamento;
4. vaccinazione d’emergenza e preventiva;
5. laboratori nazionali di riferimento;
6. esami di laboratorio per la diagnosi – manuale diagnostico;
7. piani di emergenza nazionali.
Sopralluogo in allevamento
1.
2.
3.
4.
5.
6.
Iniziale acquisizione di informazioni:
specie, numero e tipo volatili presenti;
anamnesi patologica;
numero e ubicazione ricoveri;
altre aziende stesso proprietario;
recenti acquisti vendite di volatili;
visitatori.
Accertamento malattia
Anamnesi:
1. sintomatologia clinica (attività respiratoria; caratteristiche delle feci e sintomatologia nervosa);
2. morbilità e mortalità;
3. lesioni anatomopatologiche;
4. stima periodo di tempo trascorso dall’inizio della malattia.
Prelievo campioni (tamponi cloacali, tratti di intestino in toto, organi respiratori come polmone e trachea, animali
interi, sangue in fase acuta e a distanza di 2-3 settimane) e loro immediato invio al laboratorio.
Per i tamponi usare materiale del Kit n°2 e seguire protocollo di cui all’Allegato 8 e 9, accompagnati da scheda
prelievo (Allegato 10). Il materiale va confezionato in barattoli a chiusura ermetica e sacchetti di plastica; recapitarli
quanto prima all’IZS.
Se un allevamento è sospetto occorre fare:
1. censimento e registrazione volatili;
2. sequestro sanitario;
3. evitare che il personale dell’azienda visiti altri
allevamenti (dichiarazione di impegno);
4. esecuzione indagine epidemiologica.
http://quizmedicinaveterinaria.altervista.org/index.html
11
1.
2.
3.
1.
2.
3.
4.
5.
Si farà quindi il tracing (rintraccio dei movimenti); il successo di questa indagine è legata alla:
identificazione dei gruppi infetti;
registrazione dei movimenti in entrata ed uscita dal focolaio;
collaborazione dell’allevatore.
Se il focolaio è ufficialmente confermato bisognerà fare:
comunicazione a ministero e regione e osservatorio epidemiologico;
emanazione ordinanze già predisposte;
valutazione indennizzo (animali, attrezzature, alimenti, ecc.);
estinzione focolaio:
a. abbattimento e distruzione volatili sia per LPAI che per HPAI;
b. distruzione materiali e rifiuti contaminati;
c. lavaggio e disinfezione;
gestione zone di restrizione:
a. censimento aziende che detengono volatili;
b. vigilanza sistematica negli allevamenti (precoce identificazione dei focolai, ...);
c. controllo movimenti.
Zone di restrizione
1.
2.
3.
4.
HPAI: zona protezione (3 Km) e zona di sorveglianza (10 KM).
LPAI: zona di restrizione (almeno 1 Km).
Sono istituite con la finalità di:
delimitare le aree (gli allevamenti) a rischio di infezione;
evitare un’ulteriore diffusione del contagi(restrizione movimentazione animali e divieto fiere, mercati, esposizioni
e raduni, salvo autorizzazione dell’autorità competente);
consentire una rapida individuazione di altri focolai di malattie (monitoraggio aziende avicole commerciali);
garantire la completa eradicazione dell’infezione.
Abbattimento degli animali-Regolamento (CE) N. 1099/2009
È opportuno che gli operatori il personale addetto all’abbattimento adottino provvedimenti necessari a evitare
ridurre al minimo l’ansia e la sofferenza degli animali durante il processo di macellazione abbattimento.
Allegato 1: elenco dei metodi di stordimento e relative caratteristiche
1. stordimento e morte per asfissia – biossido di carbonio (velocità di flusso, concentrazione gas per volatili collo
lungo);
2. altri metodi: monossido di carbonio (asfissia), gas inerti, iniezione di farmaci (associazione curarico- narcotico
anestetico), elettronarcosi;
3. decapitazione e dislocazione del collo:
a. distensione e torsione manuale meccanica del collo che provocano un’ichemia cerebrale;
b. volatili fino a 5 Kg;
c. non utilizzati di routine, solo per volatili malati per piccoli gruppi (al massimo 70 polli/giorno);
http://quizmedicinaveterinaria.altervista.org/index.html
12
d. anche utilizzata la pinza di Burdizzo;
e. personale addestrato.
Distruzione animali
La distruzione si effettua tramite interramento, incenerimento, trasformati in un impianto di trasformazione
riconosciuto dalla Normativa di riferimento: (Reg. CE 1774/02), (Reg. CE 811/2003).
Misure di eradicazione Direttiva 2005/94/CE
Deroga in base all’art. 40: alcuni volatili non sono stati soppressi in quanto appartenenti a specie rare in via di
estinzione (elenchi CITES); 3 focolai: Fiesso Umbertiano (RO) (25 volatili); Filago (BG) (19 volatili) e Pancalieri
(TO) (200 volatili); controlli effettuati secondo quanto previsto dal manuale diagnostico (Decisione 2006/437/CE)
Volatili presenti in allevamento
Al momento del campionamento 2140 volatili di varie specie/razze di cui 25 considerati (secondo indicazioni del
CITES Roma) a rischio di estinzione.
Specie/razza
Gru coronata grigia
Gru coronata nera
Gru antigone
Gru vipio
Gru paradisea
Gru canadese
Gru damigella di numidia
Gru linford
Oca collo rosso
Cicogna europea
Cacatua gallerita eleonora
Cacatua goffini corella
Amazzone fronte gialla
Amazzone fronte azzurra
Totale
N.
3
2
2
2
1
1
2
2
4
2
1
1
1
1
25
Operazioni di pulizia e disinfezione
Pulizia e disinfezione preliminare (dopo operazioni di rimozione delle carcasse) di locali-cortili con eliminazione
residui organici e irrorazione con idoneo disinfettante (lasciato agire per 24 ore).
Pulizia e disinfezione finale di tutte le superfici ed attrezzature, sgrassatura con opportuno prodotto detergente,
lavaggio con acqua e irrorazione con opportuno prodotto disinfettante.
Ripetizione delle operazioni dopo una settimana.
Vaccinazione
1.
2.
3.
4.
5.
6.
7.
8.
1.
2.
3.
4.
5.
6.
Si effettua la vaccinazione d’emergenza e la preventiva.
Vantaggi:
riduzione sintomi e mortalità;
riduzione danni economici diretti;
riduzione sensibilità ed escrezione virale;
riduzione pressione infettante;
riduzione rischio di diffusione dell’infezione;
riduzione numero di volatili abbattuti e distrutti;
riduzione costi per indennizzo produttori;
impatto positivo sull’opinione pubblica.
Svantaggi:
maggiore difficoltà ad individuare soggetti malati per assenza di sintomatologia clinica;
costo vaccinazione/durata protezione;
danni indiretti (blocco movimentazione animali vivi e commercio prodotti);
riduzione delle performance zootecniche;
maggiore rischio di drift;
necessaria contemporanea applicazione rigorose misure di monitoraggio e prevenzione.
Strategia DIVA (Differentianting Infected from Vaccinated Animals)
Approvata con D.C.E. 2001/874/CE → Sistema di rilevazione ab contro la proteina N1.
Vaccinazione d’emergenza (PVE) – 2007 in Italia
http://quizmedicinaveterinaria.altervista.org/index.html
13
Ceppo circolante LPAI H7N3.
Predisposto ai sensi della Direttiva 2005/94/CE, Approvato con Decisione della Commissione 2007/638/CE.
Avviato il 9 ottobre 2007 e concluso il 31 marzo 2008.
Vaccinazione obbligatoria in tacchini da carne, ovaiole per la produzione di uova da consumo e capponi; Vaccini
utilizzati: vaccino bivalente eterologo (H7N4 e H5N9) e vaccino monovalente eterologo(H7N1). Basato sulla
strategia “DIVA” (differentiating infected from vaccinated animals).
Effettuato piani di monitoraggio specifici per valutare:
1. l’efficacia dei programmi di vaccinazione;
2. l’evoluzione della situazione epidemiologica.
Biosicurezza: strategie a livello territoriale.
http://quizmedicinaveterinaria.altervista.org/index.html