SPETTROSCOPIA DI ASSORBIMENTO
E’ la misura di una radiazione elettromagnetica assorbita o prodotta dalla
materia.
L’ emissione d’onde elettromagnetiche, da parte di un analista, scaturisce
da tre tipi di energia a cui sottoporre l’ analita stesso:
1. energia termica
2. energia elettrica
3. energia radiante
L’ assorbimento, invece, è l’alterazione d’intensità di radiazione
elettromagnetica causata dalla presenza dell’analita. Le applicazioni della
spettroscopia di assorbimento rivestono notevole importanza sia in campo
qualitativo che in campo quantitativo.
RADIAZIONE ELETTROMAGNETICA
Forma di energia trasmessa nello spazio ad alta velocità.
La teoria sulle radiazioni elettromagnetiche si basa sull’integrazione delle
teorie onda-particella.
PROPRIETA’ ONDULATORIE DELLA RADIAZIONE
ELETTROMAGNETICA
La radiazione elettromagnetica è un’onda sinusoidale. E’ un campo di
forza elettrico che oscilla con un periodo che va da 0 al massimo di
ampiezza A. L’ oscillazione avviene perpendicolarmente alla direzione di
propagazione dell’onda. Un campo elettrico è una quantità vettoriale e la
radiazione rappresenta l’andamento, di questo vettore, nel tempo t (preso
un punto fisso nello spazio).
1
Rappresentazione di un raggio di radiazione monocromatica polarizzata
nel piano. (a)Campi elettrico e magnetico ad angolo retto l’uno con l’altro
e con la direzione di propagazione. (b)Rappresentazione bidimensionale
del vettore elettrico.
PARAMETRI D’ONDA
Periodo (P): tempo intercorso tra un massimo d’onda e il successivo
Frequenza (): numero di oscillazioni in 1 secondo; è il reciproco del
periodo e dipende dalla sorgente di radiazione.
Velocità di propagazione ( vi ): è funzione della densità del mezzo e della
frequenza
Lunghezza d’onda () :distanza lineare tra massimi e minimi di un’onda.
Angstrom ( A ): unità di misura della lunghezza d’onda ed equivale a
10 10 m
Numero d’onda ( v ): è definito come il reciproco della lunghezza d’onda e
rappresenta il numero di onde per cm.
Intensità (I): potere radiante per unità di angolo solido.
2
PROPRIETA’ PARTICELLARI DELLA RADIAZIONE
ELETTROMAGNETICA
Si basa sul postulato che la radiazione elettromagnetica sia costituita da
“pacchetti” discreti d’energia chiamati fotoni o quanti. L’energia del
fotone dipende dalla frequenza della radiazione ed è data da:
E h*v
dove h è la costante di Planck ( 6.63 10 34 J*s). Possiamo correlare
l’energia della radiazione alla lunghezza d’onda e al numero d’onda:
E
h*c
h*c*v
dove c è la velocità della luce nel vuoto. Si noti come il numero d’onda,
analogamente alla frequenza, sia direttamente proporzionale all’energia.
SPETTRO ELETTROMAGNETICO
3
MISURA DELL’ASSORBIMETO
E’ la misura delle interazioni tra radiazione e le pareti della cella
contenente la soluzione da analizzare. La perdita di potere radiante per
riflessione; nell’interfaccia aria-vetro equivale circa al 4%.
L’assorbanza di una soluzione è definita dall’equazione:
A log 10 T log
P0
P
tale legge è nota come legge di Beer.
I limiti di tale legge sono rappresentati da deviazioni strumentali e da
deviazioni chimiche(dipendenti da variazione di concentrazione).
Per concentrazioni minori a 0.01M le interazioni legate alla
concentrazione, portano all’alterazione delle assorbanze specifiche molari,
con il risultato di ottenere rette non lineari.
L’aumento della concentrazione porta all’aumento dell’indice di rifrazione
che è un fattore principale dell’assorbanza.
Deviazioni apparenti della legge di Beer si osservano quando un analita si
associa, si dissocia, o reagisce con un solvente per dare un prodotto che ha
uno spettro di assorbimento diverso da quello dell’analita. Un comune
esempio di questo comportamento è riscontrabile in soluzioni acquose di
indicatori acido/base.
ESERCIZIO
Le assorbanze specifiche molari dell'acido debole Hln (Ka = 1.42 10 5 )e la
sua base coniugata In a 430 nm e a 570 nm sono state determinate per
mezzo di misure delle soluzioni fortemente acide o fortemente basiche
dell'indicatore (condizioni in cui essenzialmente tutto l'indicatore era nelle
forme Hln e In , rispettivamente). I risultati furono i seguenti
470
570
HIn
6.3 10 2
7.12 10 3
In
2.06 10 4
9.60 10 2
4
Derivate i dati di assorbanza(celletta di 1 cm)alle due lunghezze d’onda
per le soluzioni non tamponate con concentrazioni totali di indicatore che
variano da 2 10 5 a 1610 -5 M.
Calcoliamo le concentrazioni molari di [HIn] e [ In ] in una soluzione in
cui la concentrazione totale dell’indicatore è 2.0010-5 M. Valgono
HIn H In
e
Ka=1.4210-5 =[H+]*[In-]/[HIn]
Dall’equazione del processo di dissociazione si ricava
[H+]=[In-]
Inoltre la somma delle concentrazioni delle due specie dell’indicatore deve
uguagliare la concentrazione totale molare dell’indicatore. Così,
[HIn] + [In-] = 2.0010-5
La sostituzione di queste relazioni nell’espressione per Ka porta alla
seguente espressione
In
2.00 10
5
In
1.42 10 5
Un riarrangiamento porta all’espressione quadratica
[ In ] 1.42 10 5 [ In ] 2.84 10 10 0
La soluzione positiva di questa equazione è
[In-] = 1.1210-5
[HIn] = 2.0010-5 – 1.1210-5 = 0.8810-5
Siamo ora in grado di calcolare le assorbanze alle due lunghezze d’onda.
5
A = HIn b[HIn] + In- b[In-]
A430 6.30 10 2 *1.00 * 0.88 10 5 2.06 10 4 *1.00 *1.12 10 5 0.236
Analogamente a 570 nm,
A570 7.12 103 *1.00 * 0.88 10 5 9.60 10 2 *1.00 *1.12 10 5 0.073
E’ ora possibile tracciare un grafico che dimostra l’andamento delle curve
di assorbanza alle due lunghezze d’onda considerate
come si può ben notare, all’aumentare della concentrazione dell’indicatore,
le curve assumono un andamento non lineare, specialmente alla lunghezza
d’onda di 570 nm.
Sono imputabili
monocromatiche.
DEVIAZIONI STRUMENTALI
a strumenti incapaci di produrre
radiazioni
PROCESSO DI ASSORBIMENTO
Dal momento che gli elettroni danno salti discreti di energia, e che il loro
numero è limitato, l’assorbimento avviene solo se l’energia del fotone è
6
uguale o maggiore alla differenza di energia tra stato fondamentale e stato
eccitato. Passando dagli atomi alle molecole i livelli energetici aumentano
e gli spettri di assorbimento sono più complessi.
CURVE SPETTRALI
Uno spettro di assorbimento riporta in ascissa le lunghezze d’onda() e in
ordinata le assorbanze, le trasmittanza o il log delle assorbanze,
rispettivamente rappresentati nelle figure (a), (b), (c). Gli spettri espressi in
trasmittanza (a), danno una maggiore risoluzione, mentre quelli espressi in
funzione dell’assorbanza (b) sono meno evidenti. Gli spettri espressi in
funzione del log delle assorbanze (c), dette anche estinzioni, si presentano
più piatti rispetto a quelli rappresentati in funzione delle trasmittanze,
come pure rispetto a quelli espressi in funzione delle assorbanze.
7
RADIAZIONE ELETTROMAGNETICA
Atomi, ioni, molecole hanno un numero limitato di livelli energetici
discreti e quantizzati. Lo stato fondamentale rappresenta il livello
energetico più basso occupato dagli elettroni, invece lo stato eccitato
rappresenta un livello energetico più alto; tale stato è più instabile. Quando
l’elettrone torna ad uno stato energetico inferiore o allo stato fondamentale
si genera uno stato di emissione o decadimento. Lo spettro di emissione
rappresenta l’energia emessa da una sostanza in funzione di e varia da
sostanza in sostanza. Lo spettro di emissione di atomi eccitati si presenta
come una banda discontinua meglio nota come spettro a righe; lo spettro di
emissione di molecole eccitate, invece, si presenta come una banda a righe
ravvicinate. Ciò si spiega per il fatto che l’energia totale di una molecola è
il risultato della somma di energie di varia natura:
Etot = Eelettronica + Evibrazionale + Erotazionale
Lo spettro di una sostanza solida incandescente si presenta come una
banda continua. Le caratteristiche dello spettro di emissione è un utile
indice per l’identificazione delle sostanze in esame.
ASSORBIMENTO
Una sostanza in un mezzo trasparente sposta in modo selettivo alcune
frequenze delle radiazioni elettromagnetiche. Il fotone assorbito trasforma
una sostanza M nella forma eccitata M*. L’energia assorbita si libera sotto
forma di calore in 10-8-10-10 secondi. Per decomposizione fotochimica
della forma eccitata M* è possibile la formazione di prodotti secondari con
l’emissione di radiazioni particolari, incluse nella fascia del visibile, e
l’instaurarsi di fenomeni quali la fluorescenza o la fosforescenza.
8
LEGGE DI BEER
Misura l’assorbimento, calcolando la diminuzione dell’intensità di un
fascio di radiazioni per interazione con sostanze assorbenti nel suo
cammino ottico. Un fascio monocromatico di radiazioni di potere radiante
P0 si attenua attraversando una soluzione di 1litro di concentrazione c. La
variazione subita è
-P = k*P0*N
in cui P0 è il potere radiante incidente, k è una costante, N è la variazione
continua.
La figura sopra rappresenta schematicamente, nell’apparato sperimentale,
l’attenuazione della radiazione con potenza iniziale P0 ad opera della
soluzione contenente c mol/l di un soluto assorbente e un cammino ottico
di lunghezza b cm(P<P0). Espressione dell’assorbanza è, come già
discusso in precedenza, la legge di Beer
A = log
P0
b*c
P
in cui è l’assorbanza specifica molare, b è il cammino ottico in cm, c è la
concentrazione mol/l della soluzione. Volendo calcolare l’assorbanza di
più sostanze è necessario effettuare la sommatoria delle singole assorbanze
Atot = A1 + A2 + A3 + … + Ai = 1*b1*c1 + 2*b2*c2 + 3*b3*c3* + … +
i*bi*ci
9
TERMINOLOGIA DELLA AMERICAN SOCIETY FOR TESTING
MATERIALS
Trasmittanza (T): T
P
P0
P0
P
Assorbanza specifica molare o coefficiente di estinzione molare
Assorbanza (A) o Estinzione (E): A log
A
():
b*c
A
k
Assorbanza specifica o coefficiente di estinzione (k):
b*c
La trasmittanza è la porzione di radiazione incidente che viene trasmessa
dalla soluzione e viene espressa in %
.
ESERCIZIO
Una soluzione di KMnO4, 7.510-5 M, ha una assorbanza A=0.439.
Usando una cella di spessore di 1 cm, =525, calcolare la trasmittanza %
T
La trasmittanza è uguale a
l'assorbanza è
A log
P
P0
P0
P
è evidente che nell’espressione dell’assorbanza compare il reciproco della
trasmittanza, dunque
A log
1
T
effettuando i dovuti calcoli, sfruttando i dati del testo, si ricava che
1
1
2.748 T
0.364 *100 36.4%
T
2.748
10
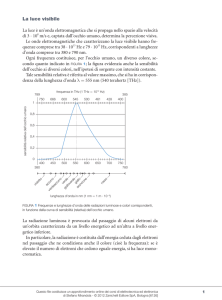
ASSORBIMENTO UV-VIS
E’ riferito all’energia dei salti elettronici che in definitiva è l’energia
maggiore. Ad ogni spettro UV, di qualunque stato elettronico di una
molecola, corrisponde uno stato di energia vibrazionale e di energia
rotazionale; per questo motivo il risultato dello spettro UV-VIS di una
molecola consiste in una o più bande spettrali. Grazie alle misure di
assorbimento è possibile effettuare analisi quantitative e qualitative di
numerose molecole organiche.
COMPOSTI ORGANICI
L’assorbimento di radiazioni da parte di
composti organici per valori di lunghezza
d’onda compresi tra 180 e 780 nm, deriva
da interazioni tra fotoni ed elettroni che
partecipano direttamente ad un legame o
che sono localizzati attorno ad eternatomi
come N, O, S, Cl.
I singoli legami(es. C-C, C-H) assorbono
raggi UV, detti UV del vuoto, con
lunghezze d’onda minori a 180 nm; i
legami doppi, tripli e i doppietti non
condivisi sono legati più debolmente e
sono perciò più facilmente eccitati dalle
radiazioni. Gruppi funzionali insaturi
organici che assorbono nelle regioni UVVIS sono noti come cromofori.
Si riporta nella figura a lato un tipico esempio di spettro effettuato con
radiazioni UV.
COMPOSTI INORGANICI
11
In generale, gli ioni e i complessi degli elementi delle prime due serie di
transizione assorbono bande ampie di radiazioni visibili in almeno uno dei
loro stati di ossidazione e sono, di conseguenza, colorati. In tal caso
l’assorbimento comporta transizioni fra orbitali d pieni e vuoti, con energie
che dipendono dai legami che complessano gli ioni metallici. Le differenze
di energia fra questi orbitali d (e così la posizione del corrispondente picco
di assorbimento) dipendono dalla posizione dell’elemento nella tavola
periodica, dal suo stato di ossidazione, e dalla natura degli elementi. Gli
spettri di assorbimento degli ioni delle serie di transizione di lantanidi e
attinidi differiscono da quelli degli altri elementi metallici di transizione;
gli elettroni responsabili dell’assorbimento sono schermati dalle influenze
esterne da elettroni che occupano orbitali con numero quantico principale
maggiore. Come risultato, le bande tendono ad essere più strette e
relativamente non influenzate dalle specie coinvolte nei legami con
elettroni esterni (fig. a seguire).
a)
c)
b)
d)
STRUMENTI TIPICI PER MISURE DI ASSORBIMENTO
Gli strumenti usati sono composti da:
1. sorgente stabile di energia
2. selettore di lunghezza d’onda
3. contenitori trasparenti per il campione
4. rivelatore(trasduttore di energia in segnale elettrico)
5. dispositivo di lettura
12
La sorgente luminosa deve avere alcune caratteristiche molto importanti:
1. intensità sufficiente
2. radiazione continua
3. uscita stabile
Per esperienze di spettroscopia di assorbimento nel
UV le lampade utilizzate sono quelle ad idrogeno e a
deuterio(figura a sinistra) che hanno lunghezze d’onda
che vanno da 180 nm fino a valori superiori a 375 nm.
In queste lampade i gas devono trovarsi allo stato
gassoso ed in stato eccitato,tramite scarica elettrica tra
i due elettrodi.
Per quanto riguarda, invece, il campo del visibile, le
lampade utilizzate sono al tungsteno(figura a destra) che
emettono luce con lunghezza d’onda compresa tra 320 e
2500 nm. L’inconveniente di queste lampade è che
l’intensità del fascio emesso in uscita è soggetto a
variazioni dovute a sbalzi di tensione; per ovviare a
questo problema è opportuno, dunque, l’utilizzo di stabilizzatori che
mantengano la tensione costante su un valore di circa 6V.Per controllare e
selezionare la lunghezza d’onda è necessario l’utilizzo di strumenti atti al
restringimento del rang delle lunghezze d’onda. I vantaggi di queste
tecniche sono:
1. riconducibilità alla legge di Beer
2. abbattimento delle interferenze
13
3. aumento della sensibilità
In base alla larghezza di banda , viene espressa la % di trasmittanza. Nel
grafico, riportato di seguito, si noti la curva A con una banda di 50 nm,
mentre la curva B ha una banda di 10 nm. Nel caso della curva B l’altezza
diventa maggiore di circa 3 volte.
Per migliorare la qualità delle radiazioni utilizzate in spettroscopia, si
utilizzano filtri di assorbimento, che eliminano radiazioni con lunghezze
d’onda di 30-250 nm. I filtri più
economici sono quelli di vetro che
emettono bande che coprono in campo
del visibile. Esistono, inoltre, filtri che
emettono bande strette e assorbono
essi stessi un 10% del raggio incidente.
Un altro filtro utilizzato è quello di
tipo cut-off che ha valori di trasmittanza pari al 100% nel visibile e 0% nel
14
resto dello spettro. Nella figura a lato è riportata: (a) la sezione trasversale
schematica di un filtro ad interferenza, (b) lo schema che dimostra le
condizioni di interferenza costruttiva su cui di basa il meccanismo di
filtrazione e correzione della lunghezza d’onda del raggio incidente. La
radiazione attraversa il primo strato ed è in parte riflessa. Un’altra parte
passa attraverso lo strato di dielettrico e incontra il secondo strato. Il
raggio subisce una ulteriore riflessione, creando così una maggiore
selettività. Le nuove radiazioni che passano attraverso il filtro incontrano
le altre: se sono in fase con esse, vengono rafforzate, mentre se sono fuori
fase sono annullate. La trasmittanza di questo tipo di filtri è del 1.5%.
MONOCROMATORI
I monocromatori sono in generale di due tipi, uno dei quali impiega un
reticolo per disperdere la radiazione nelle sue lunghezze d’onda
componenti; l’altro utilizza
un prisma per lo stesso
scopo. I primi strumenti
spettroscopici erano del tipo
a
prisma.
Attualmente
comunque, quasi tutti i
monocromatori
commercialmente disponibili
sono basati su reticoli a
riflessione in quanto sono
meno costosi dei prismi e
rendono
possibile
la
progettazione
di
strumenti
più
15
compatti e più semplici. La Figura a destra mostra il disegno di un tipico
monocromatore a reticolo. La radiazione emessa da una sorgente arriva
sul monocromatore attraverso una stretta fenditura rettangolare. La
radiazione è poi collimata da uno specchio concavo, dispositivo che
produce un raggio parallelo il quale a sua volta colpisce la superficie di un
reticolo a riflessione. La dispersione angolare è il risultato della diffrazione
che si ha sulla superficie riflettente. Le due lunghezze d’onda sono
focalizzate da un altro specchio concavo sul piano focale del
monocromatore, dove appaiono come due immagini della fenditura di
ingresso, una per 1 e l’altra per 2. Ruotando il reticolo, sia 1 che 2
possono essere focalizzate sulla fenditura di uscita del monocromatore.
Nei monocromatori a prisma, invece, la dispersione della radiazioni è
prodotta da un prisma di materiale birifrangente (calcite) sfaccettato a 60°,
in modo che la radiazione entri ed esca dalla stessa faccia. Le radiazioni
incidenti oltre l’angolo limite sono annullate per riflessione(vd. Figura a
sinistra).
CONTENITORI PER CAMPIONI
I contenitori per il campione che sono usualmente chiamati cellette o
cuvette, devono avere finestre costruite con un materiale trasparente nella
regione spettrale di interesse. Quarzo, o silice fusa, è richiesto per la
regione ultravioletta (sotto 50 nm) e
può essere usato nella regione visibile
e fino a circa 3000 nm nel1’infrarosso.
A causa del suo basso costo, il vetro
silicato è generalmente usato nella
regione fra 375 e 2000 nm. Anche i
contenitori di plastica hanno trovato
applicazione nella regione visibile. Il
più comune materiale trasparente per gli
studi nell’infrarosso è il cloruro di sodio cristallino. Le migliori cellette
hanno finestre che sono normali alla direzione del raggio per minimizzare
le perdite dovute alla riflessione. La lunghezza di celletta più comune per
gli studi nelle regioni ultravioletta e visibile è 1 cm. Possono essere
acquistati anche altri cammini ottici, da quelli inferiori a 0,1 cm fino a 10
cm. Per ragioni di economia, talvolta si utilizzano cellette cilindriche.
Occorre una attenzione particolare per replicare la posizione di tali cellette
rispetto al raggio; altrimenti variazioni nella lunghezza del cammino ottico
16
e perdite da riflessione alla superficie curva possono causare errori
significativi. La qualità dei dati spettroscopici dipende criticamente dal
modo in cui le cellette accoppiate sono usate e conservate. Impronte
digitali, grasso, o altri depositi sulle pareti alterano marcatamente le
caratteristiche di trasmissione di una celletta. Di conseguenza è
obbligatoria la pulizia prima e dopo l’uso, ed occorre aver cura di evitare
di toccare le finestre dopo che la pulizia è stata completata. Le cellette
calibrate non devono essere mai seccate per riscaldamento in un forno o su
una fiamma perché questo potrebbe causare un danno fisico o un
cambiamento nella lunghezza del cammino ottico. Tali cellette dovrebbero
essere regolarmente calibrate l’una rispetto all’altra con una soluzione
assorbente.
RIVELATORI E TRASDUTTORI DI RADIAZIONI
Un rivelatore è un dispositivo in grado di indicare l’esistenza di un
qualche fenomeno fisico.
Un trasduttore è un tipo speciale di rivelatore che converte segnali, come
intensità luminosa, pH, massa e temperatura in segnali elettrici che
possono essere in seguito amplificati, manipolati, e finalmente convertiti in
numeri proporzionali alla grandezza del segnale originale.
Il trasduttore ideale per la radiazione elettromagnetica risponde
rapidamente a bassi livelli di energia radiante su un ampio intervallo
di lunghezze d’onda. In aggiunta, produce un segnale elettrico che è
facilmente amplificato ed ha un livello di rumore relativamente basso.
Infine, è essenziale che il segnale elettrico prodotto dal trasduttore sia
direttamente proporzionale alla potenza P del raggio:
G KP K '
dove G è la risposta elettrica del rivelatore in unità di corrente, resistenza o
potenziale. La costante di proporzionalità K misura la sensibilità del
rivelatore in termini di risposta elettrica per unità di potenza radiante.
Molti rivelatori esibiscono una risposta piccola e costante, nota come
corrente di fondo K’, anche quando nessuna radiazione colpisce la loro
superficie. Strumenti con rivelatori che hanno una risposta con corrente di
fondo significativa sono ordinariamente equipaggiati con un circuito
compensante che permette la sottrazione di un segnale proporzionale alla
corrente di fondo, per ridurre K’ a zero. Così, in condizioni ordinarie,
possiamo scrivere
17
G KP
Esistono vari tipi di rivelatori, ma quelli maggiormente utilizzati sono:
fotocelle,
rispondono
fotomoltiplicatori
nel
(figura
visibile;
a
tubi
sinistra),
consistono di un catodo e un anodo a
filamento
saldati
in
un
contenitore
trasparente sotto vuoto e di un diodo
mantenuto ad un potenziale di 90V più
elevato rispetto al catodo, sono strumenti molto sensibili e non producono
radiazioni di fondo, rispondono nell’ultravioletto e nell’infrarosso; celle
fotovoltaiche (o barrier-layer, figura a destra), hanno sensibilità massima a
circa 550 nm, con una risposta che cade a circa il 10% del massimo a 350
e 750 nm; fototubi (figura sotto), consistono di un catodo e un anodo a
filamento saldati in un contenitore trasparente sotto vuoto,molto simili ai
tubi fotomoltiplicatori, ma senza diodo, producono una piccola corrente di
fondo.
18
STRUMENTI OTTICI
Un colorimetro è uno strumento per misure di assorbimento in cui
l’occhio umano è il rivelatore. Sono richiesti uno o più standard di
confronto ogni volta che lo strumento è utilizzato.
Un fotometro è uno strumento fotoelettrico che può essere utilizzato per le
misure di assorbimento, emissione, o fluorescenza con la radiazione
ultravioletta, visibile, o infrarossa. Un fotometro si distingue perché usa i
filtri di assorbimento o interferenza per la selezione delle lunghezze
d’onda ed un dispositivo fotoelettrico per la misura della potenza radiante.
Gli strumenti di questo tipo che sono utilizzati per le misure di
assorbimento con radiazione visibile sono talvolta chiamati colorimetri
fotoelettrici o anche semplicemente colorimetri.
I fotometri per i metodi di assorbimento offrono i vantaggi di basso costo,
semplicità, robustezza, trasportabilità, e facilità di manutenzione. Inoltre,
dove non è importante (e spesso non lo è) un’alta purezza spettrale,
l’accuratezza e la precisione delle misure realizzate con un fotometro
possono raggiungere quelle fatte con uno spettrofotometro. Gli svantaggi
dei fotometri sono la loro minore versatilità, la loro incapacità di produrre
spettri interi, e la loro generalmente più ampia larghezza di banda effettiva.
19
La figura è un diagramma di un semplice fotometro a raggio singolo
utilizzato per misure quantitative nella regione visibile. I fotometri di
questo tipo sono ordinariamente provvisti di parecchi filtri, ciascuno dei
quali trasmette una differente porzione dello spettro visibile.
Un altro importante strumento utilizzato è lo spettrofotometro. In
commercio sono disponibili decine di modelli prodotti da vari costruttori
di strumentazione scientifica. Alcuni sono progettati soltanto per la regione
spettrale del visibile. Altri hanno intervalli di lavoro che si estendono da
180 a 200 nm nella regione dell’ultravioletto attraverso l’intera regione del
visibile fino a 750 o 800 nm. Alcuni modelli, infine, operano nella regione
dell’ultravioletto/visibile e nel vicino infrarosso fino a 3000 nm. Si
utilizzano due tipi di spettrofotometro: quello a raggio singolo e quello a
doppio raggio.
Gli spettrofotometri a raggio singolo sono equipaggiati con una sorgente
di luce a filamento di tungsteno alimentata con un alimentatore
stabilizzato. L’intensità della radiazione della lampada è sufficientemente
costante da fornire dati di assorbimento riproducibili. La radiazione
emessa dalla sorgente passa attraverso una fenditura fissa e giunge sulla
superficie di un reticolo di diffrazione. La radiazione diffratta passa quindi
attraverso una fenditura di uscita fino alla celletta del campione o del
riferimento ed infine al fototubo. Il segnale elettrico amplificato dal
rivelatore alimenta un contatore dotato di una scala lineare in trasmittanza
percentuale; vi è anche una scala logaritmica che è calibrata in
assorbanza.
Gli strumenti a raggio singolo, sono più che idonei per misure di
assorbimento quantitative ad una singola lunghezza d’onda. In tal caso,
semplicità della strumentazione, basso costo e facilità di manutenzione
costituiscono vantaggi apprezzabili.
20
Parecchi costruttori di strumentazione scientifica offrono strumenti a
raggio singolo per misure sia nell’ultravioletto che nel visibile. Il valore di
lunghezza d’onda inferiore per tali strumenti varia da 190 a 210 nm mentre
quello superiore da 800 a 1000 nm. Tutti sono forniti di lampade
intercambiabili al tungsteno e al deuterio o ad idrogeno. La maggior parte
di tali strumenti impiega quali rivelatori tubi fotomoltiplicatori e reticoli
quali elementi di dispersione della radiazione. Alcuni sono dotati di
dispositivi digitali di lettura, altri utilizzano dei contatori.
Gli spettrofotometri a doppio raggio (figura in basso) sono dotati di
sorgenti luminose al deuterio/tungsteno intercambiabili, di un
monocromatore a reticolo di riflessione, e di un rivelatore a
fotomoltiplicatore. L’elemento che divide il fascio è un disco circolare
azionato da motore, o chopper, che è diviso in tre segmenti, uno dei quali
è trasparente, il secondo riflettente e il terzo opaco. Ad ogni rotazione il
rivelatore riceve tre segnali, il primo corrisponde a P0 il secondo a P, e il
terzo alla corrente di fondo. I segnali elettrici risultanti sono poi
processati elettronicamente per dare la trasmittanza o l’assorbanza su un
dispositivo di lettura.
21
MODI DI OPERARE IN SPETTROFOTOMETRIA
Occorre scegliere la lunghezza d’onda opportuna, che solitamente è quella
massima poiché è riconducibile alla legge di Beer. Vi sono molti fattori
che influenzano il dato sperimentale dell’assorbanza e l’incremento
dell’errore:
1. scelta del solvente
2. utilizzazione di standard poco puri
3. pH
4. concentrazione dell’analita
5. opportuna calibratura delle cuvette e loro pulizia
22