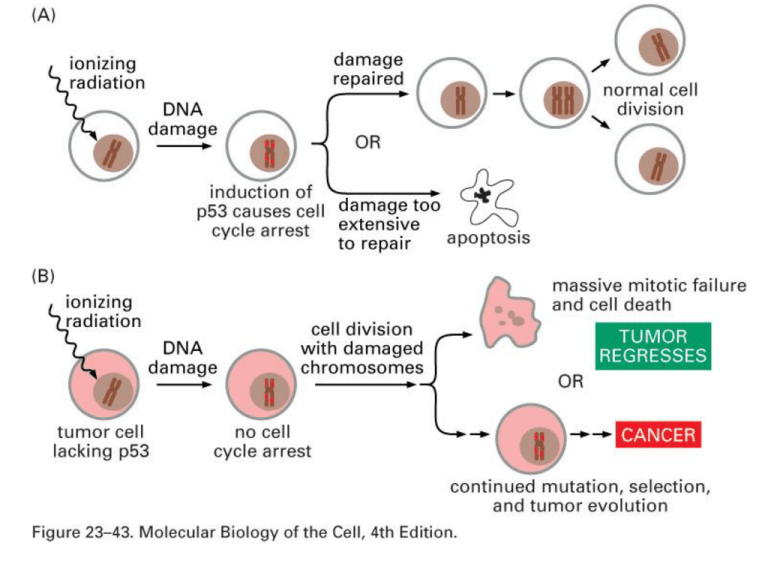
P53 (Tumor Suppressor Gene)
• Mutata (inattivata) in più del 60% di
tutti i tumori umani
• P53 regola (attiva o reprime) la
trascrizione di più di 50 differenti geni
• La quantità di P53 attivata aumenta
rapidamente quando c’è un danno al
DNA o si accumulano prodotti
intermedi della riparazione
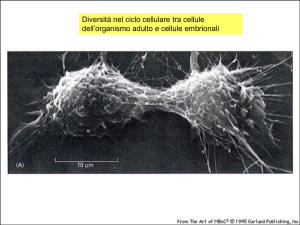
Tre tipi di cellule con diversa durata ciclo cellulare:
Cellule molto specializzate che hanno perso la capacità di
dividersi e si trovano in fase Gz, irreversibile. Le cellule
molto specializzate come le cellule nervose, le cellule
muscolari, i globuli rossi hanno perso per sempre la
capacità di dividersi
Cellule differenziate che normalmente non si dividono, ma
lo possono fare in risposta ad uno stimolo appropriato,
per esempio le cellule del fegato che si trovano in fase G0
ma che possono tornare in G1
Cellule attivamente proliferanti come le cellule staminali.
Hanno le fasi G1, S, G2 e Mitosi tutte le cellule che
possono proliferare, cioè le cellule embrionali e le cellule
staminali nei tessuti epiteliali e nel midollo osseo (globuli
rossi e bianchi), le cellule germinali maschili.
APOPTOSI: è una opzione possibile per la Cellula
restare e
funzionare
apoptosi
L’apoptosi si manifesta
con alterazioni tipiche della
cellula che ne sta attuando il
programma genetico
ipertrofia
L’apoptosi viene spesso
attivata in risposta ad una
situazione di danno che
permane e che non
riesce ad essere
compensata
risposta allo stress
crescere e
dividersi
transdifferenziare
dedifferenziare
Le cellule di un organismo multicellulare pur avendo gli stessi geni, sono in grado
di rispondere a segnali di differenziamento in modo variabile.
Le cellule sono plastiche, sono in grado di eseguire la loro funzione specializzata
pur mantenendo la capacità di adattarsi ai cambiamenti ambientali.
Questo si realizza attraverso molteplici meccanismi che coinvolgono la regolazione
diretta dello stato della cromatina in risposta a stimoli.
E’ ancora poco conosciuto come le vie di trasduzione del segnale possano
comunicare direttamente con cromatina per cambiare il paesaggio epigenetico, ma
è sempre più evidente la possibilità che la cromatina agisca come sito di
integrazione e di stoccaggio dei segnali.
Nei mammiferi, le informazioni comunicate agli organi sensoriali sono trasmessi al
sistema nervoso centrale, in cui l'informazione viene elaborata e convertita in una
risposta fisiologica.
A livello cellulare, le cascate di signalling trasmettono messaggi tramite
proteine effettrici che raggiungono il nucleo, dove opportuni fattori di trascrizione
attivano/inibiscono l’espressione genica. Questo evento può essere di natura
transitoria, ad esempio quando una cellula deve rispondere ad un evento acuto e poi
tornare al suo precedente stato stazionario.
Emerging roles for chromatin as a signal integration and storage platform - Nat Rev Mol Cell Biol. 2013 Apr;14(4):211-24. doi:
10.1038/nrm3545 - Badeaux AI, Shi Y.
Gli esosomi: vescicole liberate da cellule sia normali che
patologiche per trasferire RNA e proteine ad altre cellule
Gli esosomi si liberano gemmando dalla membrana
plasmatica con il concorso delle GTPasi Rab
Gli esosomi contengono proteine di secrezione, molecole della
superficie cellulare come antigeni umani leucocitari, antigeni
tumore-associati, citochine coinvolte nella regolazione
immunitaria, e molecole di RNA (sia mRNA che microRNA)
Gli esosomi possono giocare un ruolo importante nella
formazione delle metastasi generando un microambiente
specializzato che si forma nei siti di metastasi future e
promuove la sopravvivenza e la conseguenza di cellule
tumorali disseminate
________________________________________________________________________________
Metastasis: Exosomes drive premetastatic niche formation - Gemma K. Alderton - Nature Reviews Cancer 12, 447, 2012 - doi:10.1038/nrc3304
Melanoma exosomes: messengers of metastasis - Somasundaram e Herlyn - Nature Medicine, 18, 853-854, 2012 - doi: 10.1038/nm.2775
Gli esosomi del melanoma sono messaggeri per
l'angiogenesi e l'invasione metastatica, preparano nel
midollo osseo, nei polmoni, nei linfonodi ed in altri organi siti di
metastasi nicchie per la crescita del tumore, inducendo
infiammazione tissutale, aumentando la permeabilità
vascolare e la promozione di altri eventi pro-angiogenici
Gli esosomi del melanoma contribuiscono all’invasione
metastatica trasportando proteine che indirizzano le cellule
del midollo osseo verso un fenotipo prometastatico, con
promozione di eventi proangiogenici e modificazione della
matrice extracellulare nei siti premetastatici
Gli esosomi potrebbero essere utilizzati per identificare
i pazienti a rischio di sviluppare metastasi, ed il processo di
produzione di esosomi potrebbe produrre nuovi bersagli per
la terapia antimetastatica
Metastasis: Exosomes drive premetastatic niche formation - Gemma K. Alderton - Nature Reviews Cancer 12, 447, 2012 doi:10.1038/nrc3304
Melanoma exosomes: messengers of metastasis - Somasundaram e Herlyn - Nature Medicine, 18, 853-854, 2012 - doi:
10.1038/nm.2775
TNF-α = fattore di necrosi tumorale-α
Gli esosomi vescicole che sono liberate dalle cellule
da strutture multivescicolari o dalla membrana
plasmatica. La maggior parte, se non tutti, i tipi
cellulari rilasciano vescicole extracellulari, che quindi
entrano in circolazione nei fluidi corporei. Queste
vescicole contengono un sottoinsieme di proteine,
lipidi ed acidi nucleici che sono derivati dalla cellula
madre.
Si pensa che le vescicole extracellulari abbiano un
ruolo importante nella comunicazione intercellulare,
sia a livello locale che sistemico, in quanto
permettono di trasferire il loro contenuto (tra cui
proteine, lipidi e their contents, including proteins,
lipids and RNAs, between cells. RNA) tra le cellule.
Gli esosomi sono coinvolti in numerosi processi
fisiologici, e le vescicole provenienti dalle cellule
immunitarie e non-immunitarie svolgono ruoli
importanti nella regolazione immunitaria.
Sono in sviluppo e si stanno testando clinicamente
terapie basate su vescicole per il trattamento delle
malattie infiammatorie, malattie autoimmuni e il
cancro.
Dato l'enorme potenziale terapeutico delle vescicole
extracellulari, questa recensione si concentra sul loro
ruolo nel modulare le risposte immunitarie, così come
le loro potenziali applicazioni terapeutiche.
Feb 2014
Ago 2014
Prove convincenti dimostrano
che le vescicole consentono lo
scambio di informazioni
complesse e sta diventando
chiaro che i diversi tipi di
vescicole secrete coesistono,
con diverse origini intracellulari
e modalità di formazione, e
quindi probabilmente diverse
composizioni e funzioni.
Gli esosomi sono un sottotipo
di vescicole secrete. Essi si
formano all'interno delle cellule
eucariotiche in compartimenti
multivescicolari, e sono secreti
quando questi compartimenti
si fondono con la membrana
plasmatica.
Endosomal Sorting Complex Required
for Transport (ESCRT) machinery
Biogenesi e secrezione di esosomi.
Schema dell'origine e rilascio di esosomi da parte delle cellule eucariotiche.
Gli esosomi si formano come ILV per gemmazione in endosomi precoci e MVB. Diverse molecole sono coinvolte
nella biogenesi di ILV, quali i macchinari ESCRT, lipidi (quali ceramide) e le tetraspanine. Non è ancora chiaro se
questi meccanismi agiscono contemporaneamente sulla stessa MVB o su differenti MVB. Il destino di MVB può
essere la fusione con i lisosomi o la fusione con la PM, che consente l'uscita del loro contenuto nell'ambiente
extracellulare. Diverse proteine Rab (Rab11, RAB27 e RAB35) hanno dimostrato di essere coinvolte nel
trasporto di MVB alla PM ed alla secrezione degli esosomi. In questa review si propone che queste
proteine possano agire su diversi MVB. Inoltre, le proteine SNARE sono probabilmente coinvolte nella fusione
dei MVB con la PM. Altri tipi di vescicole secrete che gemmano direttamente dalla membrana plasmatica sono
spesso chiamate microvescicole, o microparticelle, due parole che sono a volte utilizzate per tutti i tipi di
vescicole EV.
APOPTOSI
è una morte cellulare programmata, esecuzione di un complesso
programma genetico
l’altra forma di morte cellulare - necrosi – è invece una morte accidentale
che si realizza in modo caotico e senza chiamare in causa trascrizione e
traduzione
la
cellula in apoptosi si frammenta in corpi apoptotici che sono fagocitati
dai fagociti
nel corso dello sviluppo embrionale/fetale, l’apoptosi
rimuove le cellule indesiderate; per esempio quelle
della membrana interdigitale, circa metà dei neuroni
in differenziamento, i linfociti che possono aggredire
il “self”
nei tessuti maturi che vanno incontro a rinnovamento, come le cellule del sangue e
quelle epiteliali, l’apoptosi è l’autoeliminazione delle cellule vecchie e non più utili
alcune cellule difensive si sacrificano nell’espletamento della loro funzione di
protezione del corpo, ad esempio i granulociti neutrofili o i linfociti
le cellule infettate da virus impediscono la diffusione del contagio ad altre
cellule attivando il programma genetico dell’apoptosi
l’Apoptosi è usata nel continuo ricambio ciclico delle cellule dell’endometrio
uterino, del corpo luteo, dell’epitelio della ghiandola mammaria
proliferazione di
cellule staminali
proliferazione con
differenziamento
A competitive protein interaction network buffers Oct4-mediated differentiation to promote pluripotency in
embryonic stem cells - Descalzo et al. - Mol Syst Biol. 2013 Oct 8;9:694. doi: 10.1038/msb.2013.49
Nelle cellule staminali embrionali, la
pluripotenza è mantenuta regolando l'attività di
un piccolo insieme di fattori di trascrizione, tra cui
sono particolarmente importanti (Oct4, Nanog,
TCF3, β-catenina) che controllano l'espressione
dell’auto-rinnovamento e dei geni per il
differenziamento
Il blocco dell'attività trascrizionale di Oct4 sembra
essere il principale determinante per uscire dalla
condizione di pluripotenza
The Use of Induced Pluripotent Stem Cells in Drug Development - Clin Pharmacol Ther. 2011 May;89(5):655-61. doi:
10.1038/clpt.2011.38 - Inoue H, Yamanaka S.
La tecnologia delle cellule staminali pluripotenti indotte (iPSC) sta
rivoluzionando la scienza medica, permettendo di esplorare i meccanismi di
molte malattie, fornendo nuovi bersagli molecolari terapeutici, e offrendo nuove
opportunità per la scoperta ed il testaggio di farmaci vecchi e nuovi
L’induzione di quattro geni
codificanti per fattori di
trascrizione (Oct3/4, Sox2,
Klf4, c-Myc) basta per
innescare la riprogrammazione
di cellule somatiche umane
e di topo per generare
cellule somiglianti alle rispettive ESC
Esistono già vari altri metodi alternativi per generare iPSC
Le cellule iPSC hanno risolto i problemi di natura etico/morale connessi con la
ricerca nel campo delle cellule staminali embrionali
La tecnologia delle iPSC ci sta mettendo sempre di più nelle condizioni di
sviluppare una efficiente medicina personalizzata
Utilizzando i sarcomi come modello sperimentale abbiamo dimostrato che:
(1) tumori solidi umani dal cariotipo complesso possono essere riprogrammati ad uno stato
pluripotente che soddisfa
tutti i criteri in vitro utilizzati
per definire le cellule staminali
pluripotenti generate da
cellule somatiche;
(2) sarcomi riprogrammati
possono essere differenziati
in tessuto connettivo maturo
e globuli rossi;
(3) la differenziazione terminale
dei sarcomi riprogrammati abolisce
in modo irreversibile il loro
potenziale oncogeno misurato
dalla capacità di ulteriore
proliferazione in vitro o negli
xenotrapianti.
Forse, la conclusione più sorprendente è che la riprogrammazione delle
cellule tumorali dimostra la capacità delle cellule tumorali di impegnarsi
nuovamente e completare l’esecuzione di una normale via di
differenziazione cellulare con conseguente perdita della cancerogenicità.
Reprogramming cancer cells: back to the future - Oncogene, 32, 2247–2248 (2013), doi:10.1038/onc.2012.349; publ online 6 august 2012 - Lang JY, Shi Y & Chin YE
Vascularized and functional human liver from an iPSC-derived organ bud transplant - Nature. 2013 Jul
25;499(7459):481-4. doi: 10.1038/nature12271 - Takebe et al.
La grave carenza di donatori di organi per il trattamento della insufficienza
d'organo in fase terminale rende urgente la necessità di generare organi
da cellule staminali pluripotenti indotte (iPSC).
Fino ad ora nessun laboratorio era riuscito a generare un organo
tridimensionale vascolarizzato come il fegato.
Si dimostra la generazione di un fegato umano vascolarizzato e funzionale
ottenuto dal trapianto di gemme di fegato formate da iPSC umane create in
vitro. Queste gemme si collegano ai vasi sanguigni entro 48 ore dal
trapianto e crescono portando alla formazione di tessuto simile al fegato
adulto che presentava le funzioni fegato-specifiche, come la produzione di
proteine e il metabolismo dei farmaci, con la possibilità di rendere non
necessaria la sostituzione del fegato del destinatario.
Questo è il primo lavoro che dimostra la generazione di un organo umano
funzionale da cellule staminali pluripotenti. Ulteriori sforzi dovranno essere
effettuati per tradurre queste tecniche in trattamenti per i pazienti, un
nuovo promettente approccio per la medicina rigenerativa.
Vascularized and functional human liver from an iPSC-derived organ bud transplant - Nature. 2013 Jul 25;499(7459):481-4.
doi: 10.1038/nature12271 - Takebe et al.
Generazione di gemme di fegato umano da
iPSC umane:
(a) Schema del disegno sperimentale;
(b) auto-organizzazione tridimensionali di
umane in colture di umana;
(c) confronto tra quando ottenuto dalle iPSC
(pannello superiore) rispetto alle culture
Generazione di fegato
umano vascolarizzato
in vivo
iPSC
umane
bidimensionali convenzionali
(pannello inferiore)
(d) presenza di reti endoteliali
nascenti all'interno delle gemme di
iPSC umane;
(e) analisi di PCR quantitativa di
espressione dei geni marcatori
epatici al sesto giorno di coltura.
Caratterizzazione funzionale
di gemme di iPSC di fegato
umano
Transcription factor-mediated reprogramming of fibroblasts to expandable, myelinogenic oligodendrocyte
progenitor cells - Nature Biotechnology, 31, 5 may 2013, 426-433 - Najm FJ, Lager AM, Zaremba A, Wyatt K, Caprariello
AV, Factor DC, Karl RT, Maeda T, Miller RH & Tesar PJ
Le terapie cellulari per le malattie della mielina, come la sclerosi
multipla e le leucodistrofie, necessitano di tecnologie per la
generazione di cellule progenitrici degli oligodendrociti funzionali. In
questo lavoro si descrive la conversione diretta di fibroblasti
embrionali e polmonari murini a cellule progenitrici degli
oligodendrociti indotte (iOPC) utilizzando set di otto o tre ben definiti
fattori di trascrizione. Le iOPC presentano una morfologia bipolare ed
un profilo di espressione genica globale coerente con le vere OPC. Le
iOPC possono essere espanse in vitro per almeno cinque passaggi,
mantenendo la capacità di differenziarsi in oligodendrociti.
Quando sono trapiantate in topi ipomielinati, le iOPC sono in grado
di inguainare gli assoni dell’ospite e di generare mielina compatta.
La conversione di linee di cellule somatiche a iOPC espandibili fornisce
una strategia per studiare il controllo molecolare della identità delle linee
degli oligodendrociti e può facilitare la costruzione di modelli animali per
lo studio delle malattie neurologiche e per arrivare a mettere a punto
terapie rimielinanti autologhe.
Figura 1 - ………….. (a) schema del disegno sperimentale e sviluppo temporale per la
riprogrammazione mediata da di fibroblasti Plp1-eGFP e R26-M2rtTA per formare iOPC,
espandibili ed in grado di differenziare in iOL. Il transgene di Plp1-eGFP modificato è
espresso sia nelle iOPC che negli oligodendrociti in vivo ……...
Il potenziale delle terapie cellulari per le malattie della mielina si basa sulla capacità di
generare cellule autologhe mielinogeniche da trapiantare.
La fonte cellulare più promettente per tali terapie sono le OPC. Gli oligodendrociti maturi
sono molto poco efficaci nel rimielinare gli assoni dell’ospite dopo il trapianto. Sebbene le
cellule staminali neurali e le cellule staminali neuronali indotte possano generare
oligodendrociti, l'efficienza di questo processo è piuttosto basso, e le cellule hanno una
propensione a formare neuroni ed astrociti. Al contrario, le iOPC appaiono limitate alla
generazione degli oligodendrociti. Abbiamo dimostrato che le iOPC si integrano nel
sistema nervoso centrale e mielinizzano gli assoni di topi congenitamente demielinati dopo il
trapianto in vivo. Tuttavia, affinché le iOPC possano avere rilevanza clinica, gli studi futuri
dovranno estendere questa strategia di riprogrammazione a cellule somatiche umane e
dimostrare una estesa mielinizzazione nel CNS ed un beneficio funzionale a lungo
termine nei destinatari del trapianto.
Transcription factor-mediated reprogramming of fibroblasts to expandable, myelinogenic oligodendrocyte progenitor cells - Nature
Biotechnology, 31, 5 may 2013, 426-433 - Najm et al.
Stem cells: A time to heal - Cassandra Willyard - Nature 503, S4–S6 (14 November 2013) doi:10.1038/503S4a Published online 13 November 2013
Le prime terapie con cellule staminali per le lesioni del midollo
spinale sono già in fase di sperimentazione in studi clinici, ma
restano l’incertezza scientifica e politica.
Regenerative medicine: Rebuilding the backbone - Mike May - Nature 503, S7–S9 (14 November 2013)
doi:10.1038/503S7a Published online 13 November 2013
I chirurghi possono aiutare a
fissare le vertebre danneggiate,
ma potrebbe un'infusione di
cellule in un materiale
bioingegnerizzato crescere per
sostituire una colonna
vertebrale danneggiata?
Developmental Neuroscience: Miniature human Brains - Nature. 2013 Sep 19;501(7467):319-20. doi: 10.1038/nature12552 Brüstle O.
Le cellule staminali indotte possono essere utilizzate per formare tessuti tridimensionali
che imitano il cervello umano in sviluppo. Questi tessuti forniscono un mezzo importante
per lo studio dei disturbi dello sviluppo neuronale. Cellule staminali embrionali
pluripotenti possono differenziarsi in tutti i tipi di cellule del corpo. Questo processo può
anche essere ottenuto in vitro, usando sia staminali pluripotenti (ES) che staminali
indotte (iPSC) ottenute dalla riprogrammazione di cellule epiteliali differenziate.
In condizioni adeguate, le iPSC umane possono auto-organizzarsi in organoidi cerebrali
che ricreano i primi passi della
formazione della corteccia cerebrale
del cervello umano , e quindi si prestano
a studi sullo sviluppo del cervello
e sui disturbi dello sviluppo neurale.
Recentemente era stata dimostrata la
formazione di tratti di corteccia cerebrale,
di intere strutture oculari nei primi stadi di
sviluppo ed anche retine stratificate a
partire da cellule umane e d murine.
Figura in alto: generazione di organoidi da cellule staminali umane pluripotenti che possono essere
derivate sia ES (cellule embrionali dalla massa cellulare interna della blastocisti di embrioni a 70200 -cellule) che staminali pluripotenti (iPS) indotte attraverso la riprogrammazione di cellule adulte.
Le cellule neurali derivate da cellule staminali pluripotenti si auto-organizzano in organoidi cerebrali
con architetture dei tessuti che ben ricordano la corteccia cerebrale umana.
Developmental Neuroscience: Miniature human Brains - Nature. 2013 Sep 19;501(7467):319-20. doi: 10.1038/nature12552
- Brüstle O.
Figura a sinistra: organoide umano generato in vitro in cui si vedono i
neuroni (fluorescenza verde e le cellule progenitrici (fluorescenza
magenta). La morfologia della regione superiore destra corrisponde a
quella della corteccia cerebrale e la regione in basso a sinistra ha una
morfologia simile a quella del plesso coroide. All’interno è presente una
cavità piena di liquido.
La corteccia cerebrale umana è evolutivamente il tessuto più
complesso del regno animale. Come nel cervello nativo, le aree
corticali segregano in diversi strati e queste peculiarità dello sviluppo corticale umano sono ben
riassunte negli organoidi.
Negli organoidi cerebrali le aree imitano le diverse regioni del cervello ma distribuite
casualmente, non hanno la forma e la complessiva organizzazione spaziale che si vede nel
cervello e sono privi di un sistema circolatorio che impedisce di avanzare alla complessa
architettura a sei livelli della loro controparte naturale.
Anche se con queste limitazioni, le potenziali applicazioni di tale modello in vitro sono
affascinanti e gli organoidi cerebrali possono fornire un modello per studiare i meccanismi di
sviluppo iniziale del cervello umano in laboratorio. Tali studi possono essere estesi ai disturbi
dello sviluppo neurale. Sono state utilizzate cellule iPSC derivate da fibroblasti della pelle di un
paziente con una forma genetica di microcefalia (disordine dello sviluppo neurale caratterizzato
da una sostanziale riduzione delle dimensioni del cervello che è difficile da studiare in modelli
animali a causa delle differenze di specie nello sviluppo del cervello). Rispetto agli organoidi
derivati da pazienti sani, quelli derivati da pazienti microcefalici avevano un minor numero di
cellule progenitrici e un aumento del numero di neuroni differenziati. Questa osservazione
indica il precoce differenziamento neuronale come meccanismo alla base di questa forma di
microcefalia.
The Use of Induced Pluripotent Stem Cells in Drug Development -Clin Pharmacol Ther. 2011 May;89(5):655-61. doi:
10.1038/clpt.2011.38 - Inoue H, Yamanaka S.
Medicina personalizzata
Il vantaggio evidente di
utilizzare iPSC piuttosto
che ESC è che le iPSC
possono essere
derivate da qualsiasi
individuo con relativa
facilità, consentendo in
tal modo lo sviluppo
di una piattaforma di
studio personalizzato
sul singolo genoma.
iPSC e cellule differenziate
da iPSC mantengono la loro identità personale, come un alter ego del paziente,
e possono essere usate per studiare le sue malattie con approccio personaspecifico per esaminare le differenze individuali nella risposta ai farmaci (vedi figura
in alto).
Apr 2014
Le cellule staminali pluripotenti indotte umane (iPSC) possono rivoluzionare la
ricerca e la terapia delle malattie del fegato, fornendo una fonte di epatociti per
la terapia cellulare autologa e modelli di malattia. Tuttavia, nonostante i
progressi nel promuovere la differenziazione delle iPSC in epatociti (iPSCHeps) in vitro, non ci sono evidenze che queste siano comparabili con gli
epatociti umani adulti primari (aHeps) per la proprietà di proliferare ampiamente
in vivo. Questa mancanza ha ostacolato gli sforzi per ricreare le malattie di
fegato umano nei topi, ed ha messo in dubbio il potenziale uso delle iPSC-heps
per la terapia del fegato. La ragione è necessaria una vasta espansione posttrapianto per stabilire e mantenere una massa di cellule epatiche
terapeuticamente efficace nei pazienti, una lezione imparata da studi clinici sul
trapianto di cellule aHep. In questo lavoro si segnala la generazione di epatociti
da fibroblasti umani che è in grado di ripopolare i fegati di topi. A differenza dei
protocolli correnti per derivare epatociti da fibroblasti umani, il nostro non
genera iPSC ma accorcia la riprogrammazione verso la pluripotenza per
generare cellule multipotenti progenitrici indotte (iMPC) da cui potrebbero
essere efficientemente differenziate le cellule progenitrici dell’endoderma e
successivamente gli epatociti (iMPC-heps). A questo scopo abbiamo
identificato piccole molecole che aiutano il differenziamento dell’endoderma e
degli epatociti senza comprometterne la proliferazione. Dopo il trapianto in topo
immuno-deficiente modello di insufficienza epatica umana, le iMPC-heps hanno
proliferato estesamente ed hanno acquisito livelli di funzionalità epatocitaria
simili a quelli delle aHeps. Le cellule iMPC-heps non formano tumori, molto
probabilmente perché non hanno mai raggiunto lo stato di pluripotenza. I nostri
risultati dimostrano la possibilità di un significativo ripopolamento del fegato di
topi usando epatociti umani generati in vitro, e questo rimuove un ostacolo
lungo la strada della terapia cellulare autologa del fegato.
Mag 2014
La conversione diretta delle cellule della pelle in cellule
staminali somatiche ha aperto nuove possibilità
terapeutiche nella medicina rigenerativa. In questo
lavoro si dimostra che cellule staminali mesenchimali
umane indotte (iMSC) possono essere efficientemente
generate da cellule di sangue del cordone ombelicale
(CB)-CD34 (+) o di sangue periferico adulto (PB)-CD34
(+), mediante riprogrammazione diretta con un singolo
fattore, OCT4. … Una efficiente riprogrammazione
diretta si ottiene sia dall’espressione episomiale
transiente di OCT4 che dalla trasduzione di OCT4
mediata da vettori lentivirali. … come le BM-MSC
naturali, òe iMSC formano osso e tessuti connettivi
senza essere tumorigenici nei topi. Inoltre, cosa che
non riescono a fare le BM-MSC, le iMSC formano
anche fibre muscolari, il che indica un potenziale
vantaggio funzionale delle iMSC. Abbiamo inoltre
osservato che sono necessari alti livelli di espressione
di OCT4 per la riprogrammazione iniziale e per un autorinnovamento ottimale delle iMSC, mentre è necessaria
una riduzione dell’espressione di OCT4 per la
differenziazione in multilineare. Il nostro metodo può
consentire di generare iMSC specifiche del paziente, il
che potrebbe avere applicazioni nella medicina
rigenerativa. Questa scoperta potrebbe anche facilitare
lo sviluppo di strategie per la conversione diretta di
cellule del sangue in altri tipi di cellule di importanza
clinica.
Mag 2014
Le terapie basate su cellule staminali pluripotenti indotte (iPSC)
hanno un grande potenziale per la medicina rigenerativa, ma sono
anche potenzialmente associate a rischi di cancerogenicità. I
modelli murini che vengono usati non sono predittori ottimali di
efficienza e di sicurezza per l'applicazione clinica. Abbiamo quindi
sviluppato con un primate non umano un modello clinicamente
rilevante per valutare il potenziale di tumorigenicità e l'efficacia in
vivo delle iPSC sia indifferenziate che differenziate in ambienti
autologhi senza immunosoppressione. Le iPSC autologhe
indifferenziate formano teratomi maturi in modo dose-dipendente.
Tuttavia, la formazione di tumori è accompagnata da una reazione
infiammatoria. D'altra parte, le cellule iPSC derivate da cellule
mesodermiche stromal-like formano nuovo osso in vivo senza
alcuna evidenza di formazione di teratomi. Siamo stati quindi in
grado di dimostrare in un grande modello animale che assomiglia
molto alla fisiologia umana che le iPSC indifferenziate autologhe
formano teratomi, e che iPSC derivate da cellule
progenitrici possono dare origine ad un tessuto funzionale in vivo.