12/05/15 Le vie BIOSINTETICHE non sono mai
s e m p l i c e m e n t e l ’ i nve r s o d e l l e
corrispondenti vie CATABOLICHE
I tessuti animali devono essere
in grado di sintetizzare glucosio
a partire da altri precursori per il
funzionamento di tessuti ed
organi che vivono solo di questa
sostanza ed anche per
l’immagazzinamento del
glicogeno in altri tessuti.
ORGANISMO
CERVELLO
160 gr al dì
120 gr al dì
RISERVE
190 gr
nei fluidi corporei 20 gr
Durante periodi di digiuno di
durata superiore ad un
giorno, il glucosio deve
essere sintetizzato da altri
precursori che non siano le
riserve di glicogeno ormai
terminate.
Ciò è vero anche in una intensa attività fisica
1 12/05/15 FORMAZIONE DI
GLUCOSIO DA
PRECURSORI NON
GLUCIDICI
PRINCIPALI PRECURSORI SONO:
lattato, aminoacidi, alanina prodotta dal
muscolo attraverso il ciclo piruvato- alanina,
propionato (degradazione di alcuni a.a) e il
glicerolo
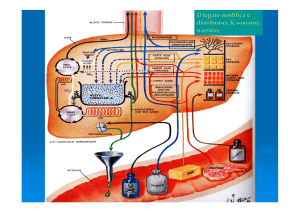
L’organo in cui avviene la maggior parte della
gluconeogenesi è il FEGATO sebbene in minor
quantità avvenga anche nella midollare dei reni
ma anche l’intestino tenue può essere una fonte
di glucosio negli stati di digiuno. Avviene nel
citosol anche se alcuni precursori sono prodotti
nei mitocondri.
Un difetto della gluconeogenesi è di solito fatale.
L’ipoglicemia causa disfunzione cerebrale che
può portare al coma e alla morte
2 12/05/15 Sette reazioni della GLICOLISI
(reversibili) fanno parte anche
della via GLUCONEOGENICA.
Le tre reazioni irreversibili della
glicolisi, catalizzate
dall’ESOCHINASI,
FOSFOFRUTTO CHINASI;
PIRUVICO CHINASI, sono
sostituite da diverse reazioni
catalizzate da DIFFERENTI
ENZIMI
La gluconeogenesi
utilizza enzimi specifici
per aggirare tre reazioni
irreversibili della glicolisi
3 12/05/15 PRIMA REAZIONE ESCLUSIVA
2 REAZIONI
ESOERGONICHE
4 12/05/15 La piruvato carbossilasi
REAZIONE ANAPLEROTICA
catalizza la conversione ATP Utilizzata per mantenere ad un livello
e Biotina dipendente del
costante gli intermedi del ciclo di Krebs
piruvato ad ossalacetato
L’enzima richiede in modo
assoluto l’acetil-CoA come
attivatore allosterico
La fosfoenolpiruvato
carbossichinasi catalizza
la reazione GTP
dipendente
dell’ossalacetato a
fosfoenolpiruvato
GTP al posto
dell’ATP come
donatore di energia
nel fegato e nel
rene dove si
produce GTP nel
ciclo di Krebs
La reazione a
fosfoenolpiruvato
avviene nel citosol
cellulare. Per essere
trasformato in PEP nella
seconda reazione
l’ossalacetato deve
attraversare la
membrana
mitocondriale che è
impermeabile
all’ossalacetato ma non
lo è al malato
CO2 fissata dalla
piruvico
carbossilasi è
rilasciata dalla
fosfoenolpiruvato
carbossichinasi
La formazione di
ossalacetato nel citosol ha
la funzione di fornire NADH
necessario in altri passaggi
della gluconeogenesi
5 12/05/15 SECONDA
REAZIONE
ESCLUSIVA
Fruttosio-1,6-bisfosfatasi
Fruttosio-1,6-bisfosfatasi
Fruttosio-1,6-bisfosfato + H2O
fruttosio-6-fosfato + Pi
KJ/mole
ΔG°’= -16,3
6 12/05/15 TERZA
REAZIONE
ESCLUSIVA
Glucoso 6-fosfatasi
Glucoso-6fosfatasi
enzima localizzato
principalmente nel
reticolo
endoplasmatico degli
epatociti e nelle cellule
renali
7 12/05/15 AMINOACIDI GLUCOGENICI
8 12/05/15 PROPIONATO
a. Grassi o
dall’ossidazione
di alcuni a.a.
GLICEROLO
La regolazione della gluconeogenesi è cruciale
per molte funzioni fisiologiche, ma in particolare
per un corretto funzionamento del tessuto
nervoso. Il controllo è particolarmente importante
quando un animale si adatta all’esercizio
muscolare o quando va incontro ad alternanza di
condizioni di abbondante alimentazione o di
digiuno
G l u c o n e o g e n e s i e g l i c o l i s i r e a z i o n i i nve r s e
avvengono in gran parte nel citosol e devono perciò
essere regolate in modo reciproco.
La regolazione reciproca è in gran parte legata alla
carica energetica degli adenilati.
9 12/05/15 Anche l’acetil-CoA può
essere visto come un
regolatore reciproco
della glicolisi e della
gluconeogenesi, in
quanto agisce sugli
enzimi che
interconvertono il
piruvato e il
fosfoenolpiruvato
attivatore
+
inibitore
La glucosio-6-fosfatasi non è
regolata allostericamente , ma
la sua Km per il glucosio-6fosfato è molto più alta della
concentrazione intracellulare
di questo metabolita per cui la
v di reazione è di ordine uno
Enzima di
membrana del
reticolo
endoplasmatico
10 12/05/15 Il glucagone, ormone
che segnala i bassi
aa
livelli di glucosio nel
sangue provoca una
diminuzione dei livelli
di fruttosio 2,6bisfosfato
aa
rallentando nel fegato il consumo di glucosio da
parte della glicolisi e stimolando la produzione di
glucosio per l’espor tazione da par te della
gluconeogenesi.
Nel fegato la regolazione
reciproca della fosfofruttochinasi
e della fruttosobisfosfatasi
impedisce un ciclo futile e regola
la concentrazione di glucosio nel
sangue
La carica energetica influisce sulla regolazione della glicolisi
e della gluconeogenesi agendo sulla interconversione del
fruttosio-6-fosfato e fruttosio-1,6-bisfosfato e determinando
un aumento o una diminuzione di ATP a seconda delle
esigenze della cellula .
L’AMP stimola le vie
che ossidano i nutrienti
e inibisce la
gluconeogenesi, per
fornire ENERGIA alla
cellula epatica
11 12/05/15 Effettore
allosterico
i cui livelli
riflettono i
livelli di
glucagone
nel sangue
e quindi
regolatore
del
glucosio
ematico
Regolazione dei livelli EMATICI di glucosio
Il fruttosio 2,6-bisfosfato è
una molecola di fruttosio che
viene prodotta e defosforilata
in posizione 2 da uno stesso
complesso proteico che
contiene due attività
enzimatiche che catalizzano
reazioni inverse
PFK-2
FBPasi-2
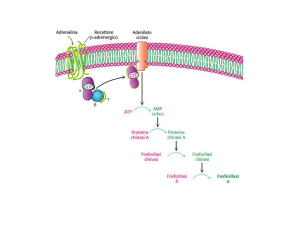
12 12/05/15 La concentrazione di fruttosio-2,6-bisfosfato dipende dalla velocità della sua
formazione e distruzione. Quando il glucagone arriva sulla membrana di un
epatocita determina la formazione di cAMP che attiva una proteina chinasi
a catalizzare la fosforilazione del complesso proteico determinando
l’attivazione enzimatica della FBPasi-2 e l’inattivazione contemporanea
della PFK-2.
Attività distinte di una stessa
proteina
PFK-1
FBPasi-1
La fosforilazione da
parte della proteina
chinasi diminuisce
l‘attività della PFK-2
ed aumenta quella
della FBPasi-2
La formazione del fruttosio-2,6-bis-P è regolata
covalentemente attraverso una cascata enzimatica
innescata dal Glucagone
13 12/05/15 INOLTRE controlla i
livelli dell’enzima
FOSFOENOLPIRUVATO
CHINASI attivandone la
trascrizione del gene
strutturale; mentre
deprime la sintesi della
PIRUVATO CHINASI
INSULINA
effetto
opposto
Il livello di glucosio nel
sangue aumenta grazie a
due meccanismi:
1. Regolazione ad opera
del cAMP della
regolazione a cascata
che porta alla
demolizione del
glicogeno.
2. La depressione
sempre ad opera del
cAMP, del livello del
fruttosio-2,6-bisfosfato,
che stimola la
gluconeogenesi
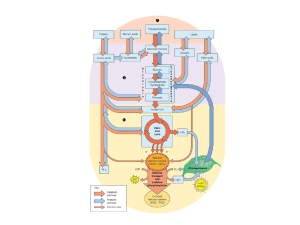
14 12/05/15 Un compito importante nella regolazione del glucosio nel
sangue è dovuto, oltre ovviamente all’attività dei diversi
ormoni, alla capacità dei trasportatori di glucosio e delle
loro differenze nelle diverse cellule.
Punti d’ingresso
degli amminoacidi
Altri substrati per la
gluconeogenesi
Effetti
allosterici
Importante
nei
ruminanti
15 12/05/15 16 12/05/15 1. formazione metabolicamente
irreversibile
Il substrato
per la sintesi
del
glicogeno
catalizzata
dalla
GLICOGENO
SINTASI è l’UDP-glucosio
SINTESI DELL’UDP-glucosio
Molte delle reazioni in cui
gli esosi vengono
trasformati o polimerizzati
utilizzano
2. Aumentano l’efficienza
catalitica dell’enzima
3. I gruppi nucleotidilici sono
eccellenti gruppi uscenti
4. “etichetta” molecolare
1.
ZUCCHERI LEGATI
A NUCLEOTIDI
SINTESI DEL GLICOGENO
Avviene praticamente in tutti i
tessuti animali, ma soprattutto
nel fegato e nel muscolo
scheletrico
Glucosio-6fosfatasi
Una parte di glucosio
ingerito durante il pasto
segue una via più lunga:
entra negli eritrociti dove
viene convertito in lattato
dalla glicolisi, esce quindi
nel torrente sanguigno come
lattato va al fegato dove sarà
convertito in glucosio-6fosfato nella gluconeogenesi
per la sintesi di glicogeno.
17 12/05/15 Se la biosintesi del glicogeno dipendesse unicamente
dalla glicogeno sintasi il glicogeno
sarebbe costituito da lunghe catene lineari simili a
quelle dell'amilosio.
La GLICOGENO SINTASI catalizza il trasferimento di residui
UDP-glucoso alle estremità non riducenti di una
ramificazione del GLICOGENO costituita da almeno 8 residui
di glucosio
Formazione delle ramificazioni
ENZIMA RAMIFICANTE
denominato anche
Amilo (1,4->1,6)
transglicosilasi
in quanto rompe un
legame α1,4 e
forma un legame
α-1,6
Tale enzima consente lo spostamento di un oligomero di 6-8 residui di
glucosio (legati con legame α- 1,4) dall'estremità non riducente di una
catena ad un residuo di glucosio , lontano almeno 4 residui dalla
ramificazione più vicina
Le ramificazioni aumentano la solubilità del polimero e aumenta, inoltre, il
numero delle estremità non riducenti che sono i siti per la demolizione e la
sintesi del glicogeno
18 12/05/15 Ma la glicogeno fosforilasi non è capace
di legare due molecole di UDP-glucosio
per dare inizio alla sintesi del glicogeno
Il primer per la Glicogeno
sintasi è rappresentato da una
corta catena di residui di
glucosio sintetizzata da una
proteina chiamata
GLICOGENINA, che trasferisce
il glucosio dall’UDP-Glc ad un
residuo di tirosina della stessa
proteina. Inneschi di circa 8
residui che vengono in seguito
estesi dalla Glicogeno sintasi.
La glicogenina continuerà a far
parte della molecola di
glicogeno restando legata
covalentemente all’estremità a
cui ha dato origine
19 12/05/15 Le condizioni che attivano la demolizione
del glicogeno inibiscono la sintesi del
glicogeno e viceversa
L’adrenalina e il glucagone inibiscono
la sintesi del glicogeno con gli stessi
meccanismi con cui ne promuovono
nello stesso tempo demolizione
20 12/05/15 Proteina
chinasi A
cAMP
dipendente
(attiva)
21 12/05/15 22