La Gluconeogenesi
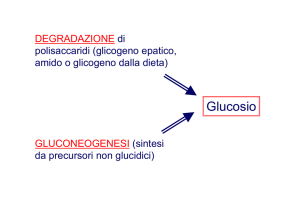
La gluconeogenesi è la sintesi di glucosio da precursori non saccaridici
Questo processo utilizza il piruvato ed i composti a 3 o 4 atomi di
carbonio ad esso correlati ed avviene in tutti gli animali, piante, funghi
e microrganismi con le stesse reazioni enzimatiche
Per il cervello ed il sistema nevoso dell’uomo, come per gli eritrociti, i
testicoli, la parte midollare del rene ed i tessuti embrionali, il glucosio
ematico è l’unica o la principale sostanza nutriente
Il solo cervello consuma circa 120 grammi di glucosio al giorno, più
della metà di tutto quello immagazzinato come glicogeno nei muscoli
e nel fegato
I mammiferi non possono convertire gli acidi grassi in glucosio, poiché la
reazione della piruvato deidrogenasi è irreversibile e le cellule non
possono convertire l’acetil-CoA in piruvato
Le piante, il lievito e molti batteri possono farlo,
tramite la via del gliossilato
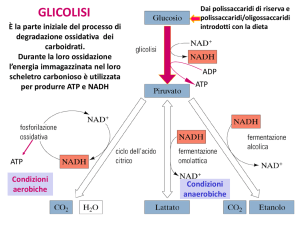
La glicolisi e la gluconeogenesi sono regolate in modo reciproco, sia
mediante un controllo allosterico che mediante modificazione covalente
(fosforilazione)
La gluconeogenesi e la glicolisi non sono vie metaboliche identiche
percorse in direzioni opposte
Solo sette delle dieci reazioni enzimatiche della gluconeogenesi sono tappe
della glicolisi in direzione opposta (DG vicino a zero in vivo)
Tre reazioni della glicolisi sono irreversibili in vivo (DG fortemente
negativo) e, quindi, non possono essere utilizzate nella gluconeogenesi:
1) Conversione del glucosio in glucosio 6-fosfato (esochinasi)
2) Fosforilazione del fruttosio 6-fosfato a fruttosio 1,6-bisfosfato (PFK-1)
3) Conversione del PEP in piruvato (piruvato chinasi)
Queste tre reazioni nella gluconeogenesi sono catalizzate da enzimi diversi,
che rendono anche la sintesi del glucosio irreversibile nelle condizioni
cellulari
Glicolisi versus Gluconeogenesi
Prima “deviazione”
Conversione del piruvato in fosfoenolpiruvato (PEP), che avviene in due
tappe esoergoniche, una mitocondriale e l’altra citosolica
Per passare dal mitocondrio al citosol, l’ossalacetato deve essere ridotto a
malato dalla malato deidrogenasi (a spese del NADH), per poi essere
riconvertito in ossalacetato da una malato deidrogenasi citosolica
(con produzione di NADH)
Sintesi del PEP da piruvato
in due tappe esoergoniche
La compartimentalizzazione della
piruvato carbossilasi
Seconda “deviazione”
Conversione del fruttosio 1,6-bisfosfato in fruttosio 6-fosfato, catalizzata
dalla fruttosio 1,6-bisfosfatasi (FBPasi-1)
La FBPasi-1 richiede Mg2+ per promuovere l’idrolisi del gruppo fosforico
sull’atomo C-1 (non il suo trasferimento all’ADP!)
Glicolisi versus Gluconeogenesi
Terza “deviazione”
Conversione del glucosio 6-fosfato in glucosio, catalizzata dalla
glucosio 6-fosfatasi
L’enzima richiede Mg2+ per promuovere l’idrolisi di un estere fosforico
Esso si trova nel lume del reticolo endoplasmatico degli epatociti e delle
cellule renali ed epiteliali dell’intestino tenue, ma non è presente negli altri
tessuti che, quindi, non possono rifornire di glucosio il sangue
Se la glucosio 6-fosfatasi fosse presente in tutti i tessuti, idrolizzerebbe il
glucosio 6-fosfato necessario per la glicolisi
La Glucosio-6-fosfatasi
La gluconeogenesi è energeticamente dispendiosa, ma essenziale
La somma delle reazioni biosintetiche che dal piruvato portano al
glucosio libero è:
2Piruvato + 4ATP + 2GTP + 2NADH + 2H+ + 4H2O →
Glucosio + 4ADP + 2GDP + 6Pi + 2NAD+
Glucosio + 2ADP + 2NAD+ + 2Pi →
2Piruvato + 2ATP + 2NADH + 2H+ + 2H2O
In vivo, sia la glicolisi che la gluconeogenesi sono processi irreversibili
(DG = -63 kJ/mole e -16 kJ/mole, rispettivamente)
Il ciclo di Cori
I principali meccanismi di regolazione della
glicolisi e della gluconeogenesi
L’inibizione della fruttosio-1,6-bisfosfatasi
La sintesi e la degradazione del
fruttosio-2,6-bisfosfato
La biosintesi del glicogeno
La reazione della glicogeno sintasi
L’attività dell’enzima ramificante
Amilo-(1,41,6)-transglicosilasi
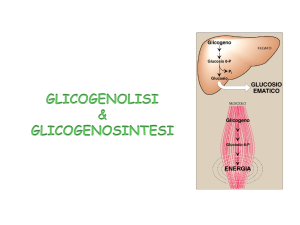
Il glicogeno e l’amido endogeni vengono degradati per fosforolisi
La glicogeno fosforilasi negli animali e l’amido fosforilasi nelle piante
catalizzano l’attacco da parte del Pi di legami glicosidici (α1→ 4), fino
a che non si avvicinano ad un legame (α1→ 6). Qui è necessario un
enzima deramificante, che rimuove la ramificazione e consente alle
fosforilasi di riprendere la loro attività
Il glucosio 1-fosfato prodotto dalle fosforilasi viene convertito
reversibilmente in glucosio 6-fosfato dalla fosfoglucomutasi, un
enzima che condivide il meccanismo d’azione già visto per la
fosfoglicerato mutasi
Il glucosio 6-fosfato può entrare nella via glicolitica
La degradazione dell’amido e del glicogeno
Le α-amilasi salivari e pancreatiche generano maltosio, maltotriosio
ed oligosaccaridi denominati “destrine limite”
Demolizione del glicogeno intracellulare
ad opera della glicogeno fosforilasi
L’attività della glicogeno fosforilasi è regolata
allostericamente
Il meccanismo della modificazione covalente e
della regolazione allosterica
Il meccanismo della modificazione covalente e
della regolazione allosterica
Il meccanismo della modificazione covalente e