Corpo umano
1° anno
Capitolo 1
Concetti generali
Energia
• Energia è un “entità dinamica “ in continua
trasformazione.
Locomozione
• Sole > alberi> carbone > elettricità
Industrie
Consumi domestici
Lavoro
Forme di energia
Energia
E=M.C
2
Massa come forma di energia , che può liberarsi e trasformarsi in altre forme.
La “Massa” è la fonte di energia primaria
da cui derivano tutte le altre
Termica
atomica
massa
Chimica
Meccanica
Massa
Massa = quantità di materia contenuta in un corpo.
Tipi di materia
Legno
Ferro
Grassi
Proteine
Acqua
Carta
Plastica
Vetro
…
“Agglomerati”
Di Energia
Energia chimica
Nella materia l’energia e sotto forma di energia chimica
L’energia chimica è data da un equilibrio
più o meno stabile di 2 fattori elettrici opposti.
Per convenzione questi fattori sono
definiti come carica negativa e carica positiva
(avrebbero potuto chiamarsi anche yin e yang)
La materia è pertanto un aggregato di cariche
positive e negative
Elementi e composti
• Gli elementi sono gli “aggregati energetici”
elementari che compongono la materia ( vedi
TAVOLA PERIODICA degli ELEMENTI semplificata a pag. 17 e 18: la sua
prima stesura, a cura del chimico russo Mendeleev, risale al 1869).
• Gli elementi rinvenuti a oggi (gennaio 2016)
sono 118 e con questi sono composti tutti i tipi
di materiali sulla Terra e nella sua atmosfera.
• Questi 118 aggregati energetici sono appunto i
118 tipi di atomi presenti sulla Terra.
• Tipi di atomi : Calcio, Ferro, Carbonio, Azoto,
Oro, Ossigeno, Idrogeno... …118
Aggregati energetici
+++
-++
-+-+
-- -++
+++
---+++
-+-
-++
--+
--+++
++--+++ ++--++ ++--+++
----+-+-++-++-+-+
--+
-++ ----+ -++
+-+
++
--
- +-
Atomi di elementi
Ossigeno (O), Calcio (Ca),
Idrogeno (H), Azoto (N)…
Gli atomi si possono
unire tra loro a formare
molecole (composti) :
H2O, Nacl, NaOH….
+++
-+
--
+++
-+
--
Le molecole si possono
unire tra loro a
formare strutture più o
meno complesse
Organismo umano ed energia
L’organismo umano può essere letto come un aggregato energetico immerso in
ecosistema di altri aggregati energetici con cui dovrà interagire.
Interagire per difendersi, relazionarsi, nutrirsi e riprodursi.
Il mantenimento dello stato vitale, si può anche intendere,come tutti quelli
scambi energetici che avvengono all’interno della “massa uomo” e tra l’uomo e
l’ambiente che lo circonda.
Tutti questi scambi energetici devono avvenire in modo da garantire un
funzionamento ottimale degli apparati e sistemi corporei.
La malattia si può anche intendere come una perturbazione di questo equilibrio
per cause interne (genetiche, vecchiaia) o esterne (batteriche, virali, ambientali e
accidentali).
La cura sarà finalizzata a ristabilire un ottimale scambio energetico mediante
interventi manuali, verbali, meditativi e medicamentosi.
Struttura dell’atomo
L’ atomo è una particella a sua volta costituita da particelle più semplici caricate
positivamente (protoni) e negativamente (elettroni).
Ognuno dei 105 elementi ha un suo particolare numero di protoni ed elettroni.
L’atomo del Litio è costituito da 3 protoni , che
formano il nucleo, e 3 elettroni che orbitano
attorno al nucleo
Le cariche positive sono uguali a quelle negative
e l’atomo è elettricamente neutro.
Un atomo può perdere o acquistare elettroni ,
rimanendo lo stesso elemento
+
+
-
+
-
Litio
-
-
+
+
Ione Litio +
+
Ioni positivi e Ioni negativi
A
-
IONE -
-
-
-
+
+
+
+
+
+
+
+
-
+
-
+
-
-
2 atomi neutri
B
-
-
L’elettrone
passa da B
aA
IONE +
+
+
+
+
“Dinamismo atomico”
• Nella dinamica della vita gli atomi
elettricamente neutri sono poco rappresentati.
• Gli atomi tendono continuamente a perdere o
acquistare elettroni assumendo la
conformazione di ione.
Modello atomico
• Gli elettroni attorno al nucleo sono disposti
secondo uno schema preciso.
• Attorno al nucleo abbiamo un primo livello (n
1) che può ospitare 2 elettroni
• Attorno al primo livello abbiamo un secondo
livello (n 2) che può ospitare fino a 8 elettroni)
• I livelli successivi (n 3, n 4…) potranno
ospitare fino a 8 elettroni (in realtà dal terzo
livello in su la disposizione è più complessa)
• L’ultimo livello può essere riempito
parzialmente
Livelli atomici (schema)
n 1 2 elettroni
2+
n1 due elettroni, n2 otto elettroni
10 +
n1 due elettroni, n2 otto elettroni, n3 otto elettroni
18 +
Il numero positivo dentro il nucleo indica il numero
di protoni caratteristico di quell’atomo, questo
numero è detto NUMERO ATOMICO
Atomi e livelli atomici 1
H, idrogeno, numero atomico 1
Li, Litio, numero atomico 3
Na, sodio, numero atomico 11
1+
3+
11+
Tutti e
3 gli
elementi
presentano
un elettrone
nel livello
più esterno
Atomi e livelli atomici 2
C, carbonio, numero atomico 6
6+
Tutti e 2 gli
elementi
presentano 4
elettroni nel
livello più
esterno
S, silicio, numero atomico 14
14+
Atomi e livelli atomici 3
He, elio numero atomico 2
2+
Tutti e 2 gli elementi
presentano il livello
esterno completo
Ne, neon, numero atomico 10
10+
Tutti i 118 elementi possono essere raggruppati in gruppi, con la caratteristica di
avere lo stesso numero di elettroni nel livello più esterno. Tutti gli elementi che
appartengono allo stesso gruppo hanno caratteristiche chimiche simili:
reattività, conducibilità, conformazione spaziale …
H , Li e Na apparterranno allo stesso gruppo; C e Si apparterranno ad un altro
gruppo; He e Ne apparterranno ad un altro gruppo ancora (vedi pag. 18).
•
•
•
•
•
Tabella periodica degli elementi
La tabella nella prossima diapositiva è una
rappresentazione semplificata della “Tabella
periodica degli elementi”
I numeri in testa ad ogni colonna (1 a, 2 a,…
rappresentano il numero di elettroni nell’ultimo livello
di quel gruppo.
I numeri dentro ad ogni casella rappresentano il
numero atomico (numero di protoni) di
quell’elemento.
Gli elementi in rosso sono quelli più rappresentati
nella composizione del corpo umano
La colonna con in testa lo 0 significa che gli elementi
di quella colonna hanno l’ultimo livello completo.
Questi elementi sono detti “gas nobili”.
1a
2a
3a
4a
5a
6a
7a
1
H
0
2
He
3
Li
4
Be
5
B
6
C
7
N
8
O
9
F
10
Ne
11
12
Mg
13
Al
14
Si
15
P
16
S
17
Cl
18
Ar
33
As
34
Se
35
Br
36
Kr
52
Te
53
I
54
Xe
85
At
86
Rn
Na
19
K
37
Rb
55
Cs
87
Fr
20
Ca
38
Sr
56
Ba
88
Ra
Legami chimici
Un atomo è una struttura instabile nel senso che tende a perdere o acquistare
elettroni per completare l’ultima orbita e acquistare la struttura di un gas nobile.
(+)
Litio
3+
Perde un elettrone
3+
Ione litio +
(-)
Floro
Ione floro 9+
9+
Acquista un elettrone
Legame ionico 1
• Gli atomi che tendono a perdere elettroni per
acquisire la struttura di gas nobile sono quelli a
sinistra della tabella, cioè con pochi elettroni
nell’ultima orbita, mentre quelli che tendono ad
acquisirli sono quelli a destra, cioè quelli con
molti elettroni nell’ultima orbita.
• La forza con cui un atomo tende ad attirare
elettroni prende il nome di elettronegatività
• Gli elementi a destra della tabella saranno più
elettronegativi di quelli di sinistra.
Legame ionico 2
( per ogni elemento sono indicati solo gli elettroni del livello più esterno)
Na + (perde un elettrone e si carica +)
Na
Cl
Cl
- (acquista un elettrone e si carica -)
Il Na + e il Cl- avendo cariche opposte (ione+ e ione-)
eserciteranno una attrazione reciproca, legandosi fra loro, a
formare la molecola di NaCl = Cloruro di Sodio.
Na+
+ Cl-
NaCl
Il legame ionico avviene tra 2 atomi che hanno una marcata
differenza di elettronegatività
Legame covalente
Il legame covalente avviene quando 2 atomi hanno identico valore di
elettronegatività (non esiste un dominante)
H
+
H
I 2 atomi di H hanno lo stesso valore di elettronegatività
Per poter completare il livello esterno (2 elettroni) mettono in comune il
rispettivo elettrone
H
H + H
H
I 2 elettroni orbiteranno il 50% del tempo attorno ad un atomo di H e l’altro
50% attorno a quell’altro.
H+H
H2
Il legame covalente è un legame più forte del legame ionico
Legami: “visione complessiva”
Le molecole formate da legami ionici sono molecole “ fortemente
polarizzate”, nel senso che gli elettroni (negativi) tenderanno a stare dalla
parte dell’elemento più elettronegativo.
-
+
Polo positivo
NaCl
Polo negativo
Le molecole pertanto eserciteranno tra loro forze attrattive per poli opposti
(come calamite)
+ NaCl + NaCl -
+
Na
Cl
-
Legame a idrogeno
La molecola dell’acqua è fortemente polarizzata e le
molecole eserciteranno tra loro una forte attrazione
reciproca, il cosiddetto legame a idrogeno
(+) H2O (-)
(+) H2O (-)
(+) H2O (-)
(+) H2O (-)
I legami a idrogeno danno all’acqua
proprietà particolari
1) Elevata tensione superficiale
2) Alto punto debollizione (alta capacità
termica)
3) L’elevata polarità della molecola la
rende un solvente ideale per molecole
polarizzate tipo NaCl, ma non per i lipidi.
(+) H2O (-)
Le molecole biologiche 1
Gli elementi reagiscono tra loro formando molecole in cui le cariche
elettriche sono spesso “sbilanciate” e la molecola è polarizzata.
Alcune molecole sono entità molto “grandi”, una molecola di DNA è miliardi
di volte più grande di un molecola di glucosio
HCl per cui molte
Moltissime reazioni sono reversibili H+ + Cl reazioni presentano nello stesso momento sia i reagenti che il prodotto,
questo significa che nei liquidi biologici c’è una costante presenza di ioni
positivi e negativi, che sono determinanti per moltissime reazioni biologiche
Da un punto di vista della comprensione generale è utile immaginare le
molecole biologiche come strutture grandi, tridimensionali, anche con la
presenza contemporanea nella stessa molecola di polarità negative e
positive.
Molecole biologiche 2
___
___
++
Fe
Glicogeno
emoglobina
(vit B12)
++++
++++
+
-
+
-
RNA
-
-
+
+
ioni
+ + -
Reazioni chimica
• La reazione chimica è un processo per il quale
da una o più sostanze si ottengono una o più
sostanze diverse.
• Dal punto di vista metabolico esistono 2 tipi di
reazioni : anaboliche e cataboliche.
• Sono anaboliche quelle reazioni in cui i prodotti
finali hanno un contenuto energetico più alto dei
prodotti di partenza
• Sono cataboliche quelle reazioni dove i prodotti
finali hanno un contenuto energetico più basso
dei prodotti di partenza.
“Energia” di una molecola
• Una molecola grande e complessa ha in genere
un contenuto energetico più grande di una
molecola piccola
• La presenza di legami covalenti dà, a quella
molecola, un contenuto energetico più alto
rispetto ad una molecola con legami ionici.
• Fondamentalmente “l’energia” di una molecola
è data dal: numero, tipo e orientamento
spaziale dei legami atomici al suo interno.
Reazioni cataboliche
energia
+ calore
CH4 + O2
CO2 + H2O
Il metano ha 4 legami covalenti (con una particolare disposizione spaziale)
che gli danno un contenuto energetico importante; reagendo con
l’ossigeno libera energia e produce acqua e anidride carbonica con un
contenuto energetico complessivo più basso.
Nell’organismo un importante reazione catabolica vede coinvolto il glucosio
che reagendo con l’ossigeno libera energia
energia
C6H12O6 + O2
CO2 + H2O
L’energia prodotta dal catabolismo del glucosio non viene dispersa ma
viene usata per sintetizzare la molecola dell’ ATP
ATP “la molecola energetica”
L’ADP (adenosin-di-fosfato) in presenza di energia e di Fosforo (P) si
lega alla molecola formando l’ATP (adenosin-tri-fosfato).
Energia
Di Legame
energia
P
P
+
P
P
(ADP)
(ATP)
P
P
+ acqua
(H2O)
L’ ATP è di fatto la “moneta energetica” spendibile in tutti i processi
biologici che richiedono un apporto di energia
P
P
+
P
Energia disponibile
Reazioni anaboliche
• Sono reazioni anaboliche tutte quelle razioni
metaboliche che richiedono un apporto di
energia.
1) Amminoacidi
Proteine
(sostanze semplici)
(sostanze complesse)
2) Sintesi di sostanze complesse (ormoni,
enzimi, DNA…)
Metabolismo
Catabolismo
Anabolismo
Stato solido : sostanza dotata di forma e volume propri
Solidi covalenti (molto duri)
Solidi ionici (meno duri)
Forze attrattive tra le
molecole
Legami covalenti tra tutti gli atomi
(diamante)
carbonio
Legame
Ionico nella
molecola
(sale da cucina)
IL carbonio
• IL carbonio grazie alla sua struttura atomica
(4 elettroni nell’ultimo livello) ha la
caratteristica di formare legami covalenti con
altri atomi di carbonio per formare strutture
molto stabili.
• Questa sua “qualità” biochimica ha fatto si
che le catene di atomi di carbonio siano la
struttura di base della gran parte delle
molecole biologiche della “vita”
Stato liquido: la sostanza assume la forma del
contenitore
Tensione
superficiale
• Le attrazioni tra molecole
sono presenti anche nei
liquidi, solo che sono più
deboli che nei solidi.
• Queste forze si evidenziano
nella curvatura superficiale di
Liquido in
un liquido in un contenitore
un contenitore
(tensione superficiale) e
dalla forma a sfera che
piccole particelle di liquido
tendono ad assumere
Goccia
di liquido
Soluzioni, sospensioni
• Per soluzione si intende la dispersione di una
sostanza (soluto) in una fase liquida (solvente)
• Il sale da cucina in soluzione acquosa è una
soluzione nel senso che il sale reagisce con
l’acqua e si scompone in ioni Na+ e Cl-.
• Raggiunto il limite di solubilità il soluto si
deposita sul fondo e la soluzione si dice satura.
• Si dice sospensione quando una sostanza non
reagisce e non si scioglie rimanendo in
sospensione : Argilla in acqua, olio in acqua.
VES (velocità di eritrosedimentazione)
Le strutture biologiche, in virtù della loro composizione presentano
una relativa distribuzione delle cariche negative e positive. I
globuli rossi presentano sulla membrana esterna solo cariche
negative.
Messi in contenitore in virtù della carica negativa essi si
respingeranno uno con l’altro non sedimentando
immediatamente alla base del contenitore
Col passare del tempo i globuli rossi cominceranno a morire
perdendo le cariche negative in superficie
Dopo un certo periodo di tempo i globuli rossi saranno tutti morti e
sedimenteranno sul fondo.
Qualsiasi fattore che limiti il numero di cariche negative sulla
membrana dei globuli rossi aumenterà la velocità di
sedimentazione dei globuli rossi sul fondo
VES
a
b
Dopo un
ora
Globuli rossi
c
d
Dopo
mezza
ora
(2)
In (a) abbiamo il sangue di un
individuo sano, i globuli rossi si
respingono e tendono a non
sedimentare.
Dopo un certo periodo di tempo
saranno tutti sul fondo (b)
In c abbiamo il sangue di un
individuo con una generica
infiammazione, in questo
individuo i globuli rossi sono
dotati di meno cariche negative
e sedimenteranno in un tempo
più breve.(d)
VES (3)
• La VES è un indagine generica che indica
la presenza di un processo infiammatorio (
da un infezione batterica al cancro)
• In laboratorio si misura l’altezza del
sedimento dopo un ora in una provetta.
Individuo sano: altezza sedimento 1-10 mm
Ammalato: altezza sedimento 90 – 100 mm
Equilibri
1
2
3
• Molte reazioni chimiche sono
reversibili, cioè la reazione
procede nei due sensi, non sempre
con la stessa velocità.
• La reazione 3 ci indica che l’H e il
Cl associandosi non formeranno
solo HCl ma che una parte
dell’HCl si dissocia riformando H e
Cl. Le 2 reazioni non procedono
con la stessa velocità, le 2 frecce
significano che la reazione è più
veloce verso sinistra.
4 • Il fatto che la reazione è sposata a
sinistra indica che l’HCl e presente
più in forma dissociata che
5
associata.
6
Forma dissociata
• Il rapporto tra la forma associata e
quella dissociata è sempre
Forma associata
costante, questa costante prende il
nome di costante di equilibrio
Soluzioni acide e basiche.
• Definiremo acida, una soluzione dove sono presenti
ioni H +
Definiremo basica una soluzione dove sono presenti ioni
OH• Definiremo neutra una soluzione dove la conc. di H+ e
OH – sono uguali.
• La misura dell’acidità e basicità ci viene data dal PH
PH 0
PH 14
PH 7
Neutro
(Cresce L’acidità)
(molti H+)
(cresce la basicità)
Molti OH-
Acidi e basi forti e deboli
(acido Cloridrico)
(acido Acetico)
(Soda caustica)
(Idrato di Ammonio)
• L’acido cloridrico e l’acido acetico
sono 2 acidi (rilasciano H+); però
l ’ HCl è molto più dissociato
dell’acido acetico, rilascia più ioni
H+, pertanto l’acido cloridrico è un
acido più forte dell’acido acetico.
• La soda caustica e l ’ idrato
d’ammonio sono 2 basi, la soda
caustica essendo più dissociata
sarà una base più forte, rilasciando
in soluzione più ioni OH- dell’idrato
d’ammonio.
• L’acqua è dissociata in ioni H+ e
OH-, ma essendo gli H+ e gli OHin numero uguale, l’acqua è neutra.
PH fisiologico
• Le reazioni fisiologiche avvengono nella
maggioranza a PH leggermente basico (7,4) a
parte alcuni liquidi fisiologici come il succo
gastrico PH 2, e la bile PH5
• Il plasma ha un PH di 7,4 e il Liquido
cerebrospinale ha un PH di 7,36.
• E’ fondamentale il mantenimento del PH
fisiologico.
• In genere il PH fisiologico si altera verso l’acidità
• L’organismo mette in atto diversi sistemi (sistemi
‘Tampone’) per il ripristino del PH fisiologico (tutti
finalizzati, in caso di acidosi, a togliere o neutralizzare
ioni H+)
Soluzioni tampone
Le soluzioni tampone sono reazioni in cui gli ioni H+ dissociati (che creano
acidità) sono combinati con dei sali. Lo ione H+ combinato perde la natura di
ione e non influisce più sul valore dell’acidità.
H+ +
HCl
NaHCO3
Na+
Cl - (situazione di iperacidità gastrica)
+ HCO3- (ingestione di sale )
Gli ioni H+ dell’ HCl si andranno a combinare con lo ione carbonato (HCO3 -)
a formare l’acido carbonico. L’acido carbonico è poco dissociato pertanto
rilascia pochi ioni H+ in soluzione.
H+
+
HCO3-
H2CO3
Da un punto di vista strettamente quantitativo molti atomi di idrogeno sono
passati da una forma dissociata ad una associata e questo alza il PH
diminuendo l’acidità della soluzione
Ossa e acidosi 1
ossa
sangue
(1)
Ca(HCO)2
Ca+ + HCO3
In caso di acidosi
c’è un aumento di
(2)
H+ nel sangue
H+ H+ H+
H+ HCO3-
H2CO3
-
Il bicarbonato di calcio
(costituente delle ossa) è in
equilibrio con i suoi ioni sciolti
nel sangue.
(3)
Lo ione HCO3si combinerà
con H+
formando H2CO3
poco dissociato
e l’acidità
diminuisce
Ossa e acidosi 2
La perdita di ioni HCO3- andati a tamponare l’acidità comporta un
aumento della dissociazione del Ca(HCO3), per il rispetto della costante
di equilibrio. (se calano gli ioni deve calare anche il sale)
Ca(HCO)2
Ca+ + HCO3(a combinarsi con H+)
(aumento del calcio ematico con il
rischio di calcoli)
Diminuzione della
densità minerale
ossea
conseguenze
Reni ed Acidosi
reni
H+
H+
Na+
Na+
sangue
H+
Na+
H+
H+
Na+
Na+
1) I reni possono togliere ioni H+ dal
sangue ed eliminarli con l’urina
2) L’eliminazione degli H+ comporta da
parte del rene una immissione nel
sangue di ioni Na +. Questo scambio
avviene per rispettare l’equilibrio tra
cariche positive e negative nel sangue.
(un positivo escreto un positivo
riassorbito)
Cause di acidosi
•
•
•
•
Insufficienza respiratoria
Digiuni prolungati
Dieta iperlipidica e iperproteica
Errori alimentari.
Un’alimentazione che contrasta l’acidosi è ricca di Sali minerali.
I Sali minerali esplicano la stessa funzione del bicarbonato di calcio:
tamponano l’acidità e fanno in modo che il bicarbonato di calcio
rimanga nelle ossa.
Gli alimenti ideali ricchi di Sali minerali sono le verdure
Pressione osmotica
• La pressione osmotica è una grandezza da
considerare relativamente al volume degli ioni
in una soluzione.
Caratteristiche dell’acqua:
• Possibilità di formare legami idrogeno
• Alta tensione superficiale
• Elevata capacità di trattenere il calore
• Ottimo solvente
• Reagente in molte reazioni metaboliche
“Spinta” del solvente
solvente
soluto
In 2 contenitori separati da
membrana impermeabile al
soluto ma non al solvente, se la
concentrazione del soluto è
uguale nei 2 contenitori, non si
genera nessun flusso (soluzioni
isotoniche)
Pressione Osmotica 2
a
b
Se la concentrazione di soluto è più
alta nel contenitore a (soluzione
ipertonica), si genera un flusso di
solvente da b verso a : flusso
passivo dalla soluzione più diluita o
ipotonica a quella più concentrata.
La “spinta” del solvente tende a far
alzare il livello della soluzione nel
contenitore a . Questa “spinta”
prende il nome di Pressione
Osmotica
A
Cellule e pressione osmotica
B
Na
Na
Mg
Mg
k
Na
k
k
ioni
Na
Na
Se una cellula si trova immersa in un
ambiente ipotonico si genera un
flusso osmotico di liquido verso
l’interno della cellula.
Na
Na
Na
Na
Se una cellula si trova immersa in un
ambiente ipertonico si genera un
flusso osmotico li liquido dalla cellula
verso l’esterno
Il flusso osmotico è relativo alla concentrazione di ioni fuori e dentro la cellula.
Per esempio: una cellula può aumentare la concentrazione di ioni al suo interno
fino ad avere una concentrazione di ioni più alta di quella presente nel liquido
extracellulare e passare dalla situazione B alla situazione A.
Pressione osmotica e capillari
P.idrostatica
Capillari arteriosi
P. Osmotica
Capillari venosi
I capillari sanguigni sono strutture fenestrate in grado di scambiare con
l’ambiente esterno ( gas, nutrienti, cataboliti…)
I Capillari arteriosi trapassano nei capillari venosi.
2 tipi di pressione agiscono a livello dei capillari: 1) la pressione idrostatica,
che è la pressione esercitata dal cuore, che tende a spingere i liquidi verso
l’esterno e 2) la pressione osmotica che in virtù degli ioni sciolti nel sangue
tende a richiamare i liquidi verso l’interno.
A livello dei capillari arteriosi prevale la pressione idrostatica per cui
prevarranno i processi espulsivi (ossigenazione e rinnovo tessuti)
A livello dei capillari venosi prevale la pressione osmotica, pertanto saranno
più attivi i processi di rimozione dai tessuti.
Liquidi corporei
• I liquidi corporei, in generale, risultano composti per il
90% di acqua e per il rimanente 10 % di ioni, proteine,
gas, cataboliti…
• Nel corpo umano questi liquidi sono distinti in 2 tipi:
• 1) liquidi intracellulari (sono i liquidi dentro le cellule)
• 2) liquidi extracellulari (tutti i liquidi fuori dalle cellule)
cioè sangue, liquido interstiziale, linfa, liquido
cerebrospinale…
Questi 2 liquidi si differenziano, in generale, per il fatto
che i liquidi intracellulari sono ricchi di potassio mentre
i liquidi extracellulari sono più ricchi in sodio.
Liquidi corporei 2
• La distribuzione dei liquidi corporei e regolata
principalmente dalla pressione osmotica e da
quella cardiaca.
• Una alterazione della pressione cardiaca può
alterare questa distribuzione
• Una anomala distribuzione di ioni può
modificare la pressione osmotica e creare una
alterata distribuzione di liquidi corporei.
• Chiameremo edema un accumulo di liquidi
negli spazi interstiziali fra le cellule dei tessuti,
dovuto a una alterazione dell’equilibrio tra
pressione cardiaca e pressione osmotica.
Edema 1
Fisiologico richiamo osmotico
(1) Alterazione della permeabilità
dei vasi (per es: allergie ->
istamina) con fuoriuscita di ioni
(2) Anomalo richiamo osmotico di
liquido in una cavità interstiziale con
formazione di edema
Edema 2
Richiamo
osmotico
Le proteine nel sangue sono più o meno
costanti ed esercitano una fisiologica
attrazione osmotica a carico dei liquidi
extracellulari.
Richiamo osmotico
diminuito
edema
I digiuni prolungati fanno calare
drasticamente la concentrazione di
proteine nel sangue e
conseguentemente diminuirà il richiamo
per osmosi dei liquidi extracellulari, che
ristagneranno negli spazi interstiziali,
formando edema
Edema 3
Sangue venoso
fegato
Sangue venoso
Il fegato “filtra” il sangue venoso proveniente dall’apparato digerente
fegato
Se il fegato è ipofunzionale e danneggiato nella struttura (cirrosi, tumore)
non riesce a filtrare efficacemente il sangue che tenderà a fuoriuscire dai
vasi causando edema e rischio di emorragie addominali
Edema 4
ostruzione
linfa
edema
Il circolo linfatico è un sistema circolatorio privo di
una forza propulsiva, come lo è il cuore per il
circolo sanguigno.
Al suo interno scorre la linfa che circola grazie alla
contrazione muscolare.
Ostruzioni dei vasi o scarsa attività muscolare
possono causare edema.
Caratteristiche degli esseri viventi
• Crescere e svilupparsi
• Scambiare energia con l’esterno
• Possedere informazioni relative alla propria
organizzazione
• Essere in grado di riprodursi trasmettendo le
informazioni relative alla propria organizzazione
• Essere in grado di adattarsi all’ambiente.
Fanno eccezione a queste regole i virus e i prioni
Composizione del corpo umano
• Il corpo umano risulta composto per il 60-70%
di acqua di cui il 60% è intracellulare e il 40% è
extracellulare.
• Composizione in bioelementi
1) Per il 96% in peso risulta composto da:
Ossigeno, Carbonio, Idrogeno e Azoto e per il
3,3% da: Calcio, Fosforo, Zolfo, Potassio,
Sodio, Cloro e Magnesio, nel loro insieme
definiti MACROCOSTITUENTI.
2) Per lo 0,7% da Iodio, Fluoro,Ferro, Zinco,
Bromo, Silicio, Rame e altri, che nel loro
insieme sono definiti MICROCOSTITUENTI.
IL carbonio
Il carbonio grazie alla caratteristica di formare 4 legami covalenti stabili con
altrettanti atomi e/o molecole è in grado di creare strutture molecolari stabili
e anche molto grandi.
Quasi tutte le molecole biologiche: carboidrati, lipidi, proteine, DNA, RNA…
hanno un “telaio” di atomi di Carbonio. ( un po’ come il mattoncino del Lego)
H
H
C
H
Atomo di Carbonio che
forma 4 legami covalenti
con 4 atomi di idrogeno
(catena carboniosa)
H
C
C
C
C
C
C
Elettroni disponibili per legami covalenti
con atomi e/o molecole
=
La linea
sottintende 2
elettroni
Glucosio
Serina (amminoacido)
Catena carboniosa satura
nessun doppio legame
(molto stabile)
Catena carboniosa insatura 1 doppio
legame (instabile)
Catena carboniosa insatura 1 triplo legame
(molto instabile)
“Nuovi” legami con i
2 atomi di idrogeno
“Nuovo” legame
tra i 2 atomi di
carbonio
L’atomo di carbonio tende a instaurare dei legami semplici per avere maggiore
stabilità.
La catena carboniosa insatura, in presenza di una molecola di idrogeno,
spezza il doppio legame tra i 2 atomi di carbonio.
I 2 atomi di carbonio si legano rispettivamente, con un legame covalente, ai 2
atomi di idrogeno.
Ai 2 atomi di carbonio rimane un elettrone disponibile ciascuno che mettono in
comune per un legame covalente
Glucidi
CO2
energia
amido
Clorofilla
Fruttosio
CO2 + H2O
GLUCIDI
cellulosa
H2O
Cellulosa
Amido
Fruttosio
GLUCIDI
Monosaccaridi
I monosaccaridi
sono composti
da un’unica
molecola
Fruttosio
F
Si trova libero e combinato
nel mondo vegetale
Galattosio
Ga
Non si trova
libero negli
organismi
Glucosio
Gl
Si trova libero e
combinato nel mondo
animale e vegetale
Disaccaridi
Gl
F
Saccarosio
Largamente
diffuso nel
mondo vegetale
I disaccaridi risultano composti
dall’unione di 2 molecole
Ga
Gl
Lattosio
Sintetizzato dalle
ghiandole
mammarie
Gl
Gl
maltosio
Presente nel mondo
vegetale come fase
intermedia della
scomposizione
dell’amido
Polisaccaridi
I polisaccaridi sono costituiti da lunghe catene di molecole di monosaccaridi,
più o meno ramificate. (le lunghe catene di molecole prendono in generale il
nome di polimeri)
= Glucosio
Amido
Glicogeno
Cellulosa
Cellofan
Polisaccaridi : proprietà
Amido, glicogeno, cellulosa sono polimeri costituiti da
molecole di glucosio ma il diverso orientamento spaziale
conferisce loro caratteristiche diverse:
•AMIDO: la Ptialina salivare e gli enzimi pancreatici
riescono a digerirlo e scomporlo in molecole di glucosio
•GLICOGENO: il glicogeno viene sintetizzato
dall’organismo umano partendo dal glucosio, in caso di
necessità il glicogeno viene scomposto in molecole di
glucosio che viene utilizzato a fini energetici
•La CELLULOSA non viene scissa dai succhi digerenti e
il glucosio non può essere utilizzato. Riveste però un
ruolo nutrizionale importante in quanto è componente
fondamentale della fibra alimentare.
Lipidi
Acidi grassi
(saturo)
(monoinsaturo)
(polinsaturo)
(omega 6) 2 doppi legami
• I lipidi sono molecole
che hanno la
caratteristica di avere
nella loro molecola uno
o più acidi grassi
• La natura dell’acido
grasso determina le
proprietà del lipide
(omega 3) 3 doppi legami
Gli acidi grassi sono catene carboniose
da 4 a 20 atomi di carbonio con un
gruppo ( COOH) alla fine. Possono
avere zero, uno o più doppi legami
• La presenza di doppi
legami rende l’acido
grasso più
instabile.(tende a
traformarli in due legami
semplici ciascuno)
Gliceridi
I gliceridi sono lipidi formati dall’unione di una molecola di glicerina e da uno
a tre acidi grassi
G
L
I
C
R
I
N
A
Acido grasso
OH
OH
Monogliceridi
G
L
I
C
R
I
N
A
Acido grasso
Acido grasso
Digliceridi
OH
G
L
I
C
R
I
N
A
Acido grasso
Acido grasso
Acido grasso
Trigliceridi
La natura dell’acido grasso determina lo stato fisico del lipide: Gli acidi grassi
insaturi sono più fluidi dei saturi, perciò i lipidi vegetali, in genere più ricchi di
grassi insaturi, a temperatura ambiente saranno liquidi; mentre quelli animali,
composti di grassi saturi, saranno solidi.
Dal punto di vista del metabolismo umano i gliceridi, sotto forma di trigliceridi,
si accumulano nei tessuti in forma di grasso corporeo (adipe)
Fosfogliceridi
G
L
I
C
E
R
I
N
A
Acido grasso
Acido grasso
Acido fosforico
I fosfogliceridi sono formati dalla
unione di una molecola di glicerina
con 2 acidi grassi e una molecola di
acido fosforico.
Sono componenti importanti delle
membrane cellulari
Le membrane cellulari sono determinanti nel definire una buon
funzionamento dell’attività cellulare.
La natura degli acidi grassi dei fosfogliceridi è in buona parte definito dal
tipo di alimentazione.
Un alimentazione ricca di grassi saturi definirà una membrana “infarcita”
di acidi grassi saturi, meno fluida: ciò renderà tutti i processi metabolici a
livello di membrana meno funzionali.
Sfingolipidi
Alcol
sfingosina
Acido grasso
Gli sfingolipidi sono formati
dalla unione di una molecola
di sfingosina, un alcol e un
acido grasso. Formano la
guaina di Mielina che avvolge
i neuroni
fibra nervosa
Guaina di mielina
I neuroni sono cellule del tessuto nervoso in grado di condurre l’impulso
motorio e sensoriale; la guaina di mielina è fondamentale per la funzionalità del
neurone. Alcune malattie degenerative del sistema nervoso (sclerosi multipla)
sono state collegate alla carenza di grassi insaturi nella dieta, che può alterare
la sintesi della mielina e una guaina meno funzionale.
Lipoproteine
proteina
trigliceride
colesterolo
I lipidi, non essendo solubili nel sangue,
per essere veicolati debbono legarsi ad
una proteina.
Esistono diversi tipi di lipoproteine a
secondo del “tragitto” fisiologico che
devono percorrere.
Chilomicroni : dal digerente al fegato
LDL: Dal fegato alla periferia (colesterolo ‘cattivo’)
HDL: Dalla periferia al fegato.
I tipi di grassi assunti col cibo influenzano la sintesi delle lipoproteine.
Gli acidi grassi insaturi omega 3 (e omega 6) favoriscono la sintesi delle
HDL; oltre ad altri accorgimenti alimentari e abitudini di vita
Prostaglandine
Acido grasso
Molecole formate da un anello a 5
atomi di carbonio e 2 catene laterali
ad una delle quali è legata un acido
grasso.
Gruppo di molecole ad attività ormonale sintetizzate direttamente dalle
cellule.
Agiscono su pressione del sangue, aggregazione piastrinica, modulazione
del sistema immunitario e metabolismo glucidico e lipidico.
Le prostaglandine agiscono in modo antitetico : se una aggrega le piastrine,
un’altra le disaggrega, se una stimola l’immunitario, un’altra lo deprime:
attraverso le Prostaglandine le cellule influenzano direttamente la fisiologia
dei tessuti di cui fanno parte.
Per la sintesi delle Prostaglandine sono fondamentali gli acidi grassi
polinsaturi che devono essere introdotti con l’alimentazione.
Una carenza relativamente a questi nutrienti, può provocare una
sbilanciamento nella sintesi delle Prostaglandine.
Altri lipidi
Alcune molecole di interesse biologico, anche se prive di acidi grassi,
vengono classificate come lipidi. Due di queste sono l’Isoprene e il
Ciclopentanodeidrofenandrene da cui derivano:
Oli essenziali
isoprene
Sostanze aromatiche
Vit. A, E, K
Colesterolo
Ormoni
Ciclopentanodeidrofenandrene
Vit D
Proteine
• Rappresentano il 50% del peso secco del corpo
• Sono costituite da polimeri più o meno lunghi
composti da vari fra 20 tipi di amminoacidi
Sono fondamentali in quasi tutte le funzioni
metaboliche:
1)Struttura contrattile dei muscoli
2)Trasporto gas respiratori
3) Funzioni strutturali: composizione ossa e
connettivi
4) Immunitario : composizione degli anticorpi
5) Composizione degli enzimi
6) Composizione di molti ormoni
Amminoacidi
H
NH2
C
COOH
CH2OH
(Amminoacido Serina)
Gli amminoacidi che costituiscono le
proteine umane sono venti. Sono tutti
costituiti da un carbonio centrale legato a
4 gruppi. Tutti gli amminoacidi hanno i
gruppi NH2 e COOH e differiscono tra
loro per la diversa composizione degli altri
gruppi o radicali (in rosso nella figura)
NH2
Alanina
COOH
NH2
Serina
NH2
Glicina
COOH
NH2
Lisina
Alcuni amminoacidi in struttura semplificata
COOH
COOH
Struttura delle proteine
Gli amminoacidi si legano tra loro con i rispettivi gruppi COOH e NH2
formando catene anche lunghe migliaia di unità.
….
CONH
CONH
….
Nella formazione
del legame si libera una
molecola di H2O
L’organismo partendo dai 20 amminoacidi sintetizza tutte le proteine per le
proprie esigenze metaboliche e strutturali.
Durante questo lavoro di sintesi è importante la presenza di tutti i 20
amminoacidi. 10 di questi se non sono presenti, l’organismo riesce a
fabbricarli, i rimanenti 10 l’organismo non riesce a fabbricarli e devono
essere introdotti con l’alimentazione. Questi ultimi prendono il nome di
amminoacidi essenziali.
Struttura spaziale delle proteine
Il lungo polimero degli amminoacidi di una proteina assume, in virtù
principalmente dei legami idrogeno, forme globulari a volte molto complesse
amminoacidi
Enzimi
Le reazioni metaboliche (digestione, assimilazione, contrazione
muscolare…) avvengono tutte a 37 gradi, a pressione atmosferica ed in
tempi relativamente brevi. Questo è reso possibile dagli Enzimi.
Un enzima è una proteina che favorisce la velocità di una reazione,
rendendo possibile il fatto che le reazioni metaboliche possano avvenire in
frazioni di secondi; le stesse reazioni, senza l’azione enzimatica,
avrebbero tempi incompatibili con la vita!
Ogni enzima è altamente specifico, nel senso che favorisce solo una
reazione (per es. per arrivare da A a E ci sono 4 reazioni intermedie)
Enzima 2
Enzima 1
A
b
Enzima 3
c
Enzima 4
d
E
Metabolismo
Tramite l’alimentazione l’organismo assume
grassi, proteine e glucidi; prima di essere
utilizzati per il proprio metabolismo questi
nutrienti debbono essere scomposti attraverso
l’apparato digerente in:
•Glucidi: in Glucosio
•Proteine: in Amminoacidi
•Lipidi: in Acidi Grassi
Metabolismo dei glucidi
= glucosio
= galattosio
Amido
Saccarosio
= fruttosio
Lattosio
Maltosio
Piatto
Bocca
Stomaco
Duodeno
Cellule
intestinali
Fegato
(sintesi glicogeno)
Glucosio finale
(produzione energia)
Zuccheri nel sangue
• La glicemia misura il tasso di glucosio nel
sangue: il suo valore, a digiuno, deve essere
attorno al grammo per litro.
• Il fruttosio incide poco sulla glicemia in quanto
deve essere trasformato in glucosio nel fegato
e viene in buona parte convertito in trigliceridi.
• La cosiddetta intolleranza al Lattosio è in realtà
una carenza di enzima lattasi. La carenza di
questo enzima, che scinde il lattosio a glucosio
e galattosio, lascia indigerito il lattosio
nell’intestino, dove per osmosi attira acqua,
causando diarrea.
amminoacidi
Metabolismo Proteico
Proteine alimentari
Nello stomaco, grazie
alla pepsina le
proteine sono scisse
in frammenti (peptoni)
Nel duodeno grazie agli enzimi
pancreatici abbiamo la liberazione
degli amminoacidi
Gli amminoacidi digeriti nel duodeno sono inviati al fegato dove possono:
1) Essere convertiti in altri amminoacidi
2) Usati per la sintesi di proteine
3) Inviati ad altri distretti per la sintesi di proteine
4) Metabolizzati per produrre energia (in mancanza d’altro)
(1)
Metabolismo lipidico
LDL
(4)
(Lipidi alimentari)
colesterolo
HDL
trigliceridi
Fegato
arrivano indigeriti nel duodeno dove grazie
alla bile e alla lipasi pancreatica sono
scomposti in
(2)
Acido grasso
(3)
Acido grasso
Acido grasso
glicerina
proteina
trigliceridi
colesterolo
colesterolo
monogliceridi
All’interno delle cellule
intestinali vengono
sintetizzati i
Chilomicroni ed inviati
al fegato
Principi nutrizionali
• Dopo la digestione i nutrienti vengono
scomposti fondamentalmente in 3 principi
nutrizionali : Glucosio, amminoacidi e acidi
grassi.
• Glucosio: utilizzato a scopo energetico
• Acidi grassi: utilizzati a scopo funzionale e
energetico
• Amminoacidi: utilizzati a scopo plastico,
funzionale ed eventualmente energetico.
Produzione energetica dal glucosio
Cellula
2 mol.
O
Acido
lattico
S
S
G
Glicolisi
anaerobica
Acetil
Co A
N
I
E
O
mitocondrio
glucosio
8 molecole
di ATP
Ciclo di Kreps
Glicolisi
Aerobica
30molecole
di ATP
H2O
CO2
Glicolisi anaerobica e ciclo di Kreps
• La produzione energetica dal glucosio nella cellula
avviene in 2 fasi
• Il glucosio viene demolito attraverso una serie di
reazioni, in assenza di ossigeno, a 2 molecole di acido
lattico queste reazioni sviluppano una quota
energetica di 8 molecole di ATP.
• Successivamente l’acido lattico, dopo essere
trasformato in Acetil CoA entra dentro i mitocondri
dove reagendo con l’ossigeno sviluppa 30 molecole di
ATP producendo come residuo acqua ed anidride
carbonica.
• La reazione di demolizione dell’acido lattico a CO2,
H2O, con produzione di ATP viene definita
OSSIDAZIONE
Produzione energetica dai lipidi
La demolizione degli acidi grassi a scopo energetico avviene dentro i
mitocondri
Vengono staccati 2 atomi di carbonio alla volta, trasformati in Acetil CoA, ed
immessi nei mitocondri per l’ossidazione
O2
COOH-CH2-CH2-CH2-CH3
Acetil CoA
Acido grasso
ATP
CO2
H2O
Se la produzione energetica avviene solo a scapito dei lipidi, come nel caso
di digiuno o di un’alimentazione iperlipidica, abbiamo un eccesso di
produzione di Acetil CoA (demolizione tumultuosa), i quali non riescono ad
entrare tutti dentro i mitocondri. La conseguenza sarà che gli Acetil CoA
eccedenti si combineranno tra loro formando acidi (corpi chetonici) ,
creando acidosi metabolica
Produzione energetica dalle proteine
amminoacido
COOH
H-C-NH2
CH2OH
COOH
H-C
Acetil CoA
CH2OH
ATP
Deaminazione
O2
CO2
H2O
La produzione energetica dagli amminoacidi da un punto di vista metabolico
non è conveniente. Comporta una perdita di massa magra (Gli amminoacidi
nel sangue sono in parte di origine alimentare e in parte provengono dalle
proteine corporee ); per essere immessi nel ciclo di Kreps gli amminoacidi
debbono essere privati del radicale ammonio (deaminazione).
Il radicale ammonio è tossico e viene eliminato dal fegato e reni. Un eccesso
proteico nell’alimentazione può pertanto comportare un affaticamento renale
ed epatico ed un accumulo di radicale ammonio nel sangue.
Energia ed eccessi ponderali
• L’ Acetil CoA è l’imbuto metabolico in cui
convergono: Glucidi, Lipidi e Proteine.
• Si è visto che un’alimentazione iperlipidica
porta, per un eccesso di Acetil CoA, alla
formazione di corpi chetonici.
• Un’altra strada che possono percorrere gli
Acetil CoA (qualunque sia la loro provenienza)
è il percorso inverso, cioè la formazione di acidi
grassi e depositarsi come eccesso lipidico nei
tessuti.
Tessuti che “funzionano” solo a glucosio
• Si è visto che per le proprie esigenze
energetiche le cellule possono “bruciare”
glucosio, proteine e grassi.
• Alcuni tessuti (cellule nervose e gonadi) non
sono in grado di “bruciare” grassi e proteine e
debbono sopperire alle proprie esigenze
energetiche solo con il glucosio.
• In caso di carenza il glucosio il fegato può
trasformare l’acido lattico, il glicerolo e gli
amminoacidi in glucosio con cui rifornire le
cellule nervose e le gonadi (Neoglucogenesi)
Metabolismo dell’alcol etanolo
• L’etanolo viene assorbito agevolmente nello
stomaco e lungo tutto l’intestino. In parte viene
eliminato come tale attraverso reni e polmoni, e
il resto trasformato in acido acetico nel fegato.
L’acido acetico può essere trasformato in Acetil
CoA ed entrare nelle reazioni correlate. Come
nelle diete iperlipidiche, l’Acetil CoA viene
prodotto in modo “tumultuoso” con conseguente
acidosi e accumulo di grasso nel fegato
(steatosi). Inoltre l’energia prodotta viene
dissipata in calore e non utilizzata a fini
metabolici.
La cellula
• E’ l’unità biologica alla base di tutti gli esseri viventi.
• Struttura delimitata da una membrana flessibile e
dinamica attraverso cui avvengono gli scambi con
l’ambiente e le altre cellule.
• All’interno della membrana si trova il citoplasma dove
avvengono i processi metabolici cellulari
• E’ dotata di un nucleo di materiale genetico o DNA
contenente le informazioni relative al suo metabolismo
• Le sue informazioni possono essere trasmesse alla
progenie
• Le cellule hanno dimensioni da 10 a 100 micron
( 1 micron = 1millesimo di millimetro).
Cellula procariote
• Dal punto di vista evolutivo è la più antica forma
di organizzazione cellulare
• Nel citoplasma non sono presenti organelli
• Il materiale genetico è organizzato in una unica
molecola di DNA
• Non sono mai organizzate in tessuti e sono
presenti solo allo stadio di vita unicellulare
• Hanno struttura Procariote alcune alghe
unicellulari ‘azzurre’ (per es. Chlorella, Klamath,
Nori, Spirulina..) e tutti i batteri.
Cellula eucariote
• Sono cellule più grandi, complesse ed evolute
rispetto le procariote
• Le funzioni metaboliche avvengono in definite
strutture (organelli), dentro il citoplasma.
• Il materiale genetico (DNA) è organizzato in
cromosomi dentro il nucleo.
• E’ presente anche allo stadio di vita
unicellulare (Ameba, Tripanosoma)
• Tutti gli organismi pluricellulari sono formati da
cellule eucariote (dalla spugna all’uomo)
Cellula
Reticolo endoplasmatico
(sintesi dei lipidi)
membrana
Ribosomi
(sintesi proteica)
mitocondri
Lisosomi
(contengono
enzimi
digestivi)
Nucleo
Con
cromosomi
Apparato del Golgi
(sistema vescicolare
dove vengono accolte
ed escrete le proteine)
Filamenti proteici
(citoscheletro)
Cellule differenziate.
• In un organismo pluricellulare le cellule sono
organizzate in vari tipi di tessuti.
• Ci sono tessuti contrattili, secernenti, di
sostegno, eccitabili, di deposito e altri.
• All’inizio dello sviluppo dell’organismo (fase
embrionale) le cellule sono indifferenziate
(staminali), poi maturando si differenziano
acquistando le caratteristiche relative al tessuto
di appartenenza.
• Le cellule costituenti i differenti tessuti hanno
caratteristiche morfologiche e biochimiche
diverse.
Cellula nervosa (neurone) molto specializzata, eccitabile,
conduce lo stimolo, molto attiva metabolicamente, lunga
fino a 45 cm.
Cellula epatica : molto attiva la sintesi proteica
Cellula muscolare (miofibrilla) ricca di filamenti proteici e mitocondri
emoglobina
trigliceridi
Globulo rosso (eritrocita) cellula senza nucleo, vita breve,
privo di organelli, è pieno di emoglobina.
Adipocita : cellula del tessuto adiposo, ha
l’aspetto di un enorme sacca (vacuolo) piena di
trigliceridi; organelli e nucleo sono schiacciati
contro la membrana.
lisosomi
Leucocita (macrofago) cellula competente
del sistema immunitario, molto mobile, in
grado di fagocitare (inglobare) sostanze e
materiali, e distruggerli grazie ai lisosomi.
Spermatozoo : Cellula aploide riproduttiva
dotata di un lungo flagello mobile (coda)
di natura proteica.
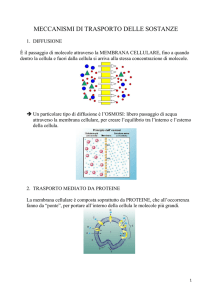
Membrana plasmatica cellulare
• Tutte le cellule sono dotate di membrana.
• Tutti i processi metabolici e osmotici di scambio
con l’ambiente esterno avvengono attraverso la
membrana.
• Gli acidi grassi rivestono un ruolo fondamentale
nella funzionalità di membrana, nel senso che
la qualità degli stessi, determina la qualità degli
scambi di membrana.
• Gli acidi grassi omega 3 e 6 danno alla
membrana quella struttura a “mosaico fluido”
che determina una fisiologica attività di
membrana
Struttura della membrana plasmatica
esterno
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
Testa polarizzata
+
-
+
-
+
-
+
-
Membrana costituita da un
“ mosaico” di molecole di
fosfogliceridi con una testa polare
e una coda costituita da 2 acidi
grassi, non polarizzati
+
+
interno
+
-
+
-
+
-
+
-
Acidi grassi
La presenza di grassi
saturi e colesterolo
rende la membrana
rigida, meno fluida
con compromissione
degli scambi
attraverso la
membrana
+
-
Colesterolo
Grassi
insaturi
Grassi
saturi
Canalicolo = struttura
proteica di membrana
esterno
+
+
-
(2)
+
-
(1)
+
-
(3)
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
interno
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
Le sostanze polari non possono attraversare la membrana in quanto respinte
dalle cariche + e – della superficie (1)
Le sostanze non polari (lipidi) possono attraversare la membrana (2)
Le sostanze polarizzate possono attraversare la membrana in corrispondenza
delle strutture canalicolari costituite da proteine, che ne consentono il
passaggio (3)
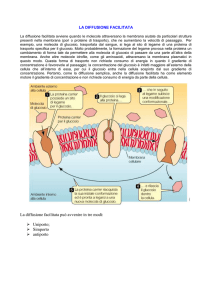
Proteine di membrana
• Le proteine di membrana sono strutture per il
trasporto di sostanze (soluti). Esse si legano al
soluto e lo veicolano all’interno della cellula.
• Possono veicolare sostanze ionizzate e
molecole come: ormoni, enzimi, zuccheri …
modulando la loro entrata a seconda delle
esigenze cellulari.
• Il consumo di energia (ATP) delle proteine di
membrana dipende dalla concentrazione del
soluto dentro e fuori la membrana: passaggio
osmotico (senza consumo di ATP) o trasporto
attivo (con consumo di ATP)
Doppio strato lipidico
Concentrazione
esterna bassa
di soluto
Fuori
Proteina di trasporto
Dentro
ADP
ATP
soluto
Trasporto di membrana con dispendio energetico
Trasporto con dispendio energetico = trasporto attivo: la proteina di
membrana consuma ATP per trasportare un soluto da un ambiente dove
questo è meno concentrato ( fuori dalla cellula) a dentro la cellula dove il
soluto è più concentrato.
Concentrazione esterna alta di soluto
Fuori
Dentro
Trasporto di membrana senza dispendio energetico
Il flusso di soluto da fuori la cellula, dove questo è più concentrato, a
dentro la cellula dove questo è meno concentrato avviene attraverso la
proteina di membrana, senza dispendio energetico (flusso osmotico).
(A)
Trasporto relativo alle cariche del soluto
+
+
+
+
+
+
+
+
energia
+
(B)
+
+
-
Il consumo energetico per il
trasporto del soluto è
elevato nella situazione (A),
dove gli ioni interni e ioni
esterni possiedono la
stessa carica.
+
-
+
+
+
+
energia
+
La maggiore richiesta
energetica serve a vincere
la naturale repulsione tra
cariche uguali.
Nella situazione (B), a parità
di soluto introdotto la
richiesta energetica sarà più
bassa di (A) in quanto il
flusso sarà facilitato dalla
naturale attrazione tra
cariche diverse.
Cavità gastrica
Sangue
H+
Cellula
gastrica
H+
H+ H+ H+
H+ H+ H+
H+
H+
H+
H+
Conc. H+
Bassa
PH 7
H+
L’acidità molto forte nello stomaco
è creata dalle cellule gastriche
(mucosa gastrica) che sono
interposte tra il sangue e la cavità
gastrica.
H+ H+ H+
H+ H+ H+
H+
La concentrazione di ioni H+ è
molto alta nello stomaco (PH 2)
mentre nel sangue è bassa (PH 7).
H+ H+ H+
H+ H+
Conc H+
Alta
PH 2
Esse introiettano da un polo, quello
verso il sangue, ioni H+, e
“spingono” gli stessi ioni H+ nella
cavità gastrica attraverso il polo
opposto.
Questo tipo di trasporto prende il
nome di Trasporto Transcellulare in
quanto attraversa tutta la cellula e
riesce a creare concentrazioni
molto alte di ioni H+nello stomaco.
Pompa Sodio- Potassio
+
2 K+
ATP
3 Na+
esterno
ADP
interno
La concentrazione intracellulare di K è circa
15 volte quella del Na, mentre quella
extracellulare è circa l’inverso.
Questa differenza di concentrazione è
mantenuta dall’espulsione attiva (con
consumo di energia) di 3 ioni Na+ fuori dalla
cellula e dalla loro sostituzione con 2 ioni K+
dentro, da parte di una proteina di trasporto di
membrana (pompa Sodio-Potassio).
La pompa Sodio-Potassio trasportando 3 ioni
Na positivi fuori e 2 ioni positivi dentro
contribuisce a creare una disuguale
distribuzione di cariche tra l’esterno e interno
la membrana in modo che l’esterno risulta
positivo e l’interno negativo. Concentrazioni di
Potassio alte sono fondamentali per:
1)Sintesi proteica
2) Sintesi enzimatica
3) Mantenimento del potenziale di membrana
( positivo fuori, negativo dentro)
Potenziale di membrana
+
+
-
+
- +
-
+
-
-
+
+
La differente distribuzione di
cariche, viene misurata
come potenziale di
membrana, le cellule hanno
un potenziale di membrana
di - 60 millivolt
0
+
- 60 millivolt
+
-
La differente distribuzione di cariche della membrana, viene definita
MEMBRANA POLARIZZATA (nel senso che presenta 2 polarità)
Neurone a riposo (polarizzato) -60
Potenziale a
riposo
1
Uno stimolo provoca in un punto un
Inversione di polarità +30 (depolarizza)
2
Potenziale di
eccitazione
+
+
Il punto depolarizzato si ristabilizza
mentre si depolarizza quello adiacente
3
4
mielina
La depolarizzazione (per punti)
prosegue per tutta la fibra
Lo stimolo, punto x punto, percorre tutta la fibra fino al prossimo neurone, che
a sua volta, sarà stimolato dalla depolarizzazione e la trasmetterà.
Virus
DNA
virale
DNA
virale
DNA
cellulare
DNA
virale
DNA
virale
Il virus introduce il proprio DNA dentro la cellula infettandola.
Il DNA virale, usando i materiali e organelli della cellula,
replica se stesso e si moltiplica.
Quando la cellula muore i virus fuoriescono e possono
trasmettere l’infezione ad altre cellule.
DNA
virale
Proteina
sana
Prioni
Prione
1
2
La proteina anomala (Prione) si “stende” su
una proteina sana e la modifica rendendola
uguale a se stessa e disfunzionale.
L‘alterazione continua fino alla totale
modifica del tessuto.
Metabolismo autotrofo ed eterotrofo
• Per metabolismo autotrofo si intende il
metabolismo di quegli organismi in grado di
utilizzare la luce solare per la sintesi dei glucidi
partendo dall’acqua e dalla anidride carbonica.
• Per metabolismo eterotrofo si intende il
metabolismo di quegli organismi che non sono
in grado di produrre glucidi e se li devono
procurare ingerendo altri organismi.
Procarioti
Eucarioti
Unicellulari
unicellulari
Eucarioti
pluricellulari
Evoluzione e complessità
Alghe azzurre
Batteri
Amebe
Flagellati
Funghi
Funghi
Alghe
Vegetali
Animali
Uomo
Microrganismi come patogeni (batteri)
• Alcuni batteri si possono insediare su tessuti
umani e tramite il loro sviluppo produrre tossine
e infiammazione, con decorso a volte molto
severo, in genere si sviluppano in condizioni
favorevoli (per loro): disbiosi, caduta delle
difese immunitarie, età avanzata, alimentazione
impropria…
• Si vuole rimarcare che aldilà della possibile
infezione è fondamentale per il loro sviluppo lo
stato del nostro terreno fisiologico
Metabolismo batterico
• I batteri risultano adattati a quasi tutti gli
ambienti con relativi diversi tipi di metabolismo.
• Alcuni riescono ad ossidare completamente i
glucidi: ma gli enzimi della glicolisi aerobica non
sono nei mitocondri bensì nella membrana.
• Altri batteri sono in grado di compiere solo la
glicolisi anaerobica e producono acido lattico.
Batteri (buoni)
I batteri rivestono un ruolo fondamentale nella trasformazione e
conservazione degli alimenti.
Batteri dello Yogurt
Glucidi
Glicolisi anaerobica
Acido lattico
Batteri del formaggio
Glucidi
glicolisi anaerobica
acido lattico
acido butirrico
acido lattico
alcol etilico
Batteri del vino
Glucidi
glicolisi anaerobica
… e altri ancora : burro, birra, salumi, crauti, tamari…
Contrasto dei batteri
I batteri in particolari situazioni ambientali a loro non favorevoli (temperatura,
umidità) possono assumere la conformazione di spore. La spora è una forma
di resistenza vitale, assunta dal batterio, per superare condizioni ambientali a
lui non favorevoli.
Sotto forma di spora il
Batterio in condizioni
batterio non compie
ambientali favorevoli
alcuna attività metabolica
e si blocca; al ripristino
delle condizioni ambientali
favorevoli, potrà riattivarsi
Sterilizzazione e disinfestazione
Per sterilizzazione si intende l’uccisione di tutti i microrganismi: può essere
fatta col calore, uso di sostanze chimiche, filtrazione e irraggiamento.
La disinfestazione o disinfettazione uccide solo in parte i microrganismi
bloccandone altri.
Un batterio sotto forma di spora è notevolmente più resistente alla
sterilizzazione e alla disinfezione dell’equivalente non sotto forma di spora.
Funghi come patogeni
• Anche se assomigliano alle piante hanno un
metabolismo di tipo etetrotrofo e possono accumulare
glicogeno.
• Si nutrono di materiale organico e possono insediarsi
su organismi viventi e diventare patogeni. Le malattie
causate dai funghi sono dette micosi
• Le persone ammalate o immunodepresse sono
particolarmente esposte alle micosi: è il caso tipico del
fungo Candida albicans che compare normalmente in
molte persone senza causare particolari problemi, ma
in persone debilitate può proliferare e causare
infezioni a carico della mucosa orale, vaginale e
intestinale.
Commensalismo, simbiosi, parassitismo
I microrganismi possono instaurare con l’uomo,
con gli animali e con le piante rapporti di
convivenza di diverso tipo
•Commensalismo: il microrganismo invade
l’ospite senza danneggiarlo.
•Simbiosi: Il microrganismo e l’ospite traggono
entrambi dei benefici: protisti e batteri entrano
nella composizione della flora batterica dei
ruminanti e dell’uomo.
•Parassitismo: L’ospite viene danneggiato dalla
presenza del microrganismo come nel caso dei
batteri e protisti patogeni.
Ameba (Entamoeba Histolitica)
senza membrana, si
alimenta con l’emissioni
di pseudopodi
L‘Ameba è un organismo
pluricellulare parassita che può
infettare l’intestino dell’uomo
causando gravi dissenterie.
Viene espulsa con le feci e in
questa fase rimane latente.
intestino
In condizioni igieniche precarie le
feci col parassita possono
direttamente/indirettamente
infettare acqua e/o cibo
Ameba
Feci
infette
Se l’ameba viene ingerita dall’uomo,
nell’intestino essa esce dalla fase
latente, si rivitalizza e causa
l’infezione.
Questo tipo di infezione segue il
cosiddetto circuito orofecale
La Giardia enterica (Giardia
Lamblia) presenta un ciclo infettivo
analogo
Tripanosoma Gambiense
Parassita flagellato
sangue
zanzara
Il Tripanosoma è un parassita del
sangue, responsabile della Malattia
del Sonno.
Il ciclo infettivo inizia quando un
vettore (zanzara) preleva
indirettamente il parassita da un
individuo infetto.
Nella zanzara il parassita rimane
latente.
parassita
Quando la zanzara punge un altro
individuo il Tripanosoma può
passare nel sangue del nuovo
ospite, riattivarsi e provocare la
malattia.