IL MATERIALE CONTENUTO IN QUESTE
DIAPOSITIVE E’ AD
ESCLUSIVO USO DIDATTICO PER
L’UNIVERSITA’ DI TERAMO
LE IMMAGINE CONTENUTE SONO
SCARICATE DAI SITI WEB DI CUI SONO
RIPORTATI I LINK
Tecniche spettroscopiche in biotecnologie
Annalaura Sabatucci
SPETTROSCOPIA
L’ interazione tra luce e materia 1. DIFFUSIONE-DIFFRAZIONE
da’ luogo a fenomeni di :
2. ASSORBIMENTO
Generazione di spettri
La spettroscopia è lo studio di tali
interazioni.
Per campioni di tipo biologico, in funzione dell’energia della
radiazione e del tipo di interazione, si possono ottenere spettri di
diverso tipo che forniscono diverse informazioni di carattere fisico e/o
chimico sul campione da analizzare.
Informazioni sulla struttura della materia
RADIAZIONE ELETTROMAGNETICA
La radiazione elettromagnetica (più comunemente nota
come LUCE) è, dal punto di vista dell‘elettromagnetismo
classico, un fenomeno ondulatorio dovuto alla
contemporanea propagazione di perturbazioni periodiche
(ONDE) di un campo elettrico e di un campo magnetico,
oscillanti in piani tra di loro ortogonali
Una carica unitaria nello spazio genera un campo elettrico E=F/q
(Dove F= forza di Coulomb)
le cui linee sono radiali (direzione uscente per cariche positive ed entrante per cariche
negative)
Una carica q in movimento crea una corrente elettrica i=dq/dt
ESPERIENZA DI OERSTED (1820) dimostra che la corrente elettrica fa deviare
l’orientamento di un dipolo elettrico, dunque produce un campo magnetico.
La forza di tale campo e’ la forza di Lorentz: F=qv x B
Infatti, sia il filo elettrico di lunghezza l, F=il x B
Ma i=dq/dt
Dunque F=q dl/dt x B = q v x B
Dunque su una carica in movimento agiscono sia la forza di
Coulomb (Fc=qE)che la forza di Lorentz (FL=qv x B)
Quindi la forza totale è data da:
Ft= q (E + (v x B))
Dove campo elettrico e magnetico sono perpendicolari tra di
loro e perpendicolari alla direzione del movimento della
carica.
ESPERIENZA DI HERTZ
1865: Maxwell predice l’esistenza di ONDE ELETTROMAGNETICHE che si propagano
alla velocità della luce (c)
1886: Heinrich Hertz realizza il primo esperimento per dimostrare l’esistenza di tali onde.
Hertz, per generare onde elettromagnetiche,
pensò di far scoccare una scarica elettrica tra
due conduttori metallici, applicando tra di essi
una elevata differenza di potenziale.
L’idea era che, se la scintilla avesse creato
un percorso conduttivo tra i due pezzi di
metallo, la carica elettrica avrebbe compiuto
rapide oscillazioni tra di essi, producendo
onde
elettromagnetiche
di
lunghezza
comparabile con le dimensioni dei conduttori
stessi.
LA LUCE E’ UN’ONDA ELETTROMAGNETICA
http://www.fis.unical.it/pls_fisica/lo/fotoelettrico/fotoelettrico/
percorso/approfondimenti/hertzIntro.html
Onda elettromagnetica (OEM)
http://www.phy.ntnu.edu.tw/ntnujava/index.php?topic=35
Grandezze fisiche che caratterizzano un’onda
elettromagnetica
Per semplicità supponiamo che l’onda si
propaghi nel piano. Prendiamo una delle
componenti - elettrica o magnetica (l’altra si
propaga in un piano perpendicolare)
A=ampiezza dell’onda
T= periodo (s)
tempo impiegato per
passare da un massimo di
ampiezza al massimo
successivo
l= lunghezza d’onda (m)
= spazio percorso
dall’onda in un periodo.
c=velocità di
propagazione dell’onda
nel vuoto= velocità della
luce (c= 3•108 m/s)
Grandezze fisiche che caratterizzano un’onda
elettromagnetica
Poiché velocità= spazio/tempo, abbiamo che:
c=l/T=ln
Dove n=1/T= frequenza (s-1 oppure hertz)
Inoltre l’OEM ha associata Energia
L’energia associata ad’un’onda
elettromagnetica e’ QUANTIZZATA (cioè
suddivisa in unità discrete)
E=hn
h=costante di Planck
(6.63 10-34 J•s)
n=frequenza
Max Planck
ES. Un fascio di luce con lunghezza d’onda di 300 nm
ha associata un’energia di :
E=hn=h(c/l)=6.63 10-34*3*108/300 10-9 = 6.63 10-19 J= 4.1 eV
(1eV= 1.602 10-19J = energia cinetica di un elettrone accelerato da una ddp di 1 V)
E=hn=hc/l
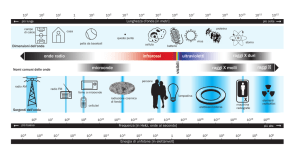
Radiazioni ionizzanti
All’aumentare della frequenza le Onde e.m. hanno associate Energie
crescenti.
I raggi gamma emessi dai materiali radioattivi, i raggi cosmici ed i raggi
X hanno un’energia tale da essere in grado di rompere i legami tra
molecole e sono chiamati “radiazioni ionizzanti”.
I campi elettromagnetici prodotti da sorgenti artificiali, che svolgono un
ruolo di primo piano nel mondo industrializzato – elettricità, radioonde e
campi a radiofrequenza – si trovano nella regione dello spettro
elettromagnetico a lunghezze d’onda relativamente grandi (e frequenze
relativamente basse), ed i loro quanti non possiedono energie sufficienti
da rompere i legami chimici. Sono dunque “radiazioni non ionizzanti”.
Radiazioni ionizzanti
Tipi di interazione radiazione-materia:
applicazioni in campo biologico
Lunghezza
d'onda (l)
100 cm e oltre
400 mm-30 cm
0.8-25 mm
(radio onde)
(micro onde)
(infrarosso)
Frequenza
<0.3 MHz
(u)
E (eV)
<1*E-6
INTERAZIONE Orientazione di spin
nucleare in campi
magnetici
750-1 MHz
TECNICA di NMR
assorbimento
EPR
TECNICA di
diffusione
3 E-3 - 4 E-6
orientazione di spin
elettronico in campi
magnetici
200-800 nm
1-200 nm
1-0.1 nm
(UV vicino e
visibile)
375000-12000 1.5THzMHz
375GHz
1.5-0.05
6-1.5
Vibrazioni
Elettroni di
molecolari
valenza
(UV)
Raggi X
300THz1.5THz
1000-6
ionizzazione
3 E9
IR
spettrofotome Assorbimento X
tria UV
(XAS)
Colorimetria
Fluorimetria
light
scattering
10000
elettroni interni
Diffrazione
Diffusione a piccoli
angoli (SAXS)
RADIO ONDE
Lunghezza d'onda (l) 100 cm e oltre
Frequenza (u)
E (eV)
INTERAZIONE
TECNICA di
assorbimento
TECNICA di
diffusione
(radio onde)
<0.3 MHz
-6
<1*10
Orientazione di spin
nucleare in campi
magnetici
NMR
Spettroscopia NMR (nuclear magnetic resonance)
La spettroscopia di risonanza magnetica nucleare (NMR) può
fornire informazioni di carattere fisico - chimico e proprietà
biologiche della materia. Di conseguenza, essa trova applicazioni
in diverse aree della scienza.
La Spettroscopia NMR è solitamente usata dai chimici per lo
studio della struttura chimica utilizzando semplici tecniche
monodimensionali.
Tecniche bidimensionali sono utilizzate per determinare la
struttura di molecole più complesse. Queste tecniche sono
alternative alla cristallografia a raggi X per la determinazione
della struttura delle proteine.
Spettroscopia NMR
I nuclei atomici composti da protoni e neutroni, quindi con carica diversa da
zero, possiedono un momento angolare, P. In modo classico, possono essere
rappresentati come sfere in rotazione.
Il momento angolare è quantizzato:
P I(I 1)
I è il numero quantico di momento angolare o SPIN NUCLEARE.
I=(1/2)n dove n= 0,1,2,3…12.
Sappiamo che una carica in movimento genera un campo
magnetico.
Il momento magnetico m è proporzionale allo spin:
l
In presenza di un campo magnetico esterno (B0),esistono 2
stati di spin: +1/2 e -1/2. Il momento magnetico dello stato
a più bassa energia (+1/2) è allineato con il campo esterno;
quello dello stato a più alta energia (spin -1/2) è
antiparallelo.
La differenza di energia tra questi 2 stati è proporzionale alla
forza del campo magnetico esterno applicato.
RISONANZA:
Applicando un secondo campo magnetico a lunghezza d’onda variabile
(campo a radio frequenza!) posso far saltare i nuclei da uno stato
all’altro (condizione di assorbimento o RISONANZA)
Spettroscopia NMR (nuclear magnetic resonance)
Principali nuclei atomici di interesse biologico:
1H (tutte le molecole di interesse biochimico)
13C (gruppi contenenti carbonio)
31P (acidi nucleici e gruppi fosforilati)
Il valore del campo a cui si ha risonanza è
influenzata dall’intorno chimico del nucleo
(chemical shift)
QUINDI posso derivare informazioni
strutturali dettagliate sulle molecole
NMR bidimensionale
Spettroscopia NOESY: con impulsi multipli si
puo’ rivelare l’effetto della perturbazione dello
spin di un nucleo sullo stato di spin di altri
protoni a distanze inferiori a 0.5 nm
Tale tecnica
permette la
determinazione
della
conformazione
tridimensionale di
piccole proteine
(<25 kDa)
Struttura
del BPTI
(58 aa)
MICRO ONDE
Lunghezza
d'onda (l)
400 mm-30 cm
Frequenza (u)
E (eV)
INTERAZIONE
(micro onde)
750-1 MHz
-3
-6
3 *10 fino a 4*10
orientazione di spin elettronico in
campi magnetici
TECNICA di
assorbimento
EPR
TECNICA di
diffusione
Tipicamente in Europa le bande usate dalla rete
GSM sono attorno a 900 e 1800 MHz
Spettroscopia EPR (electron paramagnetic resonance)
Simile all’NMR
Studio di sistemi con elettroni non appaiati. Tali elettroni non
appaiati hanno spin quantizzati associati che si possono allineare con
un campo magnetico o in direzione opposta.
Metalli come cobalto, rame, manganese, molibdeno sono
paramegnetici in uno o 2 stati redox e hanno elettroni non
appaiati.
Mediante EPR posso studiare l’intorno di un metallo e ottenere
informazioni sui suoi ligandi => studio del sito attivo di
metalloproteine.
IL FORNO A MICROONDE
Quando una molecola d’acqua viene immersa in un campo
elettrico essa si orienta esponendo la sua carica negativa verso
il polo "+" , quella positiva punta verso il polo "-"
Se il campo elettrico viene ripetutamente invertito, la molecola
d'acqua è costretta a riposizionarsi a ogni inversione del campo .
Alla frequenza di 2450 MHZ la molecola d'acqua inverte la sua posizione 2450 milioni di volte in un
secondo, senza un attimo di posa;
a una frequenza superiore la rotazione della molecola verrebbe interrotta prima di aver completato
l'arco di 180°;
per frequenze inferiori, la molecola d'acqua avrebbe la possibilità di riposare tra una rotazione e
l'altra.
E' questa l'origine del calore che scalda i cibi fino a cuocerli, agendo al loro interno
INFRAROSSO
Lunghezza d'onda (l)
Frequenza (u)
E (eV)
INTERAZIONE
0.8-25 mm
(infrarosso)
375-12 GHz
1.5-0.05
Vibrazioni molecolari
TECNICA di assorbimento IR
TECNICA di diffusione
Spettroscopia all’infrarosso (IR)
Effetto dell’interazione della luce IR con la materia:
Cambiamenti negli stati energetici vibrazionali delle molecole
Spettroscopia all’infrarosso (IR)
Analisi di tipo qualitativo: gruppi sostituenti come carbonili, alcolici, anelli
aromatici, legami Carbonio-alogeni hanno frequenze di gruppo che ne
permettono l’identificazione.
FOSFOLIPIDI
Il doppio strato lipidico è costituito principalmente
da FOSFOLIPIDI: lipidi contenenti un gruppo fosfato
ad un’estremità della molecola.
I fosfolipidi sono tipicamente idrofilici nella regione
del gruppo fosfato ed idrofobici lungo la regione
della coda lipidica. In ogni strato della membrana
plasmatica, le code lipidiche idrofobiche sono
orientate verso l’interno ed i gruppi fosfato
idrofilici sono allineati verso l’esterno, o verso la
frazione acquosa citosolica della cellula, o verso
l’ambiente esterno. Quindi i fosfolipidi tendono ad
aggregare
spontaneamente
quando
esposti
all’acqua.
POPC
~8Å
Testa
idrofilica
~18Å
Code idrofobiche
Fasi lipidiche
GEL PHASE
FLUID PHASE
Liquid Disordered- Ld
GEL
Lipid chain conformational and translational order Lipid chain conformational and translational disorder
Tm
(melting temperature)
ESEMPIO: Studio della transizione di fase di liposomi a
composizione nota
FTIR
2853.5
temperatura -CH2
30
35
38
40
42
44
46
48
50
52
55
55
-1
Symmetric CH2 vibration (cm )
2853
2852.5
2852
AEA CH2
2851.5
2851
2850.5
25
30
35
40
45
T (°C)
50
55
60
2850.88
2851.16
2851.47
2852.24
2852.85
2853.01
2853.09
2853.19
2853.27
2853.22
2853.42
2853.46
Frequenza di massimo
assorbimento del
gruppo metilene
UV-VISIBILE
Lunghezza d'onda
(l)
Frequenza (u)
E (eV)
INTERAZIONE
TECNICA di
assorbimento
TECNICA di
diffusione
200-800 nm
1-200 nm
(UV vicino e visibile) (UV)
1.5 THz-375 GHz
300THz-1.5THz
6-1.5
1000-6
Elettroni di valenza ionizzazione
Colorimetria
Fluorimetria
light scattering
spettrofotometria
UV
Spettroscopia UV-visibile
Range: 200-800 nm
Transizioni elettroniche nella molecola
da uno stato fondamentale a uno stato
eccitato
CAMPIONI BIOLOGICI:
A) Regione UV :
determinazione della concentrazione di
proteine e acidi nucleici
•
assorbimento delle proteine dovuto alle
catene laterali degli aa aromatici
(regione 270-290 nm)
(Triptofano, tirosina, fenilananina)
•
Assorbimento del DNA (intorno a 260
nm) dovuto alle basi azotate
B) Regione visibile:
•Alcune proteine contengono gruppi
cromofori (Es. l’eme nell’emoglobina) o
metalli legati (es. Cu nell’Hc) .
L’assorbimento nella regione visibile in
questo caso può essere sfruttato per
analizzare cambiamenti nella molecola
all’intorno al cromoforo. Nel caso di Hc e
Hb il grado di ossigenazione
C. Aestuarii Hc
•nel caso in cui substrato o prodotto di una reazione enzimatica
assorbano luce in una regione dello spettro in cui non assorbano altri
substrati o prodotti, la cinetica di reazione puo’ essere seguita tramite
spettrofotometria
•Composti biochimici privi di colore possono essere convertiti in
composti colorati da reazioni cromogene
(Metodi colorimetrici per la determinazione della concentrazione delle
proteine - biureto, Lowry, Bradford )
Schema di uno spettrofotometro
Lampada al deuterio (UV) +
Lampada tungsteno (vis)
Trasmittanza: T=I/I0
Legge di Lambert-Beer:
T=10-ecl => logT=-ecl= - logT =log (1/T)
=A (Assorbanza) = ecl
e= coefficiente di estinzione (coefficiente di assorbimento caratteristico
del campione ad una particolare lunghezza d’onda in una serie definita di
condizioni
e molare (M-1 cm-1)
e 0.1% assorbanza allo 0.1% di proteina in soluzione (mg/ml)
c= concentrazione della proteina
l= cammino ottico (di solito 1 cm)
Aspetti pratici
Risoluzione dello strumento:
Limite inferiore: A=0.02 (sotto: rumore di fondo)
Limite superiore: A=circa 2 (sopra: saturazione dello
strumento) => diluire il campione se molto concentrato
Portacampioni:
cuvetta di quarzo *(assorbimento quasi nullo) con cammino
ottico generalmente 1 cm =>
A=ec
Sottrazione del fondo dal segnale del campione di interesse
mediante misura del BIANCO
(ossia del tampone nel quale viene preparato il campione)
* Valore commerciale 130 euro
RAGGI X
Lunghezza d'onda
(l)
1-0.1 nm
Raggi X
9
Frequenza (u)
3 10
E (eV)
INTERAZIONE
10000
elettroni interni
TECNICA di
assorbimento
Assorbimento X (XAS)
TECNICA di
diffusione
Diffrazione
Diffusione a piccoli angoli
(SAXS)
Spettroscopia X
Wilhelm Conrad Roentgen notò che dei
raggi, chiamati "X" in quanto sconosciuti,
scaturivano in un tubo catodico dal
contatto
dei
raggi
catodici
con
l'anticatodo (8 novembre 1895). In
seguito capì che inserendo un oggetto tra
l'emettitore dei raggi e una lastra
fotografica
era
possibile
ottenere
immagini fisse e conservabili nel tempo.
Dopo pochi giorni la moglie Bertha si
prestò a tenere ferma la sua mano sulla
lastra per un tempo di quindici minuti,
ottenendo come risultato il famoso
prototipo della radiografia delle ossa
della sua mano sinistra e degli anelli
indossati.
Diffrazione dei raggi X
Struttura tridimensionale di proteine e DNA
Rosalind Franklin (1920-1958),
Spettro di diffrazione X del DNA
J. Watson e F. Crick
elaborano il modello
della molecola di DNA
(1953)
Premio Nobel 1962
Luce di sincrotrone
http://www.dailymotion.com/video/x8zxvi_sciences-quand-la-lumiererencontre_tech?ralg=meta2-only#from=embed
Diffusione a piccoli angoli dei raggi X (SAXS)
detector
Quartz capillary
slits
source
Optical
system
Solvent s (r )
k0
k
p (r )
O+ r
i
i
k
2q
k0
q
4
q
sinq
l
2q 5 deg 85 mrad
Spettroscopia X (XAS)
Transizioni di elettroni interni allo stato di elettrone libero
Atomo isolato
I1
e x
I0
Fascio di Raggi X
EE0
Fotoelettrone emesso
=COEFFICIENTE DI ASSORBIMENTO
x=spessore del campione
I0=fascio incidente
I1=fascio trasmesso
Emissione di
fluorescenza
K
ASSORBIMENTO
L
ENERGIA
BIO-XAS
EXAFS IN BIOLOGIA
Lo XAS fornisce informazioni su:
struttura del sito attivo di metallo-proteine in soluzione.
Infatti le energie impiegate (sorgente di luce di sincrotrone)
sono dell’ordine delle soglie k dei metalli di transizione (Fe, Cu,
Co, Mb…)
Spettrometria di massa
La spettrometria di massa è una tecnica analitica applicata sia
all'identificazione di sostanze sconosciute, sia all'analisi in tracce di
sostanze. Viene comunemente usata in combinazione con tecniche
separative, quali la gascromatografia e la cromatografia in fase liquida
(HPLC) o, più recentemente, con tecniche quali il plasma a induzione.
La spettrometria di massa è un tipo di spettrometria che sfrutta non
solo le proprietà fisiche ma anche quelle chimiche delle molecole in
esame.
In particolare, essa permette lo studio degli IONI POSITIVI che si
possono ottenere, in fase gassosa, per bombardamento del composto
organico con una corrente di elettroni (spettrometria ad impatto
ionico).
Funzioni di uno spettrometro di massa:
1. Produrre ioni positivi dalla molecola organica in esame
2. Separare gli ioni prodotti in funzione del rapporto carica/massa: m/q
3. Misurare l’abbondanza relativa di ciascuno ione
FUNZIONAMENTO
A. INIETTORE:Il campione da analizzare, portato in fase gassosa, viene
iniettato nel sistema
B. CAMERA DI IONIZZAZIONE E ACCELERAZIONE: il campione viene
bombardato da un fascio di elettroni perpendicolare alla direzione
di propagazione del gas. L’interazione elettrone-gas produce ioni
positivi e negativi. Gli anioni vengono catturati dall’anodo. I
cationi (con carica q) passano attraverso una fenditura in una
camera di accelerazione (con voltaggio V) e vengono accelerati ad
una velocità finale v.
Dopo completa accelerazione, l’energia potenziale iniziale dei cationi
E=qV si trasformerà completamente in energia cinetica: E=1/2 mv2
Quindi, per il principio di conservazione dell’energia:
qV=1/2 mv2.
Da qui si può ricavare il rapporto massa/carica:
m/q=2(V/v2)
TUBO ANALIZZATORE E CAMPO MAGNETICO
Gli ioni accelerati passano attraverso un tubo ad U piegato a 180° (tubo
analizzatore) per arrivare al collettore ed analizzatore.
Il tubo analizzatore è posto tra i 2 poli di un campo magnetico orientato
e variabile perpendicolare in ogni punto alla direzione di propagazione
della particella.
Il campo magnetico (B) sottopone le particelle cariche ad una forza
centripeta (la forza di Lorentz) FL= q v x B =qvB
A tale forza va ad opporsi la forza centripeta Fc=mw2r=mv2/r
SOLO quando la forza centrifuga bilancia esattamente la forza
centripeta (equilibrio), la particella compirà una traiettoria circolare
attraversando tutto il tubo ad U per giungere al rivelatore:
qvB=mv2/r
possiamo esprimere la velocità in funzione del campo magnetico B:
v=qBr/m
E la sostituiamo nell equazione m/q=2(V/v2)
Otteniamo così:
(m/q)=2V/v2= 2V/(rqB/m)2 =>
(m/q)=(rB)2/2V
Come si può notare, il rapporto carica/massa dipende solo dal
voltaggio applicato per accelerare gli ioni e dal campo magnetico
applicato.
Variando l’intensità del campo o il voltaggio dell’acceleratore è
possibile ottenere al collettore uno SPETTRO di ioni separati in
base al rapporto m/q.