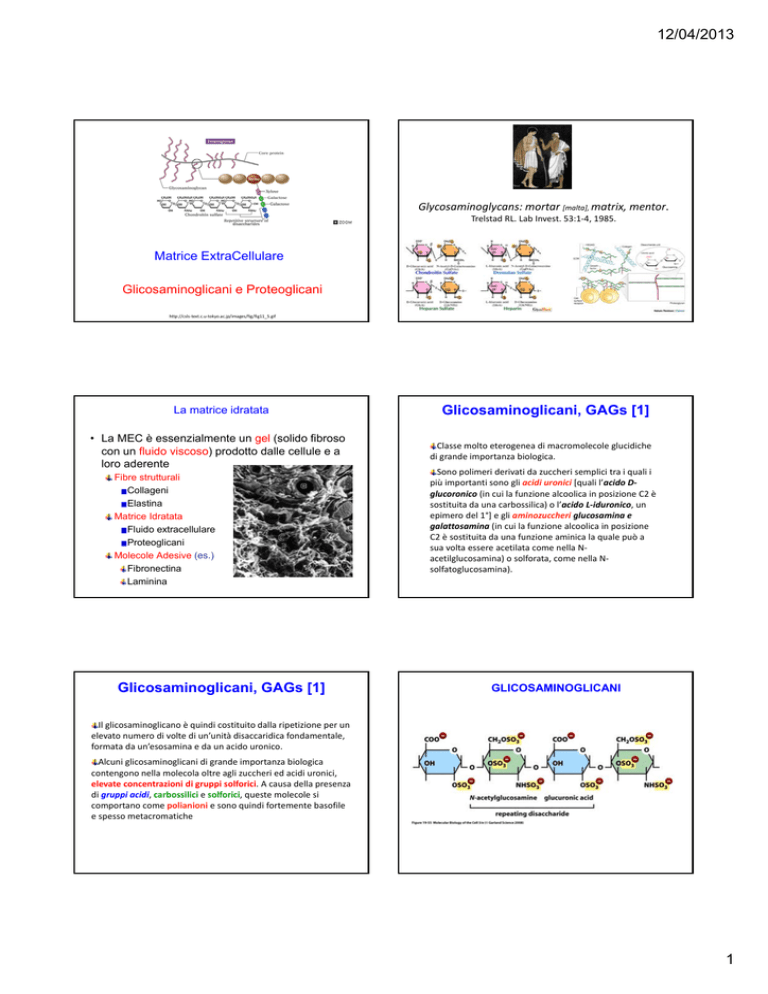
12/04/2013
Glycosaminoglycans: mortar [malta], matrix, mentor.
Trelstad RL. Lab Invest. 53:1‐4, 1985. Matrice ExtraCellulare
Glicosaminoglicani e Proteoglicani
http://csls‐text.c.u‐tokyo.ac.jp/images/fig/fig11_5.gif
La matrice idratata
• La MEC è essenzialmente un gel (solido fibroso
con un fluido viscoso) prodotto dalle cellule e a
loro aderente
Fibre strutturali
Collageni
Elastina
Matrice Idratata
Fluido extracellulare
Proteoglicani
Molecole Adesive (es.)
Fibronectina
Laminina
Glicosaminoglicani, GAGs [1]
Glicosaminoglicani, GAGs [1]
Classe molto eterogenea di macromolecole glucidiche di grande importanza biologica.
Sono polimeri derivati da zuccheri semplici tra i quali i più importanti sono gli acidi uronici [quali l’acido D‐
glucoronico (in cui la funzione alcoolica in posizione C2 è sostituita da una carbossilica) o l’acido L‐iduronico, un epimero del 1°] e gli aminozuccheri glucosamina e galattosamina (in cui la funzione alcoolica in posizione C2 è sostituita da una funzione aminica la quale può a sua volta essere acetilata come nella N‐
acetilglucosamina) o solforata, come nella N‐
solfatoglucosamina).
GLICOSAMINOGLICANI
Il glicosaminoglicano è quindi costituito dalla ripetizione per un elevato numero di volte di un’unità disaccaridica fondamentale, formata da un’esosamina e da un acido uronico.
Alcuni glicosaminoglicani di grande importanza biologica contengono nella molecola oltre agli zuccheri ed acidi uronici, elevate concentrazioni di gruppi solforici. A causa della presenza di gruppi acidi, carbossilici e solforici, queste molecole si comportano come polianioni e sono quindi fortemente basofile e spesso metacromatiche 1
12/04/2013
Galattosio,
non acido
uronico
Acidi uronici: glucuronico e iduronico
1. Acido Iduronico (IdoA)
Espansione e contrazione a fisarmonica
delle subunità di iduronato nel Dermatan Solfato
E’ la principale componente del GAG Dermatan Solfato (DS) e dell’eparina.
E’ inoltre presente nel Eparan Solfato (HS) nonostante si trovi in quantità
minore rispetto all’acido glucuronico. E’ uno zucchero exapiranoso.
La maggior parte degli exapiranosi sono stabili solo in una delle due conformazioni tipo “sedia” 1C4 o 4C1. L’iduronato è diverso e adotta più di una soluzione di conformazioni, con un equilibrio fra tre isomeri conformazionali a bassa‐energia:le forme
“sedia” ” 1C4 e 4C1 e un’altra conformazione “skew‐boat” 2S0. E’ perciò
considerate un’unità di zuccheri “elastica” (Scott & Roswell, 2007).
Può essere modificato mediante l’aggiunta di un gruppo O‐solfato al carbono in posizione 2 per formare il 2‐O‐sulfo‐L‐iduronic acid (IdoA2S).
Skew‐boat conformation 2S0
Scott JE, Stockwell RA. Cartilage elasticity resides in shape module decoran and aggrecan sumps of damping fluid: implications in osteoarthrosis. J Physiol. 2006 Aug 1;574(Pt 3):643‐50. Acidi uronici: glucuronico e iduronico
2. Acido glucuronico
Conformazione: Al contrario del suo epimero C5, l’acido iduronico, che può esistere in diverse conformazioni, l’acido glucuronico si trova predominantemente nella
conformazione 4C1.
Conformation tetrahydropyran.svg
http://commons.wikimedia.org/
wiki/File:Conformation_tetrahyd
ropyran.svg
2
12/04/2013
Glicosaminoglicano non legato covalentemente a proteine
Acido ialuronico
Sequenze ripetuta di disaccaride nell’ialuronato, un GAG relativamente semplice. Questa molecola ubiquitaria nei Vertebrati consiste di una singola ed unica catena contenente fino a 25000 monomeri di zuccheri. Notare l’assenza di gruppi solfato.
Acido ialuronico, 1
Somiglianza con gli altri GAGs:
Polisaccaride non ramificato, composto dalla ripetizione regolare di un’unità disaccaridica (glucoronato –N‐acetilglucosamina)
Differenze dagli altri GAGs
La lunghezza della sua catena è molto superiore a quella degli altri GAGs
Tutte le subunità disaccaridiche sono identiche
NON è solfatato
NON subisce epimerizzazione durante la sintesi
NON è legato covalentemente ad un asse proteico
NON è sintetizzato nell’apparato di Golgi come gli altri glicosaminoglicani e rilasciato per esocitosi, ma viene “filato” direttamente dalla superficie cellulare da un complesso enzimatico inglobato nella membrana plasmatica. L’allungamento della catena avviene per aggiunta di zuccheri all’estremità riducente.
Nei tessuti adulti è presente di solito in piccole quantità.
Acido ialuronico, 3
Dovuto sia alla repulsione tra cariche negative che alla formazione di legami di idrogeno fra residui adiacenti di zuccheri , esiste una inerente rigidità della membrana che dà origine ad una struttura avvolta espansa e polidispersa ad elevato peso molecolare.
Tuttavia, ad elevate concentrazioni le catene si possono aggrovigliare e formare strutture lasse a doppia o tripla elica formando una rete continua che intrappola molecole di acqua.
La capacità dell’ialuronato di formare una rete continua anche a basse concentrazioni è dipendente dall’alto peso molecolare del polisaccaride.
Una limitata degradazione delle molecole produce una riduzione considerevole della viscosità delle soluzioni di ialuronato.
Acido ialuronico, 2
E’ presente in quantità superiori durante lo sviluppo embrionale, e, nell’adulto durante la fase di guarigione delle ferite ed in alcuni tessuti specializzati quali la cartilagine, l’umor vitreo dell’occhio, il cordone umbilicale e il fluido sinoviale.
Nei tessuti è presente come:
Rivestimento alla superficie cellulare.
Come parte di grandi aggregati con i proteoglicani.
Apparentemente come polisaccaridi liberi nel fluido sinoviale e nell’umor vitreo.
Acido ialuronico, 4
Nel fluido della sinovia e nell’umor vitreo dell’occhio, l’elevata concentrazione di ialuronato ha due scopi:
produce un gel ad alta viscosità che ritarda i movimenti dell’acqua ed anche ammortizza gli effetti dei carichi rapidi sulle articolazioni
Esclude le cellule o materia particolata di grandi dimensioni in modo da permettere un percorso ottico pulito nell’occhio.
Nell’embrione svolge importanti compiti come riempitore di spazi, potendo essere usato per forzare una variazione di forma di una struttura, dato che una piccola quantità si espande con acqua occupando un grande volume.
L’ialuronato sintetizzato nel dominio basale di un epitelio, ad esempio, spesso serve per creare una spazio libero in cui le cellule possano in un secondo tempo migrare; ciò ha luogo ad esmpio nella formazione del cuore, della cornea e di diversi altri organi.
Quando la migrazione delle cellule cessa, l’eccesso di ialuronato viene di solito degradato dall’enzima ialuronidasi.
3
12/04/2013
Acido Ialuronico – ialurano [1]
L’ialuronato é un polisaccaride sia extracellulare che associato alla superficie cellulare, che viene tradizionalmente considerato come una sostanza biologica appiccicosa che partecipa alla lubrificazione delle articolazioni o al mantenimento dei tessuti connettivi con consistenza gelatinosa.
Nonostante questi siano ruoli fisiologici comuni dell’ialuronato negli organismi adulti, l’ialuronato funziona inoltre come un segnale microambientale che co‐regola il comportamento cellulare durante lo sviluppo embrionale, i processi di guarigione delle ferite, l’infiammazione e lo sviluppo dei tumori. Ricerche recenti hanno messo in evidenza un ruolo chiave per le interazioni tra l’ialuronato e le cellule tumorali in diversi aspetti della crescita maligna e indicano la possibilitè di nuove strategie terapeutiche
Acido ialuronico [2]
Quando una pressione esterna viene applicata ad una rete di ialuronato, questa si contrarrà, ma quando la pressione esterna non sussiste più la rete di ialuronato riprenderà la sua forma originaria, dovuto alla pressione interna di turgore, o acquisirà una nuova forma se sono state applicate nuove restrinzioni o confini per controbilanciare questa pressione. Questa proprietà fornisce resilienza (capacità di riprendere la forma originaria) e malleabilità a molti tessuti. Inoltre, le aree ricche di ialuronato all’interno dei tessuti di sviluppo esercitano pressioni interne che possono provocare la separazione di strutture fisiche e creare “autostrade” per la migrazione cellulare.
Toole BP. Hyaluronan: from extracellular glue to pericellular cue. Nat Rev Cancer. 4:528-539, 2004.
Acido ialuronico [3]
Un esempio drammatico di questo é la migrazione delle cellule mesenchimali verso la cornea in risposta all’aumentata deposizione di ialuronato, l’idratazione e il rigonfiamento concomitante della via migratoria. Questo fenomeno é stato dimostrato sperimentalmente usando cellule di glioma che migrano attraverso un gel di fibrina.
A scala minore, queste proprietà possono facilitare i cambiamenti di forma cellulare che sono richiesti per la divisione cellulare e il movimento, fornendo una zona altamente idratata attorno alla cellula che la separa dalle cellule adiacenti
Acido ialuronico
(a) Struttura dell’ialuronato, che è composto di unità disaccaridiche ripetute di acido glucoronico e N‐acetilglucosamina. Il polimero ha parti sia cariche
che idrofobiche, a causa dei gruppi carbossilici dell’acido glucoronico e di un cluster di atomi di idrogeno su una faccia del disaccaride, rispettivamente. Gli atomi di idrogeno assiali che contribuiscono alla forza idrofobica sono illustrati in rosso. (b) Il dominio occupato da ogni molecola di ialuronato in soluzione diluita si espande a causa di repulsione reciproca fra i gruppi carbossilici, e perciò occupa un grande volume, in cui l’acqua é intrappolata all’interno della struttura.
In soluzioni più concentrate, le molecole di ialuronato si aggrovigliano, formando una rete continua ma porosa. Questa rete esercita la cosidetta “pressione di turgore” a causa dell’aumentata repulsione fra e all’interno delle molecole.
Toole BP. Hyaluronan: from extracellular glue to pericellular cue. Nat Rev Cancer. 4: 528-539, 2004.
Sintesi dell’ialuronato nella membrana cellulare
delle cellule eucariotiche La sintesi dell’ialuronato ha luogo sulla superficie interna della membrana plasmatica e l’ialuronato nascente viene estruso sulla membrana plasmatica mentre è ancora legato alla sintasi che lo produce. Ciò assicura che l’ialuronato abbia un rapporto intimo con la superficie cellulare e possa participare prontamente alla creazione di una zona pericellulare idratata (X e Y sono proteine regolatorie putative.
Toole BP. Hyaluronan: from extracellular glue to pericellular cue. Nat Rev Cancer. 4:528-539, 2004
4
12/04/2013
SINTESI BATTERICA DELL'IALURONATO [2]
SINTESI BATTERICA DELL'IALURONATO [1]
Nonostante possa sembrare strano che alcuni batteri possano sintetizzare lo stesso polimero di ialuronato dei mammiferi questi microorganismi hanno creato
un modo molto furbo per vivere il loro stile di vita di agente patogeno. I batteri di tipo Streptococcus equisimilis del Gruppo C (un patogeno degli animali e talvolta dell'uomo), gli Streptococcus pyogenes del gruppo A (un patogeno umano), e la Pasteurella multocida (un patogeno animale) sono in grado di nascondersi dal sistema immunitario dei loro ospiti circondandosi con una spesso strato di ialuronato.
Dato che questa barriera di ialuronato, o capsula, ha la stessa struttura
dell'ialuronato dei nostri tessuti, i batteri non sono facilmente riconoscibili dagli
anticorpi o attaccati dai fagociti. Diversi studi hanno confermato che la capsula di ialuronato contribuisce in gran parte alla patogenicità di questi batteri. Nonostante il vantaggio guadagnato da un battere patogeno nel
fare una capsula di ialuronato, solo circa sei specie di batteri (fra
molte migliaia) hanno acquisito questa capacità biosintetica. Forse la formazione della capsula comporta dei notevoli svantaggi
allo stesso tempo. Uno svantaggio ... é che la capsula può rallentare
la crescita cellulare direttamente inibendo la produzione della
parete cellulare. Un altro fattore consiste nel fatto che la spessa
capsula di ialuronato rappresenta un carico metabolico molto grande. Le subunità di zuccheri usate per assemblare questa capsula
potrebbero essere usati per invece come sorgenti di energia per la crescita e la divisione della cellula batterica. Non tutti i tipi di batteri hanno la capacità metabolica di sostenere la propria crescita
mentre usano una gran parte dei loro carboidrati e metabolismo
energetico per produrre la capsula.
http://www.glycoforum.gr.jp/science/hyaluronan/HA06/HA06E.html#II
Glicosaminoglicani
MAST CELLS - EPARINA
http://www.nutritionreview.org/images/figure1_mastcells.jpg
a, Mast cell and venule (small vein) in normal tissue under physiological conditions. The functions and potential functions (?) of heparin stored within the mast cell's cytoplasmic granules are listed. b, An activated ('degranulated') mast cell induces enhanced permeability of the adjacent venule, as well as recruitment of white blood cells (leukocytes). http://www.nature.com/nature/journal/v400/n6746/fig_tab/400714a0_F1.html
Eparina
Eparina nei granuli delle mast cells
Schema della molecola di eparina a forma di piuma dei granuli delle mast cells.
L’asse lungo è una proteina alla quale sono legate covalentemente molecole di glicosaminoglicani (GAGs).
Ai GAGs sono legati non covalentemente istamina, serotonina ed enzimi proteolitici (chimasi di diversi tipi).
(adattato da Majno & Joris: Cells,Tissues and Disease,
Blackwell, 1996)
5
12/04/2013
Basofilia dell’eparina
Colorazione Giemsa
ECM
proteoglicani
Mast cells nel tumore di Ehrlich
Mast cells nel polmone di ratto
normale
I proteoglicani consistono di un “core” centrale proteico (marrone) e di una o più catene di glicosaminoglicani legati covalentement. HS: blu; CS/DS: giallo.
Polisaccaridi e proteoglicani
I proteoglicani della membrana plasmatica attraversano totalmente la membrana (proteine di membrana di tipo I) oppure sono legati ad un’ancora di GPI. I proteoglicani della matrice extracellulare sono di solito secreti, ma alcuni proteoglicani possono essere scissi proteoliticamente e rilasciatii dalla superficie cellulare (non illustrato
http://www.ncbi.nlm.nih.gov/bookshelf/br.fcgi
?book=glyco2&part=ch16&rendertype=figure
&id=ch16.f2
L’acido ialuronico e i proteoglicani formano
complessi macromolecolari di grandi dimensioni
che intrappolano acqua nelle loro maglie
richiamano acqua
riempionono gli spazi
resistono alla compressione meccanica
Proteoglicani
Sono costituti da un asse proteico a cui si lega covalentemente un elevato numero di glicosaminoglicani, che costituiscono circa il 90% della molecola di proteoglicani.
Solitamente alla stessa proteina si lega un singolo tipo di glicosaminoglicani, ma può essere presente anche più di un tipo, come ad es. nel proteoglicano della cartilagine, che contiene quasi in uguale misura condroitin solfato e cheratan solfato.
I glicosaminoglicani si legano all’asse proteico sia mediante legame N‐glicosidico analogo a quello delle glicoproteine, sia mediante legame O‐glicosidico a cui può partecipare il monosaccaride xiloso oltre a due molecole di galattosamina.
6
12/04/2013
Classificazione dei proteoglicani in base alla loro
localizzazione e tipo di proteina centrale
Alcuni comuni proteoglicani
PROTEOGLICANO
Mr della proteina “core”
Principali membri
(kD)
225-250
aggrecano, versicano
decorina, biglicano
40
fibromodulina
Localizzazione
Tipo di catena di GAG
ECM
HA, CS, KS
Associati al collagene
CS, DS, KS
“Membrana”/lamina
basale
HS
Superficie cellulare
HS, CS
33[a]-60[b]-92[c]
Granuli intracellulari
Eparina, CS
17-19
120
perlecano
sindecano, glipicano,
betaglicano, CD44E,
cerebroglicano
serglicina
CS, condroitin solfato; DS, dermatan solfato; KS, cheratan solfato; HA, acido ialuronico; HS, eparan solfato
RUOLI FUNZIONALI PROPOSTI PER I
PROTEOGLICANI
Tipo
Proteoglicani a Condroitin
Solfato (CS-PGs)
Localizzazione
Cartilagine
Parete dei vasi sanguignil
Proteoglicano a dermatan
Solfato (DS-PGs)
Fluido follicolare ovarico
Tendine, pelle
Proteoglicano ad eparan
solfato (HS-PGs)
Proteoglicano a cheratan
solfato (KS-PGs)
Superficie cellulare
Interazione/collegamento
Acido ialuronico, proteine di
collegamento
Acido ialuronico, proteine di
collegamento, elastina,
collagen, superficie
cellulare
(?) (1985)
Banda-d del collagene,
auto-interazione
“Membrana”/lamina basale
Auto-interazione,
fibronectina, collagene,
membrana plasmatica
Collagene di tipo IV
Stroma della cornea
Collagene (?)
Ruoli funzionali
Resilienza, legame con
acqua
Mantenimento della
viscoelasticità, rgolazione
della permeabilità e della
deposizione lipidica
Mantenimento della
viscosità, coinvolto
nell’ovulazione
Regolazione della
fibrillogenesi e del diametro
delle fibrille; mantenimento
dell’arichittetura normale
Riconoscimento cellulare,
collegamento cellulare,
trasformazione neoplastica
Permeabilità, filtrazione di
macromolecole
Mantenimnto della
trasparenza e delle
proprietà rifrattive della
cornea
TIPO DI CATENE NUMERO DI LOCALIZZAZIONE
PESO MOLECOLARE
DI GAGs
CATENE DI
APPROSSIMATIVO DELLA
GAGs
PROTEINA “CORE”
Aggrecano
210,000
condroitin solfato
+ cheratan solfato
(in catene
separate)
~130
Betaglicano
36,000
condroitin solfato/
dermatan solfato
1
Decorina
40,000
condroitin solfato/
dermatan solfato
1
Perlecano
600,000
eparan solfato
2–15
cartilagine
FUNZIONI
sostegno meccanico;
forma grandi aggregati
con l’ialuronato
superficie cellulare e si lega al TGF-β
matrice
diffuso nei tessuti
connettivi
si lega a fibrille di tipo I di
collagene e al TGF-β
lamine basali
funzione strutturale e di
filtrazione nella lamina
basale
Sindecano-1
32,000
condroitin solfato
+ eparan solfato
1–3
superficie cellulare
adesione cellulare; si lega
al FGFe ad altri fattori di
crescita
Dally (nella
Drosophila)
60,000
eparan solfato
1–3
superficie cellulare
co-recettore per proteine
di segnalamento Wingless
e Decapentaplegic
Proteoglicani
In termini di dimensioni vanno dalla serglicina con 104 residui di aminoacidi (10,2 kD) al versicano, con 2409 residui (265 kD).
Ogni tipo di proteoglicano contiene uno o due tipi di GAGs legati covalentemente
Di solito le unità di GAGs sono “O‐linked” a residui di serina di sequenze dipeptidiche Ser‐Gly. La serglicina prende il nome da un dominio centrale unico con 49 aminoacidi composti di residui alternati di serina e di glicina.
Il proteoglicano della matrice della cartilagine contiene 117 paia Ser‐Gly alla quali si legano le catene di condroitin solfato.
La decorina, un piccolo PG secreto dai fibroblasti nella matrice del tessuto connettivo contiene soltanto tre paia Ser‐Gly, una delle quali è di solito glicosilata.
Oltre alle unità di GAGs, i PGs possono contenere altri gruppi oligosaccaridici “O‐
linked” oppure “N‐linked”
7
12/04/2013
Info su proteoglicani ‐ 1
Le cellule secernono molti proteoglicani nella MEC, ma trattengono alcuni tipi nella membrana plasmatica mediante polipeptidi transmembrana o un’ancora a glicosilfosfatidilinositolo (GPI).
Le proteine assiali variano in dimensioni da 100 a 4000 aminoacidi.
Molte sono modulari, e contengono i domini strutturali familiari: EGF, proteina regolatoria del complemento, ripetizioni ricche di leucina o lectine.
Tre famiglie di collageni hanno catene laterali di GAGs: i tipi IX e XII hanno catene di condroitin solfato e il tipo XVII ha catene di eparan solfato. Info su proteoglicani ‐ 2
I numeri di GAGs attaccati alla proteina assiale varia da uno (decorina) a più di 200 (aggrecano).
Una particolare proteina assiale può avere tipi di GAGs identici (fibroglicano, glipicano, versicano) oppure GAGs diversi (aggrecano, serglicina, sindecano).
Alcuni tipi cellulari possono aggiungere diversi GAGs alla stessa proteina assiale o secernere una proteina assiale senza GAGs.
http://web.virginia.edu/Heidi/chapter9/chp9frameset.htm
Info su proteoglicani ‐ 3
Date le loro proprietà fisiche e distribuzione fra gli elementi fibrosi della MEC, i proteoglicani e l’acido ialuronico sono considerati come “riempitori di spazi”.
Ogni disaccaride idrofilico porta un gruppo carbossilico o solfato o entrambi, e quindi i GAGs sono polianioni carichi che si espandono tramite repulsione elettrostatica in soluzione e attraggono fino a 50g di acqua per grammo di proteoglicano.
L’ialuronato, il GAG di maggiori dimensioni, occupa un volume molto ampio:
Una singola molecola idratata di 25,000 kD occupa un volume simile a quello di un piccolo organello con un diametro di 200 nm.
La retenzione di acqua dall’ialuronato e del proteoglicano aggrecano‐cheratan solfato/condroitin solfato è essenziale per la cartilagine.
Info su proteoglicani ‐ 4
Nella MEC di altri tessuti, delle reti di ialuronato ad elevata densità di cariche negative restringe il flusso di acqua, limita la diffusione dei soluti (specialmente delle macromolecole) e impedisce il passaggio dei microorganismi.
L’ialuronato e i proteoglicani possono agire inoltre da lubrificanti nelle articolazioni e come mezzo otticamente trasparente, riempitivo degli spazi dell’umor vitreo dell’occhio.
8
12/04/2013
Funzioni dei proteoglicani
Solubili, localizzati nella MEC
Es: Serglicina, versicano, proteoglicsano della matrice della cartilagine (aggrecano)
Proteine integrali transmembrana
Es: Sindecano
Entrambi i tipi funzionano interagendo con una gran varietà di molecole:
Mediante le componenti GAGs
Mediante domini recettoriali specifici nel polipeptide stesso.
Esempio: PG transmembrana Sindecano
Si associa intracellularmente con il citoscheletro di actina
Fuori dalla cellula interagisce con la fibronectina, proteina extracellulare che si lega a diverse protewine della superficie cellulare e a componenti della MEC
La sua capacità di participare a interazioni multiple con queste proteine bersaglio lo rende ccome una specie di “colla” nello spazio extracellulare
collegando componenti della MEC
Facilitando il legame delle cellule alla MEC
Mediando il legame di fattori di crescita e di altre molecole solubili alla matrice e alle superficie cellulari.
http://web.virginia.edu/Heidi/chapter9/chp9frameset.htm
I fattori di crescita sono sequestrati
e presentati alle cellule dai proteoglicani della matrice
e della membrana plasmatica
Syndecan‐2 regulates signaling through integrin alpha5beta1 on a fibronectin substrate On a fibronectin substrate, the binding signal of integrin alpha5beta1 to the cell‐binding domain of fibronectin transduces intracellularly an accumulation of F‐actin to cell periphery to form ruffling membrane. If syndecan‐2 binds simultaneously to the heparin‐binding domain of fibronectin through its heparan sulfate side chain, the signal transduces to organize F‐actin to form stress fibers. This transduction can be reversibly altered by a choice of the domain of fibronectin as the substrate, by an inhibition of the binding of heparan sulfate to fibronectin using antibody or oligosaccharides, or by a change of expression level of syndecan‐2. The molecular interaction between syndecan‐2 and fibronectin is sufficient with 5 repeating disaccharide units having sulfate residues as indicated in the figure. However, the regulation of integrin alpha5beta1 signaling requires 12 mer. The cytoplasmic domain of syndecan‐2 contains serine residue which is phosphorylated. Rho protein is involved in the cascade to form stress fibers.
http://www.glycoforum.gr.jp/science/word/proteoglycan/PGA08E.html
Mark R. Morgan, Martin J. Humphries & Mark D. Bass: Synergistic control of cell adhesion by integrins and
syndecans. Nature Reviews Molecular Cell Biology 8, 957-969 (December 2007)
The ability of cells to adhere to each other and to their surrounding extracellular matrices is essential for a multicellular existence. Adhesion provides physical support for cells, regulates cell positioning and enables microenvironmental sensing. The integrins and the syndecans are two adhesion receptor families that mediate adhesion, but their relative and functional contributions to cell–extracellular matrix interactions remain obscure. Recent advances have highlighted connections between the signalling networks that are controlled by these families of receptors. Here we survey the evidence that synergistic signalling is involved in controlling adhesive function and the regulation of cell behaviour in response to the external environment. Funzioni dei PGs, segue
Molte delle funzioni dei PGs coinvolgono il legame di proteine specifiche ai gruppi di GAGs dei PGs
I siti specifici di legame con i GAGs di queste proteine contengono molteplici residui di aminoacidi basici.
La sequenza di AA BBxBe BBBXXB (dove B è un aminoacido basico e X un qualsiasi AA) è ricorrente in questi siti.
Aminoacidi basici come la lisina e l’arginina forniscono una neutralizzazione di cariche per le cariche negative dei residui dei GAGs.
In molti casi il legame delle proteine della MEC ai GAGs è sopratutto carica‐dipendente.
Ad es. i GAGs più altamente solfatati si legano più fortemente alla fibronectina
http://www.nature.com/nrm/journal/v8/n12/fig_tab/nrm2289_F4.html
9
12/04/2013
Funzioni dei PGs, segue, 2
Alcune interazioni proteina‐GAG tuttavia richiedono sequenze di carboidrati specifiche:
Nell’eparina, ad es. una una particolare sequenza pentosaccaridica si lega strettamente all’antitrombina III, spiegando le proprietà anticoagolanti dell’eparina.
Altri GAGs si legano molto più debolmente
I proteoglicani modulano
i preocessi di crescita cellulare
Sia l’eparina che l’eparan solfato inibiscono la proliferazione cellulare in un processo che vede l’internalizzazione della componente GAG e la sua migrazione fino al nucleo.
Il Fibroblast Growth Factor (FGF) si lega strettamente all’eparina e ad altri GAGs e il complesso eparina‐FGF protegge il fattore di crescita dagli enzimi degradativi, così aumentando la sua attività.
Il legame dei FGF ai PGs e GAGs della MEC crea un serbatoio di fattori di crescita a disposizione delle cellule.
Il Transforming Growth Factor β stimola la sintesi e la secrezione di PGs da parte di alcune cellule
Diverse “core proteins” dei PGs, tra cui il versicano e il “lymphocyte homing receptor”, hanno domini simili in sequenza di legame verso il “Epidermal Growth Factor” e “Complement Regulatory Factor”.
Differenze di genere tra Eparan Solfati (HS)
Proposed structural model of male and female mouse liver intact HS chains. The
structure of male and female mouse liver HS chains has been predicted with
combined data obtained from chain length heparin lyases digestion patterns, SAXHPLC disaccharide profile, percentage disaccharide composition and percentage of
sulfated and N-unsubstituted disaccharides . Note: 3 repeats of duplicated GlcAGlcNAc, 4 repeats of triplicated GlcA-GlcNH 3 + and 2 repeats of triplicated GlcA-GlcNH
3 + (6S).
Murali S, Leong DF, Jaslyn LJ, Cool SM, Nurcombe V. Comparative assessment of the effects of gender-specific heparan sulfates on
mesenchymal stem cells. J Biol Chem. 2011 Mar 25.
Proteoglicano della Membrana Basale
PERLECANO
PERLECANO
10
12/04/2013
Perlecano (1)
Proteoglicano multidominio ad eparan solfato (HSPG) essenziale per lo sviluppo dei vasi sanguigni, del cuore, del cervello e nella condrogenesi.
Si trova in tutte le lamine basali vascolari (sopratutto
quelle associate alle cellule endoteliali) e dei tessuti
epiteliali; può anche trovarsi associato alla superficie
cellulare dove si ritiene interagisca con integrine. Si trova inoltre in tessuti avascolari quale la cartilagine e nello stroma del tessuto connettivo.
Burgess JK, Weckmann M. Matrikines and the lungs. Pharmacol Ther. 134:317‐37, 2012. Perlecano (3)
La proteina centrale del perlecano ha
approssimativamente 470 kDa.
Quando i molti oligosaccaridi”O-linked” e le fino a quattro
catene di HS (tre nel dominio I e una potenzialmente nel
dominio V) sono presi in considerazione, la dimensione
totale può raggiungere 800 kDa.
Burgess JK, Weckmann M. Matrikines and the lungs. Pharmacol Ther. 134:317‐37, 2012. Perlecano (2)
Ha cinque domini (I a V) dal N-terminale al C-terminale.
I domini contengono regioni di omologia con altre proteine note
coinvolte nel controllo della crescita, adesione cellulare e captazione
di nutrienti.
Il dominio I contiene tre sequenze tripeptidiche a cui si lega l’eparan
solfato e un modulo caratteristico “sea urchin sperm protein,
enterokinase, agrin (SEA)” che non ha altra funzione nota tranne quella
di aumentare il collegamento dell’HS e la glicosilazione “O-linked”.
Il dominio II contiene quattro regioni omologhe al recettore per le
lipoproteine a bassa densità di classe A (LDL) e una ripetizione tipo
immunoglobulina.
Il dominio III possiede tre moduli tipo laminina e otto ripetizioni tipo
«epidermal growth factor» (EGF).
Il dominio IV è il dominio più grande. Ha ripetizioni immunoglobuliniche
di tipo N-CAM, il cui numero varia fra le specie.
Il dominio V ha tre domini globulari separati da quattro ripetizioni tipo
EGF. E’ potenzialmente molto interattivo ed è il principale dominio
coinvolto nel legame cellulare.
Burgess JK, Weckmann M. Matrikines and the lungs. Pharmacol Ther. 134:317‐37, 2012. Perlecano (4)
I domini del perlecano e le catene laterali di eparan solfato possono interagire con un gran numero di ligandi:
Le catene laterali di HS del dominio I interagiscono con laminina, collagene IV, fibronectina, “fibroblast growth factor” (FGF) 2, “platelet derived growth factor”(PDGF), VEGF, trombospondina, prolina, “arginine‐rich and leucine‐rich repeat protein” (PRELP), angiopoietina‐
3 e fibrillina‐1.
Il dominio II interagisce con “very low density lipoprotein” (VLDL) e con la fibrillina‐1.
Il dominio III interagisce con FGF7, “FGF‐binding protein” e PDGF.
Il dominio IV interagisce con il nodogeno‐1/2, fibulina, fibronectina, collagene IV, sulfatidi e PDGF.
Il dominio V interagisce con nidogeno‐1, fibulina‐2, FGF7,sulfatidi, complesso laminina‐nidogeno, , α‐dystroglycan, α2β1 integrina, progranulina, ECM1, e collagen XVIII/endostatin
Burgess JK, Weckmann M. Matrikines and the lungs. Pharmacol Ther. 134:317‐37, 2012. Cartilagine
Proteoglicani
CARTILAGINE - AGGRECANO
http://www.pt.ntu.edu.tw/hmchai/Biomechanics/BMmaterial/Cartilage.files/CartilageLayer.png
11
12/04/2013
I proteoglicani rendono la cartilagine
flessibile e resiliente
Il proteoglicano della matrice della cartilagine è responsabile dalla flessibilità e resilienza del tessuto cartilagineo.
Nella cartilagine lunghi filamenti di acido ialuronico sono tempestati o rivestiti di molecole di PGs.
Le catene di ialuronato possono essere lunghe fino a 4 μm e possono coordinare 100 o più unità di proteoglicani.
Il proteoglicano della cartilagine possiede un dominio di legame all’ialuronato (indiretto) nella porzione N‐terminale del polipeptide che si lega all’ialuronato con l’assistenza di una “link protein”.
Gli aggregati ialuronato‐PGs possono avere pesi molecolari superiori ai 2 milioni di Dalton
Cartilagine
La matrice della cartilagine è un materiale omogeneo principalmente
composto da proteoglicani. I GAGs irraggiano dalla “core protein” come le setole di una spazzola.
I principali GAGs della cartilaginee sono condroitin solfato (CS) e cheratan
solfato (KS)
Un altro GAG della matrice della cartilagine è l’acido ialuronico, che funge da collante legando I PGs gli uni agli altri in grandi aggregati. Struttura dell’aggregato di proteoglicani
della cartilagine
Il dominio N‐terminale della “core protein” si lega ad una molecola di acido ialuronico (HA). Il legame è facilitato da una “link protein”, che si lega sia al disaccaride dell’ialurano che alla “core protein” dell’aggrecano.
Ogni “core protein” dell’aggrecano ha sequenze 127 Ser‐Gly alle quali sono aggiunte le catene di GAGs: 30 corte catene di cheratan solfato
97 catene di condroitin solfato più lunghe
http://www.ncbi.nlm.nih.gov/books/NBK21706/figure/A6576/
AGGRECANO
L’aggrecano è il principale proteoglicano della cartilagine articolare. Questa molecola è importante per il funzionamento corretto della cartilagine articolare perchè fornisce una struttura gelatinosa idratata (mediante le sue interazioni con l’ialurano e con proteine di collegamento (“link”)) che conferisce alla cartilagine proprietà di resistenza ai carichi. E’ anche cruciale per la morfogenesi del condroscheletro durante lo sviluppo.
Kiani C, Chen L, Wu YJ, Yee AJ, Yang BB. Structure and function of
aggrecan. Cell Res. 12:19-32, 2002.
12
12/04/2013
ECM - CARTILAGINE
Matrice extracellulare della cartilagine.
Nella cartilagine articolare sono presenti tre classi di proteine: collageni (sopratutto
collagene di tipo II), proteoglicani (sopratutto aggrecano) e altre proteine non affini ai
collageni (che includono le proteine di collegamento “link”, la fibronectina, e la proteina
oligomerica della matrice della cartilagine) nonchè proteoglicani più piccoli (biglicano,
decorina e fibromodulina). L’interazione fra i proteoglicani ad elevata carica negatica della
cartilagine e le fibrille di collagene di tipo I è responsabile della resistenza alla tensione alla
compressione del tessuto, che resiste ai carichi in vivo. Abbreviazioni: COMP: “cartilage
oligomeric matrix protein”.
Chen FH, Rousche KT, Tuan RS. Technology Insight: adult stem cells in cartilage regeneration and tissue engineering. Nat Clin Pract Rheumatol.
2:373-382, 2006.
13