25/04/2012
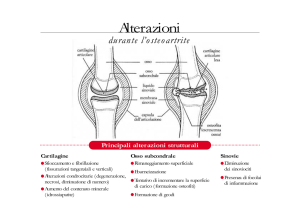
La matrice idratata
• La MEC è essenzialmente un gel (solido fibroso
con un fluido viscoso) prodotto dalle cellule e a
loro aderente
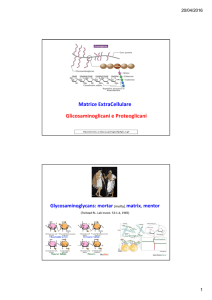
Matrice ExtraCellulare
Glicosaminoglicani e Proteoglicani
1
Fibre strutturali
Collageni
Elastina
Matrice Idratata
Fluido extracellulare
Proteoglicani
Molecole Adesive (es.)
Fibronectina
Laminina
2
Glicosaminoglicani
Glicosaminoglicani, GAGs
Classe molto eterogenea di macromolecole glucidiche di grande importanza
biologica.
Sono polimeri derivati da zuccheri semplici tra i quali i più importanti sono gli
acidi uronici [quali l’acido D-glucoronico (in cui la funzione alcoolica in
posizione C2 è sostituita da una carbossilica) o l’acido L-iduronico, un
epimero del 1°] e gli aminozuccheri glucosamina e galattosamina (in cui la
funzione alcoolica in posizione C2 è sostituita da una funzione aminica la
quale può a sua volta essere acetilata come nella N-acetilglucosamina) o
solforata, come nella N-solfatoglucosamina).
Il glicosaminoglicano è quindi costituito dalla ripetizione per un elevato
numero di volte di un’unità disaccaridica fondamentale, formata da
un’esosamina e da un acido uronico.
Alcuni glicosaminoglicani di grande importanza biologica contengono nella
molecola oltre agli zuccheri ed acidi uronici, elevate concentrazioni di
gruppi solforici. A causa della presenza di gruppi acidi, carbossilici e
solforici, queste molecole si comportano come polianioni e sono quindi
fortemente basofile e spesso metacromatiche
3
4
1
25/04/2012
Galattosio,
non acido
uronico
5
6
7
8
2
25/04/2012
Glicosaminoglicano non legato covalentemente a proteine
Acido ialuronico
Acido ialuronico, 1
Somiglianza con gli altri GAGs:
Polisaccaride non ramificato, composto dalla ripetizione regolare di
un’unità disaccaridica (glucoronato –N-acetilglucosamina)
Differenze dagli altri GAGs
La lunghezza della sua catena è molto superiore a quella degli altri
GAGs
Tutte le subunità disaccaridiche sono identiche
NON è solfatato
NON subisce epimerizzazione durante la sintesi
NON è legato covalentemente ad un asse proteico
NON è sintetizzato nell’apparato di Golgi come gli altri
glicosaminoglicani e rilasciato per esocitosi, ma viene “filato”
direttamente dalla superficie cellulare da un complesso enzimatico
inglobato nella membrana plasmatica. L’allungamento della catena
avviene per aggiunta di zuccheri all’estremità riducente.
Nei tessuti adulti è presente di solito in piccole quantità.
Sequenze ripetuta di disaccaride nell’ialuronato, un GAG
relativamente semplice. Questa molecola ubiquitaria nei Vertebrati
consiste di una singola ed unica catena contenente fino a 25000 monomeri
di zuccheri. Notare l’assenza di gruppi solfato.
http://www.ncbi.nlm.nih.gov/books/NBK26810/figure/A3541/
9
Acido ialuronico, 2
10
Acido ialuronico, 3
E’ presente in quantità superiori durante lo sviluppo embrionale, e,
nell’adulto durante la fase di guarigione delle ferite ed in alcuni
tessuti specializzati quali la cartilagine, l’umor vitreo dell’occhio, il
cordone umbilicale e il fluido sinoviale.
Nei tessuti è presente come:
Rivestimento alla superficie cellulare.
Come parte di grandi aggregati con i proteoglicani.
Apparentemente come polisaccaridi liberi nel fluido sinoviale e
nell’umor vitreo.
11
Dovuto sia alla repulsione tra cariche negative che alla
formazione di legami di idrogeno fra residui adiacenti di
zuccheri , esiste una inerente rigidità della membrana che dà
origine ad una struttura avvolta espansa e polidispersa ad elevato
peso molecolare.
Tuttavia, ad elevate concentrazioni le catene si possono
aggrovigliare e formare strutture lasse a doppia o tripla elica
formando una rete continua che intrappola molecole di acqua.
La capacità dell’ialuronato di formare una rete continua anche a
basse concentrazioni è dipendente dall’alto peso molecolare del
polisaccaride.
Una limitata degradazione delle molecole produce una riduzione
considerevole della viscosità delle soluzioni di ialuronato.
12
3
25/04/2012
Acido ialuronico, 4
Acido Ialuronico - ialurano
Nel fluido della sinovia e nell’umor vitreo dell’occhio, l’elevata
concentrazione di ialuronato ha due scopi:
produce un gel ad alta viscosità che ritarda i movimenti
dell’acqua ed anche ammortizza gli effetti dei carichi rapidi sulle
articolazioni
Esclude le cellule o materia particolata di grandi dimensioni in
modo da permettere un percorso ottico pulito nell’occhio.
Nell’embrione svolge importanti compiti come riempitore di spazi,
potendo essere usato per forzare una variazione di forma di una
struttura, dato che una piccola quantità si espande con acqua
occupando un grande volume.
L’ialuronato sintetizzato nel dominio basale di un epitelio, ad
esempio, spesso serve per creare una spazio libero in cui le cellule
possano in un secondo tempo migrare; ciò ha luogo ad esmpio nella
formazione del cuore, della cornea e di diversi altri organi.
Quando la migrazione delle cellule cessa, l’eccesso di ialuronato
viene di solito degradato dall’enzima ialuronidasi.
L’ialuronato é un polisaccaride sia extracellulare che associato
alla superficie cellulare, che viene tradizionalmente considerato
come una sostanza biologica appiccicosa che partecipa alla
lubrificazione delle articolazioni o al mantenimento dei tessuti
connettivi con consistenza gelatinosa.
Nonostante questi siano ruoli fisiologici comuni dell’ialuronato negli
organismi adulti, l’ialuronato funziona inoltre come un segnale
microambientale che co-regola il comportamento cellulare
durante lo sviluppo embrionale, i processi di guarigione delle
ferite, l’infiammazione e lo sviluppo dei tumori.
Ricerche recenti hanno messo in evidenza un ruolo chiave per le
interazioni tra l’ialuronato e le cellule tumorali in diversi aspetti della
crescita malgna e indicano la possibilitè di nuove strategie
terapeutiche
13
14
Toole BP. Hyaluronan: from extracellular glue to pericellular cue. Nat Rev Cancer. 4:528-539, 2004.
Acido ialuronico
Acido ialuronico, segue
Quando una pressione esterna viene applicata ad una rete di ialuronato, questa
si contrarrà, ma quando la pressione esterna non sussiste più la rete di
ialuronato riprenderà la sua forma originaria, dovuto alla pressione interna di
turgore, o acquisirà una nuova forma se sono state applicate nuove restrinzioni
o confini per controbilanciare questa pressione. Questa proprietà fornisce
resilienza (capacità di riprendere la forma originaria) e malleabilità a molti
tessuti.
Inoltre, le aree ricche di ialuronato all’interno dei tessuti di sviluppo esercitano
pressioni interne che possono provocare la separazione di strutture fisiche e
creare “autostrade” per la migrazione cellulare.
Un esempio drammatico di questo é la migrazione delle cellule
mesenchimali verso la cornea in risposta all’aumentata deposizione di
ialuronato, l’idratazione e il rigonfiamento concomitante della via migratoria.
Questo fenomeno é stato dimostrato sperimentalmente usando cellule di
glioma che migrano attraverso un gel di fibrina.
A scala minore, queste proprietà possono facilitare i cambiamenti di forma
cellulare che sono richiesti per la divisione cellulare e il movimento,
fornendo una zona altamente idratata attorno alla cellula che la separa dalle
cellule adiacenti.
(a) Struttura dell’ialuronato, che è composto di
unità disaccaridiche ripetute di acido
glucoronico e N-acetilglucosamina. Il
polimero ha parti sia cariche che idrofobiche, a
causa dei gruppi carbossilici dell’acido
glucoronico e di un cluster di atomi di idrogeno
su una faccia del disaccaride, rispettivamente.
Gli atomi di idrogeno assiali che contribuiscono
alla forza idrofobica sono illustrati in rosso.
(b) Il dominio occupato da ogni molecola di
ialuronato in soluzione diluita si espande a
causa di repulsione reciproca fra i gruppi
carbossilici, e perciò occupa un grande
volume, in cui l’acqua é intrappolata
all’interno della struttura.
In soluzioni più concentrate, le molecole di
ialuronato si aggrovigliano, formando una rete
continua ma porosa. Questa rete esercita la
cosidetta “pressione di turgore” a causa
dell’aumentata repulsione fra e all’interno delle
molecole.
15
16
Toole BP. Hyaluronan: from extracellular glue to pericellular cue. Nat Rev Cancer. 4: 528-539, 2004.
4
25/04/2012
Sintesi dell’ialuronato nella membrana cellulare
delle cellule eucariotiche segue
Sintesi dell’ialuronato nella membrana cellulare
delle cellule eucariotiche
http://glycoforum.gr.jp/science/hyaluronan/HA07
/HA07E.html
La sintesi dell’ialuronato ha luogo sulla superficie interna della membrana
plasmatica e l’ialuronato nascente viene estruso sulla membrana plasmatica mentre è
ancora legato alla sintasi che lo produce. Ciò assicura che l’ialuronato abbia un rapporto
intimo con la superficie cellulare e possa participare prontamente alla creazione di una
zona pericellulare idratata (X e Y sono proteine regolatorie putative.
Toole BP. Hyaluronan: from extracellular glue to pericellular cue. Nat Rev Cancer. 4:528-539, 2004
17
SINTESI BATTERICA DELL'IALURONATO
a | Una matrice pericellulare ricca di ialuronato circonda cellule di
fibrosarcoma (cellule allungate “rivestite”; indicate dalle frecce).
Questa matrice o “involucro” può essere visualizzata mediante
exclusione di particelle, come in questo caso globuli rossi fissati.
b | Il trattamento di queste cellule con ialuronidase specifica per
l’ialuronato rimuove i rivestimenti dimostrando che queste strutture
sono dipendenti dall’ialuronato.
c | Representazione del rivestimento, mostrando che l’ialuronato si
lega alla superficie cellulare mediante interazioni con recettori
quali il CD44. Si può presumere che l’ialuronato possa essere legato
ad altri recettori tipo RHAMM (“Receptor for Hyaluronic-AcidMediated Motility”), ma ciò non è stato ancora dimostrato.
L’ialuronato si lega a molte molecole di proteoglicani, che hanno una
grande carica negativa e si respingono una con l’altra, forzando
l’ialuronato ad estendersi verso l’esterno della superficie cellulare
assumendo una configurazione “a spazzola” che esclude le
particelle.
Anche altre molecole che legano l’ialuronato - quali TSG6, proteine
“linker” e “inter--inhibitor” – possono essere trattenute all’interno di
questo rivestimento.
La composizione del rivestimento /matrice pericellulare variano con il
tipo cellulare, ma questo assemblaggio è sempre dipendente
dell’ancoraggio dell’ialuronato alla superficie cellulare.
L’ialuronato inoltre forma uno stampo per le interazioni di
proteoglicani e altri fattori nelle matrici extracellulari, ma in questo
caso l’ialuronato non è ancorato alla superficie cellulare.
d | Il rivestimento è qui illustrato con ialuronato collegato alla
superficie cellulare mediante retenzione dell’enzima sintasi
dell’ialuronato. In questo caso, l’ialuronato é collegato all’enzima sul
versante citoplasmatico della membrana plasmatica, ma si proietta
sulla superficie cellulare attraverso pori della membrana.
Nonostante possa sembrare strano che alcuni batteri
possano sintetizzare lo stesso polimero di ialuronato dei
mammiferi questi microorganismi hanno creato un modo
molto furbo per vivere il loro stile di vita di agente
patogeno. I batteri di tipo Streptococcus equisimilis del
Gruppo C (un patogeno degli animali e talvolta dell'uomo),
gli Streptococcus pyogenes del gruppo A (un patogeno
umano), e la Pasteurella multocida (un patogeno animale)
sono in grado di nascondersi dal sistema immunitario dei
loro ospiti circondandosi con una spesso strato di
ialuronato. Dato che questa barriera di ialuronato, o
capsula, ha la stessa struttura dell'ialuronato dei nostri
tessuti, i batteri non sono facilmente riconoscibili dagli
anticorpi o attaccati dai fagociti. Diversi studi hanno
confermato che la capsula di ialuronato contribuisce in
gran parte alla patogenicità di questi batteri.
19
Toole BP. Hyaluronan: from extracellular glue to pericellular cue. Nat Rev Cancer. 4:528-539, 2004
18
http://www.glycoforum.gr.jp/science/hyaluronan/H
A06/HA06E.html#II
Nonostante il vantaggio guadagnato da un battere patogeno nel fare una capsula di ialuronato, solo circa
sei specie di batteri (fra molte migliaia) hanno acquisito questa capacità biosintetica. Forse la formazione
della capsula comporta dei notevoli svantaggi allo stesso tempo. Uno svantaggio ... é che la capsula
può rallentare la crescita cellulare direttamente inibendo la produzione della parete cellulare. Un altro
fattore consiste nel fatto che la spessa capsula di ialuronato rappresenta un carico metabolico molto
grande. Le subunità di zuccheri usate per assemblare questa capsula potrebbero essere usati per invece
come sorgenti di energia per la crescita e la divisione della cellula batterica. Non tutti i tipi di batteri
hanno la capacità metabolica di sostenere la propria crescita mentre usano una gran parte dei loro
20
carboidrati e metabolismo energetico per produrre la capsula.
5
25/04/2012
Proteoglicani
Proteoglicani
Sono costituti da un asse proteico a cui si lega covalentemente un elevato
numero di glicosaminoglicani, che costituiscono circa il 90% della molecola di
proteoglicani.
Solitamente alla stessa proteina si lega un singolo tipo di glicosaminoglicani,
ma può essere presente anche più di un tipo, come ad es. nel proteoglicano
della cartilagine, che contiene quasi in uguale misura condroitin solfato e
cheratan solfato.
I glicosaminoglicani si legano all’asse proteico sia mediante legame Nglicosidico analogo a quello delle glicoproteine, sia mediante legame Oglicosidico a cui può partecipare il monosaccaride xiloso oltre a due molecole di
galattosamina.
Complesso di una “core protein”
e glicosaminoglicani
GAGs sono ripetizioni di
disaccaridi lineari con
modificazioni dei gruppi aminici
Spesso solfatati
Sempre negativi
Perciò, i GAGs idrofilici
si respingono uno con l’altro e
formano una matrice idratata
capace di assorbire fino a 1000
volte in loro volume in acqua.
21
22
http://www.ncbi.nlm.nih.gov/books/NBK26810/figure/A3543/?report=objectonly
Classificazione dei proteoglicani in base alla loro
localizzazione e tipo di proteina centrale
Localizzazione
Tipo di catena di GAG
ECM
HA, CS, KS
Associati al collagene
CS, DS, KS
Mr della proteina “core”
Principali membri
(kD)
225-250
aggrecano, versicano
decorina, biglicano
40
fibromodulina
“Membrana”/lamina
basale
HS
120
Superficie cellulare
HS, CS
33[a]-60[b]-92[c]
Granuli intracellulari
Eparina, CS
17-19
perlecano
sindecano, glipicano,
betaglicano, CD44E,
cerebroglicano
serglicina
CS, condroitin solfato; DS, dermatan solfato; KS, cheratan solfato; HA, acido ialuronico; HS, eparan solfato
23
24
6
25/04/2012
RUOLI FUNZIONALI PROPOSTI PER I PROTEOGLICANI
Alcuni comuni proteoglicani
PROTEOGLICANO
PESO MOLECOLARE
TIPO DI CATENE NUMERO DI LOCALIZZAZIONE
APPROSSIMATIVO DELLA
DI GAGs
CATENE DI
PROTEINA “CORE”
GAGs
Aggrecano
210,000
condroitin solfato
+ cheratan solfato
(in catene
separate)
~130
Betaglicano
36,000
condroitin solfato/
dermatan solfato
1
Decorina
40,000
condroitin solfato/
dermatan solfato
Perlecano
600,000
eparan solfato
Sindecano-1
32,000
Dally (nella
Drosophila)
60,000
1
cartilagine
Tipo
Proteoglicani a Condroitin
Solfato (CS-PGs)
FUNZIONI
Localizzazione
Cartilagine
Parete dei vasi sanguignil
sostegno meccanico;
forma grandi aggregati
con l’ialuronato
Proteoglicano a dermatan
Solfato (DS-PGs)
superficie cellulare e si lega al TGF-β
matrice
diffuso nei tessuti
connettivi
si lega a fibrille di tipo I di
collagene e al TGF-β
2–15
lamine basali
funzione strutturale e di
filtrazione nella lamina
basale
condroitin solfato
+ eparan solfato
1–3
superficie cellulare
adesione cellulare; si lega
al FGFe ad altri fattori di
crescita
eparan solfato
1–3
superficie cellulare
co-recettore per proteine
di segnalamento Wingless
e Decapentaplegic
Proteoglicano ad eparan
solfato (HS-PGs)
Proteoglicano a cheratan
solfato (KS-PGs)
Fluido follicolare ovarico
Interazione/collegamento
Acido ialuronico, proteine di
collegamento
Acido ialuronico, proteine di
collegamento, elastina,
collagen, superficie
cellulare
(?) (1985)
Tendine, pelle
Banda-d del collagene,
auto-interazione
Superficie cellulare
“Membrana”/lamina basale
Auto-interazione,
fibronectina, collagene,
membrana plasmatica
Collagene di tipo IV
Stroma della cornea
Collagene (?)
Ruoli funzionali
Resilienza, legame con
acqua
Mantenimento della
viscoelasticità, rgolazione
della permeabilità e della
deposizione lipidica
Mantenimento della
viscosità, coinvolto
nell’ovulazione
Regolazione della
fibrillogenesi e del diametro
delle fibrille; mantenimento
dell’arichittetura normale
Riconoscimento cellulare,
collegamento cellulare,
trasformazione neoplastica
Permeabilità, filtrazione di
macromolecole
Mantenimnto della
trasparenza e delle
proprietà rifrattive della
cornea
25
26
Proteoglicani
In termini di dimensioni vanno dalla serglicina con 104
residui di aminoacidi (10,2 kD) al versicano, con 2409
residui (265 kD).
Ogni tipo di proteoglicano contiene uno o due tipi di
GAGs legati covalentemente
Di solito le unità di GAGs sono “O-linked” a residui di
serina di sequenze dipeptidiche Ser-Gly.
La serglicina prende il nome da un dominio centrale unico con 49
aminoacidi composti di residui alternati di serina e di glicina.
Il proteoglicano della matrice della cartilagine contiene 117 paia Ser-Gly alla
quali si legano le catene di condroitin solfato.
La decorina, un piccolo PG secreto dai fibroblasti nella matrice del tessuto
connettivo contiene soltanto tre paia Ser-Gly, una delle quali è di solito
glicosilata.
Oltrealle unità di GAGs, i PGs possono contenere altri gruppi
oligosaccaridici “O-linked” oppure “N-linked”
27
28
7
25/04/2012
Info su proteoglicani - 1
Info su proteoglicani - 2
Le cellule secernono molti proteoglicani nella MEC, ma
trattengono alcuni tipi nella membrana plasmatica
mediante polipeptidi transmembrana o un’ancora a
glicosilfosfatidilinositolo (GPI).
Le proteine assiali variano in dimensioni da 100 a 4000
aminoacidi.
Molte sono modulari, e contengono i domini strutturali
familiari: EGF, proteina regolatoria del complemento,
ripetizioni ricche di leucina o lectine.
Tre famiglie di collageni hanno catene laterali di GAGs: i
tipi IX e XII hanno catene di condroitin solfato e il tipo
XVII ha catene di eparan solfato.
I numeri di GAGs attaccati alla proteina assiale
varia da uno (decorina) a più di 200
(aggrecano).
Una particolare proteina assiale può avere tipi di
GAGs identici (fibroglicano, glipicano, versicano)
oppure GAGs diversi (aggrecano, serglicina,
sindecano).
Alcuni tipi cellulari possono aggiungere diversi
GAGs alla stessa proteina assiale o secernere
una proteina assiale senza GAGs.
29
30
Info su proteoglicani - 3
Date le loro proprietà fisiche e distribuzione fra gli elementi fibrosi
della MEC, i proteoglicani e l’acido ialuronico sono considerati come
“riempitori di spazi”.
Ogni disaccaride idrofilico porta un gruppo carbossilico o solfato o
entrambi, e quindi i GAGs sono polianioni carichi che si espandono
tramite repulsione elettrostatica in soluzione e attraggono fino a 50g
di acqua per grammo di proteoglicano.
L’ialuronato, il GAG di maggiori dimensioni, occupa un volume molto
ampio:
Una singola molecola idratata di 25,000 kD occupa un volume
simile a quello di un piccolo organello con un diametro di 200
nm.
La retenzione di acqua dall’ialuronato e del proteoglicano
aggrecano-cheratan solfato/condroitin solfato è essenziale per la
cartilagine.
31
32
http://web.virginia.edu/Heidi/chapter9/chp9frameset.htm
8
25/04/2012
Info su proteoglicani - 4
Funzioni dei proteoglicani
Nella MEC di altri tessuti, delle reti di ialuronato
ad elevata densità di cariche negative restringe
il flusso di acqua, limita la diffusione dei soluti
(specialmente delle macromolecole) e
impedisce il passaggio dei microorganismi.
L’ialuronato e i proteoglicani possono agire
inoltre da lubrificanti nelle articolazioni e come
mezzo otticamente trasparente, riempitivo degli
spazi dell’umor vitreo dell’occhio.
Solubili, localizzati nella MEC
Es: Serglicina, versicano, proteoglicsano della
matrice della cartilagine (aggrecano)
Proteine integrali transmembrana
Es: Sindecano
Entrambi i tipi funzionano interagendo con una
gran varietà di molecole:
Mediante le componenti GAGs
Mediante domini recettoriali specifici nel polipeptide
stesso
33
34
http://web.virginia.edu/Heidi/chapter9/chp9frameset.htm
Esempio: PG transmembrana Sindecano
Si associa intracellularmente con il
citoscheletro di actina
Fuori dalla cellula interagisce con
la fibronectina, proteina
extracellulare che si lega a diverse
protewine della superficie cellulare
e a componenti della MEC
La sua capacità di participare a
interazioni multiple con queste
proteine bersaglio lo rende ccome
una specie di “colla” nello spazio
extracellulare
collegando componenti della
MEC
Facilitando il legame delle
cellule alla MEC
Mediando il legame di fattori di
crescita e di altre molecole
solubili alla matrice e alle
superficie cellulari.
Syndecan-2 regulates signaling through integrin alpha5beta1 on a fibronectin substrate On a fibronectin
substrate, the binding signal of integrin alpha5beta1 to the cell-binding domain of fibronectin transduces intracellularly
an accumulation of F-actin to cell periphery to form ruffling membrane. If syndecan-2 binds simultaneously to the
heparin-binding domain of fibronectin through its heparan sulfate side chain, the signal transduces to organize F-actin
to form stress fibers. This transduction can be reversibly altered by a choice of the domain of fibronectin as the
substrate, by an inhibition of the binding of heparan sulfate to fibronectin using antibody or oligosaccharides, or by a
change of expression level of syndecan-2. The molecular interaction between syndecan-2 and fibronectin is sufficient
with 5 repeating disaccharide units having sulfate residues as indicated in the figure. However, the regulation of integrin
alpha5beta1 signaling requires 12 mer. The cytoplasmic domain of syndecan-2 contains serine residue which is
phosphorylated. Rho protein is involved in the cascade to form stress fibers.
http://www.ncbi.nlm.nih.gov/books/NBK21706/
figure/A6578/
35
36
http://www.glycoforum.gr.jp/science/word/proteoglycan/PGA08E.html
9
25/04/2012
Mark R. Morgan, Martin J. Humphries & Mark D. Bass: Synergistic control of cell adhesion by integrins and
syndecans. Nature Reviews Molecular Cell Biology 8, 957-969 (December 2007)
Funzioni dei PGs, segue
Molte delle funzioni dei PGs coinvolgono il legame di
proteine specifiche ai gruppi di GAGs dei PGs
I siti specifici di legame con iGAGs di queste proteine
contengono molteplici residui di aminoacidi basici.
The ability of cells to adhere to each other and to their surrounding extracellular matrices is essential for a multicellular
existence. Adhesion provides physical support for cells, regulates cell positioning and enables microenvironmental
sensing. The integrins and the syndecans are two adhesion receptor families that mediate adhesion, but their relative
and functional contributions to cell–extracellular matrix interactions remain obscure. Recent advances have
highlighted connections between the signalling networks that are controlled by these families of receptors. Here we
survey the evidence that synergistic signalling is involved in controlling adhesive function and the regulation of cell
behaviour in response to the external environment.
http://www.nature.com/nrm/journal/v8/n12/fig_tab/nrm2289_F4.html
La sequenza di AA BBxBe BBBXXB (dove B è un aminoacido
basico e X un qualsiasi AA) è ricorrente in questi siti.
Aminoacidi basici come la lisina e l’arginina forniscono una
neutralizzazione di cariche per le cariche negative dei residui dei
GAGs
In molti casi il legame delle proteine della MEC ai GAGs è
sopratutto carica-dipendente.
Ad es. i GAGs più altamente solfatati si legano più fortemente
alla fibronectina
37
Funzioni dei PGs, segue, 2
38
I proteoglicani modulano i preocessi di crescita cellulare
Alcune interazioni proteina-GAG tuttavia
richiedono sequenze di carboidrati specifiche:
Nell’eparina, ad es. una una particolare sequenza
pentosaccaridica si lega strettamente all’antitrombina
III, spiegando le proprietà anticoagolanti dell’eparina.
Altri GAGs si legano molto più debolmente
Sia l’eparina che l’eparan solfato inibiscono la proliferazione
cellulare in un processo che vede l’internalizzazione della
porzione GAG e la sua migrazione fino al nucleo.
Il Fibroblast Growth Factor (FGF) si lega strettamente all’eparina
e ad altri GAGs e il complesso eparina-FGF protegge il fattore di
crescita dagli enzimi degradativi, così aumentando la sua
attività.
Il legame dei FGF ai PGs e GAGs della MEC crea un serbatoio di
fattori di crescita a disposizione delle cellule.
Il Transforming Growth Factor β stimola la sintesi e la secrezione
di PGs da parte di alcune cellule
Diverse “core proteins” dei PGs, tra cui il versicano e il
“lymphocyte homing receptor” hanno domini simili in sequenza di
legame verso il “Epidermal Growth Factor” e “Complement
Regulatory Factor”.
39
40
10
25/04/2012
I proteoglicani rendono la cartilagine flessibile e resiliente
• Il proteoglicano della matrice della cartilagine è
responsabile dalla flessibilità e resilienza del tessuto
cartilagineo.
• Nella cartilagine lunghi filamenti di acido ialuronico sono
tempestati o rivestiti di molecole di PGs.
• Le catene di ialuronato possono essere lunghe fino a 4
μm e possono coordinare 100 o più unità di
proteoglicani.
• Il proteoglicano della cartilagine possiede un dominio di
legame all’ialuronato (indiretto) nelporzione N-terminale
del polipeptide che si lega all’ialuronato con l’assistenza
di una “link protein”.
• Gli aggregati ialuronato-PGs possono avere pesi
molecolari superiori ai 2 milioni di Dalton
41
Eparina
Differenze di genere tra Eparan Solfati (HS)
Proposed structural model of male and female mouse liver intact HS chains. The
structure of male and female mouse liver HS chains has been predicted with
combined data obtained from chain length heparin lyases digestion patterns, SAXHPLC disaccharide profile, percentage disaccharide composition and percentage of
sulfated and N-unsubstituted disaccharides . Note: 3 repeats of duplicated GlcAGlcNAc, 4 repeats of triplicated GlcA-GlcNH 3 + and 2 repeats of triplicated GlcA-GlcNH
3 + (6S).
Murali S, Leong DF, Jaslyn LJ, Cool SM, Nurcombe V. Comparative assessment of the effects of gender-specific heparan sulfates on
mesenchymal stem cells. J Biol Chem. 2011 Mar 25.
42
Eparina nei granuli delle mast cells
Schema della molecola di
eparina a forma di piuma dei
granuli delle mast cells.
L’asse lungo è una proteina alla
quale sono legate
covalentemente molecole di
glicosaminoglicani (GAGs).
Ai GAGs sono legati non
covalentemente istamina,
serotonina ed enzimi proteolitici
(chimasi di diversi tipi).
(adattato da Majno & Joris: Cells,Tissues and Disease,
Blackwell, 1996)
43
44
11
25/04/2012
Basofilia dell’eparina
Colorazione Giemsa
Struttura dell’aggregato di proteoglicani
della cartilagine
Mast cells nel tumore di Ehrlich
Mast cells nel polmone di ratto
normale
45
Il dominio N-terminale della “core protein” si lega ad una molecola di acido ialuronico (HA).
Il legame è facilitato da una “link protein”, che si lega sia al disaccaride dell’ialurano che
alla “core protein” dell’aggrecano.
Ogni “core protein” dell’aggrecano ha sequenze 127 Ser-Gly alle quali sono aggiunte le
catene di GAGs:
30 corte catene di cheratan solfato
97 catene di condroitin solfato più lunghe
http://www.ncbi.nlm.nih.gov/books/NBK21706/figure/A6576/
46
Cartilagine
Cartilagine
La matrice della cartilagine è un materiale omogeneo principalmente composto da
proteoglicani.
I GAGs irraggiano dalla “core protein” come le setole di una spazzola.
I principali GAGs della cartilaginee sono condroitin solfato (CS) e cheratan solfato (KS)
47
Un altro GAG della matrice della cartilagine è l’acido ialuronico, che funge da collante
legando I PGs gli uni agli altri in grandi aggregati.
48
12
25/04/2012
AGGRECANO
AGGRECANO
L’aggrecano è il principale proteoglicano strutturale
che si trova nella matrice extracellulare della
cartilagine.
L’aggrecano è il
principale proteoglicano
della cartilagine articolare.
Questa molecola è
importante per il
funzionamento corretto
della cartilagine articolare
perchè fornisce una
struttura gelatinosa
idratata (mediante le sue
interazioni con l’ialurano e
con proteine di
collegamento (“link”)) che
conferisce alla cartilagine
proprietà di resistenza ai
carichi. E’ anche cruciale
per la morfogenesi del
condroscheletro durante lo
sviluppo.
Ha un peso molecolare >2,500 kDa.
La proteina centrale (210-250 kDa) ha 100-150 catene
di glicosaminoglicani (GAG) collegate.
La maggioranza delle catene di GAG sono
condroitin/dermatan solfato e le rimanenti sono di
cheratan solfato.
La molecola strutturale produce un gel rigido,
deformabile in modo reversibile, che resiste alla
compressione.
Esso si combina con l’acido ialuronico per formare
complessi macromolecolari di grandi dimensioni.
L’aggiunta di piccole porzioni (0.1-2% w/w) di acido ialuronico ad una
soluzione di aggrecano (2 mg/ml) provoca la formazione di un complesso
con un aumentato volume idrodinamico (30-40%) e un dignificativo aumento
della viscosità relativa della soluzione.
L’aggrecano è un componente critico della cartilagine
strutturale e della funzione delle articolazioni.
49
Aggrecano
Kiani C, Chen L, Wu YJ, Yee AJ, Yang BB. Structure and function of
aggrecan. Cell Res. 12:19-32, 2002.
50
I proteoglicani consistono di
un “core” centrale proteico
(marrone) e di una o più
catene di glicosaminoglicani
legati covalentement. HS:
blu; CS/DS: giallo.
I proteoglicani della
membrana plasmatica o
attraversano totalmente la
membrana (proteine di
membrana di tipo I) oppure
sono legati ad un’ancora di
GPI.
Il grande proteoglicano a CS della cartilagine (aggrecano) forma un
aggregato con l’ialuronato e proteina di collegamento. In The biochemistry of
glycoproteins and proteoglycans [ed. W.J. Lennarz], p. 291. Plenum Press,
New York.).
51
http://www.ncbi.nlm.nih.gov/bookshelf/br.fcgi?book=glyco2&part=ch16&rendertype=figure&id=ch16.f1
I proteoglicani della matrice
extracellulare sono di solito
secreti, ma alcuni
proteoglicani possono essere
scissi proteoliticamente e
rilasciatii dalla superficie
cellulare (non illustrato
http://www.ncbi.nlm.nih.gov/bookshelf/br.fcgi
?book=glyco2&part=ch16&rendertype=figure
52
&id=ch16.f2
13
25/04/2012
ECM - CARTILAGINE
53
54
Fluido Extracellulare (interstiziale)
L’ambiente in cui le cellule
vivono e “apprezzano”
Proprietà
Quasi isosmotico (isotonico) con il
citoplasma
Basso contenuto in proteine
Tamponato con Bicarbonato
Sodio e cloruro sono I principali ioni
Matrice extracellulare della cartilagine.
Nella cartilagine articolare sono presenti tre classi di proteine: collageni (sopratutto
collagene di tipo II), proteoglicani (sopratutto aggrecano) e altre proteine non affini ai
collageni (che includono le proteine di collegamento “link”, la fibronectina, e la proteina
oligomerica della matrice della cartilagine) nonchè proteoglicani più piccoli (biglicano,
decorina e fibromodulina). L’interazione fra i proteoglicani ad elevata carica negatica della
cartilagine e le fibrille di collagene di tipo I è responsabile della resistenza alla tensione alla
compressione del tessuto, che resiste ai carichi in vivo. Abbreviazioni: COMP: “cartilage
55
oligomeric matrix protein”.
Fluidi x flebo I.V.
Soluzione salina: 0.9% NaCl
Ringer-Lactate (Hartmann’s)
fornisce sodio, calcio, cloruro e
bicarbonato in concentrazioni simili
a quelle illustrate a ds.
56
Chen FH, Rousche KT, Tuan RS. Technology Insight: adult stem cells in cartilage regeneration and tissue engineering. Nat Clin Pract Rheumatol.
2:373-382, 2006.
14