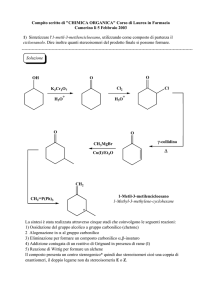
Composti eterociclici
I composti eterociclici danno spettri in cui:
lo ione molecolare è molto intenso
i frammenti sono pochi
La frammentazione degli eterocicli aromatici sostituiti segue
vie parallele a quelle osservate per i corrispondenti derivati
benzenici.
La posizione dei sostituenti non è mai facilmente deducibile
dall'esame di un singolo spettro; avendo a disposizione gli
spettri di tutti gli isomeri è a volte possibile tentare
l'attribuzione.
Composti eterociclici
Un esame affrettato dello spettro potrebbe portare ad errori
interpretazione, facilmente evitabili con un minimo
conoscenza dei meccanismi di frammentazione attesi per
diverse strutture molecolari.
di
di
le
Ad esempio, una alchil piridina ha la stessa composizione
elementare di una alchil anilina con un atomo di carbonio in
meno in catena laterale.
CH3
NH2
CH3
N
C9H13N
Da derivati benzenici di uguale composizione elementare
C9H13N ci si aspettano frammentazioni diverse;
Composti eterociclici
106
NH2
CH3
135
- 27
- C2H5.
-
C2H5.
Da derivati benzenici di uguale composizione elementare
C9H13N ci si aspettano frammentazioni diverse;
Composti eterociclici
Confronto tra spettro della butil piridina e quello del butil benzene
91
CH3
- 27
134
65-
C2H2
105
tH
In entrambi i casi le frammentazioni più importanti sono la rottura benzilica
(C3H7.) con trasposizione di H o senza;
Segue la perdita di acetilene (26 Da) nel caso del butil benzene, e di HCN (27
Da) per il derivato piridinico. In entrambi i casi si forma lo ione a massa 65.
Piridina
Lo ione molecolare è molto intenso e i frammenti sono pochi.
La via di frammentazione principale porta all’eliminazione di HCN
-HCN
Etilpiridine: rottura benzilica
Danno spettri diversi a seconda della posizione dell’alchile rispetto
all’azoto. La perdita di HCN diventa meno importante rispetto alle
frammentazioni che coinvolgono la catena alchilica.
1) rottura benzilica
2-etilpiridina
[M-H]+
4-etilpiridina
[M-H]+
-.CH3
-.CH3
Etilpiridine: rottura benzilica
Lo ione a m/z 92 è più stabile nell’isomero sostituito in posizione 3, perché la
DENSITÀ ELETTRONICA è più alta in posizione 3
3-etilpiridina
+
CH2
-.CH3
3
N
m/z 92 : picco base
Etilpiridine rottura α
2) rottura σ che porta alla formazione dello ione [M-H]+
2-etilpiridina
[M-H]+
4-etilpiridina
[M-H]+
[M-H]+
Etilpiridine
2) Rottura σ che porta alla formazione dello ione [M-H]+
Più favorita se il sostituente è in posizione 2
ione ciclico
riarrangiamento
Etilpiridine: rottura del legame C-Ar
3) rottura del legame C-Ar e trasposizione di idrogeno
-.C2H4
Propilpiridine: Trasposizione di McLafferty
4) Trasposizione di McLafferty (se la catena è sufficientemente lunga)
2-propilpiridina
-C2H4
+
N
CH 2
H
CH 2
+.
CH 2
tH
N
H
CH2
CH2
.CH2
α
+.
N
H
m/z 93
CH2
Propilpiridine: Trasposizione di McLafferty
4) Trasposizione di McLafferty
4-propilpiridina
-C2H4
CH2
CH2
CH2
+.
CH2
H
H
H
N
N
+.
m/z 93
Propilpiridine: Trasposizione di McLafferty vs rottura benzilica
La trasposizione di McLafferty è soppressa a favore della rottura
benzilica
3-propylpyridina
+
CH2
.
- C2H3
3
N
m/z 92 : picco base
Lo ione a m/z 92 è più stabile nell’isomero sostituito in posizione 3, perché la
DENSITÀ ELETTRONICA è più alta in posizione 3
Chinolina e isochinolina
La via di frammentazione principale, come per la piridina, porta
all’eliminazione di HCN
-HCN
-HCN
CH2
N
+.
-HCN
.
m/z 102
+
+.
[M-H]+
+
N
CH2
CH2
-.CH3
Rottura benzilica
La DENSITÀ ELETTRONICA è più alta in posizione 3
+
CH2
3
.
- CH3
N
m/z 142
alchilchinolina e alchilisochinolina
-.C2H3
-C2H2
Rottura benzilica
McLafferty
+.
+
CH2
3
2
N
N
m/z 142
+.
CH2
H
CH2
CH2
N
H
m/z 143
CH2
Furano e benzofurano
-.CHO
Furano e benzofurano
L’apertura dell’anello può coinvolgere i legami:
-.CHO
-.CH3CO
O-C(5)
O-C(2)
Furano e benzofurano
Acido 2-furoico, etil estere
Tipica la sequenza di frammentazione dell'estere etilico:
McLafferty seguita da perdita di 17 unità di massa. Notare la
perdita di CO2 dall'acido furoico (m/z = 112).
Furano e benzofurano
Lo ione molecolare è molto intenso:
- estensione della coniugazione dell’anello
del furano all’anello del benzene
-CO
- mancano
facilmente
legami
che
si
rompano
+.
benzociclopropene
acetilene
Furano e benzofurano
2 e 3 alchil benzofurani hanno spettri
simili.
Rottura alfa:
R=H
Furano e benzofurano
dimetil benzofurani hanno spettri con gli stessi ioni, ma con intensità
diversa.
Rottura alfa:
Furano e benzofurano
Tiofene e benzotiofene
C2H2S+.
m/z 58
+.
-C2H2
a, b
S
- .CHS
C3H3+
m/z 39
M+.; m/z 84
C3H3.
- CH=S+
m/z 45
Tiofene e benzotiofene
Gli alchiltiofeni danno rottura benzilca
(perdita del gruppo R) generando lo
ione tiapirilio a m/z 97
Tiofene e benzotiofene
2-cloro tiofene
-Cl.
Picco isotopico M+2
Perdita di cloro dallo ione molecolare seguita da perdita di
CHS con formazione dello ione a massa 39. Notare lo ione a
massa 45 (CHS+).
Tiofene e benzotiofene
d
c
S
e
a
b
Tiofene e benzotiofene
[M-H]+
M+. m/z 148
m/z 147
Tiofene e benzotiofene
[M-H]+
M+. m/z 148
m/z 147
Pirrolo e indolo
Pirrolo e indolo
Acetil pirrolo
α
i
i
Pirrolo e indolo
-HCN
-CHN
Pirrolo e indolo
[M-H]+
[M-H]+
Pirrolo e indolo
[M-H]+