7-SBAC Fisica 1/28
TERMODINAMICA
quando un sistema fisico (per esempio un fluido) e’
costituito da un numero molto grande di particelle
(atomi o molecole) la dinamica newtoniana diventa
inapplicabile (e anche inutile!)
La termodinamica descrive le proprieta’ macroscopiche del sistema
→ calore, temperatura, energia interna, pressione volume, entropia, etc.
→ studia le trasformazioni fisico-chimiche tra le varie fasi della materia
→ pone in relazione proprieta’ microscopiche e macroscopiche (teoria
cinetica dei gas)
La termodinamica ha a che fare con i concetti di temperatura e calore
Temperatura → una misura di quanto un corpo e’ caldo o freddo
Calore → energia ceduta ad un corpo per innalzarne la temperatura
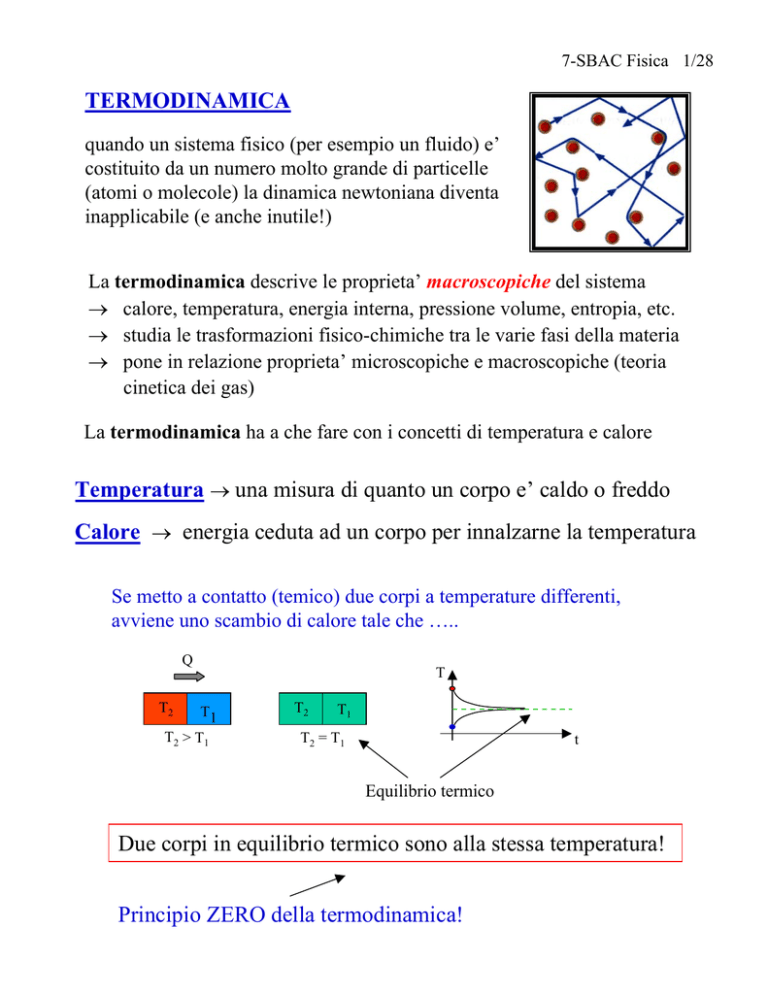
Se metto a contatto (temico) due corpi a temperature differenti,
avviene uno scambio di calore tale che …..
Q
T2
T1
T2 > T1
T
T2
T1
T2 = T1
t
Equilibrio termico
Due corpi in equilibrio termico sono alla stessa temperatura!
Principio ZERO della termodinamica!
7-SBAC Fisica 2/28
Def. Operativa di Temperatura
1) misuro una proprieta’fisica che varia con la temperatura
• dilatazione termica (lunghezza e/o volume)
• variazione della pressione di un gas (a vol. Costante)
• variazione di resIstenza elettrica
• variazione di colore di un corpo caldo
2)
stabilisco due T di riferimento:
0 oC
100 oC
3)
→
→
fusione del ghiaccio a 1 atm
ebollizione acqua a 1 atm
stabilisco l’unita’ di misura dividendo la
distanza in 100 parti uguali:
ho costruito un termometro in gradi Celsius
(gradi centrigradi)
Nel sistema MKS la temperatura si misura in gradi Kelvin
chiamata Temperatura Assoluta (vedi avanti)
7-SBAC Fisica 3/28
Dilatazione termica
ogni materiale, solido, liquido o gassoso, e’ soggetto
a dilatazione termica
⇒ le sue dimensioni variano con la temperatura!
Dilatazione lineare
∆L = L0 λ ∆T
λ coeff. dilataz. lineare
[λ] = [oK-1]
Dilatazione volumetrica
∆V = V0 α ∆T
α = 3λ coeff. dilataz. volum.
[α] = [oK-1]
Tipicamente λ e α sono positivi
⇒ la densita’ ρ aumenta al
diminuire della temperaura T
Il caso anomalo dell’ acqua
Nota: per i solidi α e’ piu’
piccola di circa un fattore 10
max ⇒ ρ (T=4oC) = 1 g / cm3
poi decresce al diminuire di T
la densita’ del ghiaccio e’
minore di quella dell’acqua!!!
7-SBAC Fisica 4/28
I gas perfetti
gas rarefatto (a bassa densita’) nel quale le
molecole non interagiscono tra loro. (urtano solo
contro le pareti del contenitore).
t = temperatura espressa in gradi Celsius [ oC ]
V0 = volume occupato dal gas a t = 0 oC [ m3 ]
p0 = pressione esercitata dal gas a t = 0 oC [ kg m–1 s–2 ]
I legge di Gay-Lussac (p = cost.)
V(t) = V0 (1 + α t ) trasf. isobara
II legge di Gay-Lussac (V = cost.)
p(t) = p0 (1 + α t ) trasf. isocora
Il coefficiente e’ lo stesso nella I e II legge ed uguale per tutti i
gas perfetti !
α = 3.7x10−3 oC–1 = ( 1/273.16) oC–1
Nota: α ~fattore 10 piu’ grande rispetto ai liquidi
7-SBAC Fisica 5/28
Posso ora introdurre T assoluta ⇒
1) trovo il valore t = ta per cui V(ta) = 0
⇒ ta = –1 / α = – 273.16 oC
V
V0
•
ta
2) definisco la nuova temperatura T = t - ta
⇒ T(oK) = t(oC) + 273.16
T0 = T(0oC )
I legge G.L. → V(T) = V0 (T / T0 )
II legge G.L. → p(T) = p0 (T / T0 )
Nel si misura in gradi Kelvin chiamata
Temperatura Assoluta
T(oK) = T(oC) + 273.16
t
7-SBAC Fisica 6/28
Legge di Boyle
pV = kost
(T = cost.)
trasf. isoterma
combinando le tre leggi
( isoterma + isobara )
N = n. molecole del gas
p V = N kB T
kB = 1.38 x 10–23 J K-1
costante di Boltzman
Equazione di stato dei gas perfetti
Nota:
• lo stato del gas e’ determinato dalle tre grandezze p V e T, due delle
quali sono indipendenti, la terza e’ imposta dall’equazione di stato
• il prodotto pV e’ proporzionale alla quantita’ di gas presente nel
contenitore, ovvero al numero N di molecole del gas
La quantita’ di gas si misura anche in …. numero di moli
7-SBAC Fisica 7/28
MOLE
quantita’ di materia corrispondente ad un
numero N di atomi (o molecole) pari a
NA = 6.02 x 1023
NA = Numero di Avogadro
n (moli) = N / NA
Massa Molecolare
massa di una mole di sostanza (cioe’ di N=NA atomi o molecole)
e si misura in grammi
Esempio:
il peso molecolare dell’ H2O e’ M=18 g.
Qual’e’ la massa m di una molecola di H2O?
m=
M
18 g
=
~ 3 x 10 − 23 g
23
N A 6.023 x 10
Posso riscrivere l’equazione di stato in termini di numero n di moli:
p V = N k B T = (N / NA ) NA k B T
pV = nRT
A cosa serve?
R = 8.31 J K-1
costante dei
gas perfetti
Problema delle condense!!!
7-SBAC Fisica 8/28
Numero e legge di Avogadro
( A. Avogadro chimico
italiano, 1776-1856 )
due gas A e B costituiti dallo
stesso numero di molecole N,
tenuti alla stessa pressione p e
temperatura T, occupano lo stesso
volume V
In particolare Avogadro misuro’ che ⇒
p0 = 1 atm, t = 0 oC, 1 mole di gas (N = NA = 6.023x1023 ) occupa 22.4 litri!
Mole: quantita’ di materia corrispondente a
NA atomi (o molecole) ⇒ n (moli) = N / NA
Il numero di Avogadro NA si misura prendendo
12 g. di dell’isotopo 126 C e dividendo per la
massa mC di un atomo di carbonio
NA
PM ( 126 C )
12 g
=
=
= 6.023 x 10 23
26
−
mC
1.99 x 10
kg
n. massa A
12 C
6
n. atomico Z
7-SBAC Fisica 9/28
Teoria cinetica dei gas
P, V, T (macrosc.) ↔ v, K (microsc.)
L
Leggi della dinamica
Esercizio:
trovare la pressione P esercitata da N molecole
che si muovono con velocita’ vx tra le pareti di
una scatola cubica di volume V= L3
vx
L
Applicando le leggi della meccanica e’ facile trovare che
P =
2 < Ec >
N
V
3
<Ec> = (1/2) m v2
Energia cinetica
media molecole
combinando con equazione di stato,
2
⎧
⎪P V = N < E c >
3
⎨
⎪P V = N k B T
⎩
<E c > =
3
kB T
2
La Tass. e’ una misura dell’energia
cinetica media delle molecole!!!
7-SBAC Fisica 10/28
Esercizio:
come dipende la velocita’ della temperatura?
In termini di velocita’vqm
v qm ≡
< v2 > =
3 kB T
=
m
Esempio : gas di O2 a T = 300 oK
v qm =
3R T
M
M(O2) = 32 g
3 x 8.31 x 300 ( J / K ) K
~ 483 m / s
32 x 10 − 3 kg
un urto (elastico)
f = m ax = m [∆vx /∆t ] = 2 m vx / ∆t
n urti in ∆t
n = (vx ∆t ) / 2 L
<F> = n f = m (vx)2 / L
N molecole nella scatola ⇒ N / 3 si muovono lungo asse x ⇒
N m < v x >2
2 < Ec >
<F> =
= N
3
L
3
L
P =
L
<F>
2 < Ec >
= N
A
3
V
A= L2
V= L3
L
L
7-SBAC Fisica 11/28
Gas perfetto
molecole non interagenti ⇔ Energia del gas = K delle molecole
Gas reale
molecole interagiscono ⇔ Energia del gas = K delle molecole + Upot
modello molecole:
sfere rigide di raggio r0~10–9 m che per
d < r0 → si respingono
d > r0 → si attraggono
d >> r0 → F = 0
per separare due molecole
da vicino a lontano →
bisogna compiere lavoro
∆U = Lext
•
•
l’energia potenziale finale U e’ maggiore!
se U(d >> r0 ) = 0 → U(d ~ r0 ) < 0
In generale quindi
⇒
Eint = K + U
7-SBAC Fisica 12/28
ricordarsi che K = K(T)
Eint = K + U
K →
U →
K
moto di agitazione termica che tende a separare le molecole
forze di attrazione che tendono a tenere unite le molecole
U
determina gli stati di aggregazione
(o fasi) della materia
SOLIDO (U >> K)
le molecole occupano posizioni (quasi) fisse
⇒ solido ↔ forma propria (reticolo cristallino)
proprieta’ → elasticita’
LIQUIDO (U ~ K)
le molecole possono muoversi, ma restano vicine
⇒ liquido ↔ volume proprio
proprieta’ → tensione superficiale - capillarita’ - viscosita’
GAS (U << K)
le molecole si muovono (quasi) liberamente
⇒ gas ↔ ne’ forma, ne’ volume proprio
proprieta’ → compressibilita’
Cambiando T
cambio K
passaggio di stato
7-SBAC Fisica 13/28
∆Eint = ∆K + ∆U
Eint = K + U
Ho due modi di cambiare Eint !
1) Cambiare K variando T (senza cambiare il volume V)
2) Cambiare U variando V (senza cambiare la temp. T)
? Come posso far cambiare K
1a) mettere a contatto (termico) due corpi a T diverse in modo che
calore venga trasferito dal corpo caldo a quello freddo.
T1 < T2
T1 = T2
T
t
corpo 1
∆K > 0
∆U = 0
corpo 2
Q
Equilibrio termico
∆K < 0
∆U = 0
Definizione di caloria: quantita’ di energia necessaria a
1 g di H2O
∆T = 1 oK
1 caloria
in realta’ ∆T = 1 oC
tra 14.5 oC → 15.5 oC
7-SBAC Fisica 14/28
1b) compiere lavoro meccanico Lext sul sistema.
Esperimento di Joule
lasciando cadere i pesi, compio lavoro
meccanico sul sistema.
→ le molecole si muovono piu’
velocemente, la T del liquido
aumenta!
∆K > 0 (e’ aumentata T)
Energia meccanica
⇒ aumento di Eint
Joule misuro’ che :
∆U = 0 (V non e’ cambiato)
1 Kg di H2O
∆T = 1 oK
4186 J
Altri esempi:
•
•
trapano, freni macchina
strofinarsi le mani quando e’ freddo
Combinando exp. 1a) e 1b) trovo:
Equivalente meccanico del calore
1 caloria = 4.186 J
7-SBAC Fisica 15/28
? Come posso far cambiare U
Variando la configurazione (la distanza) tra
le molecole del sistema.
2a) in ogni passaggio di stato la distanza media fra le molecole
varia senza che cambi la temperatura. Per cambiare tale
distanza occorre cedere al sistema del calore (latente), vedi
lezione sui passaggi di stato.
2b) in ogni reazione chimica la configurazione delle molecole
varia, poiche’ si formano nuovi legami.
Esempio: combustione
L’energia liberata per
formare CO2 e’ circa il
doppio di quella spesa
per scindere O2
Esercizio:
? Sollevamenti di un peso da
20 kg x 1 m ⇔ consumare un
pasto da 2000 Calorie-cibo
Nota:
1 Caloria-cibo = 1000 cal
7-SBAC Fisica 16/28
Capacita’ termica
non tutti i corpi subiscono lo stesso ∆T a pari ∆E.
∆E = C ∆Τ
oppure
∆Q = C ∆Τ
[ C ] = [ J / oK ]
C → capacita’ termica del corpo
C e’ proporzionale alla massa m del corpo! → Inerzia termica
C = c m
[ c ] = [ J / oK kg ]
calore specifico
Notare il c dell’acqua!!!
(altra anomalia)
H2O → elemento essenziale
per “regolare” la temperatura
→ clima temperato
Fenomeno delle brezze
giorno: Tterra > Tmare
⇒ aria calda sulla terra sale
e arriva la fredda dal mare
→ brezza: mare → terra
notte: Tterra < Tmare
→ brezza: terra → mare
7-SBAC Fisica 17/28
esercizio
trovare la temperatura finale di equilibrio T che si ottiene mescolando
i due liquidi .
Dati: m1, c1 , T1 , m2, c2 , T2
+
m1
c1 , T1
( T2 > T1 )
m2
=
c2 , T2
Suggerimento: ∆Q1→2 = - ∆Q2→1
m1
+
m2
?T
7-SBAC Fisica 18/28
Trasmissione del calore: ⇒ 3 meccanismi
Conduzione
• avviene nei corpi solidi
• non c’e’trasporto di materia
• dipende dalla conducibilita’ λ del
materiale e dalla geometria del sistema
T2 > T1
A
∆Q / ∆t = λ
T2
T1
Q
A
∆T
L
λ = conduttivita’ termica
L
[λ] = [W m–1 oK–1 ]
Argento = 460
Ferro = 67
Legno = 0.2
Vetro = 0.9
Acqua = 0.4
Aria secca = 0.02
Poliuretano exp. = 0.024
Lana vetro/roccia = 0.045
Esercizio
Calcolare la potenza dissipata attraverso i due strati in figura e
la temperatura all’interfaccia
λ2 λ1
Tx =
T2
T1
P=
Tx
(L 2 / λ 2 )T1 + (L1 / λ1 )T2
(L1 / λ1 ) + (L 2 / λ 2 )
A ∆T
(L1 / λ1 ) + (L 2 / λ 2 )
7-SBAC Fisica 19/28
Convezione
• avviene nei fluidi (liquidi e gas)
• c’e’trasporto di materia
• avviene solo dal “basso verso l’alto”
Irraggiamento
• avviene nel vuoto alla velocita’ della luce
•
•
•
•
(c = 3 x 108 m/s ) → onde elettromagnetiche
tutti i corpi irraggiano ( dipende da T)
T>1000 oC → visibile; T<1000 oC → IR
energia assorbita dipende dalla caratterist.
del materiale: opachi e traparenti
serra ed effetto serra a causa della CO2
costante solare = 1350 W/m2
7-SBAC Fisica 20/28
Esercizio 1
Calcolare la potenza necessaria per tenere riscaldata una vecchia casa
fatta di mattoni pieni e finestre a singolo vetro sapendo che
salto di temperatura
∆t = 20 oC
superficie mattoni
spessore muro
conducibilita’ mattoni
A1 = 100 m2
L1 = 0.5 m
λ1 = 0.1 W m–1 oK–1
superficie vetro
spessore vetro
conducibilita’ vetro
A2 = 5 m2
L2 = 5 mm
λ2 = 1 W m–1 oK–1
Esercizio 3
Supponendo con ∆t = 20 oC, calcolare la potenza
dissipata attraverso una finestra di superficie A= 5
m2, costituita da “doppi vetri” con le seguenti
caratteristiche
spessore vetri
conducibilita’ vetro
l1 =l2 = 5 mm
λv = 1 W m–1 oK–1
spessore aria
conducibilita’ aria
la = 10 mm
λa = 0.01 W m–1 oK–1
7-SBAC Fisica 21/28
I passaggi di stato
Solido → liquido → gas
⇒ le molecole hanno
maggiore K
⇒ devo fornire Energia al
sistema!
vaporizz.
condensaz.
CALORE LATENTE
( 1 g di H20 )
fusione
solidificaz.
Calore latente
Energia richiesta per il passaggio di stato a
T = costante
Esempio H2O
c fus = c sol = 3.3x105 J / kg
c vap= c con = 2.3x106 J / kg
c lat = ∆ E / ∆ m
[ clat ] = [ J / kg ]
7-SBAC Fisica 22/28
Esercizio
sia dato un blocco di ghiaccio di massa m = 1 kg alla temperatura di -10 oC.
Domanda a)
Quanto calore occorre fornire al sistema per ottenere acqua a +20 oC ?
Domanda b)
Quale sara’ lo stato finale del sistema e la sua temperatura se si fornisce al
ghiaccio un calore pari a 200 kJ ?
Dati:
c (ghiaccio) = 2500 J / oK kg
c fus H2O
= 3.3x105 J / kg
c (H2O)
= 4186 J / oK kg
Suggerimento: Qtot = Q1 + Q2 + Q3
Q1 = calore necessario per far passare il ghiaccio da -10 oC a 0 oC
Q2 = calore necessario a fondere il ghiaccio a 0 oC
Q3 = calore necessario per far passare l’acua da 0 oC a +20 oC
7-SBAC Fisica 23/28
T, P
Pressione di vapore
Vaporizzazione: processo di fuga delle
molecole dalla superficie di un liquido
<Ec> = 3 / 2 kB T
le molecole vicine alla superficie con E>>Ec
possono sfuggire (evaporare!)
• energia media molecole rimaste diminuisce ⇒ il liquido si raffredda
• occorre fornire energia ⇒ calore latente di vaporizzazione
• notare: la velocita’ di vaporizzazione dipende da T e P
T, V
Fisso ora T e V
(pentola chiusa e “svuotata” di aria)
all’equilibrio (termo)-dinamico
⇒
n. molec. che sfuggono = n. molec. che rientrano
il vapore e’ saturo
⇒
Pvap
• fissata T, se cambio V, Pvap non varia ! (cambiano Vliq e Vvap )
aumento V
→ piu’ mlecole passano nella fase vapore
diminuisco V
→ piu’ mlecole passano nella fase liquida
? Sudorazione, ventilatore, vento
7-SBAC Fisica 24/28
La Pvap dipende da T
( e dal tipo di sostanza)
Ebollizione:
la transizione liquido → vapore
avviene su tutto il volume del liquido
( Pvap > Pext)
• quando l’acqua raggiunge T = 100 oC
→ Pvap = 1 atm ⇒ se Pext = 1 atm,
l’acqua inizia a bollire! ( e T non sale piu’!)
Pvap (H2O) a 20 oC
~ 0.02 atm
Qualche domanda :
? perche’ d’inverno piove di piu’?
? perche’ la pentola a pressione cuoce piu’ in fretta ?
? perche’ a volte l’acqua bolle “istantaneamente” quando
aggiungiamo sale o riso ? ( fenomeno “supersaturazione”)
? quale pressione “sento” in una sauna a T= 30o C ?
(sauna = ambiente saturo di vapore acqueo)
Un buon esercizio:
spiegare come funziona la
macchinetta del caffe’!
Inizialmente Pliq = 1 atm + Pvap e’ piccola!
a T~80 oC → Pliq ~ 1.5 atm (Teboll ~ 110 oC)
e’ sufficiente a vincere gravita’ + resistenza filtro
e l’acqua sale senza bollire!
Alla fine c’e’ solo vapore e si sente il gorgoglio!
7-SBAC Fisica 25/28
Condensazione
1) aumentare la pressione a T costante
2) diminuire la temperatura a P costante
…. ma non sempre e’ possibile liquefare un vapore!!
curva liquido-vapore
Definizione:
un gas e’ un vapore non
liquefabile, ovvero
liq
uid
o
p
pc
punto
critico
gas
vapore
tc
t
t > tc
p > pc
7-SBAC Fisica 26/28
Applicazione: il problema delle condense
temp [C]
p_vap0
[ mbar ]
c_sat
[ g / m^3 ]
0
5
10
15
20
25
30
35
40
45
50
55
60
65
70
75
80
85
90
95
100
6.1
8.7
12.3
17.0
23.4
31.6
42.4
56.1
73.7
95.7
123.2
157.2
199.0
250.0
311.7
385.9
474.6
579.8
704.1
850.1
1020.6
4.8
6.8
9.4
12.8
17.3
23.0
30.3
39.5
50.9
65.1
82.6
103.8
129.4
160.1
196.8
240.1
291.1
350.7
420.0
500.2
592.4
Supponiamo che il vapor d’acqua
saturo possa essere considerato come
un gas perfetto (* vedi esercizio).
Se p0(T) e’ la sua pressione di vapore
saturo alla temp. T
p 0 (T ) V = n R T
c 0 (T ) =
p 0 (T ) M
RT
c0(T) = conc (kg/m3) del vapore saturo
Ugualmente, se il vapore non
e’ saturo
p (T ) V = n R T
Formula di Magnus
p 0 ( t ) = p 0 (0) 10
at
( b+ t )
c(T ) =
p (T ) M
RT
p0(0) [mbar] = 6.10
a [1/C]
= 7.50
B [C]
= 237.30
DEFINIZIONE:
Umidita’ Relativa (UR)
UR =
p (T )
c(T )
=
p 0 (T ) c 0 (T )
7-SBAC Fisica 27/28
Applicazione: il problema delle condense
∆ T di condensazione ( C )
temp [C]
0
5
10
15
20
25
30
35
40
45
50
55
60
65
70
75
80
85
90
95
100
p_vap0
[ mbar ]
6.1
8.7
12.3
17.0
23.4
31.6
42.4
56.1
73.7
95.7
123.2
157.2
199.0
250.0
311.7
385.9
474.6
579.8
704.1
850.1
1020.6
c_sat
[ g / m^3 ]
4.8
6.8
9.4
12.8
17.3
23.0
30.3
39.5
50.9
65.1
82.6
103.8
129.4
160.1
196.8
240.1
291.1
350.7
420.0
500.2
592.4
Umidita' Relativa
0.3
0.4
0.5
0.6
0.7
0.8
0.9
15.5
16.1
16.8
17.4
18.1
18.8
19.5
20.2
20.9
21.6
22.4
23.1
23.9
24.7
25.4
26.2
27.1
27.9
28.7
29.6
30.4
12.0
12.5
13.0
13.5
14.0
14.5
15.1
15.6
16.2
16.8
17.3
17.9
18.5
19.1
19.8
20.4
21.0
21.7
22.3
23.0
23.7
9.2
9.5
9.9
10.3
10.7
11.1
11.6
12.0
12.4
12.9
13.3
13.8
14.2
14.7
15.2
15.7
16.2
16.7
17.2
17.7
18.2
6.8
7.1
7.4
7.7
8.0
8.3
8.6
8.9
9.3
9.6
9.9
10.3
10.6
11.0
11.3
11.7
12.1
12.4
12.8
13.2
13.6
4.8
5.0
5.2
5.4
5.6
5.9
6.1
6.3
6.5
6.8
7.0
7.3
7.5
7.7
8.0
8.3
8.5
8.8
9.1
9.3
9.6
3.0
3.2
3.3
3.4
3.6
3.7
3.8
4.0
4.1
4.3
4.4
4.6
4.7
4.9
5.1
5.2
5.4
5.6
5.7
5.9
6.1
1.4
1.5
1.6
1.6
1.7
1.8
1.8
1.9
2.0
2.0
2.1
2.2
2.3
2.3
2.4
2.5
2.6
2.6
2.7
2.8
2.9
7-SBAC Fisica 28/28
Problema
• un vapore saturo puo’ essere considerato
un gas perfetto ?
• a che distanza fra loro stanno
(mediamente) le molecole di acqua?
Suggerimenti:
calcolare la concentrazione numerica N/V
e la distanza media d ~ (N/V) -1/3












