SCHEDA
7.1
L’avvelenamento da arsenico
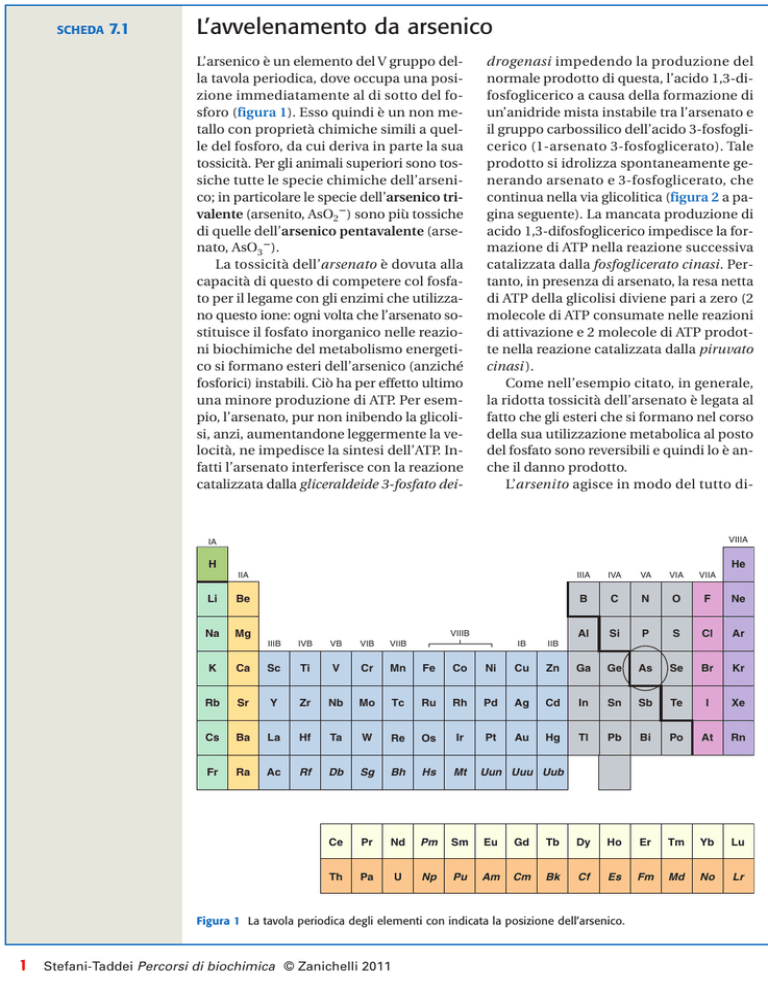
L’arsenico è un elemento del V gruppo della tavola periodica, dove occupa una posizione immediatamente al di sotto del fosforo (figura 1). Esso quindi è un non metallo con proprietà chimiche simili a quelle del fosforo, da cui deriva in parte la sua
tossicità. Per gli animali superiori sono tossiche tutte le specie chimiche dell’arsenico; in particolare le specie dell’arsenico trivalente (arsenito, AsO2ⴚ) sono più tossiche
di quelle dell’arsenico pentavalente (arsenato, AsO3ⴚ).
La tossicità dell’arsenato è dovuta alla
capacità di questo di competere col fosfato per il legame con gli enzimi che utilizzano questo ione: ogni volta che l’arsenato sostituisce il fosfato inorganico nelle reazioni biochimiche del metabolismo energetico si formano esteri dell’arsenico (anziché
fosforici) instabili. Ciò ha per effetto ultimo
una minore produzione di ATP. Per esempio, l’arsenato, pur non inibendo la glicolisi, anzi, aumentandone leggermente la velocità, ne impedisce la sintesi dell’ATP. Infatti l’arsenato interferisce con la reazione
catalizzata dalla gliceraldeide 3-fosfato dei-
drogenasi impedendo la produzione del
normale prodotto di questa, l’acido 1,3-difosfoglicerico a causa della formazione di
un’anidride mista instabile tra l’arsenato e
il gruppo carbossilico dell’acido 3-fosfoglicerico (1-arsenato 3-fosfoglicerato). Tale
prodotto si idrolizza spontaneamente generando arsenato e 3-fosfoglicerato, che
continua nella via glicolitica (figura 2 a pagina seguente). La mancata produzione di
acido 1,3-difosfoglicerico impedisce la formazione di ATP nella reazione successiva
catalizzata dalla fosfoglicerato cinasi. Pertanto, in presenza di arsenato, la resa netta
di ATP della glicolisi diviene pari a zero (2
molecole di ATP consumate nelle reazioni
di attivazione e 2 molecole di ATP prodotte nella reazione catalizzata dalla piruvato
cinasi ).
Come nell’esempio citato, in generale,
la ridotta tossicità dell’arsenato è legata al
fatto che gli esteri che si formano nel corso
della sua utilizzazione metabolica al posto
del fosfato sono reversibili e quindi lo è anche il danno prodotto.
L’arsenito agisce in modo del tutto di-
VIIIA
IA
He
H
IIA
IIIA
IVA
VA
VIA
VIIA
Li
Be
B
C
N
O
F
Ne
Na
Mg
Al
Si
P
S
Cl
Ar
VIIIB
IIIB
IVB
VB
VIB
VIIB
IB
IIB
K
Ca
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
Ga
Ge
As
Se
Br
Kr
Rb
Sr
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Ag
Cd
In
Sn
Sb
Te
I
Xe
Cs
Ba
La
Hf
Ta
W
Re
Os
Ir
Pt
Au
Hg
Tl
Pb
Bi
Po
At
Rn
Fr
Ra
Ac
Rf
Db
Sg
Bh
Hs
Mt
Ce
Pr
Nd
Pm
Sm
Eu
Gd
Tb
Dy
Ho
Er
Tm
Yb
Lu
Th
Pa
U
Np
Pu
Am
Cm
Bk
Cf
Es
Fm
Md
No
Lr
Uun Uuu Uub
Figura 1 La tavola periodica degli elementi con indicata la posizione dell’arsenico.
1
Stefani-Taddei Percorsi di biochimica © Zanichelli 2011
O
B
OH
A
HCOH
A
CH2OPO32–
D-gliceraldeide
3-fosfato
NAD+
HAsO42–
NADH + H+
O
B
COAsO32–
A
HCOH
A
CH2OPO32–
1-arsenato 3-fosfo-D-glicerato
H2O
Spontanea
verso. La sua tossicità è dovuta alla capacità di formare un complesso stabile con l’acido lipoico, uno dei costituenti dei complessi sovramolecolari di due enzimi che
catalizzano reazioni fondamentali del metabolismo energetico. Questi sono la piruvato deidrogenasi, responsabile della decarbossilazione ossidativa dell’acido piruvico ad acetil CoA, e l’␣-chetoglutarato deidrogenasi, uno degli enzimi del ciclo dell’acido citrico (figura 3).
L’avvelenamento cronico da arsenico trivalente causato dall’ingestione di acqua di
pozzi contaminati da pesticidi arsenicali
oppure provocato ad arte finisce per sconvolgere il metabolismo energetico dell’organismo con gravi danni irreversibili che
portano inevitabilmente alla morte. La condizione di avvelenamento può essere rivelata dalla ricerca dell’arsenico nelle unghie
e nei capelli, dove tende ad accumularsi. In
questi annessi cutanei, i normali livelli di
arsenico sono pari a circa 0,5 mg/kg di peso
corporeo mentre tale valore sale di oltre 100
volte in una persona con esposizione cronica a questa sostanza.
O
B
(CH2)4CO enzima
+ AsO2– + H+
H+
HAsO42–
O
SH
B
CO–
SH
A
HCOH
O
B
(CH2)4CO enzima
+ H2O
A
CH2OPO32–
3-fosfo-D-glicerato
S
As
S
A
Figura 2 L’arsenato disaccoppia la reazione di
ossidazione catalizzata dalla gliceraldeide 3-fosfato
deidrogenasi da quella di fosforilazione catalizzata
dalla fosfoglicerato cinasi impedendo la
formazione di acido 1,3-difosfoglicerico.
OH
Figura 3 Modificazione chimica dell’acido lipoico
da parte dell’arsenito.
Stefani-Taddei Percorsi di biochimica © Zanichelli 2011
2