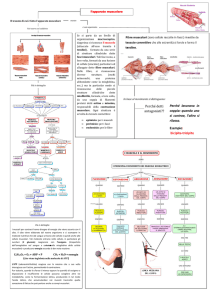
Giovedì 31 Maggio - Venerdì 1 Giugno
GIORNATE DELLA SCIENZA:
QUANDO LA RICERCA DIVENTA DI TUTTI
con il Patrocinio del Comune di Sansepolcro
Promotore Scientifico: Dr.ssa Simona Boncompagni
CeSI - Centro Scienze dell’Invecchiamento
Università degli Studi G. d’Annunzio di Chieti - Pescara
Giovedì 31 Maggio, ore 20:30
INCONTRO CON LA POPOLAZIONE
Preservare i muscoli da patologie ed invecchiamento:
cosa sta facendo la ricerca per migliorare la qualità della nostra vita.
Sede: Teatro del Convitto INPDAP “Regina Elena”
Liceo “Città di Piero”
Sansepolcro (Ar)
Venerdì 1 Giugno, ore 9.30 a.m.
INCONTRO CON GLI STUDENTI
del III e V Liceo Scientifico “Piero della Francesca”
Titolo dell’incontro:
Come un ricercatore affronta la domanda scientifica: esperienze
diverse tra Europa e Stati Uniti per trovare risposte a quesiti irrisolti.
Sede: Sala Consiliare, Palazzo delle Laudi (Municipio di Sansepolcro)
PROGRAMMA e CONTRIBUTI SCIENTIFICI PER GLI STUDENTI
PROGRAMMA:
INCONTRO CON GLI STUDENTI
IV Liceo Scientifico “Piero della Francesca”
Titolo dell’incontro:
Come un ricercatore affronta la domanda scientifica:
esperienze diverse tra Europa e Stati Uniti per trovare
risposte a quesiti irrisolti.
Moderatori:
Simona Boncompagni (Università degli Studi G. d’Annunzio di Chieti-Pescara)
Feliciano Protasi (Università degli Studi G. d’Annunzio di Chieti-Pescara)
-
Welcome from the Maior.
(Saluto del Sindaco)
Dr.ssa Daniela Frullani
-
Session Introduction.
(Introduzione alla Sessione)
Dr.ssa Simona Boncompagni (Università degli Studi G. d’Annunzio di Chieti -Pescara)
-
What muscle structure can tell us about function.
(Cosa la struttura può dirci della funzione)
Dr.ssa Clara Franzini Armstrong (University of Pennsylvania - Philadelphia,USA)
-
Unraveling function one molecule at a time.
(Svelare la funzione di una molecola alla volta)
Dr. Paul Allen (Harvard Medical School - Boston, USA)
-
The use of animal models to study human myopathies: our experience.
(La sperimentazione animale nello studio di miopatie umane: la nostra esperienza)
Dr. Feliciano Protasi (Università degli Studi G. d’Annunzio di Chieti-Pescara)
-
How to built a better muscle.
(Come costruire un muscolo migliore)
Dr. Antonio Musarò (Università degli Studi La Sapienza - Roma)
-
Restoration of muscle structure and function by electrical stimulation in
paraplegic patients.
(Recupero della struttura e della contrattilità muscolare in pazienti paraplegici
attraverso la stimolazione elettrica funzionale)
Dr. Helmut Kern (LBI-Wilheminenspital, Università of Vienna - Austria)
& Dr.ssa Sandra Zampieri (Università degli Studi di Padova)
-
Skeletal muscle impairment during aging and possible countermeasures.
(Indebolimento del muscolo scheletrico con l’invecchiamento e possibili contromisure)
Dr. Carlo Reggiani (Università degli Studi di Padova)
CONTRIBUTI SCIENTIFICI PER GLI STUDENTI:
Title:
What muscle structure can tell us about function.
(Traduzione: Cosa la struttura può dirci della funzione)
Clara Franzini Armstrong (University of Pennsylvania - Philadelphia, USA)
Nota: contributo Dr.ssa Clara Franzini-Armstrong fornito separatamente.
Title:
EC coupling: Unraveling function one molecule at a time.
Paul D. Allen (Harvard Medical School - Boston, USA)
My interest in medicine started as a young boy and when I entered University as a
member of the first class of accelerated medical students (a 6 year program) university
continued to fuel a spark of interest in scientific discovery that began in secondary school
and has continued for the rest of my life. While others spent their summers at the beach, I
spent mine in organic chemistry and biochemistry laboratories, synthesizing new
chemicals and discovering pathways of biochemical reactions. When some of my
colleagues went abroad to study medicine and have a good time, I did my 6 months
abroad at the Chester Beatty Institute in London doing a researc h project that frequently
kept me in the lab late at night from early in the morning. But I finished it, much to the
surprise of all the people there. My path to my current science career was tortuous. I first
started training as a surgeon for several years before taking a leave of absence to study
and receive a Ph.D. in Muscle Physiology. My path continued with twists and turns, first
training in anesthesiology, spending several years as a full time clinician and only part time
scientist interested in heart failure and malignant hyperthermia, a muscle disease that is
caused by anesthesia. Because the basis of this problem was thought to be somewhere in
the process of EC coupling—the process that connects the electrical signals from the
nerve to cause muscle contraction it kept my interest strong. During this time I discovered
that MH was a problem with intracellular Ca 2+ metabolism that led to a desire to
understand the molecular basis
causing this problem. The question
was how can I do this, so ~20 years
ago I decided to “re-invent” myself to
become a molecular biologist. To do
this I went back to be a post-doctoral
fellow and was assigned to clone and
study the largest and one of the most
important proteins in EC coupling, the
sarcoplasmic reticulum Ca 2+ release
channel, or as we call it the type 1
ryanodine receptor or RyR1. The rest,
as they say, is history and some is the
present. All has been fun!
But enough of how I got here, I will now move on to experiments that are described
in the title of my talk. In the cartoon (see Figure), you can see the calcium release unit
that is the protein complex controlling the release of calcium from the internal stores of
skeletal muscle and the heart which then interacts with the proteins that produce force. My
goal was to determine the individual roles of each of these proteins in this process, and
determining which were critical, without which the animal could not breath or have a useful
heart beat, and which were “useful” in that they modified function of one or more of the
other proteins, but whose absence was not critical for life. Thus I have made mouse or
muscle cell models both in skeletal muscle and in the heart, where I have removed the
protein of interest in one of three ways and looked at the result in muscle cells and in mice,
and where the protein was critical demonstrated that by putting it back into the cell you
could “rescue” the loss of function. The three methods are: 1. Natural mutation—We have
been fortunate for one of the proteins that there was a natural mutation that eliminated it.
The result was embryonic death, because it was one of the two proteins that are critical for
the systems function. 2. Knock-out using homologous recombination in embryonic stem
cells. We have done this for a 9 of the proteins in the system, three of which are critical for
life and the others “useful”. 3. Protein expression Knock-Down using Si-RNA in muscle
cells. This was done for two of the proteins, one that was part of a critical multiunit channel
in which two of the subunits had already been identified as critical for life, and in which the
knock-out had been birth lethal. Because it and the second protein were expressed in
muscle, heart and non-muscle tissues, and the cause for the embryonic lethality had not
been discovered, the latter method was used to determine the role of each protein only in
muscle.
These studies have allowed us to unravel many mysteries of how muscle works and how
Ca2+ is controlled in the muscle cell and provided us with a better understanding of the role
each protein takes in this complex process. It may seem as if we have done a lot, and we
have, but we have only scratched the surface and the remaining work is left to you and
your continued studies, to complete this understanding and use it to improve human
health.
(traduzione in italiano)
Titolo:
Accoppiamento Eccitazione-Contrazione: svelando la funzione una molecola alla
volta.
Il mio interesse per la medicina è partito fin da quando ero ragazzo e quando mi iscrissi
all’Università come membro della prima classe di studi intensivi in medicina (in un corso di sei
anni), l’università continuò a far scoccare la scintilla dell’interesse nella ricerca scientifica che
iniziò nella scuola secondaria e continuò per il resto della mia vita. Mentre le altre persone
passavano le loro giornate estive in spiaggia, io trascorrevo l’estate nei laboratori di chimica
organica e biochimica, sintetizzando nuove sostanze chimiche e scoprendo nuove vie delle
reazioni biochimiche. Quando alcuni dei miei colleghi andarono all’estero per studiare medicina e
si divertirono, io partii per sei mesi all’estero, presso l’Istituto Chester Beatty di Londra per portare
avanti un progetto di ricerca che mi teneva occupato in laboratorio dalla mattina presto fino a notte
tarda. Ma l’ho completato! Con non poca sorpresa delle persone che erano lì. Il sentiero della mia
carriera scientifica è stato tortuoso. Ho iniziato la mia formazione come chirurgo per alcuni anni
prima di prendere un congedo per studiare ed entrare nella Scuola di Dottorato in Fisiologia
Muscolare. Il mio cammino è andato avanti tra giri vari, prima occupandomi di anestesiologia,
passando alcuni anni come clinico a tempo pieno e solo per una parte come scienziato interessato
nell’insufficienza cardiaca e nell’ipertermia maligna, una patologia muscolare causata
dall’esposizione ad anestetici. Dato che si riteneva che alla base di questo problema ci fosse
qualche meccanismo legato al processo di accoppiamento eccitazione-contrazione, che trasforma
il segnale elettrico proveniente dal nervo in segnale chimico che porta alla contrazione muscolare,
mi interessai a fondo in questo meccanismo. In quel periodo scoprii che la ipertermia maligna era
legata a un problema nel metabolismo del calcio intracellulare e così scoppiò il desiderio di capire
la base molecolare che causa questa patologia. Il problema era come potessi fare questo, così
circa 20 anni fa ho deciso di “re-inventare” me stesso diventando un biologo molecolare. Per fare
ciò, regredii ad assegnista di ricerca e mi venne assegnato il compito di clonare e studiare la più
grande e una delle più importanti proteine del meccanismo di accoppiamento eccitazionecontrazione, vale a dire il canale di rilascio del calcio posto sul reticolo sarcoplasmatico, o, come lo
chiamiamo noi, il recettore della rianodina di tipo 1 o RyR1. Il resto, come si suol dire, è storia e in
parte il presente. Tutto è stato divertente! Ma a parte la storia di come sono arrivato fin qui, ora
vi parlerò degli esperimenti che sono descritti nel titolo della mia presentazione: Nella figura
(vedi Figura, sopra) potete vedere le unità di rilascio di calcio, che è il complesso proteico che
controlla il rilascio di calcio dai siti di accumulo intracellulare presenti nel muscolo scheletrico e in
quello cardiaco, che poi interagisce con le proteine che sviluppano forza. Il mio goal è stato quello
di determinare i ruoli individuali di ciascuna di queste proteine in tale processo indicando quali
fossero critiche, quali senza cui l’animale non poteva respirare o avere un battito cardiaco
corretto, e quali fossero “utili” nel senso che modificassero la funzione di una o più proteine, ma la
cui assenza non era cruciale per la sopravvivenza. Così ho creato un modello murino o di cellule
muscolari sia nel muscolo scheletrico che nel cuore, dove ho rimosso la proteina di interesse con
uno dei tre modi di seguito descritti e ho guardato i risultati nelle cellule muscolari e nei topi e fu
dimostrato dove la proteina fosse critica dal fatto che, rimettendola nella cellula, si riguadagnava
la funzione persa. I tre metodi sono: 1. Mutazione naturale- Siamo stati fortunati perchè per una
proteina c’era una mutazione naturale che la faceva eliminare. Il risultato era la morte embrionale,
perchè si trattava di una delle due proteine che sono importantissime per la funzione dei sistemi. 2Knock-out utilizzando la ricombinazione omologa nelle cellule staminali embrionali. Abbiamo fatto
questo per 9 delle proteine che compongono il sistema, e, di queste, 3 sono risultate critiche per la
vita e 3 “utili”. 3- Espressione proteica deregolata utilizzando l’ Si-RNA nelle cellule muscolari.
Questo è stato fatto per 2 proteine, una delle quali fa parte di un canale multimerico nel quale 2
subunità sono state già identificate come fondamentali per la vita, e per le quali il knock-out è stato
letale alla nascita. Poiché questa e la seconda proteina erano espres se nel muscolo, nel cuore e
in tessuti non-muscolari, e poiché la causa della letalità embrionale non è stata scoperta,
quest’ultimo metodo è stato usato per determinare il ruolo di ciascuna proteina solo nel muscolo.
Questi studi ci hanno permesso di svelare molti misteri su come il muscolo lavora e come il calcio
è controllato nella cellula muscolare e ci hanno consentito di capire meglio il ruolo di ciascuna
proteina in questo complesso processo. Può sembrare che abbiamo fatto molto, ed è così, ma
abbiamo solo graffiato la superficie e il lavoro che rimane da fare è lasciato a voi e ai vostri continui
studi, per completare a capire e mettere i risultati al servizio della salute umana per migliorarla.
Title:
The use of animal models to study human myopathies: our experience.
(Traduzione: La sperimentazione animale nello studio di miopatie umane: la nostra
esperienza)
Feliciano Protasi (Università degli Studi G. d’Annunzio di Chieti-Pescara)
Faccio ricerca da circa 18 anni. Laureato in Biologia a Perugia nel 1991 ho lasciato l'Italia
nel 1993, destinazione Stati Uniti. Lì ho lavorato per circa 10 anni: nel laboratorio di Clara
Franzini-Armstrong a Philadelphia prima (1993-1997) e nel laboratorio di Paul Allen poi
(1997-2002). Vi ricordano nulla questi nomi? In quegli anni mi sono occupato - guarda
caso - di muscolo e più specificamente di Accoppiamento Eccitazione-Contrazione (EC).
In quegli anni non usavo direttamente animali da laboratorio. La mia sperimentazione era
fatta soprattutto su cellule muscolari (miotubi) in coltura e grazie quelle tecniche pubblicai sotto la supervisione appunto di Clara e Paul - vari lavori scientifici che poi hanno segnato
positivamente la mia carriera scientifica futura.
Nel 2002 - dopo quasi 10 di Stati Uniti - sono tornato in Italia. Perchè? Non lo so neanche
io esattamente. Però credo cha il motivo principale sia stato il mio desiderio di iniziare la
mia esperienza indipendente e di mettere al servizio degli studenti italiani quello che avevo
imparato negli anni all'estero. Arrivato in Italia, ho iniziato a formare il mio gruppo di ricerca
grazie anche al supporto della mia Università e di Telethon che mi finanzia ormai da anni.
Diversi sono i progetti che stiamo portando avanti nel nostro laboratorio a Chieti, tutti
accomunati dal tema centrale "muscolo". Ci intessiamo di invecchiamento muscolare, ed
oggi ne sentiremo parlare da Antonio Musarò e Carlo Reggiani (vedi sotto). Ci siamo
occupati di denervazione causata da lezioni del midollo spinale, grazie alla collaborazione
con Helmut Kern, Ugo Carraro e Sandra Zampieri: anche di questo sentirete parlare fra un
pò (vedi sotto).
Ci occupiamo anche di miopatie causate da mutazioni genetiche in proteine implicate nel
meccanismo di Accoppiamento Eccitazione-Contrazione (EC), di cui vi hanno parlato sia
Clara che Paul (vedi sopra). In questi progetti - nei quali collaboriamo ancora con vari
gruppi di ricerca americani - usiamo per la sperimentazione modelli animali
(esclusivamente topi da laboratorio).
Sofisticate tecniche di biologia molecolare permettono oggi di riprodurre - appunto in
animali da laboratorio - patologie che colpiscono l'uomo: questo permette di studiare più a
fondo i meccanismi che sono alla base della malattia, e di sviluppare possibili terapie d a
poter un giorno applicare anche alla cura nell'uomo.
Oggi vi parlerò brevemente di uno studio che stiamo portando avanti con il support di
Telethon in un modello murino nel quale è stata deleta (eliminata) la proteina
Calsequestrina o CASQ (vedi Figura, sopra). Questo studio ci ha fatto scoprire che
l'assenza di questa proteina causa in questi animali morti improvvise in seguito a
somministrazione di anestetici o in presenza di alte temperature ambientali. Interessante il
fatto che queste patologie esistono anche nell'uomo e sono conosciute con il nome di
Ipertermia Maligna o Colpo da Calore, sindromi che colpiscono (rari) individui
geneticamente predisposti. Rimane da definire se anche nell'uomo mutazioni (o delezioni)
del gene CASQ sono responsabili per alcuni casi di morti improvvise causate da queste
patologie.
Title:
How to built a better muscle
(Traduzione: Come costruire un muscolo migliore)
Antonio Musarò (Università degli Studi La Sapienza - Roma)
Scriveva Oscar Wilde: “Il male non è che fuori si invecchia, è che molti non rimangono
giovani dentro”. Ovviamente, questa oltre ad essere un’interessante speculazione
filosofica, si presta molto bene alla genetica dell’invecchiamento. Capire dunque perché
invecchiamo e soprattutto perché i nostri muscoli perdono di efficienza con l’avanzare
dell’età rappresenta una delle domande ancora irrisolte della ricerca scientifica.
Infatti, benché negli anni recenti si sono accumulate considerevoli evidenze circa la
fisiopatologia della senescenza muscolare, molto poco si conosce riguardo i meccanismi
molecolari che regolano i cambiamenti fenotipici e che portano alla condizione patologica
dell’invecchiamento. Un problema, questo di importanza non solo scientifica, ma anche
sociale, sanitaria e politica. Uno dei problemi più ovvii è l’aumentata tendenza della
persona anziana a cadere, con conseguenti e spesso fatali fratture ossee. Questo è in
parte dovuto ad un sempre minor senso di bilanciamento, ma anche perché spesso
l’anziano non è in grado di generare una adeguata forza muscolare che impedisca di
cadere.
Come sono fatti quindi i nostri muscoli, come si adattano ai diversi stimoli esterni e cosa
succede nel corso dell’invecchiamento?
Ogni muscolo è fatto di fibre, le quali sono lunghi cilindri deriva nti dalla fusione di cellule
più piccole, i mioblasti. Esistono sostanzialmente due diversi tipi di fibre: le fibre lente e le
fibre veloci. Le prime, dette anche fibre toniche, sono importanti per la postura in quanto
stabilizzano ed equilibrano la posizione del corpo e sono meno suscettibili di
affaticamento. Le fibre veloci sono invece responsabili della potenza e forza muscolare,
mostrando però un grado di affaticamento più elevato rispetto alle fibre lente. L’insieme dei
due tipi di fibre è alla base della eterogeneità muscolare, che rappresenta una delle
caratteristiche peculiari del muscolo scheletrico. Tale eterogeneità conferisce infatti al
muscolo stesso un notevole grado di plasticità che gli permette di potersi adattare ad una
serie di influenze esterne, quali attività dei motoneuroni, attività fisica, cambiamenti nei
livelli ormonali, apporto di ossigeno e nutrienti, ecc.
Dunque, le proporzioni tra le due componenti sono variabili in funzione di diversi elementi:
tanto per intenderci, i muscoli di un maratoneta svilupperanno principalmente fibre lente,
più resistenti; mentre nei muscoli di uno sprinter prevarranno le fibre veloci. Di
conseguenza, il mantenimento della eterogeneità muscolare rappresenta un parametro
fondamentale per il normale funzionamento del muscolo scheletrico ed alterazioni nella
tipologia delle fibre possono essere associate a patologie muscolari, come quelle legate
all’invecchiamento o a miopatie ereditarie, come la distrofia muscolare.
E’ stato infatti dimostrato che l’invecchiamento comporta una progressiva perdita di massa
(nota con il nome di sarcopenia) e forza muscolare e che le fibre veloci sono i componenti
muscolari più compromessi.
Un ulteriore problema legato all’età è l’incapacità di un muscolo vecchio di sostenere un
efficiente processo di riparo quando ad esempio danneggiato da un trauma.
Che cosa perde quindi un muscolo quando invecchia?
E’ la domanda che il nostro gruppo di ricerca, dell’Università di Roma La Sapienza”, si è
posto e su cui sono concentrati parte dei nostri progetti di ricerca finanziati negli anni da
Telethon, MDA, AFM e comunità europea. E’ importante sapere che il muscolo
scheletrico non è fatto solo di fibre muscolari, ma anche da altri tipi di cellule, chiamate
cellule satelliti (vedi Figura, sotto).
Esse sono cellule mononucleate, normalmente quiescenti situate nello spessore della
membrana plasmatica delle fibre muscolari. In seguito ad un eventuale danno, che
comporti perdita di fibre muscolari, le cellule satelliti sono stimolate a replicarsi e formare
nuove fibre muscolari, che rimpiazzeranno le fibre degenerate, oppure fondersi con le fibre
danneggiate, riparandole. Le cellule satelliti sono quindi la componente staminale del
muscolo scheletrico. E’ stato dimostrato che la proliferazione e il differenziamento delle
cellule satelliti è regolata da numerosi fattori proteici come i fattori di crescita mIGF -1,
HGF, FGF ed è anche influenzata da ormoni quali l'ormone della crescita, il testosterone e
gli estrogeni.
Una delle problematiche più intriganti è dunque capire se l’invecchiamento comporta una
riduzione nel numero di cellule satelliti oppure una alterazione nella produzione di stimoli
che risveglino le satelliti dal loro stato di quiescenza. Tra l’altro, questa è una domanda
che ancora oggi non trova d’accordo i tanti gruppi di ricerca che si occupano di
invecchiamento muscolare. Utilizzando modelli animali, abbiamo recentemente dimostrato
che la diminuzione nella produzione e attività del fattore di crescita mIGF-1, il declino nella
capacità proliferativa delle cellule satelliti e dei segnali autocrini/paracrini a cui il muscolo
scheletrico è esposto sono potenziali fattori che contribuiscono al quadro patologico
dell’invecchiamento muscolare.
Un risultato questo che è stato confermato da studi condotti separatamente dal nostro
gruppo e dal gruppo del Dr. Rando dell’Università di Stanford. In particolare il Dr. Rando
ha dimostrato come il numero di cellule satelliti tra animale giovane e vecchio rimane
sostanzialmente invariato, mentre risulta alterato il segnale che media l’attivazione delle
cellule satelliti e conosciuto come segnale “Notch”.
Quindi l’ipotesi più plausibile è che il muscolo vecchio smette di produrre fattori e segnali
come mIGF-1 e Notch, i quali sono fondamenta li per garantire l’attivazione di un processo
di riparo. Questa ipotesi è stata avvalorata da una serie di evidenze sperimentali. Il gruppo
del Dr. Rando ha trattato il muscolo danneggiato di un topolino vecchio con siero ottenuto
da animale giovane ed il risultato è stato sorprendente: il muscolo vecchio era in grado di
rigenerare tanto bene quanto il giovane.
Nei nostri esperimenti, condotti in collaborazione con la Dott.ssa Rosenthal dell’EMBL,
abbiamo invece garantito l’espressione del fattore di crescita mIGF-1 anche nel corso
dell’invecchiamento. Abbiamo quindi generato dei topi geneticamente ingegnerizzati
(transgenici) per produrre il fattore di crescita mIGF1, esclusivamente nei muscoli
volontari. Aumentando i livelli di mIGF-1 nel muscolo degli animali transgenici abbiamo
notato che topi anziani, l'equivalente di un gruppo di uomini ottantenni, presentavano i
muscoli di un trentenne e l'aspetto di uno Schwarzenegger. I risultati hanno quindi
dimostrato che nei topi anziani è possibile attenuare l'indebolimento dei muscoli provocato
dall' età, tanto che topi di 22 mesi (un'età che corrisponde a 70-80 anni nell'uomo) hanno
recuperato il 27% di forza muscolare.
In una seconda fase sperimentale, abbiamo dimostrato anche come il fattore di crescita
mIGF-1 sia anche capace di contrastare il declino muscolare nel topo distrofico mdx e nel
modello animale di una patologia neurodegenerativa, come la Sclerosi Laterale
Amiotrofica, aumentando la massa e la forza muscolare ed attivando le cellule satelliti.
Il nostro obiettivo è quindi di partire dai risultati ottenuti dai modelli animali per focalizzare
la nostra attività sull’uomo.
Title:
Restoration of muscle structure and function by electrical stimulation in
paraplegic patients.
Helmut Kern (LBI-Wilheminenspital, University of Vienna - Austria)
& Sandra Zampieri (Università degli Studi di Padova)
The trophism and contractile properties of the skeletal muscle are strictly dependent on the
activity of the nervous system which innervates muscle fibers (see Figure 1). The
disruption of innervation causes a permanent lack of the contact between the nervous
system and the muscle, with a consequent paralysis, reduction of the mass and
disorganization of the structure of those muscles initially innervated by the injuried nerves.
Paraplegia is the paralysis of the muscles of both legs, with a possible involvement of the
trunk, as a consequence of lesions which occur at the spinal cord level. These lesions are
mainly of traumatic origin, as a consequence of road or working accidents, and
predominantly concern young male subjects. Nowadays, it is estimated a incidence of 30
new paraplegic subjects per year and per million of habitants, thus making necessary
rehabilitation therapies for the treatment of these spinal cord injuries as well as of their
consequences. Up to now, these therapies are performed in highly specialized
rehabilitation centres, in order to yield an adequate quality of life also to young patients.
The “EU-RISE” project, financed by the E uropean Community and realized by several
participating partners (Austria, United Kingdom, Italy, Slovenia, Germany and Island),
aimed to develop a new rehabilitation strategy by the use of Functional Electrical
Stimulation (FES) of the denervated muscle in paraplegic patients, affected with a
permanent lesions of the spinal cord, without any possible recovery of the nervous system.
During FES, electric currents are delivered to the
denervated muscle by electrodes directly applied to
the skin inducing muscle contraction, thus mimicking
the action of the nerve which is not in contact with
the muscle anymore, as a consequence of the
injury.
The FES training has demonstrated to be an
effective treatment for the restoration of the leg
muscles in terms of structural reorganization of the
muscle fibers, rescue of the muscle mass to a
similar extent of an healthy sedentary adult, and
partial recovery of the muscle function (tetanic
contractions with weight lifting during electrical
stimulation). Moreover, those patients who most
benefit from the treatment, were able to achieve and
maintain the standing position using parallel bars,
during the electrical stimulation (see Figure 2).
Figure 1. Anatomy of central and peripheral Nervous
System.
One of the aim of this project, in collaboration with engineers from the University of
Vienna, was also to develop a custom-designed electrical stimulator and to provide the
European biomedical industries with a new generation of devices specifically created for
the home-based therapy and with a variety of clinical applications.
Based on the results and on the knowledge achieved with the RISE experience, a new
European Project “Mobility in aging”, in collaboration with the University of Vienna, was
next financed with the aim to rehabilitate muscle tone and function in elderly subjects by
the development of electrical stimulators and specific training programs.
Figure
2. Paraplegic
patients
standing during Functional Electrical
Stimulation treatment: A) patient
suffering of spastic paraplegia; B)
patient
suffering
of
flaccid
paraplegia.
(traduzione in italiano)
Titolo:
Recupero della struttura e della contrattilità muscolare in pazienti paraplegici
attraverso la stimolazione elettrica funzionale.
La contrattilità ed il trofismo del muscolo scheletrico dipendono strettamente dal sistema nervoso
che innerva le fibre muscolari (vedi Figura 1, sopra). L’interruzione dell’innervazione, dovuta a
cause di diversa natura, provoca una permanente perdita di contatto tra il sistema nervoso ed il
muscolo con conseguente paralisi, diminuzione della massa muscolare e disorganizzazione della
struttura delle fibre scheletriche dei muscoli originariamente innervati dai fasci di fibre nervose che
hanno subito il danno.
Per paraplegia si intende la paralisi dei muscoli di entrambe le gambe, con possibile
coinvolgimento anche del tronco, come conseguenza di lesioni che avvengono a livello del midollo
spinale. L’origine di tali lesioni è prevalentemente di natura traumatica, avendo come causa
principale incidenti stradali o lavorativi, e coinvolge una popolazione per la maggior parte
rappresentata da soggetti maschi di giovane età.
Si calcolano circa 30 nuovi casi di soggetti paraplegici per anno e per milione di abitanti, e a fronte
di tali dati sono molto importanti le terapie riabilitative per il trattamento di queste lesioni e delle
loro conseguenze, oggi prevalentemente effettuate in centri altamente specializzati, volte a
garantire una qualità di vita accettabile anche da parte di persone di giovane età.
Il progetto RISE (ALZATI!), finanziato nell’ambito del 5° programma Quadro dall’Unione Europea e
realizzato attraverso la collaborazione di numerosi partners (Austria, Regno Unito, Italia, Slovenia,
Germania ed Islanda), è nato allo scopo di sviluppare una nuova strategia riabilitativa attraverso la
Stimolazione Elettrica Funzionale (FES) del muscolo scheletrico denervato, in soggetti paraplegici,
affetti da lesioni spinali permanenti, senza nessuna possibilità di recupero del sistema nervoso.
La stimolazione elettrica prevede il rilascio di scariche elettriche al muscolo denervato, attraverso
l’utilizzo di elettrodi applicati direttamente sulla superficie cutanea. La corrente elettrica scaricata al
muscolo attraverso la cute, lo induce a contrarsi. In questo modo viene mimata quindi l’azione
originariamente svolta dalle fibre nervose non più connesse al muscolo in conseguenza del danno
subito.
Il protocollo di allenamento muscolare con FES, si è dimostrato in grado di far recuperare ai
muscoli della coscia di questi pazienti non solo la fisiologica organizzazione strutturale delle fibre
muscolari, ma anche una massa muscolare vicina ai valori di adulti sani sedentari, con un parziale
recupero anche della funzione muscolare (contrazioni tetaniche con sollevamento pesi durante la
stimolazione elettrica). Inoltre, i soggetti che hanno dimostrato i migliori benefici, sono stati in
grado di raggiungere attivamente la stazione eretta (Alzarsi, in inglese: RISE) e di mantenere la
stazione eretta (in inglese: standing) durante la stimolazione elettrica (vedi Figura 2, sopra).
Uno degli scopi di questo progetto è stato anche quello di sviluppare, grazie all’intervento di
un’equipe di ingegneri dell’Università di Vienna, un elettrostimolatore con le necessarie
caratteristiche per questa particolare classe di pazienti, e di fornire l’industria biomedica europea di
una nuova famiglia di prodotti per eseguire la stimolazione elettrica a domicilio, con un ampio
ventaglio di applicazioni cliniche.
Proprio in questo ambito, si è successivamente sviluppato, sempre in collaborazione con
l’Università di Vienna, il progetto europeo “Mobility in aging”, tutt’ora in corso di svolgimento, con
l’obiettivo di riabilitare il tono e la funzione muscolare nell’anziano mediante l’utilizzo di
elettrostimolatori e programmi di allenamento mirati, sviluppati grazie alle conoscenze e
competenze acquisite durante il progetto RISE.
Figura 1. Anatomia del sistema nervoso centrale e periferico.
Figura 2. Soggetti paraplegici in stazione eretta durante la stimolazione elettrica funzionale (FES):
A) paziente affetto da paraplegia spastica, B) paziente affetto da paraplegia flaccida.
Title:
Skeletal muscle impairment during aging and possible
countermeasures.
(Traduzione: Indebolimento del muscolo scheletrico con l’invecchiamento e possibili
contromisure)
Carlo Reggiani (Università degli Studi di Padova)
Il secolo scorso è stato segnato da alcuni importanti fenomeni che hanno modificato sotto
il punto di vista biologico la nostra società: fra questi:
a) Il prolungamento della durata della vita che, associato alla caduta della natalità, ha
causato l’invecchiamento della popolazione: oggi in Italia il 20% della popolazione ha oltre
65 anni;
b) una disponibilità alimentare praticamente illimitata;
c) la riduzione della attività fisica sia nel lavoro per la cresciuta disponibilità di macchine e
strumenti sia negli spostamenti per la diffusione su scala di massa di mezzi di trasporto a
motore.
Il prolungamento della durata della vita ha consentito a moltissime persone di arrivare in
età avanzata, superando gli ottanta anni ma ha posto il problema di garantire la qualità
della vita. Insieme con molti altri fattori la possibilità di muoversi autonomamente in casa
come fuori è essenziale per la buona qualità della vita. Questa possibilità dipende dalla
funzione muscolare.
Negli anziani, la potenza richiesta dal movimento può diventare limitante. Per fare un
esempio: se la potenza richiesta per una semplice azione quale alzarsi da una sedia
(contrazione degli estensori della gamba sulla coscia con contemporanea fissazione da
parte degli estensori del piede sulla gamba) è molto inferiore alla capacità di generare
potenza muscolare di un giovane o di un adulto, in un anziano può diventare il fattore che
lo obbliga alla immobilità su una sedia a rotelle.
Le ragioni della perdita di potenza muscolare con l’avanzare dell’età sono oggetto di
intensa attività di ricerca che ha portato a riconosce due componenti: una riduzione di
forza e una riduzione di velocità. La riduzione di velocità è legata al cambiamento della
tipologia delle fibre muscolare, mentre la riduzione della forza è determinata dalla perdita
di fibre muscolari e dalla progressiva atrofia. Tra queste tre componenti, praticamente
nessun intervento è oggi possibile per frenare la trasformazione delle fibre e la loro
progressiva scomparsa: infatti la causa sta nella morte progressiva dei motoneuroni
spinali. Invece la atrofia delle fibre residue può essere frenata dal mantenimento di un
livello adeguato di attività fisica. Un approccio sperimentale basato su protocolli di
allenamento su volontari e in modelli animali permette di confrontare l’efficacia della
allenamento di resistenza con l’efficacia dell’allenamento di potenza, di analizzare il ruolo
svolto dalla dieta adeguata e di valutare l’efficacia di possibili interventi farmacologici e di
integrazione alimentare. Un ulteriore tematica di grande interesse è quella del recupero di
una piena funzionalità muscolare dopo un periodo di forzata inattività quale quella causata
da un trauma o da una malattia infettiva. Mentre è ben noto che le possibilità di recupero
sono molto inferiori in un anziano rispetto a un giovane o a un adulto, i meccanismi che
sono responsabili di questa differenza sono ancora oggetto di intensi studi sperimentali.
Con riferimento a queste tematiche, l’Unione Europea individua “Active aging and
independent living” fra gli obiettivi proposti alla ricerca con il frame work o progetto quadro
“Horizon 2020“ che dovrà dare le linee guida alla ricerca nel periodo 2014-2020.