S.I.E.C - CORSO DI FORMAZIONE IN ECOCARDIGRAFIA PEDIATRICA
Lezione 8
CARDIOMIOPATIE
Secondo la scuola americana (AHA 2006): “ le cardiomiopatie rappresentano un gruppo eterogeneo di
patologie del miocardio associate a disfunzione meccanica e/o elettrica, dovute ad un’ampia varietà di cause
(frequentemente genetiche) che solitamente si associano ad un’inappropriata ipertrofia o dilatazione
ventricolare. Le cardiomiopatie possono interessare esclusivamente il cuore o essere parte di un disordine
sistemico che spesso può portare a morte cardiaca o scompenso cardiaco progressivo”.
Esse sono dunque distinte in due gruppi in relazione al coinvolgimento d’organo:
•
Primitive: sono quelle che coinvolgono esclusivamente o prevalentemente il muscolo cardiaco.
•
Secondarie: sono quelle che mostrano un coinvolgimento miocardico nell’ambito di un disordine
sistemico (multiorgano).
CARDIOMIOPATIA IPERTROFICA
La cardiomiopatia ipertrofica è una malattia caratterizzata da una inappropriata ipertrofia del miocardio in
assenza di una causa evidente di ipertrofia. Nel 2/3 dei casi l’ipertrofia interessa esclusivamente il ventricolo
sinistro (VSx) , in 1/3 dei casi l’ipertrofia è bi ventricolare.
Nel 50% dei casi si tratta di una malattia familiare a trasmissione autosomica dominante con vario grado di
penetranza. Attualmente sono noti almeno 20 geni, codificanti proteine sarcomeriche (che sono le unità
contrattili del miocardiocita), la cui mutazione circa 450 note, per lo più missense, determina CMI.
ANATOMIA PATOLOGICA
ESAME MACROSCOPICO:
•
•
•
•
•
Aumento massa miocardica con cavità ventricolari di ridotto volume;
Atri dilatati e spesso ipertrofici in relazione alla elevata resistenza al riempimento ventricolare
causata dalla disfunzione diastolica ed all’insufficienza valvolare;
La qualità ed il grado di ipertrofia mostrano grandi variazioni individuali, nella maggior parte dei casi
si parla di ipertrofia asimmetrica del setto (ipertrofia limitata alla porzione anteriore del setto
interventricolare), ma qualsiasi localizzazione dell’ipertrofia è possibile (setto anteriore, posteriore,
parete antelo-laterale, parete inferiore, apice cardiaco);
Allungamento dei lembi valvolari mitralici;
Inserzione anomala dei muscoli papillari direttamente sul lembo anteriore della mitrale.
Una particolare menzione merita la CMI apicale detta anche variante Giapponese caratterizzata da aspetto a
vanga o piede di ballerina all’angiografia, onde T giganti negative nelle precordiali e decorso generalmente
benigno.
ISTOLOGIA
•
•
•
•
Disorganizzazione delle fibre muscolari che mostrano un aspetto spiraliforme e convoluto;
Alterazione del rapporto spaziale delle miocellule contigue (disarray) sia nei segmenti ipertrofici che
in quelli di normale spessore;
Sovvertimento architettura miofibrillare nell’ambito delle singole cellule;
Fibrosi;
Alterazione delle arterie coronariche intramurali (per riduzione lume, ispessimento parete vaso
soprattutto nelle regioni di fibrosi).
ECOCARDIOGRAMMA
La diagnosi di questa malattia è fondamentalmente ecocardiografica.
M-Mode
Utile per documentare l’ipertrofia asimmetrica del setto, il movimento sistolico anteriore della mitrale e la
chiusura mesosistolica della valvola aortica nelle forme ostruttive. Tuttavia i dati M-Mode non sono specifici
per CMI. Infatti un’ipertrofia asimmetrica del SIV è riscontrabile anche nell’ipertrofia ventricolare destra,
nell’ipertensione arteriosa e nell’infarto del miocardio inferiore in soggetti con precedente ipertrofia
ventricolare. Il movimento sistolico anteriore della mitrale si può osservare anche in altre condizioni
iperdinamiche cardiache.
Bidimensionale
E’ il metodo di elezione per formulare la diagnosi di CMI; consente di localizzare la sede e quanticare il
grado di ipertrofia. La proiezione più adeguata allo scopo è la parasternale asse corto sui ventricoli a livello
dei muscoli papillari che consente la visualizzazione del setto anteriore, del setto posteriore, della parete
antero laterale e della parete inferiore. Si pone diagnosi di CMI quando lo spessore parietale massimo è ≥
15mm se non vi è familiarità per CMI oppure se lo spessore parietale massimo è ≥ 13mm se c’è familiarità
per CMI. In età pediatrica lo spessore parietale massimo va normalizzato per la superficie corporea e si
diagnosticherà CMI qualora lo spessore osservato e normalizzato per il BSA supererà di 2 deviazioni
standard il valore atteso.
In proiezione parasternale asse lungo e parasternale asse corto sui ventricoli si può valutare la
configurazione della valvola mitrale che spesso è alterata nella sua geometria per allungamento dei lembi
mitralici e per inserzione anomala dei muscoli papillari (generalmente ipertrofici) direttamente sul LAM.
Il ventricolo sinistro ha diametro conservato o talora ridotto (unica eccezione sono le forme end stage in cui il
VSx può evolvere verso la dilatazione e la regressione dell’ipertrofia).
Inoltre in bidimensionale è possibile calcolare la volumetria atriale che solitamente è aumentata (più spesso
solo quella dell’atrio sinistro per la disfunzione diastolica, meno frequentemente di entrambi gli atri per un
maggiore grado di disfunzione diastolica con il configurarsi di un pattern di tipo restrittivo).
Doppler (ad onda pulsata e continua) e color Doppler
OSTRUZIONE ALL’LVOT= Con il Doppler ad onda continua dalla proiezione apicale 5 camere è possibile
valutare, qualora presente, un’ostruzione all’efflusso ventricolare sinistro (LVOTO). Quando presente,
l’ostruzione di appalesa con un’immagine detta a lama di pugnale con apice tardivo, e dalla velocità di picco,
utilizzando l’equazione di Bernoulli si calcola il gradiente di pressione nel tratto di efflusso del VSx. Inoltre si
potrà provvedere a documentare la natura dinamica di questa ostruzione invitanto il paziente ad effettuare la
manovra di Valsalva oppure invitandolo ad inalare nitrito di amile. Con il Doppler ad onda pulsata inoltre si
può localizzare il punto di massima ostruzione, soprattutto nelle CMI medio ventricolari o apicali.
INSUFFICIENZA MITRALICA= Con il color Doppler inoltre è possibile valutare il grado di insufficienza
mitralica che appare come un jet in allontanamento dall’apice ed ad elevata velocità.
FUNZIONE DIASTOLICA= l’alterazione diastolica dominante consiste nel prolungato rilasciamento del
miocardio fortemente ipertrofico. La caduta di pressione intraventricolare durante il rilasciamento
isovolumetrico è lenta e di conseguenza: il tempo di rilasciamento isovolumetrico è prolungato, la fase di
riempimento ventricolare rapido (E) è ritardata, il tempo di decelerazione è prolungato. Tuttavia quando il
grado di disfunzione diastolica aumenta, possono configurarsi aspetti di pattern flussi metrico trans mitralico
di tipo pseudo normale o restrittivo (espressione di incremento delle pressioni anche in atrio sinistro e nel
circolo post-capillare polmonare).
Tissue Doppler
Con il doppler tissutale infine è possibile valutare correttamente le pressioni di riempimento ventricolare
sinistro. Se il rapporto E/E’ (ottenuto rispettivamente con il Doppler pulsato ed il Doppler tissutale a livello
del SIV e della parete laterale) è superiore a 14, indica una ridotta compliance ventricolare sinistra, elevate
pressioni di riempimento ventricolare sinistro ed elevate pressioni capillari polmonari (wedge >15mmHg).
Per quanto riguarda la funzione di pompa cardiaca, solitamente nella CMI la frazione di eiezione è
conservata, nelle forme ostruttive è ipercinetica, mentre nelle forme ad evoluzione versus end-stage per
definizione la FE è < 50%, in tali casi il diametro del VSx può incrementare e lo spessore parietale ridursi
(divenendo in tal caso indistinguibile da una cardiomiopatia dilatativa) oppure il diametro e lo spessore del
VSX restano inalterati e si riduce solo la FE.
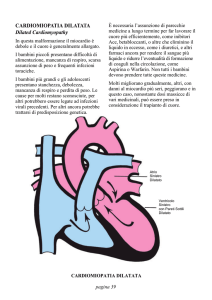
LA CARDIOMIOPATIA DILATATIVA
DEFINIZIONE
La cardiomiopatia dilatativa è una malattia del muscolo cardiaco caratterizzata da dilatazione di una o
entrambe le cavita’ ventricolari e da una ridotta funzione sistolica.
La prevalenza stimata della CMD nei paesi occidentali è di circa 1:2500.
EZIOLOGIA
Più della metà dei pazienti con quadro clinico di CMD non presenta un’eziologia identificabile evidente.
Sebbene la causa, o le cause, siano tuttora incerte, l’interesse si è concentrato su tre possibili meccanismi
fondamentali di danno: fattori ereditari e genetici, miocardite virale ed altri insulti citotossici e alterazioni
immunologiche.
L’impatto della genetica nella patogenesi della patologia si intuisce dal 20-35% dei casi di CMD etichettati
come familiari, anche se a penetranza incompleta ed età-dipendente, e collegati a un gruppo eterogeneo di
circa 20 loci e geni. La CMD è causata anche da una serie di mutazioni in altri geni che codificano per il
citoscheletro / sarcolemma, per l’ involucro nucleare, per il sarcomero e per coattivatori trascrizionali. Il più
comune di questi è probabilmente il gene che codifica per la lamina A /C , anche associata al malattie del
sistema di conduzione, che codifica per una proteina dei filamenti intermedi dell’ involucro nucleare.
Mutazioni in questo gene causano anche la distrofia muscolare di Emery-Dreifuss.
ANATOMIA PATOLOGICA
II quadro macroscopico è quello, nei casi avanzati, di una cospicua dilatazione ventricolare e atriale
interessante entrambe le sezioni del cuore ma in maggior misura il ventricolo sinistro. Vi può essere un certo
grado di ipertrofia mascherato dalla dilatazione. Nelle cavità vi possono essere dei trombi. Le valvole sono
normali con anulus spesso dilatato, coronarie di solito normali.
ISTOLOGIA
Il quadro istologico è per lo più aspecifico e l'aspetto più importante è rappresentato dalla fibrosi interstiziale
e periva scolare e che in talune sedi può corrispondere ad aree cicatriziali macroscopicamente visibili, nel
cui contesto sono sparsi isolotti di tessuto miocardico con miociti alterati, ipo-atrofici, miofibrille attenuate e
frammentate, mitocondri piccoli, degenerazione vacuolare. A volte è presente una infiltrazione pericellulare.
Con tecniche specifiche sono stati dimostrati reperti apoptotici. Le alterazioni sono diffuse nelle forme più
gravi e avanzate ma possono presentarsi anche a focolaio. La biopsia endomiocardica può essere utile sia
per mettere in_evidenza alterazioni precoci in casi sospetti sia per escludere patologie specifiche, il cui
riconoscimento, comunque, si verifica in meno del 10% dei casi. Il materiale bioptico può essere anche
utilizzato per l'impiego di tecniche particolari di genetica, istochimica e biologia molecolare ai finidella
diagnosi eziologica. Aspetti particolari possono essere rilevati, specie alla microscopia elettronica, in casi di
origine genetica (come da distrofinopatia).
Ecocardiogramma standard e nuove tecnologie: L'ecocardiogramma costituisce l'esame diagnostico non
invasivo più utile nella valutazione della funzione ventricolare sinistra . Fornisce in monodimensionale ed in
bidimensionale una valutazione oggettiva della struttura (diametri e volumi ventricolari, strutture valvolari,
spessori parietali) e della funzione cardiaca (sistolica e diatolica ). Caratteristicamente, nel paziente
scompensato con una disfunzione sistolica del ventricolo sinistro si osservano dilatazione del ventricolo
sinistro associata ad una alterazione della contrattilità. Nei casi eziologicamente riconducibili ad una
cardiomiopatia dilatativa è comune il riscontro di una diffusa ipocinesia ventricolare con una riduzione
globale della contrattilità sistolica. Attraverso una valutazione ecocardiografica grazie al calcolo del valore di
frazione d'eiezione del ventricolo sinistro si ottenere una valutazione quantitativa della entità della
disfunzione cardiaca. Tale parametro indica il volume di eiezione e si calcola semplicemente come la
differenza fra il volume telediastolico e il volume telesistolico/ volume telediastolico ed esprime
sinteticamente la percentuale del volume tele diastolico del ventricolo sinistro che viene espulsa durante la
fase sistolica. L’attenta analisi della cinesi segmentaria permette di escludere dissinergie riconducibili a
deficit perfusivi. In aggiunta alla volumetria volumetria cardiaca e alla funzione ventricolare, nei pazienti
affetti da scompenso cardiaco da disfunzione sistolica, l'ecocardiogramma mostra frequentemente la
presenza di un’insufficienza mitralica conseguente alla dilatazione del ventricolo e dell’anulus mitralico e di
insufficienza tricuspidalica che risulta più adeguatamente apprezzabile mediante lo studio dei flussi
transvalvolari con la funzione "color doppler". La stessa metodica permette, inoltre, attraverso la valutazione
adeguata del flusso transmitralico di studiare alterazioni eventuali della funzione diastolica del ventrìcolo
sinistro e_le alterazioni della fase di riempimento. Ricordiamo che la disfunzione diastolica si classifica in
quattro stadi: dall’anomalo rilasciamento, allo stadio pseudonormale e poi allo stadio restrittivo prima
reversibile e poi irreversibile. Si possono inoltre valutare , mediante calcoli indiretti, stroke volume e cardiac
output e rilevare eventuale aspetto a binario, presenza di trombi e versamento pericardico. Fondamentale è
anche lo studio della morfologia e funzione del ventricolo destro così come valutazione della dissincronia
interventricolare (valutata sui tempi di apertura della valvola aortica e polmonare e sull’inizio dei flussi
attraverso le stessoe valutate con Doppler continuo), pressioni polmonari e segni di eventuale TEP. Le
nuove tecnologie offrono importanti informazioni aggiuntive: con il Doppler tissutale è possibile calcolare
con formula derivata le pressioni di riempimento in ventricolo sinistro (rapporto E/E’) e si può quantificare la
dissincronia tra le pareti del ventricolo sinistro e tra queste e la parete libera del ventricolo destro.
L’ecocardiografia permette di studiare in modo più affidabile i volumi dei ventricoli, gli indici di funzione
sistolica globale e la dissincronia del ventricolo sinistro.
LA CARDIOMIOPATIA RESTRITTIVA
DEFINIZIONE
La cardiomiopatia restrittiva è una malattia del miocardio caratterizzata da una alterazione del riempimento
cardiaco, da un ridotto volume telediastolico di uno o di entrambi i ventricoli, da una funzione sistolica
normale o pressappoco normale. Il disturbo emodinamico fondamentale è costituito da una alterazione della
distensibilità e, quindi, del riempimento ventricolare con aumento notevole della pressione tele diastolica,
dilatazione atriale a volte cospicua,congestione retrograda a monte per lo più di entrambi i ventricoli. Si tratta
quindi di un quadro di insufficienza cardiaca diastolica molto più conclamato di quello della CM ipertrofica in
quanto domina la sintomatologia fin dagli inizi con un quadro talora indistinguibile dalla pericardite costrittiva.
Il sistema classificativo della AHA del 2006 riconosce forme primitive di CMR ad eziopatogenesi mista, cioè
sia genetica che acquisita, e forme secondarie a malattie sistemiche.
Accanto alle forme secondarie a patologie infiltrative e da accumulo note (amiloidosi, glicogenosi,
mucopolisaccaridosi, emocromatosi, sarcoidosi), e non infiltrative note (sclerodermia), che interessano tutto
il miocardio, vi sono, infatti, forme di eziologia sconosciuta piuttosto rare in occidente, frequenti invece in
alcuni paesi tropicali, inquadrate come CMR idiopatiche. La CMR idiopatica risulta associata a una
mutazione della gene della troponina I.
ANATOMIA PATOLOGICA
II quadro è quello di un cuore di dimensioni pressoché normali,con pareti non ipertrofiche ma ispessite per
fibrosi particolarmente localizzata in sede subendocardica. Le aree dei due ventricoli maggiormente colpite
sono la camera di afflusso e l'apice dove l’endocardio appare ispessito. Il coinvolgimento dei muscoli
papillari e delle corde tendinee provoca stiramenti dei lembi valvolari e conseguenti alterazioni della loro
motilità. Nell’interno delle cavità si ritrovano spesso deposizioni trombotiche organizzate, a volte calcifiche
che riducono notevolmente il lume e contribuiscono alle alterazioni della distensibilità ventricolare (forme
restrittivo/obliterative). In contrasto con le cavità ventricolari risultano quelle atriali che appaiono appaiono
più o meno notevolmente dilatate superando talora il volume dei ventricoli. All’esame microscopico le fibre
immerse nella ganga fibrotica interstiziale non sono ipertrofiche, alcune presentano disarray e alterazioni
degenerative.
L’ ecocardiografia con le sue varie tecniche può consentire un ottimo studio sia morfologico che funzionale.
Caratteristico è l’ ingrandimento delle cavità atriali rispetto a quelle ventricolari normali ma specialmente il
pattern da anomalo rilasciamento per l’alterata distensibilità ventricolare, la quale comporta un aumento
della pressione tetediasiolica compensato dall'aumento della forza di contrazione atriale.
CARDIOMIOPATIA/DISPLASIA ARITMOGENA DEL VENTRICOLO DESTRO
Introduzione
La Cardiomiopatia/Displasia Aritmogena del Ventricolo Destro (ARVC/D) è una malattia primitiva del
muscolo cardiaco che interessa in maniera prevalente, ma non esclusiva, il miocardio ventricolare destro,
con sua sostituzione da parte di tessuto fibroso e/o fibro-adiposo, determinando in tal modo sia alterazioni
strutturali e funzionali cardiache sia uno stato di instabilità elettrica con aritmie ipercinetiche ventricolari
anche maggiori ed a rischio di morte improvvisa.
La prevalenza della malattia varia da 1/1000 fino a 1/5000 soggetti nella popolazione generale. Tuttavia
attualmente non è possibile valutare la reale incidenza della malattia, poiché non esistono criteri diagnostici
che siano sufficientemente sensibili e specifici per identificare anche le forme minori, meno tipiche ma
probabilmente molto più frequenti, che restano spesso non diagnosticate in vivo.
L’ARVC/D è una malattia ereditaria geneticamente determinata, nella maggior parte dei casi autosomica
dominante a penetranza incompleta e quindi a differente espressione fenotipica, e più raramente autosomica
recessiva.
Anatomia
Macroscopicamente la peculiarità della malattia è la atrofia miocardica progressiva diffusa o segmentaria a
livello ventricolare destro, con sostituzione adiposa e/o fibroadiposa. La perdita del miocardio è spesso
responsabile dell’aspetto papiraceo alla trans-illuminazione della parete. All’esame esterno, il versante
destro del cuore mostra tipicamente un colorito giallastro o biancastro, tale da suggerire la sostituzione
adiposa o fibro-adiposa del miocardio sottostante. Il processo patologico è a partenza dall’epicardio,
procedendo verso l’endocardio e non sempre coinvolge tutto lo spessore miocardico. Le lesioni sono più
frequenti in corrispondenza di tre regioni del ventricolo destro: apice, area postero-basale sottotricuspidale
(camera di afflusso) ed area infundibulo-polmonare. Queste tre zone costituiscono il cosiddetto “triangolo di
displasia”.
La diagnosi di ARVC/D non sempre è semplice e non deriva da una singola indagine, ma rimane ancora
oggi un “puzzle” che raccoglie dati ed informazioni che provengono da valutazioni clinico-anamnestiche,
tecniche di imaging ed indagini elettrocardiografiche. La diagnosi si basa sul riconoscimento dei criteri
diagnostici definiti dalla Task Force del Working Group on Myocardial and Pericardial Disease della Società
Europea di Cardiologia che ha formulato nel 1994 dei criteri che tengono conto di fattori strutturali, funzionali,
istologici, elettrocardiografici, aritmici e genetici. Sulla base di questa classificazione, la diagnosi viene
formulata quando sono presenti due criteri maggiori o uno maggiore + due minori o quattro minori di gruppi
diversi.
Recentemente, nell’Aprile 2010, in virtù delle nuove acquisizioni ottenute nella genetica molecolare,
nell’istologia, nell’elettrocardiografia, nelle tecniche di imaging nella risonanza magnetica, i criteri diagnostici
sono stati rivisti e modificati per migliorare la sensibilità e specificità diagnostica degli stessi soprattutto
nell’iter diagnostico dei soggetti paucisintomatici o asintomatici, nelle forme occulte e nello screening
familiare, utilizzando anche parametri quantitativi, da confrontare con i soggetti normali.
L’ecocardiografia è in grado di rilevare le alterazioni tipiche dell’ARVC/D, in particolare nelle forme
conclamate della malattia, caratterizzate da marcata dilatazione e ipocinesia ventricolare destra, discinesia
apicale e sacculazioni. Maggiori problemi possono invece essere riscontrati nelle forme meno conclamate o
forme minori. Questi casi richiedono un accurato esame ecocardiografico mediante proiezioni multiple. Segni
indicativi della patologia possono essere: discinesia della regione sottotricuspidale, assottigliamento
parietale, disorganizzazione delle trabecole con loro disposizione trasversale separate da profonde
fissurazioni, ispessimento ed iperecogenicità della banda moderatrice, dilatazione isolata e discinesie isolate
dell’infundibulo o dell’apice. L’ecocardiogramma si è progressivamente dimostrato un’indagine non invasiva
facile e sicura nella valutazione dei pazienti con sospetta malattia e nello screening dei familiari. I limiti
principali dell’ecocardiografia comprendono il fatto che non è sempre possibile ottenere proiezioni adeguate
e non vi sono criteri oggettivi e condivisi per una valutazione precisa delle dimensioni e della funzione del
ventricolo destro.
MIOCARDIO NON-COMPATTO
Definizione
Il miocardio non compatto è una malattia del muscolo caratterizzata da trabecole multiple e prominenti a
livello di uno o di entrambi i ventricoli. La forma isolata della non compattazione del miocardio ventricolare o
isolated ventricular noncompaction (IVNC), che deve essere tenuta distinta dalla non compattazione
miocardica associata ad altre cardiopatie congenite (la persistenza dei sinusoidi, una forma diversa sia dal
punto di vista patogenetico che anatomo-patologico), è una rara cardiomiopatia cui è generalmente
associata una prognosi severa. La classificazione delle cardiomiopatie dell’AHA del 2006 la riconoscono
come entità nosologica distinta collocandola tra le forme primitive ad eziopatogenesi genetica. Il sistema
classificativo proposto dall’ESC nel 2008, che predilige l’aspetto morfologico-funzionale, la colloca, invece
ancora tra le forme non classificate di origine genetica/familiare.
Eziopatogenesi
Il meccanismo patogenetico della IVNC è legato, verosimilmente, all’arresto della normale embriogenesi
dell’endocardio e del miocardio. Durante le fasi precoci di sviluppo dell’embrione, il miocardio si presenta
come una rete di fibre muscolari con aspetto spongioso, con presenza di trabecolature e recessi, e sinusoidi
che lo attraversano e mettono in comunicazione il circolo coronarico epicardico con la cavità ventricolare.
Questo tipo di circolazione, detta lacunare, è simile a quella riscontrabile in alcuni esseri viventi, collocati in
gradini più bassi della scala zoologica, che non hanno una circolazione polmonare matura, quali ad esempio
alcuni anfibi adulti. La graduale compattazione di questa rete spongiosa si completa fra la quinta e l’ottava
settimana di vita fetale, quando l’embrione ha una lunghezza di circa 8 mm, seguendo una progressione ben
precisa, dall’epicardio verso l’endocardio e dalla base all’apice. La circolazione coronarica si sviluppa
contestualmente e i recessi intertrabecolari si trasformano in capillari. Sono state descritte anche delle forme
di non compattazione del ventricolo destro, associate o meno alle forme sinistre. Dal 18 al 62% si tratta di
forme familiari e la genetica riveste un ruolo primario nella determinazione della cardiomiopatia. La IVNC
presenta un background genetico eterogeneo. E’ stata evidenziata una mutazione del gene G4.5, localizzato
sul cromosoma X nella regione q28, come responsabile della IVNC. Questa localizzazione è in prossimità di
altri geni responsabili di miopatie con interessamento cardiaco, quali la distrofia muscolare di EmeryDreifuss, la miopatia miotubulare, la sindrome di Barth (caratterizzata da cardiomiopatia dilatativa, bassa
statura, miopatie scheletriche, neutropeniae mitocondri abnormi), la fibroelastosi endocardica X-linked e una
forma severa di cardiomiopatia X linked. Inoltre, mutazioni sono state evidenziate nella Cypher/ZASP, una
proteina citoplasmatica presente a livello della banda Z del muscolo scheletrico e cardiaco, che connette la
matrice extracellulare al citoscheletro. In altri casi, aspetti di miocardio non compatto sono stati rilevati
nell’ambito di una cardiomiopatia ipertrofica: la connessione tra queste due cardiomiopatie non è a tutt’oggi
ben definita. Una mutazione del gene FKBP12 può produrre difetti del setto interventricolare, cardiomiopatia
dilatativa e non compattazione del miocardio;
L’esame anatomo-patologico macroscopico evidenzia la presenza di un miocardio ventricolare sinistro con
profondi recessi e trabecolature a prevalente localizzazione apicale, e dei segmenti medi delle pareti laterale
e inferiore visualizzabili anche con l’ecocardiografia transtoracica. Spesso sono associati falsi tendini
ventricolari sia singoli che multipli . Non ci sono reperti istologici patognomonici della IVNC, ma la fibrosi con
aumento del contenuto collagene del miocardio trabecolare è stata descritta in molti casi così come in alcuni
casi è stata riscontrata fibroelastosi sottoendocardica e necrosi dei miociti all’interno delle trabecole.
Ecocardiogramma: L’ecocardiografia è la metodica di scelta. Sono stati proposti nel corso degli anni diversi
criteri diagnostici.
E’ stato tuttavia osservato che non c’è molta corrispondenza tra diagnosi effettuate con criteri diagnostici
diversi.
Il quadro ecocardiografico in età pediatrica può presentare delle peculiarità rispetto all’età adulta.
Pignatelli et al. hanno proposto, studiando 36 bambini con IVNC, quali criteri diagnostici da utilizzare:
a) presenza di molteplici trabecole e recessi nella cavità ventricolare, localizzati prevalentemente all’apice
e nella porzione media della parete inferiore e laterale;
b) evidenza di passaggio di sangue dalla cavità ventricolare all’interno dei recessi al color Doppler;
c) rapporto tra strato non compattato e compattato, misurato in sezione asse corto in telediastole, maggiore
di 1.4.
La funzione sistolica del ventricolo sinistro in età pediatrica risulta ridotta in grado moderato nella maggior
parte dei pazienti affetti, tuttavia in alcuni di essi si osserva una ripresa, per lo più temporanea, della
funzione contrattile globale. Per quanto riguarda la funzione diastolica, la valutazione con Doppler pulsato
del riempimento ventricolare sinistro può evidenziare differenti pattern flussimetrici,espressione sia di un
anomalo rilasciamento (riduzione del rapporto E/A), sia di una ridotta compliance(rapporto E/A > 2).
In circa un terzo dei pazienti è possibile riscontrare un pattern di tipo restrittivo all’analisi Doppler del flusso
di riempimento ventricolare sinistro.
Occasionalmente una trombosi ventricolare apicale può simulare una non compattazione del miocardio
ventricolare o, viceversa, la non compattazione del ventricolo sinistro può essere erroneamente confusa con
un’estesa trombosi murale, specie nelle forme apicali.