Nomenclatura dei
principali composti
inorganici
1
Nomenclatura dei principali
composti inorganici
Ogni specie chimica viene indicata con un nome
univoco, tutto questo per razionalizzare i nomi dei
composti in modo che vi sia una correlazione univoca
tra la formula di un composto ed il suo nome. Le regole
della nomenclatura sono pubblicate dalla IUPAC
(International Union of Pure and Applied Chemistry).
Esiste una nomenclatura tradizionale che e’ ancora
utilizzata.
2
La tavola periodica viene ottenuta ordinando gli elementi in
funzione della loro struttura elettronica (n° atomico)
3
SIMBOLOGIA DEGLI ELEMENTI
CARICA
IONICA
NUMERO DI
MASSA
32
16
S
2+
NUMERO
ATOMICO
4
Composti neutri o ioni complessi a struttura covalente
(il trasferimento di elettroni non é completo)
legame covalente H-Cl con trasferimento parziale di elettroni da H a Cl
H
Hδ+-Clδ–
Cl
La carica di ciascun atomo dovrebbe essere espressa da un numero
frazionario di difficile determinazione
Composti ionici
(il trasferimento di elettroni é completo)
(+)
Na
: :
legame ionico Na+Cl— con trasferimento totale di 1 elettrone da Na a Cl
(-)
•Cl •
• •
5
La carica di ciascun atomo viene espressa da un numero intero
Numero di ossidazione
Definizione di numero di ossidazione (n.o.): rappresenta la carica
formale, espressa in numero di elettroni, che nella formazione di
un legame l’atomo cede o assume, schematizzando il composto
come completamente ionico ed assegnando gli elettroni di legame
all’atomo più elettronegativo. Il n.o. è un parametro utile nel
visualizzare gli elettroni di legame.
Composti covalenti - Trasferimento elettronico non completo
HCl
attribuzione formale degli elettroni di legame al Cl (più elettroneg.)
Composti ionici - Trasferimento elettronico completo
CuCl2
il n.o. di ciascun ione coincide con la carica dello ione stesso
Cu
Cl
Cu2+ carica effettiva +2 n.o. Cu = +2
Cl– carica effettiva -1
n.o. Cl = -1
6
Regole per
ossidazione
la
determinazione
del
numero
di
9 Il n.o. di un atomo di una qualsiasi specie chimica allo stato
elementare é uguale a zero
Na, Fe, C, H2, Cl2, P4, S8, ecc.
n.o. = 0
9 Il n.o. di un qualsiasi ione monoatomico é uguale alla carica dello
ione
Ione
n.o.
Na+
+1
Ba2+
+2
Fe3+
+3
Br–
-1
S2–
-2
9 Il n.o. dell’idrogeno nei suoi composti é sempre uguale a +1, ad
eccezione degli idruri in cui é uguale a -1
n.o.H = +1 HCl, H2O, HNO3, NH3, NH4+, ecc.
n.o.H = -1 NaH, CaH2, B2H6, ecc.
9 Il n.o. dell’ossigeno nei suoi composti é sempre uguale a -2, ad
eccezione dei perossidi in cui é uguale a -1 e dei composti con il
fluoro in cui é uguale a +2
n.o.O = -2 H2O, BaO, H2SO4, Cl2O5, ecc.
n.o.O = -1 H2O2, Na2O2, ecc.
n.o.O = +2 OF2
7
Regole per la determinazione del numero di ossidazione
9 La somma algebrica dei n.o. di tutti gli atomi in un composto neutro deve
essere uguale a zero
9 La somma algebrica dei n.o. di tutti gli atomi in uno ione poliatomico (NH4+,
–
–
SO42 , PO43 , ecc.) deve essere uguale alla carica dello ione
9Gli elementi dei gruppi 1, 2, 3 del sistema periodico nei loro composti hanno
sempre n.o. positivo che si identifica con il numero di appartenenza del gruppo
Gruppo
1
2
3
n.o.
+1
+2
+3
9 Il n.o. massimo di un atomo di un elemento non può essere superiore al numero
del gruppo di appartenenza
Gruppo
n.o.MAX
4 (IV)
+4
5 (V)
+5
6 (VI)
+6
Attenzione! n.o. non coincide con il numero di
legami che forma un atomo.
7 (VII)
+7
8
Composti
I composti sono delle sostanze chimiche formate da 2 o più specie
atomiche e vengono dette composti binari, ternari, ecc.
H
H
B
Nei composti gli elementi
si ordinano in senso di
elettronegatività crescente
¾Ordine con cui compaiono gli elementi
nelle formule:
B, Si, C, Sb, As, P, N, H, Te, Se, S, At, I,
Br, Cl, O, F
perciò NH3 e non H3N
CH4 e non H4C
F
C
N
O
Si
P
S
Cl
As
Se
Br
Sb
Te
I
O
At
9
Composti binari con l’OSSIGENO
♦ OSSIDI
Nella nomenclatura IUPAC i prefissi (mono), di, tri, indicano il numero di
atomi di O e dell’altro elemento, altrimenti si può utilizzare la notazione di
Stock.
CaO
CO
Ossido di calcio
Ossido di carbonio
CO2
SO2
SO3
NO
NO2
N2O
FeO
Fe2O3
Diossido di carbonio
Diossido di zolfo
Triossido di zolfo
Ossido di azoto
Diossido di azoto
Ossido di diazoto
Ossido di ferro
Triossido di diferro
Eccezione OF2
difloruro di ossigeno
Ossido di carbonio(II)
(Monossido di C)
Ossido di carbonio(IV)
Ossido di zolfo(IV)
Ossido di zolfo(VI)
Ossido di azoto(II)
Ossido di azoto(IV)
Ossido di azoto(I)
Ossido di ferro(II)
Ossido di ferro(III)
10
La nomenclatura tradizionale fa distinzione tra:
Composti fra ossigeno e
un metallo:
ossidi BASICI
Composti fra ossigeno e un
non metallo:
ossidi ACIDI o ANIDRIDI
Suffissi –OSO e –ICO
Suffissi –OSA e –ICA e
prefissi IPO e PER
FeO
Fe2O3
Cu2O
CuO
Ossido ferroso
Ossido ferrico
Ossido rameoso
Ossido rameico
N2 O3
N2 O5
SO2
SO3
Cl2O
Cl2O3
Cl2O5
Cl2O7
Anidride nitrosa
Anidride nitrica
Anidride solforosa
Anidride solforica
Anidride ipoclorosa
Anidride clorosa
Anidride clorica
Anidride perclorica
11
Altri composti con l’OSSIGENO:
PEROSSIDI (contengono un legame covalente tra due atomi di O)
Na2O2
Perossido di sodio
H2 O2
Perossido di idrogeno o acqua ossigenata
SUPEROSSIDI (composti ionici contenenti O2–)
KO2
Superossido di potassio
12
Composti binari con l’IDROGENO:
♦ ACIDI NON OSSIGENATI o IDRACIDI
Sono formati dall’idrogeno più un elemento del gruppo VI o VII.
Nella nomenclatura IUPAC vengono indicati allo stesso modo di tutti i
composti binari: nome dell’elemento più elettronegativo + desinenza
uro + di idrogeno
Nella nomenclatura tradizionale si indicano come:
Acido + (radice nome elemento non metallico) + suffisso –idrico, si
chiamano anche IDRACIDI
HF
HCl
HBr
HI
H2S
HCN
Fluoruro di idrogeno
Cloruro di idrogeno
Bromuro di idrogeno
Ioduro di idrogeno
Solfuro di diidrogeno
Cianuro di idrogeno
acido fluoridrico
acido cloridrico
acido bromidrico
acido iodidrico
acido solfidrico
acido cianidrico
13
♦ IDRURI
Composti formati dall’idrogeno con elementi metallici del I e II gruppo
Idruro + nome dell’elemento metallico
NaH Idruro di sodio
LiH
Idruro di litio
CaH2 Idruro di calcio
Nomi d’uso
H2O
PH3
B2 H6
Acqua
Fosfina
Diborano
NH3 Ammoniaca
AsH3 Arsina
N2H4 Idrazina
14
IDROSSIDI
Composti ionici formati da un catione metallico e da uno o più gruppi
OH– che ne neutralizzano la carica.
Si indicano come idrossido + nome del metallo + stato di ossidazione,
che nella nomenclatura IUPAC viene indicato con la notazione di
Stock, mentre in quella tradizionale con i suffissi oso e ico.
NaOH
idrossido di sodio
Mg(OH)2
diidrossido di magnesio
idrossido di magnesio
Fe(OH)3
triidrossido di ferro(III)
idrossido ferrico
Fe(OH)2
diidrossido di ferro(II)
idrossido ferroso
15
Ioni monoatomici
CATIONI
IUPAC: IONE + NOME dell’ELEMENTO precisando tra parentesi in
NUMERO ROMANO il numero di ossidazione dello ione (notazione di
Stock), quando necessario.
TRADIZIONALE: se uno ione può avere più n.o. si indica il nome
dell’elemento con suffissi OSO (carica più bassa) o ICO (carica più elevata).
Ca2+
Zn2+
Na+
Cu2+
Cu+
Fe3+
Fe2+
Ione calcio
Ione calcio
Ione zinco
Ione zinco
Ione sodio
Ione sodio
Ione rame(II)
Ione rameico
Ione rame(I)
Ione rameoso
Ione ferro(III) Ione ferrico
Ione ferro(II)
Ione ferroso
16
Ioni monoatomici
ANIONI
IONE + NOME dell’ELEMENTO + desinenza URO.
Br–
F–
Cl–
S2–
P3–
Ione bromuro
Ione floruro
Ione cloruro
Ione solfuro
Ione fosfuro
Eccezioni:
H–
O2–
N3–
Ione idruro
Ione ossido
Ione nitruro
Non idrogenuro
Non ossigenuro
Non azoturo
17
Ioni poliatomici
CATIONI
Ione + nome dell’elemento legato all’idrogeno + desinenza onio
Eccezione:
H3 O+
PH4+
Ione ossonio
Ione fosfonio
NH4+
Ione ammonio (non azotonio)
18
Ioni poliatomici
ANIONI
Ione + nome elemento + desinenza -uro
ECCEZIONI:
S22–
CN–
C22–
Ione disolfuro
Ione cianuro
Ione carburo
OH–
O2 2 –
O2 –
ione idrossido
Ione perossido
Ione superossido
19
OSSOANIONI
Nella nomenclatura IUPAC l’elemento centrale, che assume la desinenza
–ato, viene preceduto dal termine ione, mentre il numero di atomi di O legati
all’atomo centrale viene precisato con prefissi (di, tri,…). Si può aggiungere
l’indicazione del n.o. dell’elemento centrale con la notazione di Stock.
Nella nomenclatura tradizionale, i diversi n.o. sono indicati usando suffissi
–ito e –ato, insieme ai prefissi ipo e per a indicare il n.o. più basso e più alto,
rispettivamente.
SO32–
SO42–
NO2–
NO3–
ione solfato(IV)
ione triossosolfato
ione solfato(VI)
ione tetraossosolfato
ione nitrato(III)
ione diossonitrato
ione nitrato(V)
ione triossonitrato
(ione solfito)
(ione solfato)
(ione nitrito )
(ione nitrato) 20
CO32–
ClO–
ClO2–
ClO3–
ClO4–
ione carbonato(IV)
ione triossocarbonato
ione clorato(I)
ione (mono)ossoclorato
ione clorato(III)
ione diossoclorato
ione clorato(V)
ione triossoclorato
ione clorato(VII)
ione tetraossoclorato
(ione carbonato)
(ione ipoclorito)
(ione clorito)
(ione clorato)
(ione perclorato)
21
ACIDI derivanti da anidridi(OSSOACIDI)
Gli acidi che derivano dalle anidirdi sono chiamati OSSOACIDI.
Sono composti formati da un atomo di un elemento legato ad uno o più
gruppi OH e ad eventuali atomi di ossigeno.
Nomenclatura IUPAC:
Si mantiene il nome dell’ossoanione corrispondente togliendo il
termine “ione” e specificando il nome acido e sostituendo ato con ico.
H2CO3
Acido triossocarbonico (IV)
carbonato di diidrogeno
Esempi:
HNO2
HNO3
H2SO3
H2SO4
Acido diossonitrico(III)
Acido triossonitrico(V)
Acido triossosolforico(IV)
Acido tetraossosolforico(VI)
22
ACIDI derivanti da anidridi (OSSOACIDI)
Nella nomenclatura tradizionale si usa il nome dell’ossoanione
corrispondente, sostituendo a “ione” la parola “acido” e variando la
desinenza:
-ito diventa –oso
-ato diventa –ico
SO32–
SO42–
NO2–
NO3–
ione solfito
ione solfato
ione nitrito
ione nitrato
H2SO3
H2SO4
HNO2
HNO3
Acido solforoso
Acido solforico
Acido nitroso
Acido nitrico
Se inoltre sono presenti più stati di ossidazione si usano anche i
prefissi ipo e per a indicare il n.o. più basso e più alto,
rispettivamente.
23
ACIDI derivanti da anidiridi (OSSOACIDI)
OSSOACIDI META-PIRO-ORTO:
• Nella nomenclatura tradizionale degli acidi ossigenati vengono usati i
prefissi orto, meta e piro per indicare i diversi gradi di idratazione di acidi
aventi l'atomo centrale nello stesso stato di ossidazione.
• Le anidridi di alcuni Non Metalli (P, As, Sb, B, Si) possono reagire con acqua
in diverse proporzioni, formando acidi diversi:
– Anidride + 1H2O acido meta
– Anidride + 2H2O acido piro
– Anidride + 3H2O acido orto
• In genere il prefisso "orto" è sottinteso:
– P2O5 + H2O HPO3 acido metafosforico
– P2O5 + 2H2O H4P2O7 acido pirofosforico
– P2O5 + 3H2O H3PO4 acido (orto)fosforico o fosforico
Alcuni esempi di OSSOACIDI
HClO
Acido ossoclorico(I)
acido ipocloroso
HClO2
Acido diossoclorico(III)
acido cloroso
HClO3
Acido triossoclorico(V)
acido clorico
HClO4
Acido tetraossoclorico (VII)
acido perclorico
HIO4
Acido tetraossoiodico (VII)
acido periodico
H2CrO4
Acido tetraossocromico(VI)
acido cromico
H3AsO3
Acido triossoarsenico(III)
acido arsenioso
H3AsO4
Acido tetraossoarsenico(V)
acido arsenico
24
SALI con anioni derivanti da idracidi
Composti formati da un catione e un anione.
Nomenclatura IUPAC e tradizionale: nome dell’anione (desinenza uro) + di
+ nome catione
KCl
NH4F
cloruro di potassio
fluoruro d’ammonio
Nella nomenclatura IUPAC i prefissi (mono), di, tri, …. precisano il numero
di atomi (oppure si usa notazione di Stock), mentre nella nomenclatura
tradizionale sono usati i prefissi e suffissi visti in precedenza.
CaCl2
KCN
Na2S
FeCl2
FeCl3
CuCl
CuCl2
dicloruro di calcio
cianuro di potassio
solfuro di disodio
dicloruro di ferro
tricloruro di ferro
cloruro di rame
dicloruro di rame
cloruro di Fe(II)
cloruro di Fe(III)
cloruro di Cu(I)
cloruro di Cu(II)
cloruro di calcio
cianuro di potassio
solfuro di sodio
cloruro ferroso
cloruro ferrico
cloruro rameoso 25
cloruro rameico
SALI con anioni derivanti da ossoacidi
Composti formati dall’anione di un ossoacido e da un metallo.
Sia la nomenclatura IUPAC che quella tradizionale mantengono il
nome dell’ossoanione corrispondente, omettendo il termine “ione” e
specificando il nome del catione.
CaSO3
solfato(IV) di calcio
solfito di calcio
triossosolfato di calcio
CaSO4
solfato(VI) di calcio
solfato di calcio
tetraossosolfato di calcio
Na2SO4
solfato(VI) di disodio
solfato di sodio
tetraossosolfato di disodio
KNO2
nitrato(III) di potassio
diossonitrato di potassio
nitrito di potassio
26
NaNO3
nitrato(V) di sodio
nitrato di sodio
triossonitrato sodio
Na3PO4
fosfato(V) di trisodio
ortofosfato di sodio
tetraossofosfato di trisodio
SALI contenenti atomi di idrogeno
Sia la nomenclatura IUPAC che quella tradizionale mantengono il
nome del sale corrispondente premettendo il termine idrogeno.
NaHCO3
Idrogeno carbonato(IV) di sodio
Idrogeno carbonato di sodio
bicarbonato di sodio
KHSO3
Idrogeno solfato(IV) di potassio
Idrogeno solfito di potassio
bisolfito di potassio
27
NaH2PO4
Diidrogeno fosfato(V) di sodio
Diidrogeno fosfato di sodio
Come si ottengono i composti chimici???
Elementi
metalli
non metalli
+O2
+O2
ossidi acidi
ossidi basici
+H2O
+H2O
ossoacidi
idrossidi
sali
28
Idruri
Composti binari dell’idrogeno con elementi fortemente elettropositivi (metalli
alcalini e alcalino terrosi). In H2O si decompongono liberando H2 e formando
soluzioni basiche (si comportano come basi forti formando idrossidi).
LiH + H2O → Li+ + OH- + H2
Idrossidi
Sono sostanze fortemente basiche che si ottengono per reazione degli ossidi basici con
H2O:
K2O + H2O → 2 KOH
Idracidi
In H2O gli idracidi si ionizzano in H+(aq) e X-(aq) formando soluzioni acide.
HCl + H2O
→ H3O+(aq) + Cl-(aq)
29
Ossoacidi
Si ottengono per reazione degli ossidi acidi (o anidridi) con H2O:
SO3 + H2O → H2SO4
In soluzione acquosa liberano ioni H+.
HNO3 + H2O → H3O+(aq) + NO3-(aq)
In base al numero di protoni che la molecola può liberare (idrogeni salificabili) gli
ossoacidi vengono suddivisi in:
Monoprotici:
Diprotici:
Triprotici:
HNO2
H2SO4
H3PO4
HClO
H2MnO4
H3BO3
HNO3
H2CO3
H3AsO4
Sali
Si ottengono per reazioni fra una base ed un acido (reazioni di neutralizzazione):
2 KOH + H2SO4 →
2 Al(OH)3 + 3 H2SO4 →
K2SO4 + 2 H2O
Al2(SO4)3 + 6 H2O
30
Calcolare il numero di ossidazione di tutti gli elementi presenti
nei diversi composti:
CaSO3
Na2CO3
CO2
ZnCl2
NH3
NH4Cl
CaF2
SiO2
H2SO4
Ba(OH)2
O2
Fe+3
NaHCO3
NO3HPO42K2Cr2O7
HS-
[+2,+4,-2]
[+1,+4,-2]
[+4,-2]
[+2,-1]
[-3,+1]
[-3,+1,-1]
[+2,-1]
[+4,-2]
[+1,+6,-2]
[+2,-2,+1]
[0]
[+3]
[+1,+1,+4,-2]
[+5,-2]
[+1,+5,-2]
[+1,+6,-2]
[+1,-2]
31
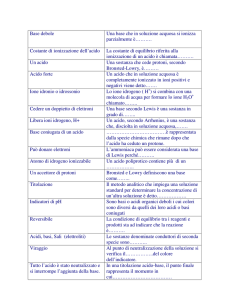
Scrivere il nome dei seguenti composti o ioni
CaSO3
ZnCl2
NH3
NH4Br
Cr+2
Na2CO3
CaF2
SiO2
H2CrO4
NO3Ba(OH)2
[triossosolfato (IV) di calcio]
[dicloruro di zinco]
[ammoniaca]
[bromuro di ammonio]
[ione cromo (II)]
[triossocarbonato (IV) di sodio]
[difloruro di calcio]
[diossido di silicio]
[acido tetraossocromico (VI)]
[ione triossonitrato (V)]
[idrossido di bario]
32
Scrivere la formula dei seguenti composti o ioni
Pentacloruro di fosforo
Ammoniaca
Acido diossonitrico
Triidrossido di alluminio
Solfuro di zinco
Perossido di potassio
Pentossido di di vanadio
Seleniuro di cadmio
Ioduro di cesio
Tetracloruro di zolfo
Idruro di potassio
Ione stagno (IV)
Ione ammonio
Tetraossoclorato (VII) di litio
Acido fluoridrico
Anidride carbonica
Idruro di magnesio
[PCl5]
[NH3]
[HNO2]
[Al(OH)3]
[ZnS]
[K2O2]
[V2O5]
[CdSe]
[CsI]
[SCl4]
[KI]
[Sn+4]
[NH4+]
[LiCLO4]
[HF]
[CO2]
[MgH2]
33