RETICOLO ENDOPLASMATICO
RUGOSO
SINTESI DI:
- PROTEINE DI MEMBRANA
- PROTEINE DI SECREZIONE
- ENZIMI LISOSOMIALI
DETOSSIFICAZIONE
LISCIO
SINTESI DI LIPIDI
ACCUMULO IONI CALCIO
La sintesi di nuovi lipidi avviene nella parte del
reticolo endoplasmatico rivolta verso il citosol
Il meccanismo di flip flop, che è sia spontaneo che enzimatico,
serve a riequilibrare la membrana spostando lipidi dal lato
citosolico al lume del reticolo
Il doppio strato lipidico presenta una distribuzione asimmetrica dei lipidi
Siamo tutti esposti ad un numero enorme di
molecole tossiche e reattive di origine sia esogena
che endogena
.
Per detossificazione da composti organici insolubili si intende
la loro solubilizzazione (fase I); i composti solubili o
solubilizzati sono coniugati con molecole idrosolubili (fase II)
e quindi escreti (fase III)
Presenza del sistema di detossificazione
nel reticolo endoplasmatico liscio di :
• Fegato
• Polmone
• Intestino
• Rene
• Epidermide
• Gonadi
• Placenta
Le ossidasi a funzione mista sono enzimi (dipendenti dal
citocromo P450) che sono localizzati nel reticolo
endoplasmatico (REL)
XENOBIOTICO
SANGUE
ESCREZIONE
Effetto
somatico
BIOTRASFORMAZIONE
Danno
al DNA
metabolita
non tossico
Attivazione
metabolita
tossico
Detossificazione
Definizione
La Biotrasformazione è la somma di tutti i processi
tramite i quali un composto è trasformato chimicamente
all’interno di un organismo vivente
Gli enzimi di detossificazione possono usare come
substrati molecole molto diverse tra loro, accomunate
dalla presenza di un qualche elemento comune (ad
esempio un certo gruppo funzionale).
Gli enzimi di detossificazione sono di tanti tipi e sono
codificati da famiglie geniche. Per il citocromo P450,
ad esempio, nell’uomo ci sono 18 famiglie (CYP1,
CYP2, CYP3, CYP4, CYP5, CYP7, CYP8, CYP11,
CYP17, CYP9, CYP21, CYP24, CYP26, CYP27,
CYP39, CYP46, CYP51) e 42 sottofamiglie; di
ciascuna, ogni individuo può avere due geni
(uguali o diversi se omozigote o eterozigote) e può
quindi esprimere fino a due diversi isoenzimi.
Questo genera variabilità individuale.
Tra un individuo ed un altro ci possono essere
notevoli differenze qualitative e/o quantitative nella
capacità di detossificare.
Tali differenze non sono solo il risultato di
differenze genetiche; in piccola parte dipendono
anche dell’eventuale effetto di altre sostanze con cui
si entra in contatto a scopo voluttuario o terapeutico.
A causa dei suoi composti cumarinici e bioflavonoidi
inibitori del CYP3A4 a livello intestinale, il succo di
pompelmo, assunto insieme a farmaci substrati del
CYP3A4, mantiene alta la loro concentrazione nel
plasma con rischio di tossicità.
Gli enzimi della fase I :
• Aumentano nei fumatori
• Aumentano o diminuiscono a seguito di
ingestione di farmaci
• Aumentano mangiando carne alla griglia,
bevendo troppi alcolici o oli vegetali vari
• Sono influenzati in modo variabile da
fitochimici, specialmente flavonoidi
• Diminuiscono nei vegani
Gli enzimi di detossificazione sono inducibili e la loro
concentrazione nelle membrane del REL è
fortemente influenzata dalle molecole con cui si
entra in contatto
Dopo …
L’aumento di espressione di un isoenzima può
comportare grandi variazioni, come la diminuita di
espressione di un altro, l’inibizione dell’espressione
di un altro isoenzima, l’improvvisa attivazione di un
isoenzima non espresso, …
La fase II è stimolata da assunzione di :
• Cavoli, broccoli, cavolfiori, cavoletti di
Bruxelles (glucosinolati)
• Olio di aglio, rosmarino, soia
• Scorze di agrumi, aneto e olio di cumino
(limonene)
• Curcumina
• S-adenosil metionina (SAM)
• Cardo mariano (silymarins)
La fase II risulta inibita o compromessa per:
• Carenze nutrizionali
• Esposizione a composti tossici che esauriscono
riserve di substrati or co-fattori
• Ad esempio: esposizione ad acetaminofene.
Alcool ed alimentazione carente di proteine
riducono i livelli del glutatione che è necessario
per la detossificazione dell’acetaminofene
Il processo di detossificazione non sempre porta alla
inattivazione di una molecola, talvolta può alterarne la
reattività o portare alla formazione di composti tossici:
• la codeina è trasformata in morfina, analgesico più potente
• il cortisone è trasformato nel più attivo idrocortisone
• il paracetamolo a basse dosi è ben tollerato perché in
parte viene eliminato come tale, oltre la metà è eliminato
coniugato con acido glucuronico, ed il resto come coniugato
con solfato e glutatione. Se però la sua dose supera la
disponibilità dei coniuganti, il suo intermedio reattivo formato
nella Fase I (N-acetil-parafenil-chinopirina) resta nella cellula
ed agisce come composto tossico, soprattutto se non si
somministra cisteina
Fattori che influenzano la detossificazione:
• Età
• Genere
• Dieta e stile di vita
• Ambiente
• Stato di salute
• Polimorfismi genetici
• Uso di integratori
• Stato dell’intestino
Supportano la detossificazione
• Co-fattori e nutrienti (Niacina, vitamina B6,
glicina, NAC)
• Antiossidanti/nutrienti protettivi (vitamine C
ed E, ioni zinco, acido lipoico)
• Fitonutrienti che possono stimolare l’attività
di geni detossificanti (sulforafano dai broccoli)
I Mitocondri si replicano come i batteri
mediante scissione binaria come
indicato in figura. La divisione
cellulare si verifica dopo la
replicazione del loro DNA.
I mitocondri non funzionanti vengono
digeriti dai lisosomi.
DNA MITOCONDRIALE
• 5-10 molecole circolari per mitocondrio
(organizzato in operon, contiene tracce di
ribosio e di uracile, nell’uomo è costituito da
poco meno di 16.000 nucleotidi)
• codifica per 37 geni
(di cui 13 geni per proteine, 2 geni per RNA ribosomali e
vari RNA transfer)
• la trasmissione ereditaria avviene per via
materna
•è duplicato da enzimi che vengono dal nucleo
della cellula, da questo fatto deriva eteroplasmia
(copie che tendono a diventare diverse tra loro per
accumulo di mutazioni)
Tutti i mitocondri dello zigote
vengono forniti dalla cellula uovo:
l’eredità materna è eteroplasmica
ma durante lo sviluppo
embrionale di ripristina la
condizione omoplasmica
Ipotesi del collo di bottiglia
Una restrizione o “collo di bottiglia” avviene precocemente nei primi stadi
di sviluppo embrionale: solo uno (o comunque pochi e sani) mitocondri
avranno la capacità di proliferare e colonizzeranno le cellule
dell’embrione. Il numero e la variabilità dei genomi mitocondriali presenti
si riduce quindi drasticamente e con essi il grado di eteroplasmia
DH=DG-TDS
DH= entalpia
DG= energia libera
TDS= energia entropica
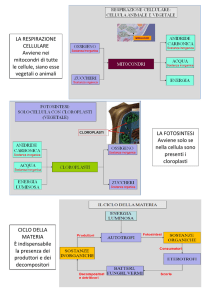
FOTOSINTESI: 6H2O + 6CO2 + light C6H12 O6 + 6O2
RESPIRAZIONE: C6H12 O6 + 6O2 6H2O + 6CO2 + 38 ATP
Anidride
Carbonica +
acqua
Cellula
Cellula
Glucosio +
Ossigeno
CITOSOL
Reazione complessiva:
GLUCOSIO (6C)
glicolisi
due molecole di
acido piruvico (3C)
O2
respirazione
CO2 e H2O
MITOCONDRIO
C6H12 O6 + 6O2 6H2O + 6CO2 + DQ
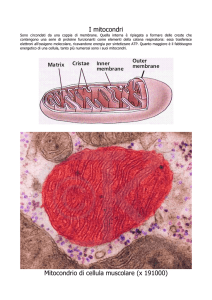
MITOCONDRI
Hanno prevalentemente forma
allungata, sono delimitati da una
membrana esterna simile a
quella cellulare , dentro c'è una
seconda membrana che si
introflette in creste.
I mitocondri sono gli organelli
dove si produce la maggior parte
di ATP delle cellule eucariotiche e
sono presenti in quasi tutti i tipi di
cellule sia vegetali che animali.
Il gradiente di protoni genera un campo elettrico nella
membrana mitocondriale interna
Il pH nello spazio intermembrana è di oltre una unità
inferiore a quello nella matrice
Il potenziale di membrana è 140 mV, parte positiva
nella faccia rivolta allo spazio intermembrana
Forza proton motrice
= DV + DpH
La sintesi di ATP,
guidata dall’energia
del gradiente di H+,
è fatta da pompe di
tipo V (reversibili)
C6H12 O6 + 6O2 6H2O + 6CO2 + DQ
DQ = max 38 molecole di ATP + CALORE
Il mitocondrio può modulare la quantità di ATP e di
calore prodotti
In inverno aumenta la quota di calore, in estate
diminuisce
nel corso di una infezione batterica aumenta la
temperatura corporea (febbre)
alcuni ormoni sono in grado di modulare la funzione
mitocondriale. Ad esempio Tiroxina e Leptina fanno
aumentare la produzione di calore, facendo
diminuire la quantità di ATP prodotta
•Le basi genetiche delle malattie mitocondriali rimasero
sconosciute fino al 1988 quando è stata individuata la
prima patologia determinata da mutazioni di mtDNA
•Oggi sono note più di 100 mutazioni puntiformi e 200
differenti riarrangiamenti del mtDNA che causano
disfunsioni mitocondriali
• Sono state individuate numerose mutazioni del DNA
nucleare che causano patologie mitocondriali
• Pare ormai accertato che le disfunzioni mitocondriali
possono avere un ruolo importante in patologie comuni
come insufficienza cardiaca, diabete mellito e neurodegenerazioni
MALATTIE CON ALTERAZIONE DEI
MITOCONDRI
•Corea di Huntington
•Atassia di Friedeich (mutazione
nel gene della fratassina, che regola
il trasporto di ferro nel mitocondrio. La mancanza di fratassina danneggia i
complessi I, II and III della carena respiratoria che sono Fe dipendenti)
•Malattia di Alzheimer (5% casi con mutazione)
•Parkinson (Riduzione del complesso I nella sostanza nigra del tronco
celebrale)
•Diabete mellito (1.5% dei casi)
•Paraganglioma (tumore celebrale ereditario)
Aspetti generali delle patologie dovute a
mutazioni del DNA mitocondriale
•Incidenza da 1:10.000 a
1:4000
•Interessano i tessuti ad
alto consumo di energia:
Cervello, Cuore e Muscoli
scheletrici