11/04/2013
Prof.ssa Bonaccorsi, Immunologia.
RUOLO DELLE CITOCHINE NELLA RISPOSTA IMMUNITARIA
Questa lezione riguarderà le citochine, sia per quanto riguarda il loro coinvolgimento nella risposta
immunitaria e in diverse malattie immuno-mediate; quindi, si tratterà sia dell’aspetto fisiologico che di
quello patologico. Al fine di introdurre questo argomento, confronteremo l’immunità innata e quella
acquisita, sia per quanto riguarda le loro peculiarità al fine di avere un quadro generale per comprendere
meglio ciò che il professore Ferlazzo vi spiegherà.
Innanzitutto, stabiliamo ciò da cui il sistema immunitario ci protegge: originariamente, venne descritto
come un sistema in grado di difenderci contro i patogeni e le infezioni, a tutt’oggi, però, le prerogative di
questa risposta immunitaria sono altre; infatti, il sistema immunitario, oltre a difenderci contro i patogeni,
ci offre protezione anche dai tumori e dalle cellule che vanno incontro a danneggiamento e a mutazioni.
Inoltre, si sa che ci sono delle patologie in cui la reazione del sistema immunitario si esplica verso delle
entità che non sono patogeni, prendiamo, ad esempio, le malattie autoimmuni nelle quali il sistema
immunitario reagisce contro il self o le allergie in cui l’antigene(sostanza che evoca la risposta del sistema
immunitario, nel caso degli antigeni patogeni. Nel caso delle malattie autoimmuni, invece, può essere anche
self.), che non è un patogeno o uno self, è una sostanza estranea innocua ma che nel contesto patologico
delle allergie genera una risposta immunitaria non desiderata.
Quindi, i tre tipi di antigene più importanti sono: l’antigene derivato da patogeni, verso il quale c’è una
risposta desiderata; l’antigene self verso il quale, se si innesca una risposta, si genera l’autoimmunità(quindi
un antigene endogeno, non estraneo); l’antigene estraneo ,ma innocuo, che può generare una risposta
immunitaria nel caso delle patologie atopiche, nel caso delle allergie.
I patogeni che possono provocare la risposta da parte del sistema immunitario sono molto differenti tra
loro: possono essere virus(che sono molto diversi tra loro), funghi, batteri, parassiti. Oggi andremo a capire,
quindi, come sia il sistema immunitario innato che quello specifico abbiano la capacità di sviluppare una
risposta immunitaria mirata e “personalizzata” verso i diversi microorganismi; proprio per questo sono
importanti le citochine che polarizzano la risposta del sistema immunitario perché, promuovendo la
comunicazione fra le varie cellule del sistema immunitario, inducono un polarizzazione(cioè una “spinta”
del sistema immunitario verso l’assunzione della immunità più appropriata e più idonea per ciascun
microorganismo). Proprio in questo sta l’importanza delle citochine, le quali coinvolgono sia il sistema
immunitario innato che quello adattivo, e mettono in relazione anche due sistemi perché la risposta che si
ottiene durante la stimolazione del sistema immunitario innato e le citochine che vengono prodotte
durante l’immunità innata sono molto importanti perché saranno esse stesse a determinare quel
microambiente citochimico, che possiamo definire network delle citochine, che poi influenza la risposta
adattiva. Quindi saranno le citochine prodotte durante le prime fasi, durante la risposta innata, a
determinare la direzione(quindi la polarizzazione) del sistema immunitario durante la risposta adattiva.
Quindi, capite bene come l’immunità innata non è fine a sé stessa; essa è ovviamente un’immunità che
deve essere effettrice e, auspicabilmente, deve essere in grado di distruggere, eliminare il patogeno, ma ha
anche un ruolo fondamentale nel direzionale la successiva risposta dell’immunità specifica. In questo,
vedrete, giocano un ruolo fondamentale le cellule dendritiche che fanno da ponte fra l’immunità innata e
quella adattiva e che vanno a polarizzare la risposta dell’immunità adattiva, a secondo delle citochine che
queste cellule andranno a produrre quando andranno a stimolare i linfociti a livello linfonodale dove,
appunto, parte la risposta immunitaria(infatti la risposta immunitaria adattiva parte dal linfonodo in cui ci
sono i linfociti naive. Le cellule dendritiche attivano e polarizzano, in modo tale da renderli più efficaci
nell’eliminazione dei vari patogeni, questi linfociti naive.
Quindi, capiamo come il sistema immunitario abbia un ruolo molto importante nella difesa dalle infezioni,
infatti, è noto che gli individui immunodeficenti sono maggiormente esposti alle infezioni, come è il caso
degli individui affetti da AIDS. Il sistema immunitario è anche molto importante nella risposta contro i
trapianti; sentirete il prof Ferlazzo parlarvi di HLA che è proprio ciò che il sistema immunitario riconosce
come diverso, come marcatore del self e del non self ed è fondamentalmente l’antigene coinvolto
nell’alloresponse, ovvero la risposta verso il trapianto, verso un organismo diverso e si parla di allorisposta
o alloresponse. Ancora, l’altro giorno abbiamo visto che il sistema immunitario ha una certa importanza
nella difesa contro i tumori; questa importanza, di fatto, esiste ma si sta cercando di potenziarla e ne
abbiamo visto l’implicazione nella immunoterapia dei tumori. Poi abbiamo visto l’impiego degli anticorpi
nella ricerca, nella diagnosi e nella terapia. Quindi, fondamentalmente, questa è un’altra importante
considerazione su quelli che sono gli impatti del sistema immunitario e del suo studio.
Le cellule coinvolte nella risposta del sistema immunitario derivano da un’unica cellula staminale
pluripotente che si differenzia in due precursori, in due linee(che vengono chiamate lineage): il lineage
linfoide e il lineage mieloide. Quindi, avremo una cellula staminale linfoide o una mieloide; della cellula
staminale linfoide fanno parte tutti i linfociti che sono i linfociti T, i linfociti B e le cellule natural killer(NK)
che fra queste tre sono le uniche che non partecipano alla immunità specifica e che appartengono invece
alla immunità adattiva. Quindi possiamo dire che, se non ci fossero le NK, tutti i linfociti sarebbero cellule
della immunità specifica. La differenziazione dei linfociti , per quanto riguarda quelli T, avviene nel timo(da
cui deriva la lettera T presente nel nome di questi linfociti); mentre dalla cellula staminale a livello del
midollo osseo si differenza il linfocita B e quello NK. Il linfocita B ha un ulteriore stadio di differenziazione
che consiste nel linfocita B attivato, ovvero il linfocita B che ha visto il suo antigene, il suo stimolo specifico,
e attivandosi si differenzia in plasmacellula che è una cellula che ha la prerogativa di produrre anticorpi che
sono fondamentalmente i meccanismi tramite i quali il linfocita B svolge la sua azione effettrice, cioè di
effettiva neutralizzazione dell’antigene che ne ha evocato la produzione.
Per quanto riguarda invece il lineage mieloide, in questo caso, nel lineage mieloide, si possono distinguere
due sottocategorie, parliamo di polimorfonucleati e di cellule nucleate. I polimorfo nucleati sono,
fondamentalmente, i granulociti: neutrofili, eosinofili e basofili. I mononucleati sono i monociti e i
mastociti. I monociti sono uno stadio che ancora può differenziare, il monocita, infatti, lo trovate solo nel
sangue. Quando il monocita, poi, migra nei tessuti attirato da un focolaio infiammatorio ad esempio,
differenzia in macrofago e per questo si parla di sistema macrofagico monolitico, perché sono i monociti
che, migrando nei tessuti, si trasformano in macrofagi. Ancora, da questo lineage derivano poi le cellule
dendritiche, la cui ontogenesi non è ancora molto chiara, non si sa esattamente quale sia il precursore di
queste cellule, ma diverse evidenze mostrano che probabilmente è un precursore monocitario, quindi della
linea monocita-macrofago.
Quindi, le linee del sistema linfatico si possono dividere in linfociti che sono quelle cellule del lineage
linfoide che hanno la prerogativa di attivare l’immunità specifica tranne, appunto, le cellule NK che
riconoscono gli antigeni. Un errore che si fa spesso è pensare che un antigene possa attivare tutte le cellule
del sistema immunitario; l’antigene, in realtà , attiva solo linfociti T e B perché le altre cellule dell’immunità
non riconoscono gli antigeni e adesso vedremo che cosa riconoscono. Poi, vi sono queste antigen
presentino cells, le APC , tra cui le cellule dendritiche sicuramente, ma anche i macrofagi e i linfociti B. le
cellule dendritiche le definiamo come APC professionali. Il compito delle APC non è di essere degli effettori;
infatti, per quanto riguarda le dendritiche, non vanno ad attivare un patogeno ma attivano la risposta
immunitaria specifica, quindi fanno da shuttle perché vanno a prelevare gli antigeni dei microorganismi e
vanno a presentarli nel linfonodo ai linfociti T naive, quindi hanno una funzione ben diversa dai linfociti:
servono da shuttle. E poi abbiamo degli effettori, cellule che come i linfociti sono in grado di attivare gli
antigeni ma che, al contrario, non riconoscono l’antigene in particolare, ma delle altre molecole. Questi
effettori, oltre ai linfociti che riconoscono l’antigene, sono i granulociti tra cui neutrofili, eosinofili e i
macrofagi. Quali sono i meccanismi attraverso i quali un effettore può neutralizzare un determinato
patogeno? Sicuramente la produzione di anticorpi che vanno a legare gli antigeni esposti dai patogeni e in
questo modo neutralizzano i patogeni, fanno si che questi non siano più invasivi, che non abbiano più
capacità infettive. Inoltre, la presenza di un anticorpo sul patogeno rende questa entità facilmente
attaccabile da altri effettori del sistema immunitario, quali i macrofagi e altre cellule come le NK che vanno
a riconoscere questa porzione dell’anticorpo, la porzione FC. Tramite un recettore FC, per la porzione FC, le
cellule NK riconoscono questa porzione dell’anticorpo legato al microorganismo e tramite questa porzione
vengono attivati nella loro attività citotossica contro la cellula eventualmente infettata dal microorganismo.
Questa reazione si chiama ADCC è una reazione di citotossicità anticorpo mediata. Quindi, questo è uno
degli esempi che ci fanno capire come gli anticorpi possano svolgere la propria funzione. Un’altra modalità
di azione effettrice, di neutralizzazione di un patogeno, è la fagocitosi che, oltre ad essere una prerogative
delle cellule dendritiche che tramite questo processo riescono a prendere gli antigeni che devono andare
poi a porre ai linfociti, è anche una prerogativa di cellule come i neutrofili e i macrofagi che, tramite questa
attività fagocitica, neutralizzano e inattivano i microorganismi. Quindi, la fagocitosi è l’internalizzazione di
un microorganismo. Questa è un’attività che si esplica sia contro un microorganismo libero che contro un
microorganismo che ha già infettato una cellula. Parliamo sia di un’attività contro un microbo extracellulare
che di una reattività contro un microorganismo intracellulare. Al contrario, quando invece parliamo di
attività effettrice dei linfociti T, parliamo esclusivamente di attività contro microbi intracellulari, quindi
questa, fondamentalmente, la potete considerare la principale distinzione tra la funzione effettrice degli
anticorpi dei fagociti e quella dei linfociti T: mentre anticorpi e fagociti riconoscono microorganismi anche
quando questi sono presenti nell’ambiente extracellulare, la funzione effettrice dei linfociti T si esplica solo
verso microorganismi che sono stati internalizzati, che sono intracellulari. E questo è molto importante per
la distinzione tra immunità intracellulare ed extracellulare. Voi sapete che il linfocita T riconosce l’antigene
nel complesso MHC, non riconosce l’antigene da solo; quindi capite bene che per essere complessato con le
molecole MHC, l’antigene deve essere internalizzato. Ed è per questo quindi che possiamo dire che
sicuramente i linfociti T riconoscono solo antigeni o microorganismi intracellulari.
Vediamo ora qualche differenza tra immunità innata ed immunità acquisita per capirne meglio anche il
significato. La differenza principale tra questi due tipi di immunità sta nella distinzione tra antigeni e profili
molecolari associati ai patogeni: la immunità innata non riconosce antigeni, cioè non riesce a discriminare
tra i vari microorganismi ma riconosce delle strutture che sono comuni a tanti microorganismi e vedremo
che sono quelli riconosciuti dai PRL; invece, queste strutture sono i PAMP che non sono altro che i profili
molecolari associati ai patogeni. Le PRL sono i recettori mediante i quali l’immunità innata riconosce questi
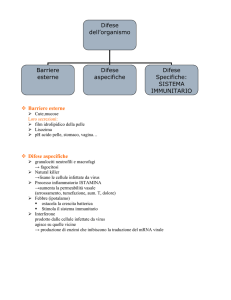
profili. Prima di vedere le cellule coinvolte nell’immunità innata, abbiamo le barriere naturali, quindi,
fondamentalmente, i microorganismi prima di venire in contatto con l’immunità innata, devono superare
queste barriere naturali che adesso vedremo nel dettaglio. Nella immunità innata sono coinvolte anche
altre molecole che sono il sistema del complemento e le citochine. Il sistema del complemento è una serie
di proteine che si attivano a catena e che poi svolgono un’azione nell’attivare l’immunità specifica. Le
citochine le vediamo sempre nell’immunità innata, sono dei mediatori solubili e lo vedremo
successivamente. Le cellule che sono coinvolte sono fagociti(quindi parliamo di macrofagi e neutrofili) poi
cellule dendritiche e cellule NK. Per quanto riguarda l’immunità acquisita, le cellule presentanti l’antigene
fanno da ponte fra questi due tipi di immunità, mentre invece le cellule che sono direttamente coinvolte
sono i linfociti B. Anche in questo caso abbiamo molecole e mediatori solubili: le molecole solubili sono gli
anticorpi, che son prodotti dai linfociti B, ed i mediatori solubili sono le citochine. Quindi, ribadisco, le
citochine sono protagoniste sia della risposta immunitaria innata che di quella acquisita. Ecco, dunque, la
differenza tra i due tipi di immunità: solo l’immunità acquisita riconosce l’antigene mediante i due
fondamentali recettori dei linfociti che sono TCR per quanto riguarda i linfociti T, e il BCR per quanto
riguarda i linfociti B. il BCR dei linfociti B non è altro che un anticorpo di membrana che non viene rilasciato,
non è solubile come gli altri anticorpi, ma rimane sulla membrana e serve al linfocita B per riconoscere il
suo antigene specifico. Quindi, queste sono due strutture che, fondamentalmente, riconoscono gli antigeni
e gli anticorpi sia solubili(rilasciati dal linfocita B) sia di membrana. Le altre strutture del sistema
immunitario non riconoscono antigeni, ma riconoscono i PAMP(che, come detto prima, sta per PathogenAssociated Molecular Pattern) e sono delle strutture molecolari, delle sequenze, comuni a tanti patogeni ,
mentre gli antigeni sono specifici per ogni patogeno e , anzi, uno dei problemi dell’immunità virale è
proprio che spesso i virus modificano così tanto il loro patrimonio genetico che gli antigeni cambiano
sempre e il sistema immunitario deve essere in grado di essere così tanto differenziato da riconoscere
sempre nuovi antigeni. Per quanto riguarda l’immunità innata, una prerogativa è, invece, di andare a
riconoscere strutture che possiamo definire conservate e sono comuni a categorie di vario genere.
Abbiamo visto le barriere naturali, cioè quelle che precedono il contatto del patogeno con il sistema
immunitario. Ma quali sono queste barriere naturali? Facciamo degli esempi. Sicuramente tra le barriere
fisiche possiamo ricordarci il muco che viene prodotto e serve ad impedire l’ingresso dei patogeni, oppure
riconosciamo delle barriere chimiche come il pH acido dello stomaco che rende l’ambiente dello stomaco
poco idoneo alla crescita dei microorganismi. Ancora, abbiamo la produzione di enzimi: in diverse
secrezioni vengono prodotti enzimi antibatterici come, ad esempio, il lisozima. Ancora, vi sono dei peptidi
antimicrobici e molto importanti soprattutto perché oggetto di vari studi nell’ambito della immunità
gastrointestinale, delle mucose e anche dell’immunità dei vaccini perché diverse sono le proposte di utilizzo
della flora batterica come adiuvante nelle immunoterapie, e sono proprio i batteri commensali che fanno
parte della flora batterica intestinale e che, a oggi, vengono chiamati probiotici. In realtà, questi batteri
hanno diversi meccanismi di protezione dalle invasioni dai microorganismi dal tratto gastrointestinale
perché antagonizzano la crescita degli altri batteri, che commensali non sono, sia perché, da studi più
recenti, sembra che questi microorganismi commensali abbiano la capacità di stimolare il sistema
immunitario delle mucose e che i vari batteri probiotici, di cui si parla, in realtà, abbiano delle capacità
diverse, peculiari a ciascun ceppo batterico, di polarizzare e stimolare diversamente la risposta immunitaria
delle mucose: questa è l’importanza dei batteri commensali e di quelli probiotici in generale. Sapete che in
realtà i batteri probiotici stanno entrando nell’uso terapeutico, però l’impiego è abbastanza generico
perché vengono somministrate anche delle formulazioni che contengono mix di vari ceppi batterici. In
realtà, oggi si sa che la flora commensale, quindi i batteri presenti nella flora commensale, hanno delle
peculiarità: non tutti i ceppi stimolano allo stesso modo il sistema immunitario. Quindi, uno degli obiettivi
della ricerca , in questo senso, è quello di stabilire le prerogative dei vari ceppi commensali che
rappresentano comunque una barriera naturale dall’invasione dei microorganismi nel tratto
gastrointestinale. Quindi queste sono degli esempi di barriere naturali.
Un microorganismo, al fine di superare queste barriere naturali, quali vie d’accesso ha a disposizione?
Sicuramente le superfici mucose e questo è il caso del tratto respiratorio(per quanto riguarda i
microorganismi che vengono ad essere inalati), del tratto gastrointestinale e dell’apparato riproduttivo.
L’altra via di ingresso può essere quella degli epiteli. Questa via di ingresso implica che vi sia un’abrasione,
una ferita nell’epitelio, oppure la puntura di insetti.
Cosa succede se, effettivamente, un microorganismo riesce ad attraversare queste barriere naturali e se,
tramite queste vie, riesce a entrare nei tessuti? Si innesca l’immunità innata che, da un po’ di anni a questa
parte, si fa coincidere didatticamente con l’infiammazione che sostanzialmente è una risposta del sistema
immunitario che coinvolge l’immunità innata. Quindi, sostanzialmente, il danno tissutale, che è provocato
dall’ingresso di un microorganismo, attiva l’immunità innata e questa, tramite sia le cellule che tutti i
mediatori visti prima, innesca dei fenomeni che vanno a innescare l’infiammazione. Fondamentalmente, le
caratteristiche di questo fenomeno infiammatorio si possono riassumere come l’aumento della
permeabilità capillare, aumento dovuto sempre a rilascio di istamina(protagonista di questo fenomeno
infiammatorio che approfondirete in patologia). Per adesso potete semplicemente ricordare che vi è questo
rilascio di istamina e questa sostanza aumenta la vasodilatazione e la permeabilità capillare e ciò è
importante per l’innesco della risposta immunitaria innata perché l’aumento della permeabilità capillare
favorisce la migrazione delle cellule dell’immunità innata verso il focolaio infiammatorio. Quindi, capite
bene che ciò coinvolge anche la risposta dell’immunità innata e, di conseguenza, la risposta dei fagociti e
degli altri leucociti. Quindi, vedete come avviene il reclutamento dei leucociti: c’è una prima parte in cui il
leucocita(neutrofili, macrofagi) rotola sull’endotelio e in questa fase vengono ad essere sintetizzate quelle
proteine, come le integrine o le selectine, che favoriscono l’interazione di questo leucocita con le cellule
dell’endotelio. Quindi vi è una fase di adesione che diventa sempre più stabile e dalla fase di interazione
stabile vi è poi l’ultima fase in cui i leucociti attraversano l’endotelio e migrano nel focolaio infiammatorio.
Perciò, sicuramente, in questa fase sono coinvolte sie le integrine che le selectine(prodotte dal leucocita e
trovano il loro recettore sull’epitelio e favoriscono l’adesione del leucocita all’endotelia) e delle molecole
chiamate chemio chine che sono molecole solubili con azione attraente: riescono a richiamare i leucociti a
secondo del grediente di produzione dove, appunto, sono state prodotte. Il leucocita ha dei veri e propri
recettori per le chemiochine che gli permettono di essere sensibile alla chemiotassi. Quindi, le chemiochine
sono le molecole che vengono rilasciate, mentre la chemiotassi è la migrazione che viene indotta nei
leucociti. Abbiamo visto quali cellule vengono ad essere coinvolte nell’immunità innata e abbiamo detto
essere le cellule NK, che approfondirete in seguito, e i fagociti: neutrofili e macrofagi. In sostanza, cosa
fanno i fagociti? Essi, con dei prolungamenti della loro membrana citoplasmatica, che si chiamano
pseudopodi, vanno a inglobare i microorganismi, li internalizzano in delle vescicole chiamate fagosomi che
poi, all’interno del fagocita stesso, vanno a fondersi con delle altre vescicole che si chiamano lisosomi che
contengono al loro interno enzimi litici. Dalla fusione di queste due vescicole, si ottiene il fagolisosoma che
è un’unica vescicola che contiene sia il microorganismo che gli enzimi litici. A questo punto nel fagolisosoma
avviene la distruzione del microorganismo. Questo avviene nei macrofagi e nei neutrofili che sono dei
fagociti effettori, ma anche in parte nelle cellule dendritiche dove però avviene anche la complessazione
con l’NHC di classe 1 e di classe 2 perché, in questo caso, l’internalizzazione delle cellule dendritiche è
sempre consequenziale alla presentazione degli antigeni del microorganismo.
Le fasi sono quindi:
-Riconoscimento
-Formazione del fagosoma
-Formazione del fagolisosoma
-Digestione
Le cellule, di nuovo, che vengono a essere coinvolte sono granulociti neutrofili, monociti macrofagi e cellule
dendritiche. Questo è il paradigma delle cellule dendritiche: dalla periferia dove catturano l’antigene,
migrano nel linfonodo dove presentano quest’antigene ai linfociti T. Quindi, per immunità acquisita si
intende tutto quello che avviene dopo la stimolazione del linfonodo e dei linfociti T naive in grado di
portare una risposta verso i patogeni e di conservare la memoria, prerogativa fondamentale dell’immunità
acquisita. Mentre per quanto riguarda i fagociti, questi riconoscono i batteri, i linfociti devono riconoscere i
batteri soltanto quando questi vengono presentati dalle cellule dendritiche. Quindi, fondamentalmente, le
caratteristiche dell’immunità adattiva sono la specificità, cioè la capacità di riconoscere i singoli
microorganismi, e tale caratteristica ha di implicito che l’ immunità adattiva è un’immunità ampiamente
diversificata: pensate a quanti mln di linfociti devono essere presenti per riconoscere i vari antigeni che
possono essere presentati al nostro sistema immunitario. Questa elevatissima diversificazione prevede che
nel momento in cui l’immunità acquisita deve attivarsi in maniera effettrice ed efficace contro un patogeno,
deve esserci una grande espansione di queste poche cellule che sono specifiche per un determinato
patogeno. Questa è proprio l’espansione clonale, cioè la capacità di un linfocita attivato dal suo antigene
specifico di proliferare in maniera molto veloce per generare cloni di linfociti con la stessa specificità e in
grado di svolgere un’azione effettrice efficace. L’altra prerogativa dell’immunità adattiva è la formazione di
cellule della memoria: quando il linfocita viene attivato dopo la prima esposizione all’antigene, oltre alle
cellule effettrici, il linfocita cede(?) cellule della memoria che vanno ad attivarsi molto precocemente nel
caso di una seconda esposizione all’antigene. Nel caso di una prima esposizione ad un antigene, entro due
settimane dalla esposizione all’antigene vi è una risposta immunitaria primaria già efficace, si ha
un’attivazione completa dell’immunità, verranno tradotte sia cellule effettrici che cellule della memoria in
questa prima esposizione chiamata, appunto, esposizione primaria . tuttavia, l’efficacia di queste cellule
non sarà della stessa intensità come invece sarà la seconda esposizione all’antigene. Infatti, nel caso di una
seconda esposizione al medesimo antigene, l’attivazione sarà più precoce e di intensità maggiore perché
durante l’esposizione primaria all’antigene sono state generate oltre che cellule effettrici, anche cellule
della memoria. Questo è il paragone tra esposizione primaria ed esposizione secondaria a due antigeni. Si
ha l’esposizione primaria ad un antigene X e si ha una debole risposta un po’ più ritardata nel tempo;
l’esposizione secondaria sarà più precoce e più intensa. Se contemporaneamente si somministra un altro
antigene che deve generare una risposta primaria, la risposta a questo antigene sarà comunque più bassa e
paragonabile alla risposta primaria che ha generato l’antigene X. Quindi, vedete la differenza di intensità tra
una risposta primaria ed una secondaria.
Come fasi della risposta immunitaria adattiva vi è una fase di riconoscimento, in cui il linfocita con il suo
recettore T cell receptor o B cell receptor riconosce l’antigene; una fase di attivazione linfocitaria in cui vi è
questa espansione clonale in cui i linfociti proliferano originando cloni che saranno linfociti identici a sé
stessi, linfociti effettori e quindi vi sarà una fase effettrice che, secondo i vari meccanismi visti prima, andrà
ad eliminare l’antigene e poi , tramite citotossicità(parliamo di attività effettrice dei linfociti T citotossici),
produzione di anticorpi( parliamo di attività effettrice dei linfociti B), produzione di citochine(parliamo di
linfociti T helper che hanno come prerogativa funzionale quella di produrre citochine). Quindi, oltre a
questa attività effettrice, vi sarà una produzione di cellule della memoria e la quarta fase della risposta
primaria è proprio la produzione di cellule della memoria. Quindi, quattro fasi: riconoscimento, attivazione
con espansione clonale, funzione effettrice( in cui si distinguono a secondo del linfocita coinvolto un’attività
di produzione di anticorpi per i linfociti B, di citotossicità per i linfociti T citotossici e di produzione di
citochine per i linfociti T helper) e fase di produzione di cellule della memoria che costituiranno un
“bagaglio” che durante una seconda esposizione al patogeno risponderanno in maniera più intensa e
tempisticamente più veloce al patogeno stesso. Vediamo un esempio di queste fasi: riconoscimento, per il
linfocita T, significa riconoscimento sulla cellula dendritica che presenta l’antigene tramite il complesso
maggiore di istocompatibilità che sarà di classe 1 per i linfociti T citotossici, di classe 2 per i linfociti T
helper. Per i linfociti B, invece, sarà mediata dall’anticorpo che è presente sulla loro membrana e che
costituisce il B cell receptor che riconoscerà il microorganismo e si attiverà. Quindi, vedete,
riconoscimento-> attivazione con espansione clonale(verranno prodotte tante cellule uguali, specifiche per
quel determinato antigene)-> attivazione con produzione di anticorpi da parte dei linfociti B e attività
effettrice dei linfociti B. Quindi fase effettrice che darà origine a due tipi di immunità: un’immunità umorale
che coinvolge i mediatori solubili, gli anticorpi; un’immunità cellulare che, invece, coinvolge i linfociti T
citotossici dell’immunità specifica. Quindi, umorale è cellulo-mediata, è la stessa identica distinzione che si
fa nella immunità innata in cui,però, l’attività cellulo-mediata è quella dei macrofagi. Alla fine dell’immunità
specifica abbiamo il declino, l’apoptosi , la morte programmata dei linfociti che fa si che vi possa essere
l’omeostasi del sistema immunitario: un ritorno alle condizioni fisiologiche. Però, insieme al declino, vi sarà
anche la generazione di cellule della memoria che risponderanno nel caso di una seconda infezione.
Abbiamo visto i linfociti B e i linfociti T. Tra i linfociti T distinguiamo i T helper che ormai conosciamo come
CD4+ che fanno le citochine e i CD8+ ovvero i citotossici che, invece, hanno questa azione
effettrice(studierete poi nel dettaglio come si svolge questa azione effettrice per adesso diciamo solo che
con tale azione vanno a distruggere le cellule infettate). I linfociti T helper, di cui ci occuperemo nella parte
finale di questa lezione, sono quelli che hanno come attività funzionale la produzione di citochine. Tra
questi linfociti distinguiamo 3 stadi di attivazione linfocitaria: i linfociti naive, vergini, che non hanno mai
visto l’antigene che chiaramente sono coinvolti solo nella risposta primaria di un antigene; linfociti effettori
che hanno appena visto l’antigene, che sono pronti, efficaci e non possono migrare nel punto in cui devono
svolgere la propria azione effettrice; cellule della memoria. Quando si parla, quindi, di stati di attivazione
linfocitaria, sono questi tre gli stadi: cellule naive, linfociti effettori e della memoria.
I linfociti T e B sono caratterizzati, abbiamo detto, dai due marker differenti CD4 e CD8. Questi ultimi
vengono attivati da stimoli diversi: mentre i CD4 vengono attivati dall’antigene che viene esposto dalle
cellule dendritiche sull’NHC di classe 2, i linfociti CD8 vengono attivati dall’antigene presentato sempre
dalle dendritiche ma su classe 1.
Oggi ci concentreremo su questi CD4: essa può essere distinta in diverse popolazioni in base alle citochine
che le cellule vanno a produrre. Le citochine che le T helper producono servono a direzionare , ad aiutare le
altre cellule dell’immunità acquisita: i linfociti CD8 e i linfociti B. Quindi in base alle citochine che i T helper
producono si può distinguere un subset detto TH1(t helper 1) che produce tante citochine di cui la più
importante, che vi dovete ricordare, è l’interferone gamma. L’altro subset dei linfociti T helper è il T Helper
2 che produce per lo più interleuchina 4. In base a che cosa si ottiene un subset th1-th2? In base al
microambiente in cui si attivano questi linfociti T helper. Per questo, inizialmente, dicevo che è la risposta
innata che determina la polarizzazione della risposta acquisita: in base a quello che si innesca nella risposta
innata, in base al microorganismo e al modo in cui esso è in grado di attivare la risposta innata, si avrà la
polarizzazione della risposta acquisita secondo un t helper 1 o un t helper 2. Vedete infatti come questi due
t helper sono relativi a due tipi di immunità distinti: il t helper 1 attiva una immunità di tipo cellulo mediato
mentre il t helper 2 attiva un’immunità di tipo umorale, con attività di produzione di anticorpi ed eosinofili.
Fondamentalmente, i due tipi di t helper possono polarizzare la risposta immunitaria verso un’immunità
cellulo mediata, piuttosto che verso una risposta umorale. Capite bene che i due tipi di immunità sono
molto differenti tra loro ed ognuno di essi è in grado di rispondere meglio ad un determinato tipo di
patogeno. Sarà proprio il microorganismo, stimolando l’immunità innata a produrre citochine diverse , a
polarizzare la stessa risposta del sistema immunitario specifico più adatta all’eliminazione del
microorganismo stesso. Per questo si parla di polarizzazione del sistema immunitario.
Ora vediamo quello che sono le citochine e poi soffermiamoci nuovamente su questo meccanismo e le
implicazioni nelle patologie immuno mediate. Le citochine sono delle proteine solubili a basso peso
molecolare che si legano con alta avidità ad un determinato recettore. Come tutte le molecole che legano
un recettore, queste citochine, legandosi al proprio recettore specifico, innescano un pathway di
trasduzione del segnale a livello intracellulare che, come risultato ultimo, ha l’attivazione di un gene o di un
gruppo, un cluster di geni che negheranno una reazione ben precisa. Quindi alla fine si ha questa
alterazione dell’espressione genica. Servono a permettere la comunicazione tra le cellule del sistema
immunitario. Possono avere un’azione autocrina, paracrina o endocrina, a secondo che agiscano sulla
cellula stessa che le ha prodotte(modalità autocrina), su una cellula vicina a quella che le ha
prodotte(attività paracrina) o a distanza nel momento in cui vengono prodotte a livello sistemico e nel
sangue raggiungono concentrazioni molto elevate assumendo, tramite il torrente circolatorio, un’azione
sistemica, come ad esempio l’interferone alfa nelle patologie come il lupus edematoso che è una citochina
che raggiunge alti livelli sistemici e quindi svolge un’azione su tutto l’organismo(modalità endocrina). Le
citochine vengono chiamate, oltre i termini più arcaici quali monochine e linfochine, vengono chiamate
interleuchine quando servono a mediare la comunicazione tra i vari leucociti (l’acronimo IL seguito da un
numero sta proprio per INTERLEUCHINA 12, ad esempio) e poi vi sono le chemiochine che sono citochine
particolari, quasi un gruppo a sé stante, sono quelle citochine che vengono rilasciate e svolgono azione
attrattiva, mediano la chemiotassi dei leucociti. Queste citochine possono avere degli effetti pleiotropici,
ovvero una stessa citochina può essere attiva su più cellule diverse e questo è molto comune, infatti si è
tentato di usare queste citochine in terapia, come farmaco ma molto spesso, in questo caso, il problema è
nel fatto che queste citochine hanno effetti diversi su tante cellule ed è difficile che si possa “selezionare”
un effetto desiderato a livello farmacologico in particolare; possono avere effetti ridondanti quando più
citochine hanno lo stesso effetto su una stessa cellula; un effetto sinergico, quando due citochine hanno un
effetto additivo su una stessa cellula ed un ‘azione antagonista quando due citochine, come vedremo oggi,
riescono a mediare azioni completamente opposte l’una dall’altra, andando a spegnere l’attività innescata
dall’altra, in questo caso si parla di effetto antagonista. Poi, molto spesso, hanno un’azione a cascata come
nel caso dell’interferone gamma prodotto dal T helper induce i macrofagi a produrre un’altra citochina che,
in questo caso, è l’IL12 e si parla proprio di meccanismo a cascata di induzione ed è molto , molto comune
nella risposta immunitaria. Quali sono le cellule che producono citochine? Nell’immunità innata sono,
soprattutto, i monociti e le cellule dendritiche. Le citochine nell’immunità innata sono di fondamentale
importanza, infatti, come vedrete, saranno come dei direttori di orchestra, infatti le citochine prodotte
durante l’immunità innata polarizzeranno la risposta durante l’immunità acquisita. Le cellule dell’immunità
innata(dendritiche e macrofagi) produrranno citochine diverse a secondo dello stimolo che ricevono: lo
stimolo ricevuto dalla risposta immunitaria innata, influenzerà, tramite le citochine, la risposta immunitaria
acquisita. Questa è l’importanza dell’immunità innata: essa, in quest’ottica, non è più finalizzata a sé stessa,
solo all’eliminazione del patogeno, ma è anche in grado poi di polarizzare la risposta immunitaria acquisita.
Quindi non è finalizzata solo all’eliminazione del patogeno durante l’immunità innata ma riguarda anche lo
sviluppo e la polarizzazione della risposta immunitaria acquisita.
Le citochine sono coinvolte in diverse funzionalità: ematopoiesi, proliferazione e differenziamento
cellulare. Ci sono alcune citochine tra cui potete ricordarvi, ad esempio, l’interferone gamma, l’IL1 e il TNF
che sono specifiche dell’immunità innata; alcune di queste vengono chiamate pirogeni endogeni, perché
l’immunità innata spesso coincide con le fasi dell’infiammazione e quindi della febbre e queste citochine
sono chiamate pirogeni endogene perché si innalzano quando si ha un rialzo febbrile e sono proprio
citochine classiche dell’immunità innata. Poi, vi sono delle citochine classiche dell’immunità acquisita come,
ad esempio, l’IL2 che stimola l’espansione clonale e citochine che sono attive in entrambe le immunità,
come l’interferone gamma. Un aspetto interessante delle citochine è che esse, di per sé, non sono
specifiche perché una volta che vengono rilasciate a livello extracellulare, potenzialmente, potrebbero
indirizzarsi contro tante cellule. E cos’è che può rendere specifica l’azione di una citochina? È l’espressione
del recettore. Se una cellula non esprime il recettore per una citochina, non è sensibile all’azione della
stessa. Ed ecco che le citochine diventano in realtà dei mediatori specifici. Ad esempio, l’IL2 viene a essere
prodotta dai linfociti quando essi vengono attivati e viene rilasciata nello spazio extracellulare e solo i
linfociti che hanno visto il proprio antigene specifico sono sensibili all’IL2 perché quando vedono il loro
antigene, i linfociti producono il recettore ad alta affinità per l’IL2, divenendo molto sensibili a essa.
Normalmente, il recettore per l’IL2 ha due subunità; quando il linfocita riconosce il suo antigene, comincia a
produrre la terza subunità che è una subunità ad alta affinità. Quali sono i fattori che influenzano le
citochine, quindi? Innanzitutto, l’espressione del recettore , la secrezione che quando avviene nello spazio
tra due cellule, chiamato spazio intersinaptico, è più efficace; poi, le citochine sono influenzate anche dalla
propria emivita che è breve e coincide con l’arco di tempo in cui si svolge quell’azione specifica; inoltre, la
produzione di antagonisti delle citochine. Cosa sono gli antagonisti delle citochine? Spesso sono dei
meccanismi caratteristici dei virus, delle proteine che vengono prodotte dai virus o per mimare l’azione di
una citochina con effetto antagonista o per bloccare l’azione di una citochina e si chiamano antagonisti
delle citochine. Alcuni antagonisti sono come dei “finti” recettori che legano la citochina come fa il
recettore ma non trasducono alcun segnale, oppure vi sono alcune sostanze, prodotte dai virus, che si
legano alle citochine e ne bloccano l’azione. Spesso si parla di decoy receptor che sono recettori solubili
rilasciati nello spazio extracellulare e che blocca l’azione di una citochina perché si legano ad essa come un
recettore vero e proprio e che, però, non essendo sulla membrana della cellula non possono mediare la
trasduzione del segnale. E si parla di antagonisti delle citochine decoy receptor. Spesso, i virus, che cercano
di evadere la risposta del sistema immunitario, producono gli antagonisti delle citochine per bloccare la
comunicazione tra i leucociti, in modo tale da inibire l’immunità. Esistono 4 famiglie, di cui le più importanti
sono quelle del TNF, interferone e delle chemiochine. Poi vi è la famiglia delle ematopoietine che servono a
modulare il differenziamento dei linfociti. Ad esempio, come effetto ultimo della trasduzione del segnale,
mediata dalle proteine intracellulari mediatrici del segnale, si ha una modifica della trascrizione genica.
Le citochine vengono prodotte nell’immunità innata dai monociti e dalle cellule dendritiche ma,
soprattutto, nell’immunità acquisita vengono prodotte dai T helper ed essi si distinguono in T helper 1 e T
helper 2 a secondo delle citochine prodotte. I TH1, che producono interferone gamma, mediano l’immunità
cellulo mediata. Al contrario, i TH2 , che producono interleuchina 4, mediano l’immunità umoralica. Quindi,
sostanzialmente, i TH1 avranno un’azione antiinfiammatoria, con attivazione di queste popolazioni di
neutrofili e macrofagi. Inoltre, i TH1 andranno anche a stimolare degli anticorpi che poi obsolizzeranno i
microorganismi (quindi, ricoprire i microorganismi), rendendoli sensibili alla fagocitosi dei macrofagi e degli
altri fagociti. Quindi, saranno solo degli anticorpi obsolizzanti, finalizzati all’attivazione dell’immunità cellulo
mediata che attiverà i macrofagi. Al contrario, il TH2 andrà a stimolare una reazione allergica con
attivazione di eosinofili e basofili e andrà a stimolare la produzione di anticorpi come gamma 1 ed IgE.
Sostanzialmente, i due tipi di immunità, stimolati da TH1 e TH2, saranno funzionali all’eliminazione di
microorganismi diversi perché una immunità cellulo mediata sarà idonea e ottimale all’eliminazione di
microorganismi intracellulari, mentre l’immunità TH2 sarà funzionale all’eliminazione di microorganismi
extracellulari. Quindi vedete perché è necessario che la risposta innata polarizzi la risposta specifica,
adattiva verso TH1 o TH2: perché proprio in base al microorganismo che stimola la risposta innata si riesce
a polarizzare la risposta helper per avere un’immunità ottimale al tipo di patogeno che l’ha innescata.
Queste due polarizzazioni si dice che sono mutuamente esclusive : l’interferone gamma prodotto dal TH1 va
a inibire la produzione di IL4, inibisce il TH2 con un feedback negativo. Mentre, l’IL4,a sua volta, va a inibire
il subset TH1. Si può vedere come l’immunità innata, stimolata da patogeni diversi possa indurre, nel caso
di antigeni solubili o di parassiti, un’immunità di tipo TH2 e questa sopprime l’immunità TH1. Mentre, un
patogeno intracellulare attiva l’immunità TH1 che spegne, a sua volta, l’immunità TH2. Quindi, sarà il tipo di
patogeno a determinare la polarizzazione del sistema immunitario mediante la stimolazione delle cellule
dendritiche e in base alle diverse citochine indotte dalle cellule dendritiche si avrà una polarizzazione verso
TH1 o TH2. TH1 produce interferone gamma, TH2 produce l’interleuchina 4 soprattutto. L’interferone
gamma, prodotto dal TH1, attiva i macrofagi , l’interleuchina 4, prodotta dal TH2, attiva invece i mastociti ,
gli eosinofili e i linfociti B. TH1 e TH2 producono citochine segregate, diverse, non sovrapponibili, e hanno
funzioni non sovrapponibili: TH1 produrrà interferone gamma soprattutto, TH2 produrrà soprattutto
interleuchina 4, IL5, IL10. Non vi è sovrapposizione tra citochina prodotta da TH1 e citochine prodotte da
TH2. Le funzioni saranno, quindi, sempre segregate: nel TH1 si avrà attivazione dell’immunità cellulo
mediata, macrofagi soprattutto; nel TH2 invece eosinofili e mastociti. Anche i segnali di trasduzione
saranno diversi: diversi mediatori attiveranno TH1 o TH2. Per quanto riguarda l’attivazione dei segnali a
cascata nella trasduzione del segnale, TH1 porta all’attivazione del fattore di trascrizione T-bet che produce
interferone gamma. Per quanto riguarda TH2, TATA 3. Quindi, abbiamo trasduzioni diverse. Alla fine
possiamo concludere che esistono due polarizzazioni: TH1 e TH2. Interferone gamma prodotto da TH1 e
interleuchina 4 prodotto da TH2.
In realtà esiste un’altra polarizzazione di recente scoperta: TH17. L’interleuchina 17 è stata scoperta da un
po’ di anni. TH17 è coinvolto nelle patologie autoimmuni. Tra i vari subset di linfociti cd4+, di cellule T
helper, abbiamo un altro subset che non è T helper, ma T regolatorio che è un subset coinvolto nello
spegnimento della risposta immunitaria. Si chiama T reg ed è caratterizzato dalla positività a questo fattore
di trascrizione chiamato COBS B3(??). Per concludere, abbiamo visto il ruolo fisiologico di questi modelli di
T Helper TH1, TH2. Negli ultimi anni, si è verificato che questo assetto immunitario non è caratteristico solo
a risposte immunitarie di microorganismi, ma caratterizza anche alcune patologie immuno mediate. Si è
visto che molte delle patologie immuno mediate hanno una configurazione ben distinta dei subset TH1,
TH2, quindi si parla di patologie TH1 dominanti o patologie TH2 dominanti. Oggi si son viste, ovviamente,
patologie autoimmuni caratterizzate da un profilo TH17. Ad esempio, per il TH1 possiamo prendere come
esempio il diabete di tipo 1, artrite reumatoide, morbo di Crohn e le malattie infiammatorie dell’intestino:
sono tutte patologie immuno mediate con assetto TH1. Quindi, in base alle citochine che vengono a essere
prodotte in queste malattie, si ha questa distinzione. Come TH2 potete ricordarvi l’allergia e l’asma che
sono gli esempi più caratteristici di una patologia con profilo TH2. Il fatto che le patologie immunomediate
possano essere distinte come TH1 o TH2 ha alcune rilevanze molto importanti nella potenzialità terapeutica
di queste patologie perché spesso nelle nuove terapie di queste patologie si parla di cercare di ripristinare
l’omeostasi , la bilancia tra TH1 e TH2 per ripristinare l’omeostasi delle condizioni patologiche di queste
malattie immuno mediate. Anche la gravidanza, ad esempio, ha un assetto citochimico ben determinato. La
maggior parte delle gravidanze normali hanno una polarizzazione del tipo TH2. Le allergie sono
caratterizzate da questo subset TH2 e le risposte patologiche di network citochimico sono proprio del tipo
TH2. Infatti, una delle terapie delle allergie che è la desinizzazione(non si sentiva bene la parola) si fa
proprio somministrando dosi di antigene sempre più elevate perché provocano uno “shift”, si ripristina
l’omeostasi tra TH1 e TH2 e si porta l’assetto citochimico verso TH1. Anche altri farmaci che vengono
utilizzati sfruttano lo stesso meccanismo. Ad esempio, farmaci che inibiscono il recrutement di eosinofili.
Anche questi poi portano l’assetto citochimico verso TH1. Poi vi è la somministrazione di allergeni che
regola TH1 e T reg. Un ultimo esempio che vi faccio è di patologie, infatti, per quanto riguarda l’artrite
reumatoide che è caratterizzata dall’eccessiva produzione di TNF alfa, è contrastata dalla cosiddetta terapia
anti-TNF alfa che blocca questa citochina andando a bloccare l’eccesso di polarizzazione TH1 mediata da
TNF alfa che si riscontra nei pazienti affetti da artrite reumatoide. Infatti questi pazienti oggi usufruiscono di
questi farmaci: infliximab che è un anti TNF umanizzato e l’enbrel che è uno di quei recettori antagonisti
delle citochine di cui parlavo prima che lega il TNF e lo blocca. In questo modo ripristina l’assetto TH1-TH2.