HER2Club
in gastric cancer
Microscopia Confocale Laser o endomicroscopia, imaging
molecolare
Renato Cannizzaro
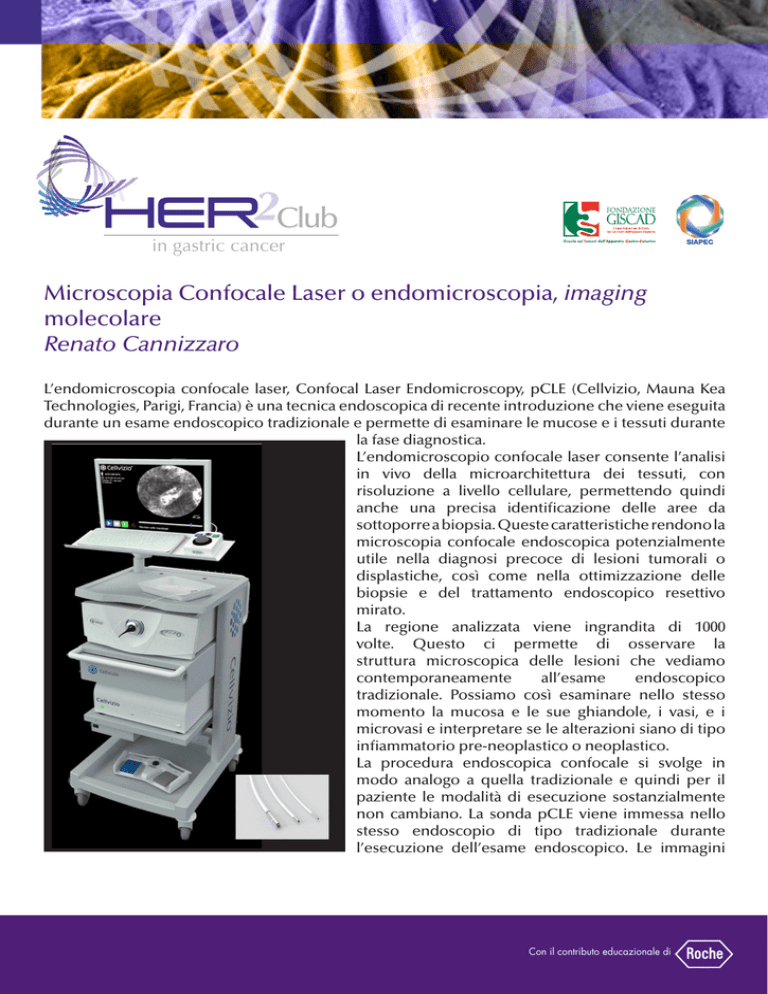
L’endomicroscopia confocale laser, Confocal Laser Endomicroscopy, pCLE (Cellvizio, Mauna Kea
Technologies, Parigi, Francia) è una tecnica endoscopica di recente introduzione che viene eseguita
durante un esame endoscopico tradizionale e permette di esaminare le mucose e i tessuti durante
la fase diagnostica.
L’endomicroscopio confocale laser consente l’analisi
in vivo della microarchitettura dei tessuti, con
risoluzione a livello cellulare, permettendo quindi
anche una precisa identificazione delle aree da
sottoporre a biopsia. Queste caratteristiche rendono la
microscopia confocale endoscopica potenzialmente
utile nella diagnosi precoce di lesioni tumorali o
displastiche, così come nella ottimizzazione delle
biopsie e del trattamento endoscopico resettivo
mirato.
La regione analizzata viene ingrandita di 1000
volte. Questo ci permette di osservare la
struttura microscopica delle lesioni che vediamo
contemporaneamente
all’esame
endoscopico
tradizionale. Possiamo così esaminare nello stesso
momento la mucosa e le sue ghiandole, i vasi, e i
microvasi e interpretare se le alterazioni siano di tipo
infiammatorio pre-neoplastico o neoplastico.
La procedura endoscopica confocale si svolge in
modo analogo a quella tradizionale e quindi per il
paziente le modalità di esecuzione sostanzialmente
non cambiano. La sonda pCLE viene immessa nello
stesso endoscopio di tipo tradizionale durante
l’esecuzione dell’esame endoscopico. Le immagini
Con il contributo educazionale di
endomicroscopiche sono generate mediante l’uso di un agente di contrasto. Per questo motivo,
al momento si somministra per endovena della fluoresceina sodica, già largamente utilizzata in
oftalmologia ed angiografia. È il mezzo di contrasto più adoperato per il basso costo e l’assenza di
effetti collaterali documentati. Dopo la somministrazione endovenosa di 5-10 ml di fluoresceina
sodica al 10%, le cellule, il sistema vascolare e il tessuto connettivo possono essere ben differenziati.
Durante l’acquisizione delle immagini endomicroscopiche il terminale della fibra deve essere
appoggiato delicatamente sulla mucosa/lesione da indagare. Su un monitor vengono mostrate
0,8 o 1,6 immagini endomicroscopiche per secondo che possono essere registrate nel data-base
dell’apparecchiatura.
Recentemente, per il crescente interesse verso l’imaging molecolare, sono stati sviluppati nuovi
agenti di contrasto biomarker specifici (detti anche sonde molecolari). In genere si tratta di peptidi a
basso peso molecolare, con affinità variabile per specifiche strutture, coniugati con la fluoresceina
(per es. anticorpi fluorescenti contro il recettore per il fattore di crescita epidermico - EGFR).
Le principali indicazioni allo studio endomicroscopico sono tutte quelle condizioni in cui è
possibile riconoscere un’alterazione della morfologia cellulare o vascolare degli strati superficiali
della mucosa, in particolare le lesioni displastiche dei vari distretti gastroenterici, compreso il dotto
biliare. L’endomicroscopia consente uno studio dinamico delle strutture della mucosa e della rete
vascolare permettendo, quindi, la valutazione di alcuni meccanismi fisiopatologici in tempo reale.
Stomaco
Diversi studi clinici basati sul confronto con l’esame istologico tradizionale hanno stabilito i criteri
diagnostici confocali per la diagnosi di mucosa gastrica normale, di gastrite cronica con metaplasia
intestinale e di neoplasia. In assenza di patologia, la somministrazione di fluoresceina permette
di identificare nel corpo gastrico una rete di capillari sottoepiteliali a nido d’ape che circonda le
foveole gastriche, mentre nell’antro assumono un aspetto a spirale. Le lesioni neoplastiche precoci
ben differenziate appaiono in genere ipervascolarizzate, con vasi tortuosi e dilatati, di forma
e dimensioni irregolari. Al contrario, il tumore indifferenziato appare ipovascolarizzato, i vasi
presentano dei rami corti e privi di connessione.
In uno studio monocentrico condotto su 31 pazienti con 35 lesioni, l’accuratezza diagnostica
dell’endomicroscopia è risultata significativamente superiore alla diagnosi istologica eseguita
su biopsie standard (94% vs 86%), quando i risultati sono stati confrontati con l’esito istologico
dell’intera lesione post-ESD.
Nella gastrite associata alla presenza di Helicobacter pylori CLE ha dimostrato la presenza di
fuoriuscita di fluoresceina attraverso gli spazi intercellulari. Il trattamento eradicante riduceva
la fuoriuscita di fluoresceina ripristinando una condizione normale. Al contrario, la fuoriuscita
di mezzo di contrasto persisteva in presenza di alterazioni morfologiche, come la metaplasia
intestinale, nonostante il successo della terapia eradicante. In questo contesto CLE ha evidenziato
l’alterata funzione della barriera mucosa in-vivo, fattore che può contribuire in questi pazienti alla
carcinogenesi.
Recentemente sono stati sviluppati anticorpi fluorescenti contro il recettore per il fattore di crescita
epidermico (EGFR) che hanno permesso di studiare in-vivo il cancro gastrico e la possibile risposta
a terapie mirate in modelli animali e ex-vivo su tessuti umani aprendo la strada allo studio di nuovi
marcatori che possano permettere l’utilizzo mirato di farmaci quali il trastuzumab.
Con il contributo educazionale di
L’osservazione endomicroscopica peraltro è time-consuming. Movimenti viscerali peristaltici o
trasmessi (respiro, battito cardiaco) e il notevole ingrandimento della visione possono generare
artefatti. La profondità di esplorazione, limitata al massimo ai 250 micron, non consente di valutare
l’infiltrazione neoplastica della sottomucosa.
Un particolare settore dell’endomicroscopia riguarda lo studio della neoangiogenesi
tumorale. Lo sviluppo di nuovi vasi sanguigni da vasi preesistenti (angiogenesi) è un fenomeno
indispensabile sia in condizioni normali che in situazioni patologiche come la crescita e la
progressione tumorale. I tumori non riescono a crescere oltre i 2 mm a meno che non insorga
un processo angiogenetico. Riuscire ad identificare in tempi relativamente brevi l’insorgenza
di nuovi vasi nell’area intratumorale può essere cruciale per una decisiva e personalizzata
terapia anti-angiogenetica. La fluoresceina che usiamo come mezzo di contrasto si rivela
molto utile nell’evidenziare questi vasi neoformati che si presentano spesso come strutture
piuttosto grandi e tortuose difettose nel flusso e con zone di fuoriuscita (“leakage”). Il quadro
morfologico di neoangiogenesi che abbiamo valutato per una ventina di pazienti era in accordo
con le analisi istologiche e immunoistochimiche, così da permetterci di sviluppare una scala
arbitraria di angiogenesi che riesce a valutare l’estensione dell’angiogenesi intratumorale
basata sull’aumento del numero dei vasi, la presenza di vasi di grandi dimensioni e tortuosi,
con fuoriuscita di fluoresceina e flusso difettoso. Un esempio è riportato nella figura. Anche se
preliminari questi risultati suggeriscono che l’applicazione di questi criteri potrebbe essere utile
nel predire una risposta a terapia anti-angiogenetica o una possibile chemioresistenza durante
il trattamento. Ovviamente è necessario lo studio di ulteriori casi di tumori a diverso grado
per il miglioramento e l’accuratezza diagnostica e la predizione di appropriate e “individuali”
strategie di trattamento.
Con il contributo educazionale di
Didascalia: sono riportate quattro immagini relative al quadro di angiogenesi registrabile con lo
strumento pCLE. Sono visibili in alto a sinistra alcuni vasi tortuosi, a destra un esempio di fuoriuscita
(“leakage”) della fluoresceina utilizzata quale metodo di contrasto; in basso a sinistra è riportato un
vaso di grande dimensione mentre a destra un esempio di flusso sanguigno difettoso.
Bibliografia essenziale
Goetz M, Kiesslich R. Advances of endomicroscopy for gastrointestinal physiology and disease. Am J Physiol Gastrointest Liver
Physiol 2010: 298(6): G797-806.
Wallace MB, Meining A, Canto MI et al. The safety of intravenous fluorescein for confocal laser endomicroscopy in the
gastrointestinal tract. Aliment Pharmacol Ther 2010; 31: 548-52.
Zhang J, Li Y, Zhao Y et al. Classification of gastric pit patterns by confocal endomicroscopy. Gastrointest Endosc 2008; 67: 843-53.
Guo YT, Li YQ, Yu T et al. Diagnosis of gastric intestinal metaplasia with confocal laser endomicroscopy in vivo: a prospective study.
Endoscopy 2008; 40: 547-53.
Liu H, Li YQ, Yu T et al. Confocal endomicroscopy for in vivo detection of microvascular architecture in normal and malignant
lesions of upper gastrointestinal tract. J Gastroenterol Hepatol 2008; 23: 56-61.
Hoetker MS, Kiesslich R, Diken M et al. Molecular in vivo imaging of gastric cancer in a human-murine xenograft model: Targeting
epidermal growth factor receptor (EGFR). Gastrointest Endosc 2012; 76: 612-20.
Li Z, Zuo XL, Li CQ et al. In vivo molecular imaging of gastric cancer by targeting MG7 antigen with confocal laser endomicroscopy.
Endoscopy 2013; 45: 79-85.
Cannizzaro R, et al. Endomicroscopy and Cancer: A New Approach to the Visualization of Neoangiogenesis. Gastroenterology
Research and Practice Volume 2012, Article ID 537170, 5 pages doi: 10.1155/2012/537170.
Trovato C, Crosta C. L’uso della endomicroscopia confocale laser GIE 2013, Volume: 36, pgg: 271-277.
Con il contributo educazionale di