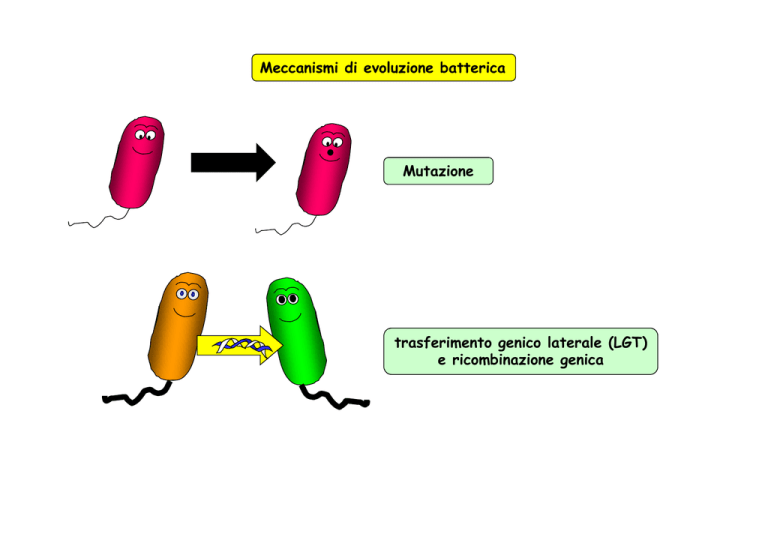
Meccanismi di evoluzione batterica
Mutazione
trasferimento genico laterale (LGT)
e ricombinazione genica
Nel cromosoma batterico
possono verificarsi
MUTAZIONI
La sequenza delle basi nel
genoma di un organismo
cambia in modo ereditario
I cambiamenti genetici provocati dalle
mutazioni sono di entità limitata
Il fenotipo corrispondente alla
sequenza normale è “selvatico” (wild)
Le mutazioni provocano la
comparsa di “mutanti”
wild
mutante
normale
Sostituzione silente
Sostituzioni, inserzioni,
delezioni
MUTAZIONI
sostituzione
UNA BASE
(puntiformi)
microinserzione
microdelezione
MOLTE PAIA DI BASI
DELEZIONI: provocano la perdita di centinaia
o migliaia di paia di basi
non revertono (a meno di ricombinazioni)
INSERZIONI: aggiungono nuove basi inattivando il gene in cui accadono
sono spesso dovute a sequenze di DNA specifiche, lunghe 700-1400 bp,
(sequenze di inserzione). Le mutazioni da inserzione possono revertere.
RETROMUTAZIONE
ripristino del fenotipo wild
Revertante dello
stesso sito
seconda mutazione
nello stesso sito
Reversione di
“frameshift”
Reversione di
“nonsense”
ripristino della sequenza
nucleotidica “wild”
REVERSIONE VERA
SOPPRESSIONE
ripristino del fenotipo wild
mutazione in un
ALTRO sito
La seconda mutazione COMPENSA
l’effetto della prima
Altro sito stesso gene:
ripristino di “frameshift”
Altro gene
Ripristino della funzione
del gene mutato
Altro prodotto che sostituisce
quello del gene mutato
Sostituzione di una base
AG
GA
TC
CT
5’...TAC...
...ATG...5’
TRANSIZIONE
AG
TC
TC
AG
TRASVERSIONE
Replicazione normale
TAC
ATG
UAC (Tyr)
mutazione
AAC
TTG
AAC (Asp)
mutazione
TAG
ATC
UAG (Stop) Proteina tronca
Mutazione nonsenso
mutazione
TAT
ATA
UAU (Tyr)
Proteina difettosa
Mutazione missenso
Proteina normale
Mutazione silente
LE MUTAZIONI
POSSONO ESSERE
OCCASIONALI
ERRORI DI LETTURA
INDOTTE DA AGENTI
CHIMICI O FISICI
ORIGINATE DA
SISTEMI DI
RIPARAZIONE
Che le mutazioni abbiano un’origine spontanea lo dimostra il
TEST DI FLUTTUAZIONE
TERRENO
CON
ANTIBIOTICO
TERRENO
SENZA
ANTIBIOTICO
REPLICA-PLATING
MUTAGENI CHIMICI-1
ANALOGHI DELLE BASI
O
O
CH3
H N
Br
H N
Es. 5-BrU: a differenza della Timina,
il suo legame con ”G” è stabile
O
O
H
H
Timina
H2N
N
N H
5-BromoUracile
H2N
N
N
Adenina
N H
N
N
C
G
N
G
2-Aminopurina
5-BrU
5-BrU
A
A
T
A:T Æ G:C
MUTAGENI CHIMICI-2
trasformano le basi alterandone
le proprietà di appaiamento
AGENTI ALCHILANTI
Inducono mutazioni con frequenza
molto più alta degli analoghi delle basi
Nitrosoguanidina, Acido nitroso,
Idrossilamina; etilmetanosulfonato
A
Es acido nitroso deamina:
U
citosina
uracile
adenina
ipoxantina
C
IPX
MUTAGENI CHIMICI-3
AGENTI INTERCALANTI
Arancio di acridina, proflavina;
bromuro di etidio
si inseriscono tra due basi
del DNA, separandole
Causano lo slittamento della DNA polimerasi, provocando
microinserzioni e microdelezioni durante la replicazione
Molti composti chimici possono
essere mutageni (cancerogeni)
IL TEST DI AMES
+
Salmonella
His-
controllo
+ Composto
da analizzare
Pochi
retromutanti
Frequenza aumentata:
il composto E’
MUTAGENO
Frequenza invariata
Il composto NON è
mutageno
Terreno privo
di istidina
Terreno privo
di istidina
Terreno privo
di istidina
MUTAGENI FISICI-1
RADIAZIONI NON
IONIZZANTI (UV)
I nucleotidi assorbono i raggi UV
con picco a a 269 nm
T
T
C
C
UV260 provoca la formazione di
DIMERI di PIRIMIDINE
Tra due C o T adiacenti si
formano legami covalenti
i dimeri aumentano la probabilità che la DNA
polimerasi inserisca un nucleotide errato
MUTAGENI FISICI-2
Radiazioni ionizzanti
Radiazioni a onda corta
molto penetranti
RAGGI
gamma
ionizzazione di H2O e
altre sostanze
X
cosmici
radicali liberi es OH-
azione mutagena
indiretta
ELEVATA FREQUENZA DI MUTAZIONI
MALFUNZIONAMENTO
DELLA CELLULA
ECCESSIVA DERIVA
DELLA POPOLAZIONE
LA FREQUENZA DELLE MUTAZIONI OCCASIONALI E’
LIMITATA DALL’AZIONE DELLA CORREZIONE DI BOZZE E
DEL SISTEMA MMR (CNFR DUPLICAZIONE DEL DNA)
ALCUNI DANNI PROVOCATI DAGLI AGENTI
MUTAGENI RENDONO IMPOSSIBILE LA
DUPLICAZIONE DEL DNA
SISTEMI DI RIPARAZIONE
Riparazione DNA
diretta
Riparazione della base
modificata
Es. Metilguanina transferasi
CH3
O
HN
H2N
N
N
Trasferisce su di sé
il gruppo metile
N
H
Guanina
Separazione dei
dimeri di pirimidine
Assorbe radiazioni
nel visibile
(fotoliasi)
TT
TT
Rompe i legami covalenti e
ricostruisce la struttura corretta
RISPOSTA SOS
DANNO AGLI ACIDI NUCLEICI
(UV o ROS)
Blocco della forca replicativa
nel punto del danno
ssDNA
Attività di co-proteasi
su LexA
Espressione coordinata di
diversi pathway (>30 geni)
Avvio di autoproteolisi
in LexA
Blocco della repressione
Rec-A
Rec-A*
LexA reprime molti
geni tra cui
parziale
RecA
recA
parziale
Error-free
uvrA
LexA
lexA
Error-prone
umuCD
IN CONDIZIONI NORMALI recA e lexA sono trascritti e
tradotti a bassa concentrazione
Le cassette SOS a monte di geni diversi hanno affinità differenti per il repressore
Non indotta
parzialmente indotta
pienamente indotta
recA
recA
recA
lexA
lexA
lexA
uvrA
uvrA
uvrA
sulA
sulA
sulA
umuCD
umuCD
umuCD
dinD
dinD
dinD
Riparazione DNA
Indiretta (escissione e ricostruzione)
La base mutata è estratta e
sostituita con quella giusta
Es: DNA-glicosilasi individua
l’uracile derivato dalla deaminazione
della citosina e lo rimuove
U
Il “vuoto” è chiamato sito “AP”
dC
U
AP-endonucleasi e
deossiribofosfodiesterasi introducono
la base corretta nel sito AP
dC
La DNA polimerasi stabilizza
la base nell’elica
SINTESI TRANS-LESIONE
Le DNA-mutasi inseriscono un nucleotide qualsiasi
corrispondenza di una lesione
x
E proseguono la sintesi
x
Quando il DNA è riparato
non ci sono più ssDNA
RecA si disattiva
La proteolisi di LexA
cessa
I sistemi di
riparazione tornano
ad essere repressi
I diversi geni hanno affinità differenti
per il repressore
diversa affinità dei
promotori per LexA
Induzione in quantità e in TEMPI diversi
I sistemi error free (es. uvrA) sono
indotti precocemente
Pieno successo: riparazione e
cessazione del segnale
Tasso di mutazione contenuto
Insufficienti a contenere il danno
Il segnale prosegue, sono indotte le
polimerasi error prone
(Pol. V e IV: DNA-MUTASI)
La frequenza di mutazione aumenta Æ maggiore variabilità Æ maggiori
possibilità di sopravvivenza di fronte a uno stress esteso
Mentre la riparazione procede, la risposta
SOS blocca la divisione cellulare
SulA, normalmente represso
da LexA, si esprime
SulA
Si lega a FtsZ e impedisce la
formazione dell’anello
F
F
F
A riparazione completa, la
repressione si ripristina
SulA
F
F
F
La proteasi Lon degrada SulA liberando
FtsZ e la divisione ricomincia
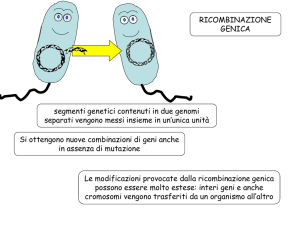
RICOMBINAZIONE
GENICA
segmenti genetici contenuti in due genomi separati
vengono messi insieme in un’unica unità
Si ottengono nuove combinazioni di geni anche in
assenza di mutazione
Le modificazioni provocate dalla ricombinazione genica
possono essere molto estese: interi geni e anche
cromosomi vengono trasferiti da un organismo all’altro
RICOMBINAZIONE
omologa
Riarrangiamento genico tra
vaste sequenze omologhe
L’orientamento dei
frammenti omologhi
opposto
uguale
Inversione di segmenti
a b c
c b a
perdita di materiale
genetico
a b c
a b c
a
b
c
c b a
a b c
a
b
c
a b c
a b c
a b c
a b c
RICOMBINAZIONE
SITO SPECIFICA
Caratterizzate da
sequenze particolari
Trasposizione
Avviene in corrispondenza
di brevi regioni omologhe
Integrazione di
genomi virali
Integrazione di
cassette geniche
In una popolazione batterica le mutazioni casuali
avvengono con frequenza bassa ma costante
(10-7 10-11 / n° bp)
Se i cambiamenti nell’ambiente superano le capacità di
adattamento, l’unica possibilità di sopravvivenza è
l’acquisizione rapida di nuove caratteristiche
Nella maggior parte dei casi le mutazioni casuali non
sono sufficienti e la risposta al problema è
l’ACQUISIZIONE DI GENI dall’esterno
!
Il passaggio di geni tra microrganismi diversi, è detto
TRASFERIMENTO GENICO ORIZZONTALE
In contrapposizione al
TRASFERIMENTO VERTICALE
(passaggio di un gene da una
cellula alla propria progenie)
Il risultato di uno scambio genico tra
procarioti, è un genoma parzialmente
diploide, che si definisce MEROZIGOTE
donatore
Il DNA trasferito
si dice esogenote
merozigote
esogenote
endogenote
Il genoma del ricevente
è l’endogenote
MOBILITA’ GENICA NEI BATTERI
A differenza di quanto accade negli Eucarioti che si riproducono
sessualmente, per i Procarioti non è previsto uno scambio genico tra
individui diversi ad ogni generazione
IL TRASFERIMENTO GENICO ORIZZONTALE
che permette sia il trasferimento di geni sia la
ricombinazione, è importante per...
B
evoluzione batterica
disseminazione
di geni di resistenza
A
RES
T
Scambio di geni
metabolici
E
disseminazione
di geni di virulenza
VIR
degradazione
Le possibili strategie con cui materiale genetico passa da
un batterio all’altro sono tre:
1-TRASFORMAZIONE
DNA LIBERO VIENE ACQUISITO E
INTEGRATO NEL GENOMA DELLA
CELLULA BATTERICA RICEVENTE
2-CONIUGAZIONE
IL MATERIALE GENICO PASSA PER CONTATTO
DIRETTO TRA UN BATTERIO E L’ ALTRO
3-TRASDUZIONE
IL TRASFERIMENTO E’ MEDIATO
DA BATTERIOFAGI
CARATTERISTICHE COMUNI
ALLE TRE STRATEGIE
Il trasferimento del
cromosoma è PARZIALE
Il trasferimento è POLARE
(DonatoreÆRicevente)
Il prodotto del trasferimento
è un MEROZIGOTE
L’esogenote è trasmesso alla progenie
SOLO SE SI INTEGRA con l’endogenote
Questa regola cade se l’esogenote è
un plasmide
TRASFORMAZIONE
Fenomeno scoperto da Griffith 1928 su
Pneumococcus
“S”: capsulato e virulento
UCCIDE
“R” non capsulato e
avirulento NON
UCCIDE
+
“S” ucciso+ R vivo
UCCIDONO
1944 AVERY DIMOSTRA “IN VITRO” CHE IL
FATTORE TRASFORMANTE E’ IL DNA
Il ceppo isolato è “S”:
UCCIDE
DNA estratto e
purificato da “S”
proteine estratte e
purificate da “S”
+ R
+ R
Il ceppo isolato è “R”:
NON UCCIDE
Il DNA esterno viene internalizzato nella cellula ospite, integrato
nella regione omologa del cromosoma e trasmesso alla progenie
Per l’internalizzazione la cellula deve essere
“competente” : capace di trasportare grandi
mmolecole di DNA attraverso parete e membrana
Streptococcus
Poche specie sono
naturalmente competenti
Diverse specie
ambientali
Bacillus
Haemophilus
Neisseria
la competenza è regolata e si manifesta in condizioni
ambientali particolari o in una fase di crescita specifica
Nei didermi la competenza si
sviluppa indipendentemente nei
diversi individui
Nei monodermi la competenza è
regolata da uno scambio di
messaggi chimici (feromoni)
all’interno di una popolazione
Quando una cellula è competente:
Il DNA trasformante vi si lega e si internalizza
dsDNA
lineare
Si integra nel cromosoma
(ricombinazione omologa)
e si esprime
PLASMIDE
si replica e
si esprime
COMPETENZA ARTIFICIALE
Può essere ottenuta con shock
CaCl2
chimici
(Cloruro di calcio o rubidio)
elettrici
(elettroporazione)
I PLASMIDI
Sono elementi genetici capaci
di replicarsi in modo
AUTONOMO (repliconi)
Hanno dimensioni molto variabili
I plasmidi che possono trovarsi
integrati nel cromosoma oltre che
liberi nel citoplasma si dicono episomi
Poche copie (stringenti)
Possono essere presenti nella
cellula batterica
Molte copie (rilassati)
L’ informazione genetica portata dai
plasmidi non è essenziale per la cellula
ma può conferire un vantaggio selettivo
in particolari condizioni ambientali
Plasmidi di virulenza: aumentano
l’efficienza dei patogeni
Plasmidi R: codificano enzimi
capaci di distruggere o
modificare gli antibiotici
Plasmidi Col: codificano batteriocine
(antagonizzanti contro cellule della
stessa specie o di specie affini)
Plasmidi metabolici: codificano
enzimi capaci di degradare composti
aromatici, pesticidi, zuccheri…
INCOMPATIBILITÀ
Plasmidi con la stessa regolazione
della replicazione NON possono
coesistere nella stessa cellula
I plasmidi regolano la
propria replicazione
Appartengono allo stesso GRUPPO
di INCOMPATIBILITA’ (Inc)
Due plasmidi dello stesso gruppo
segregano (si dividono tra le cellule
figlie) durante i cicli di divisione
In una cellula batterica possono coesistere
plasmidi di gruppi Inc differenti
Molti plasmidi a basso numero di copie assicurano
il proprio mantenimento nella cellula
Nel plasmide R1 il gene hok codifica una proteina
che forma buchi nella membrana citoplasmatica
il sok mRNA si appaia con l’hok mRNA;
il duplex è distrutto da una RNAsi
hok mRNA: emivita 20 min
hok
sok
sok mRNA: emivita < 1-2 min
Se il plasmide viene perso, l’hok mRNA può essere tradotto
perché degrada più lentamente del sok mRNA
Sul plasmide F, il gene ccdB codifica una
proteina che interferisce con la DNA girasi
Il veleno CcdB è una proteina molto stabile
ccdA
72 AA
ccdB
101 AA
Sul plasmide è anche presente il gene ccdA il cui
prodotto blocca CcdB
L’antidoto però si degrada molto facilmente: se il
plasmide viene perso, il veleno sopravvive all’antidoto
CONIUGAZIONE
Trasferimento diretto
mediato da plasmidi
I pili sessuali (1-10/ cellula)
sono spessi 9-10 nm
Alcuni plasmidi sono trasmessi solo alla progenie, altri (AUTOTRASMISSIBILI
o CONIUGATIVI) possono trasferirsi orizzontalmente per coniugazione
Un esempio tipico di plasmide
autotrasmissibile è il
Regione Tra
F
H
G
SD I
IS3
FATTORE F
gd
Elementi
Trasponibili
IS3
C
B
F
K
E
94 Kb
L
A
IS2
Regione
silente
J
oriT inc, rep
Regione della
replicazione
Stabilizzazione della coppia
coniugativa
Regione tra
Regolazione del
trasferimento
sintesi e assemblaggio del
pilo coniugativo (pilo F)
Metabolismo del DNA
coniugativo
F+
F-
F
La cellula con il
fattore F (F+) è il
donatore
La cellula senza
fattore F (F-) è il
ricevente
Il fattore F dirige la formazione di un ponte
coniugativo tra le due cellule della coppia
ponte coniugativo
Viene trasferito un
filamento singolo di F
F-
F+
Il filamento complementare viene
sintetizzato nel ricevente, che diventa F+
F+
F+
Anche nella cellula F+ la singola
elica restante viene replicata
Se il fattore F si integra nel cromosoma batterico, dirige
il trasferimento di parte del cromosoma al ricevente
HFR
I ceppi in cui il fattore F è integrato si
chiamano Hfr (High frequency ricombination)
L’integrazione avviene in corrispondenza di pochi siti
accomunati da una corta sequenza nucleotidica specifica
non è definitiva; in una popolazione
esistono cellule Hfr e cellule F+
HFR
F+
Il trasferimento comincia da OriT e si svolge come
per F, ma prosegue con i geni del cromosoma
HFR
FOriT
F-
F
La quantità di cromosoma trasferita dipende dal
tempo di contatto tra HFR e FHFR
HFR
Il donatore resta Hfr; il ricevente lo diventa
SOLO se il trasferimento è completo
Il ricevente NON diventa Hfr a meno che non venga
trasferito l’intero cromosoma
HFR
FOriT
F
a meno che non venga
trasferito l’intero cromosoma
HFR
HFR
F
In genere questo NON accade e nel
ricevente passano solo geni cromosomici
Che si integrano poi nel cromosoma con
una doppia ricombinazione
HFR
F--
Il ricevente rimane F-
Nel passaggio HfrÆF+, il processo di escissione
di F è normalmente preciso
lac
ton
lac
sxt
F ’
lac
ton
sxt
nel cromosoma si crea
una delezione
Ma a volte può accadere che un frammento di
cromosoma adiacente all’episoma si stacchi con esso
In questo caso, il plasmide F porta
con sé geni cromosomici (F’)
IN UN INCROCIO F’x F-
F-
Il donatore resta F’
Il ricevente diventa F’
IL RICEVENTE DIVENTA PARZIALMENTE DIPLOIDE
(MEROZIGOTE) PER I GENI PRESENTI SU F’
Plasmidi privi di capacità di autotrasmissione possono essere trasferiti (Mobilizzati)
se nella stessa cellula è presente un plasmide autotrasmissibile (Helper) che
provvede alla sintesi del pilo
H
M
M
M
I plasmidi mobilizzabili possiedono la regione OriT, ma mancano
di alcune funzioni, che sono vicariate dal plasmide helper
I plasmidi che non possiedono OriT, non possono essere
trasferiti in alcun caso
TRASPOSIZIONE
E’ LO SCAMBIO DI MATERIALE GENETICO TRA REPLICONI DIVERSI
Cromosoma
Plasmide
O LO SPOSTAMENTO TRA SEDI DIVERSE DELLO STESSO REPLICONE
Cromosoma
Gli elementi trasponibili sono sequenze che hanno la capacità di spostarsi e di
integrarsi con una ricombinazione sito specifica, in corrispondenza di siti bersaglio
L’inserzione richiede l’intervento di enzimi specifici
i più semplici sono le SEQUENZE DI
INSERZIONE (IS) :
IR
210 bp
InsA
273 bp
InsB
IR
contengono solo i geni per il proprio
trasferimento (trasposasi)
768 bp
sono caratterizzate da “Inverted
repeat” alle estremità
Sono comuni sia sul cromosoma che su plasmidi
Le IS sono anche chiamate “DNA egoista” ma possono avere una influenza
notevole sull’espressione genica di un ceppo batterico
IS
Sono fiancheggiate da promotori forti, diretti verso
l’esterno, che possono sostituirsi a promotori regolati
promotore
IS
O possono inserirsi all’interno di geni
bersaglio e interromperli inattivandoli
P
gene 1
gene 2
gene 3
IS
Se la trasposizione avviene in un operone si
osserva un effetto “polare” con la mancata
espressione anche dei geni 2 e 3
Quando due IS fiancheggiano un segmento di DNA
IR
IR
IR
IR
Si forma un trasposone composito, che si muove come un elemento
unico, portando con sé anche i geni compresi tra le due IS
I trasposoni si inseriscono a livello di determinate
sequenze di riconoscimento, con meccanismo:
REPLICATIVO
(Es Tn3)
CONSERVATIVO
(es. Tn10)
Pant
intI
5’-CS
INTEGRONI:
attI
sulI
3’-CS
regioni formate da cassette geniche situate a valle di una regione
conservata che codifica una ricombinasi e include un promotore forte
(Pant) e un sito di ricombinazione (attI)
I geni delle cassette non hanno promotore, entrano tutti nello
stesso orientamento, e sono co-trascritti da Pant
Le cassette di resistenza si integrano con un processo di
ricombinazione sito specifico, in corrispondenza del sito attI
Prom.
attI
int
R1
R2
R3
attC
X
int
X
R1
il sito della cassetta che si ricombina
con attI è detto “elemento 59bp”
R2
R3
Conservativo: trasposizione semplice (taglia e cuci)
La trasposasi taglia i due filamenti in modo
sfalsato in corrispondenza di ripetizioni invertite
AT
TA
CAGT ACTG
GTCA TGAC
GT
GTCA
TA
AT
ACGT
TG
Anche il DNA ospite è tagliato in modo
sfalsato in corrispondenza del sito bersaglio
TA
TA
AT
AT
Il trasposone è legato al DNA ospite, alle
due estremità, lasciando dei vuoti
GT
AT GTCA
ACGT TA
TG
I vuoti vengono riparati e il sito
bersaglio si duplica
CA GT
AT GTCA
TA
ACGT TA
TGAC AT
Nella replicazione replicativa la trasposasi
taglia i filamenti in modo sfalsato
I filamenti si legano formando
un COINTEGRATO
E vengono risolti: una copia del trasposone
è presente su ciascuna struttura
Trasferimento laterale..anche senza trasferimento genico
Nanotubuli che connettono
S.aureus/S. aureus
Nanotubuli che connettono
S.aureus/B.subtilis
Nanotubuli che connettono
Anche con un diderma
È stato possibile osservare il passaggio di molecole
fluorescenti da un citoplasma all’altro
CmR:
Gene cat
mRNA cat
Proteina (CAT)
LinR:
Gene erm
mRNA
Proteina ERM
Attraverso i nanotubuli proteine e
mRNA e passano tra le due cellule,
che mostrano un doppio fenotipo R
ma un assetto genico invariato
Gene cat
mRNA erm + cat
Proteine ERM e CAT
CmR +
LinR
Gene erm
mRNA erm + cat
Proteine ERM + CAT







![mutazioni genetiche [al DNA] effetti evolutivi [fetali] effetti tardivi](http://s1.studylibit.com/store/data/004205334_1-d8ada56ee9f5184276979f04a9a248a9-300x300.png)