Lezioni
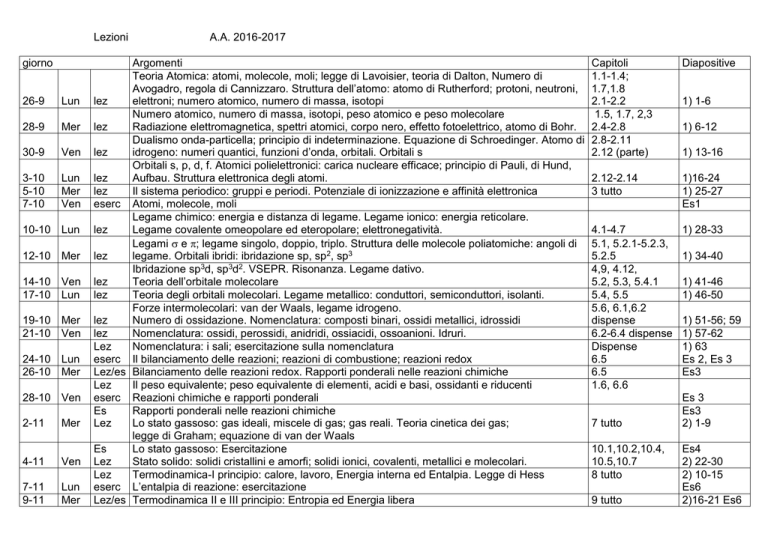
giorno
26-9
Lun
28-9
Mer
30-9
Ven
3-10
5-10
7-10
Lun
Mer
Ven
10-10 Lun
12-10 Mer
14-10 Ven
17-10 Lun
19-10 Mer
21-10 Ven
24-10 Lun
26-10 Mer
28-10 Ven
2-11
Mer
4-11
Ven
7-11
9-11
Lun
Mer
A.A. 2016-2017
Argomenti
Teoria Atomica: atomi, molecole, moli; legge di Lavoisier, teoria di Dalton, Numero di
Avogadro, regola di Cannizzaro. Struttura dell’atomo: atomo di Rutherford; protoni, neutroni,
lez
elettroni; numero atomico, numero di massa, isotopi
Numero atomico, numero di massa, isotopi, peso atomico e peso molecolare
lez
Radiazione elettromagnetica, spettri atomici, corpo nero, effetto fotoelettrico, atomo di Bohr.
Dualismo onda-particella; principio di indeterminazione. Equazione di Schroedinger. Atomo di
lez
idrogeno: numeri quantici, funzioni d’onda, orbitali. Orbitali s
Orbitali s, p, d, f. Atomici polielettronici: carica nucleare efficace; principio di Pauli, di Hund,
lez
Aufbau. Struttura elettronica degli atomi.
lez
Il sistema periodico: gruppi e periodi. Potenziale di ionizzazione e affinità elettronica
eserc Atomi, molecole, moli
Legame chimico: energia e distanza di legame. Legame ionico: energia reticolare.
lez
Legame covalente omeopolare ed eteropolare; elettronegatività.
Legami e ; legame singolo, doppio, triplo. Struttura delle molecole poliatomiche: angoli di
lez
legame. Orbitali ibridi: ibridazione sp, sp2, sp3
Ibridazione sp3d, sp3d2. VSEPR. Risonanza. Legame dativo.
lez
Teoria dell’orbitale molecolare
lez
Teoria degli orbitali molecolari. Legame metallico: conduttori, semiconduttori, isolanti.
Forze intermolecolari: van der Waals, legame idrogeno.
lez
Numero di ossidazione. Nomenclatura: composti binari, ossidi metallici, idrossidi
lez
Nomenclatura: ossidi, perossidi, anidridi, ossiacidi, ossoanioni. Idruri.
Lez
Nomenclatura: i sali; esercitazione sulla nomenclatura
eserc Il bilanciamento delle reazioni; reazioni di combustione; reazioni redox
Lez/es Bilanciamento delle reazioni redox. Rapporti ponderali nelle reazioni chimiche
Lez
Il peso equivalente; peso equivalente di elementi, acidi e basi, ossidanti e riducenti
eserc Reazioni chimiche e rapporti ponderali
Es
Rapporti ponderali nelle reazioni chimiche
Lez
Lo stato gassoso: gas ideali, miscele di gas; gas reali. Teoria cinetica dei gas;
legge di Graham; equazione di van der Waals
Es
Lo stato gassoso: Esercitazione
Lez
Stato solido: solidi cristallini e amorfi; solidi ionici, covalenti, metallici e molecolari.
Lez
Termodinamica-I principio: calore, lavoro, Energia interna ed Entalpia. Legge di Hess
eserc L’entalpia di reazione: esercitazione
Lez/es Termodinamica II e III principio: Entropia ed Energia libera
Capitoli
1.1-1.4;
1.7,1.8
2.1-2.2
1.5, 1.7, 2,3
2.4-2.8
2.8-2.11
2.12 (parte)
Diapositive
2.12-2.14
3 tutto
1)16-24
1) 25-27
Es1
4.1-4.7
5.1, 5.2.1-5.2.3,
5.2.5
4,9, 4.12,
5.2, 5.3, 5.4.1
5.4, 5.5
5.6, 6.1,6.2
dispense
6.2-6.4 dispense
Dispense
6.5
6.5
1.6, 6.6
1) 28-33
7 tutto
10.1,10.2,10.4,
10.5,10.7
8 tutto
9 tutto
1) 1-6
1) 6-12
1) 13-16
1) 34-40
1) 41-46
1) 46-50
1) 51-56; 59
1) 57-62
1) 63
Es 2, Es 3
Es3
Es 3
Es3
2) 1-9
Es4
2) 22-30
2) 10-15
Es6
2)16-21 Es6
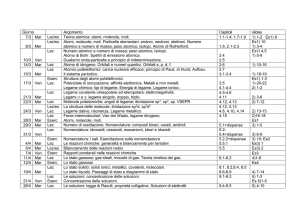
giorno
11-11 Ven
Lez
14-11 Lun
16-11 Mer
Lez/es
Lez
eserc
18-11 Ven
Lez
23-11 Mer
25-11 Ven
Lez
Eserc
Eserc
Lez
28-11 Lun
Lez/es
30-11 Mer
2-12
Ven
5-12
Lun
7/12
Mer
12/12
12/12
Lun
Lun
14/12
Mer
16/12
Ven
19/12
19/12
Lun
Lun
21/12
Mer
Lez/es
Eserc
Eserc
Lez
Lez
Lab
Lez/es
Lez
Lez
eserc
Eserc
Lez
Lab
Eserc
Lez
Argomenti
Stato Liquido. Tensione di vapore.
Passaggi di stato e diagrammi di stato. Equazione di Clausius-Clapeyron
Le soluzioni: termodinamica della formazione delle soluzioni
Le soluzioni: concentrazione delle soluzioni; tensione di vapore, legge di Raoult, distillazione
Deviazioni positive e negative dalla legge di Raoult.
Proprietà colligative. Soluzioni di elettroliti.
Cinetica Chimica: velocità di reazione, costante di velocità, ordine di reazione; reazioni di 1 e
2° ordine. Energia di attivazione, equazione di Arrhenius; catalizzatori.
Costanti di velocità e costante di equilibrio
Equilibrio chimico: energia libera e costante di equilibrio; costanti di equilibrio K P, Kc; principio
di Le Chatelier. Effetto della temperatura sulla costante di equilibrio
L’equilibrio chimico in fase gassosa: esercitazione
L’equilibrio chimico in fase gassosa: esercitazione
Reazioni acido-base: definizioni di Arrhenius, Bronsted e Lowry, Lewis. Autoprotolisi
dell’acqua: prodotto ionico, scala di pH e pOH
Reazioni acido-base: Soluzioni di acidi e basi forti e deboli, mono- e poliprotici.
Fattori che influenzano la forza degli acidi
Reazioni acido-base: Idrolisi. Soluzioni tampone.
Reazioni acido-base: esercitazione
Reazioni acido-base: esercitazione
Titolazioni acido base: acido forte-base forte, base forte-acido forte, acido debole-base forte,
base debole-acido forte; titolazione di acidi poliprotici
Indicatori acido-base
Equilibri di solubilità; prodotto di solubilità; effetto dello ione a comune
Esperienza di Laboratorio: titolazione H2C2O4/NaOH
Equilibri di solubilità; precipitazioni; effetto del pH sulla solubilità
Elettrochimica: le pile
Elettrochimica: pile, potenziali standard, elettrodo a idrogeno, equazione di Nernst.
Esercitazione: calcolo potenziali redox e f.e.m.
Le pile: esercitazione
Pile a concentrazione; Potenziometria: elettrodi di riferimento, elettrodo a vetro; il pHmetro
Potenziali standard, energia libera e costante di equilibrio.
Esperienza di Laboratorio: titolazione potenziometrica
Le pile: esercitazione
Elettrolisi; leggi di Faraday.
Capitoli
Diapositive
11 tutto
12.1, 12.3
12.2,12.4
12.4
13.1-13.3
14.1-14.10
(No 14.10.3)
15.1-15.3
15.1-15.2
15.4-15.8
2) 31-37
16.1-16.2
16.3-16.4
16.5-16.6
2) 38-40 Es5
2) 41-48
Es5
3)1-10
3) 11-20
Es7
Es7
3) 21-26
3) 25-30 Es8
3) 36
3) 31-35 Es8
Es8
Es8
16.7+ dispense 4) 11-16
16.7+ dispense 4) 17-18
16.8-16.8.1; 16.9 3) 38-40
4)1-10;19-20
16.8.2; 16.8.3
3) 41-42 Es9
17.1
3) 43-44
17.2-17.3
3) 45-49
Es10
Es10
17.4-17.8+
4) 21-23
dispense
3) 50-54
4) 21-24
Es10
17.9-17.11
3) 50-56