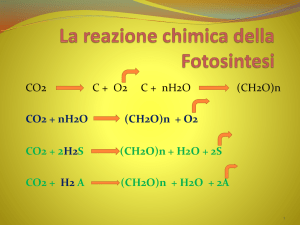
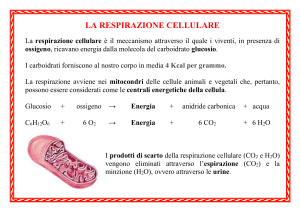
Prove di chimica
per l’ammissione al I anno
dei corsi di Laurea
in Chimica e Scienze
Geologiche
Anno accademico 1993/94
1. Dare la definizione di acido e di base secondo Arrhenius, Brönsted e Lewis e fare un esempio per ciascuna
definizione data.
2. Attribuire il numero di ossidazione a ciascun atomo
nelle specie elencate:
CO
CH4
CCl4
HFO
N2 H4 .
3. Il composto A si trasforma in B e C in soluzione acquosa
secondo l’equilibrio seguente:
A B +C .
La costante di equilibrio alla temperatura alla quale viene
condotta la reazione vale 2 moli/litro.
Sapendo che all’equilibrio sono presenti 0,2 moli di C
e 0,2 moli di B in 0,3 litri di soluzione e che all’inizio
era presente solo A, determinare la concentrazione di A sia
all’equilibrio che all’inizio della reazione.
4. Determinare il pH della soluzione acquosa ottenuta mescolando 25 ml di NaOH 0,2 M con 10 ml di HCl 0,4
M.
5. Rappresentare la formula di struttura secondo Lewis di
ciascuna delle specie elencate:
N2
CO2
SO3
H3 PO3
O3 .
6. Spiegare le ragioni per cui a temperatura ambiente
a) CO2 è un gas mentre SiO2 è un solido;
b) I2 è un solido mentre Cl2 è un gas;
c) H2 O è un liquido mentre H2 S è un gas.
Anno accademico 1994/95
1. Illustrare con esempi specifici e relazioni quantitative la
legge delle proporzioni definite e quella delle proporzioni
multiple.
Razionalizzate, con un modello semplice, queste leggi
e spiegatene la compatibilità con la legge di combinazione
tra i gas.
2. Descrivere e discutere un esperimento per misurare la
tensione di vapore (Pv ) dell’acqua in funzione della temperatura (T ).
Dimostrare che la tensione di vapore dell’acqua a T =
295 oK è Pv = 20 torr, sapendo che quella al punto triplo
(T = 273,16 oK) è Pv = 4,7 torr, la costante dei gas è R =
8,3 joules/K per mole e il calore necessario per vaporizzare
una mole di acqua a T = 273 oK è di circa 45.000 joules,
calore che assumiamo indipendente dalla temperatura in
questo ambito.
Stimate la pressione totale (P) che si raggiunge all’interno di un recipiente, contenente aria secca a P = 760 torr
e T = 295 oK, quando vi si introduce una certa quantità di
acqua e si tappa il recipiente.
Spiegate perché, in queste condizioni, l’evaporazione
interessa solo la superficie del liquido.
Ritenete che la Pv di H2 S sia maggiore o minore di
quella di H2 O alla stessa temperatura? Motivate la risposta.
3. Costruite e discutete il grafico dell’andamento della
temperatura in funzione del tempo per una soluzione di acqua e sale, cui venga somministrato calore con velocità costante. Costruite lo stesso grafico per il processo di raffreddamento effettuato sullo stesso sistema con le stesse modalità e spiegate le differenze di comportamento rispetto al
caso in cui vi sia solo il solvente.
4. Bilanciate le seguenti reazioni:
+3 + IO− + Mn2+ ;
a) FeI2 + MnO−
4 −→ Fe
3
b) CH4 + O2 −→ CO2 + H2 O ;
2−
−
c) Pt + NO−
+ NO .
3 + Cl −→ Pt Cl6
Calcolate il Peso Equivalente per almeno due delle sostanze coinvolte nelle reazioni. Scrivete due sostanze caratterizzate da peso equivalente molto basso, con le relative
reazioni di ossido-riduzione.
Prevedete il comportamento in acqua delle seguenti sostanze, fornendo le relative equazioni:
KNO3 ,
CsClO,
KF,
KBr,
CH3 COOK .
5. Scrivete la struttura elettronica e molecolare delle seguenti specie:
CO3 2− ,
C2 H2 ,
XeF2 ,
H3 O+ .
6. L’energia di ionizzazione di N è 14,5 eV, quella di O
è 13,6 eV. Scrivete i processi coinvolti e fornite una breve
spiegazione che motivi tale differenza.
Anno accademico 1995/96
1. Descrivete il comportamento in acqua, ricavandone le
relative equazioni bilanciate, dei seguenti composti chimici:
BaS,
NH4 Cl,
LiAlH4 ,
HOCl,
CO2 .
2. I dati a disposizione indicano che la forma geometrica
di un composto gassoso di formula AB6 può essere o una
piramide a base pentagonale con gli atomi B sui vertici e
l’atomo A nell’interno oppure un ottaedro regolare con A
al centro.
Quali misure sperimentali potrebbero aiutare ad identificare la sua geometria?
3. L’emoglobina (indicata con Hem) può combinarsi con
O2 e con CO formando rispettivamente la ossi- e la carbossiemoglobina. La costante dell’equilibrio
Hem O2(aq) + CO(g) Hem CO(aq) + O2(g)
vale 200. Generalmente si ritiene che valori della concentrazione di carbossiemoglobina pari a quella della ossiemoglobina siano letali.
Si calcoli il valore della pressione parziale di CO nell’aria (in condizioni standard) per cui si realizza questa
condizione.
4. Sia MX un sale poco solubile in acqua ottenuto per neutralizzazione, mediante la base forte M(OH)2 di un atomo
debole poliprotico H2 X. Si chiede:
a) come può essere aumentata la solubilità di tale sale
in acqua?
b) come varia la solubilità con la temperatura?
c) se K ps è il prodotto di solubilità di MX in acqua e K1
e K2 sono le due costanti di acidità di H2 X, qual è la
solubilità di MX in una soluzione tampone (che non
contiene ioni comuni) a pH dato?
5. Una soluzione acquosa 0,01 molare (contenente 0,01
moli/litro) di un acido XH (X − generico anione) ha un pH
pari a 4,5. A 100 cc di una soluzione 0,005 molare di
questo acido vengono aggiunti volumi crescenti v di una
soluzione 0,1 molare di NaOH. Si chiede
a) per quale valore del volume aggiunto v si ottiene un
pH pari a 7?
b) utilizzando opportune e giustificabili semplificazioni si calcoli il valore del pH quando si sia aggiunto
un volume v f contenente una quantità di base equivalente alla quantità di acido.
6. Immettendo all’istante t = 0 una certa quantità di 1,3Butadiene (C4 H6 ) gassoso in un recipiente chiuso, alla temperatura T = 600 oK, ed effettuando successive misure alla
stessa T della pressione parziale (P) esercitata dal C4 H6 all’interno del recipiente, si osserva che essa varia col tempo
secondo la legge seguente:
1
1
= + kt;
P P0
P0 = P(t = 0);
k>0.
Si chiede di:
a) giustificare da un punto di vista chimico tale osservazione sperimentale;
b) ricavare la legge cinetica sopra riportata;
c) calcolare la dipendenza dal tempo della pressione
totale all’interno del recipiente.
Anno accademico 1996/97
1. Metodi per la determinazione sperimentale di: Metodi
per la determinazione sperimentale di:
a) E 0 di Cu2+ + 2e− −→ Cu,
b) entalpia di formazione di CH4 ,
c) entalpia di formazione di H2 O(l).
2. Per la reazione RCOOH + OH− , ricavare le formule
necessarie per il calcolo del pH della soluzione acquosa
(50 cm3 ), inizialmente 0,1 M in RCOOH, quando sono
stati aggiunti 25 cm3 di soluzione acquosa di NaOH di pari
concentrazione.
3. Specificate su quali parametri occorre intervenire per
aumentare la resa di decarbonatazione di CaCO3 a CaO + CO2 .
Il ∆H della reazione è pari ad a KJ mole−1 .
4. Strutture elettroniche e molecolari di
H2 O,
SF4 ,
CH4 ,
C2 H 4 .
5. Progettate un metodo di sintesi di
Cl2 ,
H2 ,
O2 .
6. La dissoluzione di KNO3 in acqua è un processo endotermico. Utilizzando un apposito schema termodinamico,
spiegare perché.
7. Scrivere tutti i possibili isomeri strutturali dell’idrocarburo corrispondente alla formula bruta C5 H12 .
8. Nella combustione di una miscela CO/H2 (1/1) con ossigeno si forma acqua e CO2 . Supponendo che la reazione vada a completezza, scrivere l’espressione del calore
svolto in funzione dei calori di formazione delle molecole
coinvolte.
9. Il composto C2 H6 O viene ossidato da MnO−
4 in so−
luzione acida a dare CO2 , mentre MnO4 viene ridotto a
Mn2+ . Bilanciare l’equazione redox e specificare il peso
equivalente del composto che subisce l’ossidazione. Inoltre, supponendo che nel caso della titolazione venga impiegato un volume V di MnO−
4 di normalità N, scrivete
le espressioni necessarie per il calcolo del volume di CO2
svolto alla temperatura T (K) ed alla pressione barometrica
P. La soluzione titolata era stata preventivamente saturata
con CO2 .
Anno accademico 1996/97
(per Biologia)
1. Scrivere le possibili formule di struttura di isomeri e
stereoisomeri corrispondenti alla formula bruta C4 H10 O.
2. Strutture elettroniche e molecolari di
XeF4 ,
H2 S,
C2 H 2 .
3. Progettate un metodo di sintesi di
Br2 ,
CO2 ,
CO .
4. Impostate le espressioni necessarie al calcolo del pH
di una soluzione risultante dalla titolazione di CH3 COOH
con NaOH al punto di equivalenza.
5. Bilancio delle seguenti equazioni redox:
Cr2 O7 2− + I− −→ I2 + Cr3+
2+
MnO−
4 + H2 O2 −→ O2 + Mn
S2 O8 2− + C2 H6 O −→ SO4 2− + CO2 .