Biologia Molecolare
CDLM in CTF 2010-2011 – La trascrizione nei procarioti
I meccanismi della trascrizione
Il modello dell’operone
L’attenuazione
Batteri
nucleo
eucarioti
mitoc.
Polimerasi
Geni Trascritti
RNA Polimerasi
Tutti i geni batterici
Polimerasi
Geni Trascritti
RNA Polimerasi I
Geni rRNA
RNA Polimemerasi II
mRNA, snoRNA, alcuni
snRNA, miRNA
RNA Polimerasi III
tRNA, 5s rRNA, alcuni
snRNA
Polimerasi
Geni Trascritti
RNA Polimerasi
mitocondrale
Geni mitocondriali
Il confronto fra sequenze, nucleotidiche o
aminoacidiche, è uno dei compiti fondamentali della
bioinformatica.
Perché è possibile confrontare sequenze?
Perché generalmente in natura le strutture molecolari
non vengono create ex-novo ma per modificazione di
modelli preesistenti.
Obiettivi del confronto:
Filogenesi molecolare
Evoluzione dei singoli genomi
Caratterizzazione di proteine con funzione sconosciuta
Tra due o più sequenze può esserci un certo grado di
similarità.
Tale similarità può essere misurata in modi diversi,
anche a seconda del tipo di sequenze in esame
(Nucleotidiche o aminoacidiche).
A volte una similarità tra sequenze implica una
similarità strutturale e, conseguentemente, una
similarità funzionale.
L’omologia tra sequenze indica invece una comune
origine evolutiva tra di esse. Due sequenze si dicono
omologhe quando discendono entrambe da una
sequenza ancestrale comune.
Due o più sequenze simili tra loro possono quindi
essere omologhe o meno.
Allineando un certo numero di sequenze a monte dei
geni batterici è possibile individuare, a posizioni
specifiche, la presenza “preferenziale” di alcune basi
Una sequenza che contiene ad ogni posizione la base
più frequente è chiamata sequenze consenso
Non tutti i promotori hanno usa sequenza uguale
alla sequenza consenso, ma tutti hanno sequenze che
“gli somigliano”
Lettera maiuscola > 50% dei promotori
Lettera minuscola < 50% dei promotori
Fattore
sigma
Induttore
Geni bersaglio
σ70
Requisiti normali durante la crescita esponenziale
Geni “housekeeping” generali
σS
Segnali di stress, radiazioni UV, shock da calore,
iperosmolarità, pH acido, etanolo, transizione da
crescita a fase stazionaria
Geni generali che regolano lo
stress (>70 geni)
σ32
Shock da calore e altri stress: proteine non
ripiegate nel citoplasma
Proteine dello shock da calore:
proteine chaperone e proteasi
che ripiegano e degradano le
proteine danneggiate
σE
Proteine non ripiegate nell’involucro cellulare
Geni che ripristinano
l’integrità dell’involucro
σF
Condizioni che promuovono le produzione di
flagelli multipli
Assemblaggio del flagello e
chemiotassi
σ54
Mancanza di azoto
Metabolismo di fonti di azoto
alternative
Il fattore sigma stimola un forte
legame della RNA polimerasi al
promotore
La polimerasi completa si dissocia
più lentamente dal DNA
Le sequenze a -10 e -35 sono
necessarie per il riconoscimento da
parte di σ70, la regione a -10 è il
punto di contatto con il nucleo.
Inizio
Allungamento
Riconoscimento del promotore da parte dell’oloenzima
Formazione di un complesso aperto
Formazione di un complesso chiuso
Clearance del promotore
Dopo 9-12 nuecleotini cambiamento conformazionale del
nucleo
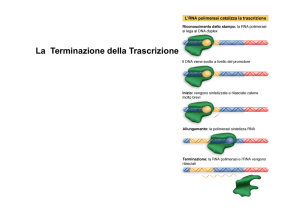
Terminazione
Terminazione Rho-indipendente
Terminazione Rho-dipendente
Legame al -10 e -35
Formazione complesso
chiuso (reversibile)
Formazione complesso
aperto (18 bp)
Clearance del promotore
prevede rottura legami tra
nucleo e σ
Mentre la bolla di trascrizione
procede viene denaturato il DNA a
valle e rinaturato il DNA a monte
il NTP entra nel sito catalitico della
RNA polimerasi e si lega al sottosito
di legame del substrato.
La catena nascente è legata al
sottosito di legame del prodotto
L’idrolisi del PPI fornisce l’energia
necessaria per la formazione del
nuovo legame covalente
I meccanismi della trascrizione
Il modello dell’operone
L’attenuazione
La regolazione dell’espressione genica è di grandissima importanza anche nei
procarioti. Non tutti gli enzimi della cellula devono essere sintetizzati
contemporaneamente e non tutti devono essere sintetizzati nella stessa quantità.
La regolazione è fortemente influenzata dall’ambiente proprio per permettere al batterio di
rispondere in maniera efficace alle variazioni nel mezzo in cui il batterio si trova.
L’induzione e la Repressione rappresentano due efficaci meccanismi di
regolazione dell’espressione genica operati dal batterio. Essi permettono al
batterio di sintetizzare gli enzimi necessari soltanto quando servono.
Gli enzimi che catalizzano la sintesi di un prodotto non vengono sintetizzati se
questo prodotto è già presente nel mezzo.
La repressione dei sistemi enzimatici deputati alla sintesi di un dato composto è
effettuata dal composto stesso che, se presente nel mezzo, assume il ruolo di
repressore.
La repressione è un fenomeno estremamente diffuso, ed è altamente specifico.
Il vantaggio della repressione è ovvio: l’organismo non spreca la propria energia
per la sintesi degli enzimi non necessari.
L’induzione enzimatica, o semplicemente induzione, rappresenta il fenomeno
attraverso il quale la sintesi di un enzima è attivata soltanto quando il suo
substrato è disponibile.
Un esempio è dato dagli enzimi per la degradazione di sostanze energetiche.
Questi vengono prodotti esclusivamente se le sostanze da degradare sono presenti
nel mezzo, e possono quindi essere utilizzate.
La
sostanza che inizia l’induzione enzimatica è chiamata induttore
La
sostanza che reprime la produzione di enzimi è chiamata corepressore
(perché richiede l’intervento di una proteina addizionale chiamata repressore)
Queste
sostanze, che di solito sono piccole molecole, vengono collettivamente
definite effettori
Come fanno gli effettori ad influenzare i geni bersaglio in maniera così
specifica?
Legando
combinandosi con proteine di regolazione specifiche
Quando un corepressore lega una proteina di regolazione (repressore) la rende
capace di legarsi in una specifica regione di DNA a valle del promotore detta
operatore.
Il legame di questo complesso impedisce alla polimerasi di proseguire e di
sintetizzare l’mRNA dei geni a valle.
I geni bersaglio sono tutti posizionati a valle della regione operatore, vengono
quindi controllati simultaneamente.
Questo tipo di organizzazione viene chiamata operone.
Promotore
Operatore
Gene 1
Gene 2
Trascrizione
RNA polimerasi
repressore
Promotore
RNA polimerasi
Operatore
repressore
corepressore
Gene 1
Gene 2
Trascrizione Bloccata
Promotore
RNA polimerasi
Promotore
Operatore
repressore
Operatore
Gene 1
Trascrizione Bloccata
Gene 1
Trascrizione
RNA polimerasi
repressore
Gene 2
induttore
Gene 2
La repressione e l’induzione sono meccanismi di controllo negativo
dell’espressione in quanto in entrambi i casi è coinvolta una proteina regolatrice
specifica, chiamata repressore, che impedisce la sintesi dei geni di un operone.
Nel controllo positivo una proteina regolatrice promuove il legame della RNA
polimerasi agendo così in modo da incrementare la sintesi degli mRNA regolati.
Le proteine regolatrici che intervengono in questo processo sono chiamate
attivatori (o proteine di attivazione)
I siti di legame per gli attivatori possono talvolta essere localizzate a distanza dai
promotori. In questo caso la loro azione è mediata dal ripiegamento del DNA
(secondo un modello simile a quello incontrato per gli enhancer eucariotici)
Promotore
Operatore
Gene 1
Gene 2
La trascrizione non ha inizio
RNA polimerasi
Promotore
attivatore
Operatore
RNA polimerasi
induttore
attivatore
Gene 1
Trascrizione
Gene 2
I meccanismi della trascrizione
Il modello dell’operone
L’attenuazione
Un’altra modalità di controllo nota come attenuazione è
utilizzata in alcuni operoni che controllano la sintesi degli
aminoacidi.
Il caso più conosciuto è quello della via biosintetica
dell’aminoacido triptofano.
L’operone del triptofano possiede diverse modalità di
regolazione, una di queste è appunto l’attenuazione che prevede
la presenza di una particolare sequenza, chiamata sequenza
guida, all’interno della quale è presente una regione codificante
per un polipetide. Questo polipeptide ha tre codoni per il
triptofano consecutivi.
L’attenuazione, nell’operone triptofano, è possibile soltanto
perché nei procarioti trascrizione e traduzione sono accoppiate:
la traduzione inizia prima che la sintesi dell’mRNA sia
terminata. Lo spostamento del ribosoma sull’mRNA in
formazione può influenzare il ripiegamento dell’mRNA stesso
nascondendo delle regioni complementari.
La terminazione prematura della trascrizione è influenzata
proprio dalla formazione di strutture secondarie tipiche
• L’operone del triptofano è sempre
acceso.
• La polimerasi comincia a produrre
mRNA messaggero.
• Il ribosoma si attacca e comincia a
produrre il polipeptide codificato dalla
sequenza dell’attenuatore
• Se vi è una elevata presenza di
triptofano la velocità del ribosoma è
elevata, il ribosoma raggiunge la regione
2 e le impedisce di legarsi, per
complementarietà, alla regione 3. In
questo modo la regione 3 si appaia con
la regione 4 formando una struttura che
induce la terminazione della trascrizione
• Se il triptofano è scarso, quando il
ribosoma arriverà in corrispondenza dei
tre codoni per il triptofano effettuerà una
pausa. La diffusione degli aminoaciltRNA per il triptofano è infatti più lenta
e il ribosoma deve aspettare che questi
arrivino.
• La sosta del ribosoma nella zona 1 non
impedisce alla zona 2, che questa volta è
libera, di appaiarsi con la regione 3. Non
potendosi più formare la struttura di
terminazione (perché la regione 3 è
impegnata e non disponibile per
l’appaiamento con la regione 4) la
trascrizione continua a valle producendo
un mRNA con i geni per la biosintesi del
triptofano.