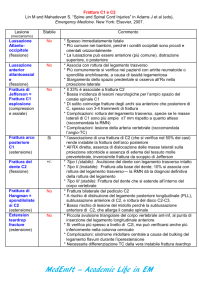
t
t
t
t
a - pretrattamenti
b- congelamento
C
- frattura
d- etching
e- ombratura e formazione della replica
I
f - lavaggio delle repliche
I
C
Fig. 4. - Rapprcsentazionr schematica dellr
I
1
i
varir fasi
I
- - - - - - - - - - -J
in cui ai articola la tecnica <Irl,frec;e-frocturity:
possono a loro volta introdurre degli artefatti e devono
quindi essere eseguiti solo se strettamente necessari e
valutando bene, a seconda del tipo del preparato, gli
effetti che possono esercitare sulle strutture in esame. I
trattamenti che vengono effettuati prima del congelamento consistono in genere in una prefissazione e/o in
un trattamento con un crioprotettivo.
La fissazione chimica ha lo scopo di immobilizzare
le strutture subcellulari e macromolecolari in uno
stato il più possibile simile a quello vitale. E' quindi
necessario che il fimtivo raggiunga e penetri ogni cellula
il più rapidamente possibile. La fissazione per immersio.
ne è perciò adeguata so10 nel caso di cellule isolate,
monostrati cellulari od organelli cellulari in sospensione.
Per quanto riguarda invece i tessuti è consigliabile la
fissazione per perfusione vascolare. La temperatura della
soluzione da perfondere deve avere, all'inizio del trattamento, un valore molto vicino a quello fuiologico per
evitare riarrangiamenti interni e separazioni di fase dei
componenti di membrana; dopo alcuni minuti la temperatura va ridotta e mantenuta a 0-4 O C per prevenire
l'estrazione dei lipidi di membrana. Nel caso di sospen-
sioni cellulari, colture batteriche in terreno liquido, organelli cellulari in sospensione ecc., il fissativo può
essere direttamente aggiunto alla sospensione fino al raggiungimento della concentrazione desiderata. Anche in
questo caso particolare importanza ha la temperatura alla quale viene eseguita la fissazione.
Il fissativo più usato nei lavori di FF è la glutaraldeide
a concentrazioni (1- 4% ) e tempi ( da alcuni minuti ad
alcune ore) variabili a seconda delle caratteristiche del
preparato. La $utaraldeide non fissa i lipidi per cui non
è in grado di arrestare con sufficiente rapidità i processi
cellulari che comportano movimenti fisici dei componenti di membrana. Tuttavia altri fisaativi usati in microscopia elettronica, come il tetrossido di osmio o il permanganato di potassio che sono buoni fisaativi dei lipidi, non possono essere impiegati per il FF in quanto
alterano le proprietà idrofobiche dei lipidi di membrana
e quindi il processo di frattura attraverso la membrana
stessa.
I1 trattamento con un crioprotettivo ha lo scopo di
ridurre il contenuto di acqua libera all'intemo del
preparato e quindi di evitare la formazione di cristal~
li di ghiaccio durante il congelamento che deve comunque avvenire il più rapidamente possibile. Le dimensioni dei cristalli di ghiaccio dipendono infatti dalla concentrazione del soluto e dalla velocità del conFclamento: più aumentano tali parametri più piccoli
sono i cristalli di ghiaccio che si formano.
La maggior parte dei campioni biologici ha una coniiucibilità termica molto bassa ed un grande contenuto
di acqua per cui è necessario proteggerli incuhandoli
con agenti anticongelanti a concentrazioni relativamehte alte, come glicerolo, dimetilsolfossido (DMSO)
o aucosio. La crescita dei cristalli di ghiaccio all'interno
del campione causerebbe infatti grossolane alterazioni
delle strutture cellulari e ovviamente un netto peggioramento del potere risolutivo. Quando invece il congelamento è ben eseguito, si ottiene la cosiddetta "vetrificazidne del campione" con formazione di microcristalli di
:hiaccio di dimensioni inferiori a quelle dei granuli
metallici che costituiranno la replica (<2 nm). In questo
caso non si peggiora il potere risolutivo e non si danneggiaho le strutture dei preparato.
1.a velocità di congelamento in corrispondenza della quale si ottiene la vetrificazione del campione, viene
definita velocità critica di congelamento (VcC) (vedi
paragrafo successivo). L'uso di crioprotettivi ha proprio
lo scopo di ridurre la VcC. L'impiego di una soluzione di
gliccrolo al ?O%,per esempio, abbassa la VcC della cellula da circa lo4 a 10'
C/s permettendo cosi la vetrificazione di oggetti dello spessore di 0,5 mm ed oltre.
'Tuttavia, anche se è stato dimostrato che la maggior
parte dclle cellule soprawive al trattamento con un
cnoprotettivo, owiamente il metabolismo cellulare
pub essere alterato con conseguente modificazione di
alcune strutture. Questi danni sono in gtnere limitati dalla precedente fissazione con glutaraldeide.
O
produce un gran numero di cristalli di ghiaccio molto
piccoli. Se la velocità arriva a valori di circa IO4 "Cls, il
numero dei cristalli diventa elevatissimo e la loro dimensione si riduce a pochi nanometri. Tali "cristallini" sono
talmente piccoli da non danneggiare nè le funzioni nè la
struttura della cellula, che rimane quindi vitale. Questo
tipo di congelamento viene chiamato "vetrificazione" ed
è quello che deve essere adottato per la preparazione di
campioni per il freeze-fracturing.
La Fig. 5 mostra graficamente le diverse situazioni
legate alla velocità di congelamento mentre la Fig. 6
mostra la relazione tra velocità di congelamento e
s o p r a w ~ e n z acellulare.
Fig. 5 . - Rappr~sintasionegrafia dclle divcrse situazioni Ifgste
alla velocità di congelamento (VC)
l
~ o n ~ e l a r n e n t o-. Quando la temperatiira di cellule
viventi viene fatta scendere al di sotto del loro punto
di congelamento (circa -2 o C), si possono verificare
principalmente tre situazioni a seconda della velocità
di congelamento che viene impiegata. Per velocità di
congelamento (VC) si intende il rapporto AT/At dove
AT è la differenza tra la temperatiira iniziale e la temperatura finale di congelamento e At è l'intervallo di tempo
in cui viene raggiunta la temperatura finale.
Se la temperatura viene abbassata molto lentamente
(<l O-' " Cis), congela prima l'acqua extracellulare ed
i cristalli di ghiaccio in formazione estraggono I'acqua necessaria alla loro crescita dall'interno della cellula
che viene in questo modo disidratata. In seguito a questo
proceso le cellule ovviamente diminuiscono di volume e
si contraggono ma restano vitali. Questo "congelamento
extracellulare" 6 normalmente usato come metodo per la
ronservazione di colture cellulari, batteri, ecc.
A velocità di congelamento più elevate (dell'ordine
di 1 " Cis), I'acqua intraceIlulare non fa in tempo ad
cssere estratta e la formazione di cristalli di ghiaccio all'intemo della ccllula causa la distruzione delle struttiire cellulari e quindi la morte della cellula.
ITn ulteriore aumento della velocità di congelamento
Fig. 6. Andamento della soprawivenaa cellulare sl vanare delln
velocità di congelamento
La vetrificazione awiene a velocità di congelamento
molto elevate in quanto in queste condizioni le stesse
molecole d'acqua, owiamente numerosimime, funzionano come nuclei di cristallizzazione: si ha in questo caso
una "nucleazione omogenea". A velocità più basse, invece, sono le impurità che agiscono da nuclei di cristallizzazione: in questo caso si ha la "nucleazione eterogenea" che produce cristalli meno numerosi e più grandi.
il passaggio dalla nucleazione eterogenea a quella omogenea awiene bmscamente ad una hen preciria velocità di
congelamento che viene chiamata velocità critica di
congelamento (VcC). In Fig. 7 è riportata la variazione
delle dimensioni dei cristalli di ghiaccio al variare della
VC.
La VcC dell'acqua è di circa lo6 " C/s mentre quella
delle cellule fisiologicamente attive è di circa IO4 " Cls.
La maggior parte dei campioni biologici possono quindi
essere vetrificati applicando velocità di congelamento
>io4 W.
Nella procedura standard della tecnica del freezefracturing il congelamento viene eseguito ponendo il
campione (un piccolissimo frammento di tessuto delle
dimensioni inferiori al millimetro o una piccola goccia
di sospensione ottenuta con un capillare) su di un apposito supporto, realizzato con una lega ad elevata
conducibilità termica, ed immergendolo poi il più rapidamente possibile in Freon 22 parzialmente solidificato con azoto liquido. I1 Freon si trova in questo
modo ad una temperatura di -160 "C e dopo alcuni secondi di immersione il preparato deve essere rapidamente trasferito in azoto liquido, senza subire innalzamento di temperatura, dove può essere conservato
fino al trasferimento all'interno della campana sotto
vuoto per la successiva fase di frattura. La diretta immersione in azoto liquido (-196 O C) ridurrebbe notevolmente la velocità di congelamento a causa della formazione di un involucro gassoso intorno al preparato.
Con questo sistema è possibile tuttavia ottenere
la velocità di congelamento desiderata solo alla superficie del campione a causa della bassa conducibilità termica del materiale biologico. E' stato calcolato
che solo un sottile strato superficiale di pochi micrometri di spessore può essere vetrificato e che tale spessore dipende molto dalla geometria del campione stesso.
Oggetti biologici molto piccoli possono essere vetrificati
con YC>lOS 'C solo se sotto forma di films dello spessore inferiore a 10 pni o gocce del diametro inferiore a 20
pm. Se il campione non ha queste caratteristiche, è necessario introdurre variazioni delle sue proprietà fisiche
allo scopo di ridurre la velocità critica di congelamento;
ciò può essere ottenuto, come abbiamo visto nel paragrafo precedente, facendo uso di agenti crioprotettivi.
Nel caso di sospensioni cellulari i: possibile congelare
0
Cri@talli
di ghiaccio
l nm i
1OW.
Fig. 7.
- Variazione delle dimmiani dei cristalli di ghiaeùo d
variare della velocità di eonp;elamento
un singolo strato di cellule opportunamente depositate
su speciali supporti [41, 421. Analogamente è possibile
congelare direttamente colture cellulari in monostrato
senza staccare le cellule dal supporto evitando così di
danneggiarle e mantenendo integi i rapporti intracellulari 143- 451.
Numerose sono le modifiche proposte al metodo di
congelamento qui descritto; recentemente sono stati
ideati e messi a punto sistemi completamente diversi
che consentono di raggiungere elevatissime VC e tali
da ottenere ottimi risultati evitando l'uso dei pretrattamenti. La descrizione di tali metodi va però oltre
gli scopi di questo articolo; ci limiteremo a ricordare
quelli noti come lo spray-freezirg [46-491, il propan
jet [50-531 ed il quick-freezing [54-591
Frattum. - Dopo il congelamento i preparati, montati sugli appositi supporti, vengono trasferiti su un tavolino portacampioni, posto all'interno dell'apparecchiatura
per il FF, preraffreddato con azoto liquido a -150 'C e
successivamente portato a valori di vuoto dell'ordine di
IO-' -IO-' Tom. Il trasferimento deve essere eseguito
molto rapidamente per evitare fenomeni di ricristallizzazione che possono awenire se la temperatura viene
innalzata al di sopra di -90 "C. L'eventuale ricristallizzazione renderebbe vani tutti gli accorgimenti presi durante la fase di congelamento.
Si procede quindi alla frattura del preparato che
può essere eseguita o mediante un microtomo a lama di
acciaio preraffreddato alla temperatura dellazoto
liquido, o mediante dispositivi che provocano una
"spaccatura" del campione in due parti. Quest'ultimo
sistema consente di ottenere una coppia di repliche
tra loro complementari relative ad entrambe le facce
di una stessa frattura.
Quando la lama fredda attraversa il campione congelato, si produce un piano di frattura. Tale piano di
frattura non procede lungo una superficie piana ma
cambia continuamente direzione seguendo piani preferenziali in corrispondenza di zone contenenti legami
deboli.
piano idrofobico mediano delle membrane
costituisce un piano preferenziale di frattura cosicchè
le cellule, in seguito alla frattura, espongono vaste
superfici delle proprie membrane. h Fig. 8 vengono
illustrati, in maniera schematica, i più comuni piani
di frattura attraverso la cellula. Nella cellula 4 la frattura
passa attraverso il piano idrofohico mediano della
membrana citoplasmatica seguendo una superficie
convessa; in questo caso è possibile osservare il monostrato della membrana adiacente al citoplasma.
Tale faccia di frattura viene chiamata PF (protoplasrnic
fracture face) secondo la nomenclatura proposta nel
1975 da un folto gruppo di esperti di F F [60] e adottata in questa rassegna. Il caso della cellula B è invece
quello di una frattura che attraversa il protoplasma, non
permettendo la visualizzazione della membrana citoplasmatica, ma consentendo in tal modo l'osservazione
dei componenti interni della cellula quali mitocondri,
vacuoli, nucleo, ecc. Anche a livello degli organelli
cellulari, la frattura può seguire il centro idrofobico delle
n
Fig. 8. - Rappresentazione ichematica ilci più comuni piani di frattura attraverso la cellula. A: frattura che percorre il piano idrofobico
liledianodella membrana plasmatiea formando una supcrfieie convessa. 0: frattura che attraversa la cellula. C: frattura che percorre il
piano idrofobico mediana della membrana plasmatiea formando una supedicie concava
loro membrane o può attraversarli esponendo la loro
matrice interna. Nella cellula C è schematizzato un piano
di frattura che segue ancora il piano mediano della
Aembrana citoplasmatica, ma lungo una superficie
concava, permettendo l'osservazione del monostrato
esterno della membrana; questa superficie di frattura
viene denominata EF (erternal or exopInsmic fracture
fnce).
In Fig. 9 vengono mostrate tre cellule osservate dopo
FF, in cui la frattura è avvenuta nei tre modi diversi
schematizzati in Fig. 8.
La Fig. 10 mostra, più in particolare, come avviene
la frattura attraverso la membrana e le quattro possibili
superfici di membrana osservabili. La PF e la EF sono,
come detto precedentemente, le facce di frattura osservobili direttamente in seguito alla frattura stessa della
rhembrana mentre le superfici esterne ed interne (ES e
PS rispettivamente) possono essere visualizzate solo se
si eb'ittua la successiva fase di etching (vedi prossimo
paragafo).
Le particelle, essenzialmente di natura proteica, intercalate all'intemo del doppio strato lipidico, vengono
esposte in seguito al processo di frattura e sono chiaramente visibili su entrambe le facce di frattura di tutte le
membrane biologiche. Della natura e funzione delle
particelle intramembranose (IMP) parleremo più in
dettaglio in seguito.
Tn Fig. 11 è mostrato un particolare a forte ingrandimento della faccia di frattura protoplasmatica della membrana citoplasmatica di un fibroblasto in coltura
in cui sono ben visihili le IMP.
Sebbene sia oggi largamente accettato che il piano
di frattura attraversi il centro idrofobico delle membrane, come proposto originariamente da Branton
128-301, e numerose sono le evidenze sperimentali in
favore di tale teoria, non mancano tuttavia dubbi in
proposito. Sjostrand, in un suo articolo pubblicato
nel 1979 [61], analizza con spirito erriremamente critico alcuni risultati ottenuti con il FF, mettendo soprattutto in dubbio diverse interpretazioni relative alla
localizzazione del piano di frattura. Egli dimostra infatti
che, almeno in alcuni casi. la frattura correrebbe lungo la
superficie della membrana rilanciando la vecchia ipotesi
di Moor e Mihlethaler [27]. In ogni caso è certo che la
localizzazione del piano di Frattura può essere influenzata da diversi parameiri che posaono essere correlati sia
al metodo usato per eseguire la frattura stessa, sia
agli eventuali trattamenti chimici cui il preparato viene
sottoposto che alla composizione stessa della membrana
in esame. Tali variabili devono quindi essere ben note e
considerate attentamente nella fase di interpretazione
delle immagini. Un altro fattore che può influire sul
processo di frattura è costituito dalla temperatura del
preparato; questa può essere regolata a seconda del valo-
~ i 9. ~- Ininiagini
.
al microscopio elettronico d i ccllulr prrprratr con la tecnica dcl freeze-fr.cturiir(l in cui la frattura è avvenuta nei tre
modi indicati in Fig. 8 . A: faccia d i frattura prutoplnsrnatica (PF). tì: frattura attraverw la cellula. C: faccia di frattura esterna (EF)
I:ig.
1U. - S c I w n i ddla fmltiira ,4liavi,rso iinii mmilirniir iii
cui sona indicate le particelle di mcmbrana e Ic varie superfici
C facce di frattura con rclativa nomrnclalura
re di vuoto a cui si lavora e se si vuole eseguire o meno
l'eventuale, successiva fase di etclting.
Etching. - Come abbiamo visto in preredenza, il processo di frattura del campione congelato evidenzia superfici che ne rivelano i principali dettagli strutturali.
Le strutture pii1 minute possono tuttavia non esscrc
rivelabili in quanto ricoperte da un sottile strato di
ghiaccio ed inoltre è possibile osservare solo qiiellr stmttnre che siano presenti sulle facrr di frattura. Yel caso
delle membrane. per esempio, sarebbe possihile visua-
lizzare solo i componenti interni alla membrana e non
quelli eventualmente presenti sulle sue superfici esterne.
E' possibile esporrc ulteriori elementi striithiraii al finc
di ricavare dalla replica una maggior mole di informazioni, facendo suhlimare un sottile strato di ghiaccio
superficiale dello spessore di alcuni nanometri. Questa
sublimazione produce una sorta di "erosione" della
superficie di frattura da cui il nome di freeze-etching
dato originariamente a qiicsta tecnica. 1,'entità della
suhlimazione dipendc dalla temperatura del campione C
dal valore del vuoto. La rimozione dei ghiaccio awiene
infatti solo sc la sua pressione di saturazione è maggiore
della pressione parziale nella camera da vuoto e la
pressione di saturazione è funzione della temperatura. Se
iiivecc P maggiore la pressione parziale, si ha deposizione
delle sostanze conteniitc nella camera sulla superficie
Frcdda frattiirata. Ad iina pressione di 10W6 T o r r i principali costitiirnti dcl viioto sono H,O, H2,W,, CO, 0 2 e
gli idrocarburi provenienti dallr pompe. Alla temperatura del preparato di -1 00 o C, condensano essenzialmente gli idrocarhnri; scendendo a -120 " C l'acqua diventa la maggior fonte di contaniinazione esscndo a quesia L<!nipwa~iirala stia ~in:ssionedi satiiraxione di IO7
'I'orr. 1.ktching deve quindi essere eseguito tra -110 'C
C -100 " C. .Al di sopra di -90 o C infatti inizia la n-
Fig. 11. - Particolure dclla faccia di flrttiira protupiasniitica (W') de,lla n~wirbraiiacitoplamnatica di un fibroblasto iti c a l l u r ~ I.?
. parti.
ecllr di mrmbrann mnu chiaramente v i s i b i l i ( 2 0 0 . 0 0 0 ~ )
i:ristallizzazione del preparato mentre al di sotto di
-110 " C si avrebbe deposizione di acqua (brinamento
dei vapori di H20 sulla superficie fredda fratturata) anziché sublimazione. Se si volesse lavorare a temperature
più basse senza avere contaminazioni eccessive è necessano ricorrere a vuoti molto più spinti. A l@'' Torr,
per esempio, non si ha praticamente condensazione sulla
superficie del preparato anche se la sua temperatura è
inferiore a -200 "C.
Generalmente I'etching viene eseguito ad una temperatura del campione di -100 " C, con un vuoto di circa
lo-' 'Torr e con il braccio del microtomo (-180 " C),
avente la funzione di "trappola fredda", posto a brevisaima distanza sopra il preparato. In queste condizioni si può raggiungere una profondità di etching di
90-100 nm in un minuto.
L'etching consente tra l'altro, come detto precedentemente, la nsualizzazione delle superfici esterne dclle
membrane. In Fig. 12 è riportato lo schema della frattura attraverso una membrana in cui è visibile, oltre alla
faccia di Frattura protoplasmatica (l'l:), la superficie
esterna della membrana (ES) esposta dopo I'etchinp in
seguito all'abbassamento del livello del ghiaccio. Analogamente è possibile osservare la superficie protoplamatica (I'S) nel caeo in cui la frattura segua il piano concavo
dclla membrana.
La Fig. 1 3 mostra iin particolare di una cellula di
Escherichin coli osservata dopo FF. L'esecuzione dcll'etching (circa 2 min) consente l'osservazione sia della
faccia di Frattura protoplasmatica (PF) della membrana
citoplasmatica, sia della superficie esterna (ES) dclla
membrana esterna dell'involucro cellulare.
Anche la fase di etching può introdurre fattori che
possono complicare l'interpretazione delle immagini.
In particolare bisogna tenere conto della possibilità
di contaminazioni della superficie di frattura durante
il tempo di etching, delle possibili variazioni ultrastrutturali conseguenti alla sohlimazione del ghiaccio
e del diveno comportamento tra zone sublimabili e
quelle che, essendo prive di acqua, non subiscono
I'etching. Va infine ricordato che I'etching non avviene, o awiene solo in misura trasciirabile, nel caso
in cui il campione sia infiltrato con crioprotettivi che.
Vig. 12. - Si:iii.tna di iiiu iniimlirani Iratturuta in cui è visibile,
oltre alla isccia di f r a t l u r ~protoplasrnatica (PF), la superficie
esterna della membrana (ES) csposta in seguito al processo di
etchiny. L, : livello del kiiaceio nihita dopo la frattura: L , :
livella del ghiaccio dopo I'rtchiiig; I?dP: particelle inhamembrnnuse:Cil: eitoplasnra
Vig. I:{. - Cdliilr iii I-diwi,:hk d i osservata dopo frar:efmcturiry: L'i:sceuzione dcll'etching (circa 2 minuti) ha permea80 la visiializeazione sia dclla faccia di frattura protoplasmatiu
(PF) della membrana citoplasmatica che appare ricca di particelle, sia della superficir esterna (ES) de!la membrana esterna
dell'involucro ccllulare. Sulla ES, che appare relativamente
liscia, sono ben visibili i flagelli ( 6 0 . 0 0 0 ~ )
legandosi all'acqua, ne impediscono la siiblimaeione. In
questo caso, soprattutto se non si dispone di una trappola fredda intorno al preparato o se non si lavora con un
vuoto molto spinto, è consigliabile ridurre al minimo il
tempo di etching, che provocherebbe solo contaminazione, o megiio ancora evitarlo del tutto iniziando le
evaporazioni per la produzione della replica immediatamente dopo la frattura.
Ombraturn e formazione del& replica - La frattura
e I'etching producono una superficie contenente "rilievi" e "awallamenti" di varie dimensioni corrispondenti a dettagli morfologici ed ultrastmtturali offrendo
in tal modo informazioni tridimensionali del campione.
Scopo delle evaporazioni è qiiello di produrre una
replica, il più possibile fedele della faccia di frattura, i
cui dettagli possano essere convenientemente osservati al
microscopio elettronico. La replica deve quindi avere le
seguenti caratteristiche: buon contrasto, cioè sufficiente
densità elettronica; minimo spessore, per sfmttare al
massimo il potere risolutivo del microscopio elettronico;
granulosità molto sottile, per non nascondere i dettagii
ultrastmttiirali più minuti; sufficiente resistenza meccanica e massima insolubilità, perché non venga danneggiata durante la successiva fase di lavaggio in cui i residui
organici vengono rimossi dalla replica mediante opportuni solventi.