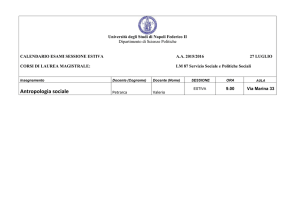
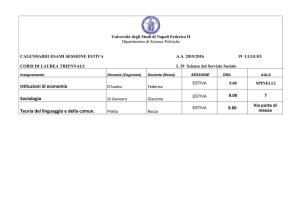
Esame complementare passerella “maturità professionale - scuole universitarie”
Locarno, sessione estiva 2015
Cognome e nome…………………….
Gruppo e numero…………………….
________________________________________________________________________________
Materia:
Scienze sperimentali: CHIMICA
Tempo a disposizione:
80 minuti
Materiale ausiliario autorizzato:
CRM, CRP, CRC, Formulari e tavole (trad. CMSI),
Ed. G d'Encre
CRM, CRP, CRC, Formulaires et tables, Editions du
Tricorne
DMK/DPK, Formeln und Tafeln, Orell Füssli Verlag
La tavola periodica degli elementi è allegata
Calcolatrice non programmabile
Indicazioni:
Tutte le risposte sono da riportare direttamente sui
fogli delle domande.
Ciò che risulta illeggibile non viene corretto e di
conseguenza non valutato.
Il punteggio massimo è indicato per ogni domanda.
Nei calcoli bisogna mostrare l’impostazione algebrica e
dare il risultato con la dovuta precisione (numero
adeguato di cifre significative).
Risposte incomplete o imprecise comportano una
riduzione dei punti assegnati.
Se è richiesta la formula di struttura completa devono
comparire tutti gli elettroni di valenza degli atomi
coinvolti.
Le equazioni chimiche devono presentare le formule
chimiche delle sostanze coinvolte (ev. le formule
condensate), devono essere bilanciate e se possibile
presentare accanto alle formule lo stato delle sostanze.
Punteggio massimo:
111 pti. su 121
________________________________________________________________________________
Esame complementare passerella “maturità professionale - scuole universitarie”
Locarno, sessione estiva 2015
Scienze sperimentali, chimica
________________________________________________________________________________
14 pti.
PARTE PRIMA: Domande a scelta multipla
Indica con una crocetta l’unica affermazione corretta.
a. Un sistema costituito da acqua e ghiaccio è
□
□
□
□
□
□
chimicamente omogeneo e fisicamente eterogeneo
fisicamente omogeneo e chimicamente eterogeneo
chimicamente eterogeneo
fisicamente omogeneo
fisicamente identico
chimicamente identico
b. Il petrolio grezzo è
□
□
□
□
□
una soluzione contenente molti composti organici
una miscela contenente molti idrocarburi diversi
una miscela di composti inorganici
una miscela di alcani diversi
un particolare idrocarburo
c. La distillazione è una tecnica di separazione basata
□
□
□
□
□
sulla diversa solubilità in acqua
sulla diversa temperatura di fusione
sulla diversa volatilità
sulla diversa massa molecolare
sulla diversa densità
d. Il sodio precede il potassio nel primo gruppo della tavola periodica. Quale affermazione è
corretta?
□
□
□
□
□
un atomo di sodio è più grande di un atomo di potassio
il potassio è più reattivo del sodio
entrambi formano anioni monovalenti nei loro composti
possiedono un numero diverso di elettroni di valenza
entrambi sono buoni ossidanti
2 Esame complementare passerella “maturità professionale - scuole universitarie”
Locarno, sessione estiva 2015
Scienze sperimentali, chimica
________________________________________________________________________________
e. Una mole di Ca(OH)2 corrisponde a
□
□
□
□
74.1 g
6,02·1023 atomi
58.1 g
114.2 g/mol
f. L’amido è
□
□
□
□
□
un lipide
una proteina
un polisaccaride
un monosaccaride
un acido nucleico
g. Identifica le coppie di isomeri costituzionali (isomeri strutturali):
□
□
□
□
acido solforico H2SO4 e acido solforoso H2SO3
butanolo e butanale
butanale e butanone
diossigeno e ozono
h. Una sostanza si riduce quando
□
□
□
□
cede calore
acquista protoni da un donatore
acquista elettroni da un donatore
cede protoni a un accettore
i. Tra due atomi con una grande differenza di elettronegatività si forma
□
□
□
□
□
un legame dipolo-dipolo
un legame covalente apolare
un legame ionico
un legame idrogeno
un legame dativo
3 Esame complementare passerella “maturità professionale - scuole universitarie”
Locarno, sessione estiva 2015
Scienze sperimentali, chimica
________________________________________________________________________________
j. Quale di questi elementi è un alogeno?
□
□
□
□
□
Rb
Ne
Fe
F
Ca
k. Indica quale tra le seguenti sostanze si scioglie in un solvente polare.
□
□
□
□
un idrocarburo
l’idrossido di sodio
un lipide
un sapone
l. La percentuale in massa dell’idrogeno nell’ammoniaca (NH3) è di 17.8 %. Qual è il rapporto
ponderale di combinazione in massa tra azoto e idrogeno nel composto?
□
□
□
□
4,63 ÷ 1,00
4,00 ÷ 1,00
1,00 ÷ 4,00
1,00 ÷ 3.00
m. Una soluzione al 3.0 M di H2SO4 contiene
□
□
□
□
12,0 mol di ioni O2- in un litro di soluzione
3,0 mol di ioni H3O+ in un litro di soluzione
9,808 g di H2SO4 in 100 ml di soluzione
non contiene ioni perché è una sostanza molecolare
n. Quale delle seguenti reazioni è una reazione di addizione:
□
□
□
□
□
2 H2 + O2
Glucosio + Fruttosio
2 H2O
Saccarosio + Acqua
CH3CHCH2 + H2O
CH3CHOHCH3
(CH3)3COH + HCl
(CH3)3CCl + H2O
Propene + Acqua
2-propanolo
4 Esame complementare passerella “maturità professionale - scuole universitarie”
Locarno, sessione estiva 2015
Scienze sperimentali, chimica
________________________________________________________________________________
PARTE SECONDA: Esercizi
Esercizio 1
16 pti.
Dello zolfo viene posto in un crogiolo e riscaldato
fortemente all’aria sopra la fiamma di un bruciatore finché si
innesca la combustione. Si forma così SO2 che, con una
mini-cappa realizzata con un imbuto rovesciato, viene
aspirata da una pompa e fatta gorgogliare nell’acqua
contenuta in una bottiglia per il lavaggio dei gas
(vedi figura a fianco).
Il cambiamento di colore di un indicatore acido base
aggiunto all’acqua contenuta nella bottiglia per il lavaggio
dei gas segnala un cambiamento da un valore di pH = 7
iniziale ad un pH = 4 finale.
a. Spiega le ragioni di questo cambiamento dell’acidità.
b. Sapendo che il prodotto finale possiede la formula chimica H2SO3 scrivi le due distinte
equazioni chimiche (complete e bilanciate) che caratterizzano l’esperienza.
c. Scegli tra le seguenti sostanze quella che, con lo stesso dispositivo, può essere aspirata per
riportare il valore del pH dapprima a 7 e poi a 10 (una sola è la risposta corretta) e scrivi nel
riquadro l’equazione chimica della reazione.
□ H2S
□ HBr
□ NaOH
□ NH3
□ CO2
□ CaO
5 Esame complementare passerella “maturità professionale - scuole universitarie”
Locarno, sessione estiva 2015
Scienze sperimentali, chimica
________________________________________________________________________________
d. Identifica e spiega l’esempio di inquinamento atmosferico che rispecchia l’esempio della prima
parte di questa esperienza.
Esercizio 2
13 pti.
Il torio è un metallo debolmente radioattivo, reperibile in natura unicamente con il suo isotopo più
stabile
Th. Il suo decadimento porta alla formazione dell’isotopo dell’elemento radio Ra.
a. Descrivi la composizione dei due isotopi (tipo e numero di particelle subatomiche).
Th
Ra
b. Descrivi la composizione e identifica la particella che viene emessa nel decadimento del
all’isotopo del radio Ra.
Th
L’analisi di una roccia ha rivelato un contenuto del composto ThO2, nella misura del 12 % in massa.
c. Ammettendo che il torio sia esclusivamente presente nel minerale ThO2 calcola la quantità di
Th presente in 100 kg di questa roccia.
6 Esame complementare passerella “maturità professionale - scuole universitarie”
Locarno, sessione estiva 2015
Scienze sperimentali, chimica
________________________________________________________________________________
Esercizio 3
25 pti.
L'acido nitrico, formula chimica HNO3, è un ossiacido inorganico forte.
a. Scrivi l’equazione relativa alla ionizzazione (protonolisi) di HNO3
b. Stabilisci qual è il valore del pH di una soluzione 0,1 M di HNO3
L'acido nitroso di formula HNO2 è invece un acido inorganico debole. Viene prodotto dalla
reazione di acqua e anidride ipoclorosa (uno degli ossidi di cloro).
c. Disegna nel riquadro la formula di struttura
completa di HNO2 e stabilisci quali sono le
geometrie di azoto e ossigeno.
Geometria di N: . . . . . . . . . . . . . . . . . . . .
Geometria di O: . . . . . . . . . . . . . . . . . . . .
d. Spiega come si giustificano i valori degli angoliHON e ONO riportati nella figura.
e. Sapendo che HNO2 si ottiene per reazione dell’anidride nitrosa, la cui formula chimica è N2O3 ,
con l’acqua scrivine l’equazione completa e bilanciata.
f. Scrivi l’equazione relativa alla ionizzazione (completa) di HNO2.
7 Esame complementare passerella “maturità professionale - scuole universitarie”
Locarno, sessione estiva 2015
Scienze sperimentali, chimica
________________________________________________________________________________
g. Una soluzione 0,10 M di HNO2 possiede un pH di 2,2. Come si spiega tale valore?
8 Esame complementare passerella “maturità professionale - scuole universitarie”
Locarno, sessione estiva 2015
Scienze sperimentali, chimica
________________________________________________________________________________
Esercizio 4
26 pti.
L’acetato di n-butile è un composto organico che si trova in natura in molti tipi di frutta, dove
conferisce un odore caratteristico di banana. Come prodotto di sintesi viene utilizzato come
aromatizzante in dolciumi e altri alimenti ma viene usato anche come solvente nella produzione di
vernici e altri prodotti.
La sintesi, catalizzata per aggiunta di acido solforico, viene realizzata secondo la seguente reazione:
O
H2SO4
+
O
+ H2O
HO
OH
O
a. Cerchia sulla figura i gruppi funzionali, attribuisci loro il nome corretto e stabilisci a quale
classe di sostanze appartiene la relativa sostanza organica.
Nome del gruppo funzionale
Classe di sostanze organiche
O
OH
HO
O
O
b. L’acetato di n-butile possiede la seguente composizione percentuale (in massa):
w(C) = 62.04 %
w(H) = 10.41 %
w(O) = 27.55 %
Mostrando i calcoli opportuni, stabilisci qual è la formula chimica della sostanza.
9 Esame complementare passerella “maturità professionale - scuole universitarie”
Locarno, sessione estiva 2015
Scienze sperimentali, chimica
________________________________________________________________________________
c. Disegna la formula di struttura completa dell’acetato di n-butile, determina la formula
molecolare e confrontala con la formula minima.
Formula molecolare:
d. Stabilisci quale o quali delle tre sostanze organiche è o sono idrosolubile/i, motivando
esaurientemente la tua risposta.
e. Questa reazione di sintesi dell’acetato di n-butile non è molto spontanea e di conseguenza la
resa è relativamente modesta. Ritieni che l’aggiunta dell’acido solforico sia finalizzata a
migliorare la resa. Argomenta in modo chiaro e preciso.
10 Esame complementare passerella “maturità professionale - scuole universitarie”
Locarno, sessione estiva 2015
Scienze sperimentali, chimica
________________________________________________________________________________
Esercizio 5
27 pti.
In un recipiente chiuso del volume di 10,0 L vengono introdotte 3,00 mol di monossido di carbonio
CO, 4,00 mol di H2O e 3,00 mol di CO2 , alla temperatura di 725 °C. In queste condizioni tutte le
sostanze sono allo stato gassoso.
Avviene la seguente reazione:
CO (g) + H2O (g)
CO2 (g) + H2 (g)
Reazione esotermica
Dopo un certo tempo la reazione si arresta con la quantità di monossido di carbonio CO che si è
ridotta a 1.00 mol.
a. Calcola in moli i nuovi valori delle quantità chimiche di H2O (g) CO2 (g) H2 (g) che sono
presenti nel recipiente.
b. Come si spiega da un punto di vista cinetico l’arresto della reazione e la situazione di invarianza
delle quantità chimiche di reagenti e prodotti che si è venuta a creare?
11 Esame complementare passerella “maturità professionale - scuole universitarie”
Locarno, sessione estiva 2015
Scienze sperimentali, chimica
________________________________________________________________________________
c. Stabilisci qualitativamente come reagisce il sistema in seguito ad una diminuzione della
pressione totale fatta avvenire a temperatura costante (sempre 650 °C) (ad esempio
raddoppiando il volume).
d. Stabilisci qualitativamente cosa cambia nel sistema a seguito di una diminuzione della
temperatura, con il volume che rimane di 10,0 L.
e. Disegna le formule di struttura complete delle sostanze coinvolte nella reazione.
CO
f. Stabilisci:
H2O
CO2
-qual è la geometria dell’atomo di carbonio nel CO e nella CO2;
-qual è la geometria dell’atomo di ossigeno nel CO nella H2O e nella CO2.
CO
H2O
carbonio
̶
ossigeno
12 H2
CO2