Lezione 08TD-2012
Argomenti di questa lezione (esercitazione)
• Iniziare ad affrontare esercizi di termodinamica
pagina 1
Lezione 08TD-2012
pagina 2
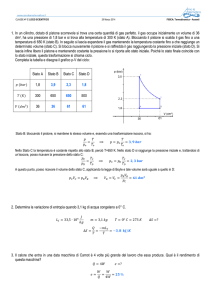
Esercizio 3, 5 luglio 2005
Una macchina di Carnot produce lavoro funzionando con 5
moli di un gas biatomico ideale, fra due termostati alle
temperature T1=7°C e T2=77°C. Nello stato A (quello a
volume maggiore), il gas occupa 200 litri e nello stato C
(quello a volume minore) ne occupa 50.
a) Rappresentare il ciclo sul piano pV, dopo aver
individuato pressione e volume di tutti gli stati gli estremi
delle due isoterme.
b) Determinare il rendimento della macchina.
c)
Calcolare il lavoro fatto in un ciclo.
d) Calcolare la variazione di entropia ∆S1 nell’isoterma a
temperatura T1 e la variazione ∆S2 nell’isoterma a
temperatura T2, poi commentare il confronto dei due
risultati ottenuti.
Lezione 08TD-2012
pagina 3
Esercizio 3, 5 luglio 2005
Il grafico che rappresenta il ciclo è qualitativamente come
quello in figura, con VC=VA/4.
Inoltre si sa che TCD=350K e TAB=280K, ovvero
TCD/TAB=5/4.
Utilizzando la relazione di Poisson per le adiabatiche, se ne
deduce che VDγ=(4/5)VAγ e VBγ=(5/4)VCγ avendo indicato
con γ il rapporto cp/cv=7/5.
Da qui si ricavano VD e VB, poi, con l’equazione di stato
dei gas perfetti si ricavano le pressioni pA, pB, pC, pD.
Il rendimento di una macchina di Carnot è notoriamente
η=1−TF/TC: in questo caso, η=1−4/5=1/5=20%.
Il lavoro sul ciclo si può calcolare direttamente per somma
dei quattro lavori (e, in tal caso, sulle adiabatiche conviene
sfruttare il fatto che L=−∆U=−ncv∆T), oppure, assai più
rapidamente, si può calcolare a partire da QCD,
moltiplicando poi per η.
La variazione d’entropia sulle due isoterme, si calcola
mediante l’integrale di Clausius, essendo esse
trasformazioni reversibili.
Si devono ottenere due risultati opposti, infatti, sommando
∆S1, ∆S2 e le due variazioni (nulle) d’entropia sulle
adiabatiche DA e BC, si deve ottenere zero, come in
qualunque ciclo termodinamico.
Lezione 08TD-2012
pagina 4
Esercizio 3, 4 aprile 2005
Si consideri un ciclo termodinamico reversibile che
riguarda n moli di gas perfetto monoatomico e che è
costituito nell’ordine da un’espansione adiabatica AB, da
un’isobara BC e da un’isocora CA. Nella trasformazione
AB, il volume del gas raddoppia.
a, b) Determinare il rapporto fra le pressioni negli stati B ed
A e rappresentare il ciclo sul piano pV.
Inoltre, supponendo note la pressione pA e il volume VA
dello stato A, calcolare:
c) il lavoro svolto dal gas in AB;
d) il calore scambiato in BC;
e) la variazione d’entropia in CA;
f) il rendimento del ciclo (specificando il tipo di macchina
cui si fa riferimento).
Lezione 08TD-2012
pagina 5
Esercizio 3 4 aprile 2005
a, b) Con buona approssimazione, per
p
A
un gas perfetto monoatomico si ha che
cp/cV=γ=5/3, per cui in una espansione
adiabatica reversibile in cui il volume
C
B
V
raddoppia, essendo
pAVAγ=pBVBγ=pB(2VA)γ si ha che la
pressione passa da pA a pB=pA×2-γ.
In conclusione, pB/pA=2-5/3≅0.315. Quindi il grafico è del
tipo rappresentato in figura.
c) Il lavoro svolto in AB può essere desunto a partire dal
primo principio della termodinamica, che applicato a
trasformazioni adiabatiche afferma che L=-∆Eint e che
quindi per un gas perfetto diventa L=-ncV∆T, nel nostro
caso L=-n(3R/2)(TB-TA). Da questa espressione, ricordando
che pV=nRT si ricava
LAB=-(3/2)(pBVB-pAVA)=(3/2)pAVA(1-21-γ)=
(3/2)pAVA(1-2-2/3).
d) La trasformazione BC è un’isobara così che se
conosciamo ∆TBC possiamo calcolare il calore (ceduto)
dalla definizione stessa di cp: QBC=ncp∆T=ncp(TC-TB). Lo
stato B è già stato determinato, lo stato C è facilmente
determinabile poiché ha la pressione pC=pB ed il volume
VC=VA, noti. Dunque il calcolo di QBC è piuttosto diretto:
TC=TA×(pC/pA)=TA×(pB/pA)=TA×2-γ; TB=pBVB/nR=21-γTA; e
quindi QBC= ncpTA(2-γ−21-γ)=(5/2)pAVA(2-γ−21-γ).
Lezione 08TD-2012
pagina 6
e) CA è una trasformazione reversibile. Per cui la
variazione d’entropia ∆SCA può essere valutata calcolando
l’integrale di Clausius su tale isocora:
∫C
A
∆SCA=
ncVdT/T=
A
=(3nR/2)× ∫C dT/T=(3nR/2)×ln(TA/TC)=
=(3nR/2)γln2=(5nR/2)ln2.
f) Il ciclo è percorso in senso orario, quindi si tratta
certamente di un ciclo che produce lavoro (motore) a spese
del calore che viene assorbito (nella trasformazione CA).
Per il primo principio della termodinamica, il rendimento
η=L/Qass si può scrivere come η=(Qass-Qced)/Qass=
1-Qced/Qass= 1-|QBC|/QCA, dove QBC è un valore già noto,
perché calcolato al punto d) e
QCA=ncV∆TCA=(3nR/2)TA(1-2-γ)=
=(3/2)pAVA(1-2-5/3).
In conclusione, η=1-(5/3)(2-γ−21-γ)/(1-2-γ)=….
Lezione 08TD-2012
pagina 7
Esercizio 3, 7 ottobre 2003
Un impianto di condizionamento viene utilizzato per
mantenere fresco (a temperatura Tint=20°C) un locale in una
giornata estiva in cui la temperatura esterna è Text=36°C).
A regime, la macchina utilizza un motore che consuma
20kW e si sa che essa ha un rendimento pari ad un terzo di
quello che avrebbe una macchina di Carnot funzionante
nelle stesse condizioni.
a) Determinare i rendimenti della macchina di Carnot e
della macchina in questione.
b) Calcolare la potenza termica ceduta dalla macchina
all’ambiente e la potenza termica entrante nel locale
(ad esempio attraverso le finestre e le pareti riscaldate
dal sole).
c) Calcolare la variazione d’entropia dell’ambiente
esterno e di quello interno in un ciclo della macchina,
sapendo che essa compie 10 cicli al secondo.
Lezione 08TD-2012
pagina 8
Esercizio 3, 7 ottobre 2003
a)ηCarnot= Qass/(Qced-Qass)
siccome la macchina di Carnot scambia con i termostati
quantità di calore proporzionali alle temperature dei
termostati stessi:
h=Tint/(Test-Tint)=293/16≅18
ηmacchina=1/3η≅6
b) dalla definizione di η=Qass/|L| la quantità di calore
immessa nella macchina (cioè sottratta all’ambiente
interno) nell’unità di tempo è uguale a η volte il lavoro
svolto nell’unità di tempo, ovvero la potenza 20KW
Ptermica= ηPmeccanica=120KW
c) la macchina considerata assorbe ogni secondo 120KJ di
calore, e poiché ogni secondo compie 10 cicli, ad ogni ciclo
assorbe Qass=12KJ di calore.
Tale scambio avviene a temperatura Tint=293K e quindi
comporta una diminuzione di entropia per l’ambiente
interno pari a ∆S=Qass/Tint=50J/K
In un ciclo la macchina compie lavoro negativo Lciclo=
12KJ=Qass-Qced è Qced=14KJ; lo scambio di calore con
l’esterno avviene a temperatura Test è ∆S=-Qced/Test=-45J/K
La somma algebrica delle variazioni di entropia è >0, si ha
globalmente un aumento di entropia, come ci si deve
aspettare da una macchina irreversibile.
Lezione 08TD-2012
pagina 9
Esercizio 4, 7 ottobre 2003
Disegnare sul piano di Clapeyron una trasformazione
ciclica costituita nell’ordine da un’isocora AB,
un’espansione libera BC e una compressione adiabatica
CA.
Supponendo che il ciclo riguardi 2 moli di gas perfetto
monoatomico e che nella compressione adiabatica si abbia
un raddoppio della pressione, si determinino i lavori svolti,
i calori scambiati e le variazioni d’entropia nelle tre
trasformazioni.
Si assumano noti il volume VA e la temperatura TA dello
stato iniziale
Lezione 08TD-2012
pagina 10
Esercizio 3, 2 ottobre 2002
Un cilindro la cui sezione ha area S è racchiuso
superiormente da un pistone di massa M
che può scorrere liberamente e
M
garantisce una tenuta perfetta. Se il
pistone sale di un tratto d, esso arriva a
d
toccare un altro oggetto di massa M,
M
così che, per sollevarsi ulteriormente
deve sollevare anche tal oggetto.
d
Fuori del cilindro la pressione è nulla,
mentre sotto il pistone ci sono n moli di
gas monoatomico che occupano inizialmente un volume Sd.
Viene fornito calore Q (da determinare), fino a quando il
pistone arriva a toccare il secondo oggetto. Poi viene fornita
una quantità di calore doppia di Q.
a) Rappresentare l’intero processo sul piano pV.
b) Calcolare Q ed il lavoro fatto dal gas per sollevare il
pistone del primo tratto d.
c) Calcolare poi il lavoro necessario a sollevare il pistone
insieme al secondo oggetto.
d) Calcolare la variazione d’entropia del gas nelle diverse
fasi del processo
Lezione 08TD-2012
Esercizio 3 2 ottobre 2002
a) Fin quando il pistone può
muoversi liberamente, la
pressione del gas è pA=Mg/S e
quindi il gas può subire solo
trasformazioni isobare a tale
pressione; ciò si verifica per tutti i
volumi inferiori a 2Sd.
pagina 11
p
C
D
A
B
V
Se il pistone tocca il secondo oggetto, la pressione può
crescere, ed il pistone resta fermo (trasformazione isocora)
fin quando la pressione non diventa così grande da
permettere di sollevare pistone+oggetto, cioè fin quando
non raggiunge il valore pC=2Mg/S=2pA.
Oltre pC la pressione non può salire: fornendo calore il
pistone salirà spostando l’oggetto, lasciando espandere il
gas in una isobara a pressione pC, analogamente a quanto
succedeva inizialmente.
Tutto ciò si riassume in un grafico come quello a lato, dove
si deve intendere che Q=QAB e QBC+QCD=2Q. Sarà poi da
definire quanto del 2Q serve nell’isocora BC e quanto ne
resta (ammesso che ne resti) per l’isobara CD.
b) In AB, T raddoppia e il gas compie lavoro LAB=MgD
(contro la gravità). Inizialmente T=
TA=pV/nR=(Mg/S)(Sd)/(nR)=Mgd/(nR), e quindi
∆TAB=2T−T=T=Mgd/(nR). Il calore Q è quindi
QAB=ncp∆TAB=n(5R/2)Mgd/(nR)=5Mgd/2.
Lezione 08TD-2012
pagina 12
c) Nell’isocora BC, p raddoppia e quindi anche T, arrivando
a 4TA, così che ∆TBC=4TA−2TA=2TA.
Quindi QBC=ncv∆TBC=n(3R/2)2(Mgd/nR)=3Mgd. Della
quantità di calore 2Q=5Mgd che viene fornita, quindi 3Mgd
serve all’isocora e ne avanza 2Mgd che viene assorbita
nell’isobara CD. Si ricava perciò che
∆TCD=2Mgd/ncp=(4/5)Mgd/R, e allora TCD=TC+∆TCD=
4TA+∆TCD=(24/5)Mgd/R. Conoscendo ∆TCD, e sapendo che
in un’isobara ∆(pV)=p∆V, si trova che
LCD=p∆VCD=nR∆TCD, quindi LCD=4Mgd/5. LCD è fatto per
sollevare una massa 2M, la quale quindi sale di 2d/5.
d) Tutte e tre le trasformazioni devono considerarsi
reversibili, così che le variazioni d’entropia si possono
valutare calcolando integrali di Clausius.
In particolare, usando i risultati ricavati sopra, si ottiene:
∆SAB=∫ABncpdT/T=ncpln2=5/2nRln2;
∆SBC=∫BCncVdT/T=ncpln2=3/2nRln2;
∆SCD=∫CDncpdT/T=ncpln2=
=5/2nRln(TD/TC) =5/2nRln(6/5).
Lezione 08TD-2012
pagina 13
Esercizio 3, 17 gennaio 2007
Del gas perfetto monoatomico compie un ciclo reversibile
ABC costituito nell’ordine da una compressione isoterma
AB, da un’isobara BC e da un’isocora CA nella quale viene
scambiata una quantità di calore nota QCA. L’isoterma
avviene con scambio di calore fra il gas in questione e
un’uguale quantità di gas che sta compiendo invece un ciclo
di Carnot fra le temperature TAB e TC. Calcolare la quantità
di calore scambiata in ogni fase dei due cicli da parte delle
due quantità di gas. Calcolare inoltre la variazione
d’entropia nell’isobara BC, nell’isocora CD e nell’isoterma
a temperatura superiore del ciclo di Carnot.
Lezione 08TD-2012
pagina 14
Esercizio 4, 17 gennaio 2007
Un impianto di riscaldamento convenzionale utilizza una
caldaia dove la fiamma brucia a 1000°C, e sviluppa energia
termica che viene trasferita all’ambiente (a 20°C) con una
potenza di 10kW.
Si supponga che la temperatura esterna sia di -10°C e che lo
stesso scopo di riscaldare l’ambiente sia perseguito
utilizzando due macchine di Carnot: la prima a produrre
energia meccanica sfruttando il salto termico fra fiamma e
ambiente esterno; la seconda a funzionare da pompa di
calore azionata prima. Quale potenza termica sarebbe
convogliata verso l’ambiente interno?