CALORE
Temperatura e calore
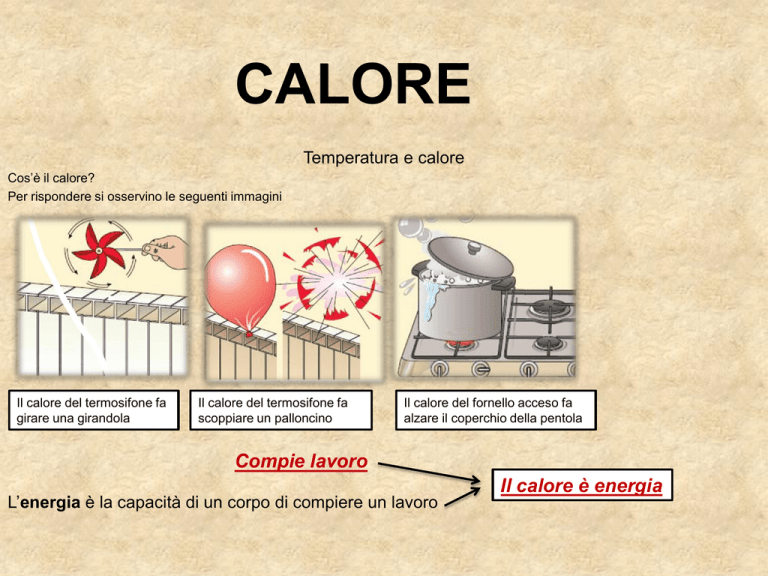
Cos’è il calore?
Per rispondere si osservino le seguenti immagini
Il calore del termosifone fa
girare una girandola
Il calore del termosifone fa
scoppiare un palloncino
Il calore del fornello acceso fa
alzare il coperchio della pentola
Compie lavoro
L’energia è la capacità di un corpo di compiere un lavoro
Il calore è energia
CALORE
L’energia è una proprietà dei sistemi
L’energia non si crea né si distrugge
L’energia entra in gioco tutte le volte che i sistemi si trasformano
L’energia si può manifestare in diversi modi tutti riconducibili a due categorie
Il vento, una bici in corsa possiedono energia cinetica
ENERGIA CINETICA, legata al movimento
ENERGIA POTENZIALE, legata alla posizione
Più un corpo sta in alto maggiore è la sua
energia potenziale
Anche una molecola possiede energia
potenziale che dipende dalla posizione
reciproca delle particelle che la costituiscono
CALORE
L’energia non si crea né si distrugge ma si trasforma
s
Energia potenziale
Si trasforma
Energia potenziale
delle molecole
presenti nel gelato
Si trasforma
energia cinetica
Energia cinetica
CALORE
Tutti i corpi possiedono energia cinetica, legata al moto delle particelle che lo costituiscono
Questa forma di energia dipende dalla temperatura
ENERGIA TERMICA
In questa immagine è rappresentato il moto delle particelle di un corpo che si trova a temperature diverse
La temperatura del corpo nell’immagine
A è minore della temperatura del corpo
nell’immagine B che a sua volta è
minore della temperatura del corpo
nell’immagine C
A
B
C
Il moto delle particelle aumenta con l’aumentare della temperatura
CALORE
Da che cosa dipende l’energia termica?
Energia termica
t = 40 oC
Energia termica
t = 40 oC
Si considerino due diverse quantità di acqua
alla stessa temperatura.
L’acqua con massa maggiore, immagine B, è
costituita da un maggior numero di particelle e
quindi ha maggiore energia termica
Energia termica
t = 40 oC
C
EA < EB
B
Energia termica
A
t = 80 oC
D
Si considerino due quantità uguali di acqua a
diversa temperatura.
L’acqua con temperatura maggiore, immagine
D, è costituita da particelle che hanno
maggiore velocità e quindi ha maggiore
energia termica
EC < ED
L’energia termica è una proprietà di un corpo ed è una grandezza che dipende dalla massa e dalla temperatura
L’energia termica aumenta all’aumentare della massa e della temperatura
CALORE
Quando due corpi a diversa temperatura vengono messi a contatto raggiungono la stessa temperatura
<
t1
temperatura di equilibrio teq
t2
I due corpi raggiungono la stessa temperatura
t2
temperatura
t1
calore
teq
teq
In questo grafico si nota la diminuzione della temperatura del
corpo caldo e l’aumento della temperatura del corpo freddo
tempo
Energia passa dal corpo a temperatura maggiore al corpo a temperatura minore: tale energia si chiama calore
Il calore si può allora definire energia termica in transito
il calore che viene assorbito dal corpo freddo e ne provoca un aumento di temperatura
Il calore viene ceduto dal corpo caldo e ne provoca una diminuzione di temperatura
CALORE
Il calore, come l’energia termica, dipende dalla massa e dalla temperatura
Il calore dipende anche da un’altra grandezza fisica che è caratteristica del materiale di cui è costituito il corpo
CALORE SPECIFICO C
Definizione 1: calore specifico è il calore che 1 Kg di sostanza deve assorbire affinchè la sua temperatura aumenti di 1 K
Definizione 2: calore specifico è il calore che 1 g di sostanza deve assorbire affinchè la sua temperatura aumenti di 1 oC
Relazioni utili nella soluzione degli esercizi
Se il sistema costituito dal corpo caldo e dal corpo freddo è isolato, il calore ceduto dal corpo caldo è uguale al calore assorbito dal
corpo freddo
1. Qceduto = Qassorbito
Formule inverse
Il calore ceduto è uguale alla massa del corpo caldo per il calore specifico
del corpo caldo per temperatura iniziale meno temperatura finale
mcorpo freddo o caldo
2.
Qceduto = mcorpo caldo x ccorpo caldo x (tiniziale − tfinale)
Il calore assorbito è uguale alla massa del corpo freddo per il calore specifico
del corpo freddo per temperatura finale meno temperatura iniziale
3.
teq =
Qassorbito o ceduto
ccorpo freddo o caldo x Δt
Qassorbito o ceduto
Δt = c
corpo freddo o caldo x mcorpo freddo o caldo
Qassorbito = mcorpo freddo x ccorpo freddo x (tfinale − tiniziale)
Dalle relazioni 1. 2. e 3
=
Δt = tmaggiore − tminore
mcorpo caldo x ccorpo caldo x (tiniziale − tfinale) = mcorpo freddo x ccorpo freddo x (tfinale − tiniziale)
mcorpo caldo x ccorpo caldo x tcorpo caldo + mcorpo freddo x ccorpo freddo x tcorpo freddo
mcorpo caldo x ccorpo caldo + mcorpo freddo x ccorpo freddo
CALORE
Il calore nei passaggi di stato
Analisi della curva di riscaldamento di una sostanza solida dal punto di vista particellare
Tratto AB: il calore fornito alla sostanza provoca un aumento del moto
vibrazionale delle particelle che continuano a occupare una
posizione fissa, la temperatura della sostanza aumenta
Tratto BC: il calore fornito alla sostanza serve a rompere la struttura
ordinata del solido, a rendere le particelle più libere di
muoversi, la temperatura della sostanza non aumenta
fusione
tale calore è il calore latente di fusione
tempo di riscaldamento t (s)
Tratto CD: : il calore fornito alla sostanza provoca un aumento del moto
delle particelle, la temperatura della sostanza aumenta
Tratto DE: il calore fornito alla sostanza serve a rompere le forze di
attrazione tra le particelle del liquido che così diventano
indipendenti, libere di muoversi in tutte le direzioni
ebollizione
tale calore è il calore latente di ebollizione
Dopo il punto E: : il calore fornito alla sostanza provoca un aumento del
moto delle particelle, la temperatura della sostanza aumenta
CALORE
Il calore nei passaggi di stato
Analisi della curva di raffreddamento di una sostanza aeriforme dal punto di vista particellare
Tratto AB: il calore tolto alla sostanza provoca una diminuzione del moto
delle particelle, la temperatura della sostanza diminuisce
Tratto BC: il calore tolto alla sostanza provoca un avvicinamento delle
particelle che la costituiscono e tra queste si stabiliscono delle
forze di attrazione , la temperatura della sostanza non
diminuisce
t oC
condensazione
tale calore è il calore latente di condensazione
tempo di raffreddamento t (s)
Tratto CD: : il calore tolto alla sostanza provoca una diminuzione del moto
delle particelle, la temperatura della sostanza diminuisce
Tratto DE: il calore tolto alla sostanza provoca un ulteriore avvicinamento delle
particelle che la costituiscono e un aumento delle forze di
attrazione tra le stesse, la temperatura della sostanza non
diminuisce
solidificazione
tale calore è il calore latente di solidificazione
s
Dopo il punto E: : il calore tolto alla sostanza provoca una diminuzione del moto
vibrazionale delle particelle, la temperatura della
sostanza diminuisce
Il calore latente è il calore che una sostanza assorbe o cede durante un cambiamento di stato
Il calore latente dipende da: sostanza, cambiamento di stato e massa
CALORE
Unità di misura
Il calore essendo energia in transito è, come l’energia, una grandezza fisica derivata
Il calore, nel sistema internazionale, ha come unità di misura il Joule simbolo J
il calore ha come unità di misura la caloria simbolo cal o kilocaloria simbolo Kcal
1 Kcal = 1000 cal
1 cal = 4,186 J
CALORE
Esempi di esercizi con soluzioni: calore assorbito o ceduto
Quanto calore bisogna fornire a un pezzo di piombo di massa 225 g per portarne la temperatura da 15 oC a 25 oC. Il calore specifico
c del piombo è 128 J/(Kg∙K)
Dati:
mpiombo = 225g = 0,225 Kg; tiniziale = 15 oC = (273 +15) K = 288 K; tfinale = 25 oC = (273 + 25) K = 298 K; cpiombo = 128 J/(Kg∙K)
Qa = ?
Il piombo deve assorbire calore per aumentare la propria temperatura
Qa = m∙c∙(tfinale − tiniziale)
Qa = 0,225 Kg∙128
J
Kg∙K
∙ (298 − 288)K = 288 J
CALORE
Esempi di esercizi con soluzioni: uso di formule inverse
Quanta acqua viene raffreddata da 75°C a 0°C se si liberano 5000 cal?
Dati: Qceduto = 5000 cal; tiniziale = 75 oC; tfinale = 0
oC;
L’acqua cede calore in quanto la sua temperatura diminuisce
cacqua = 1 cal/(g∙oC); macqua =?
Qceduto = m∙c∙(tiniziale − tfinale)
Formula inversa
m
Qceduto
c∙(tiniziale − tfinale)
=
=
5000 cal
1 cal/(g∙oC)∙(75 oC − 0oC)
= 66,67 g ≈ 67 g
Perché il risultato è espresso in grammi?
Per rispondere alla domanda bisogna fare l’analisi delle unità di misura delle grandezze che compaiono nella formula
1
cal
cal
g∙oC
∙
=
0C
1
g
=
g
CALORE
Esempi di esercizi con soluzioni: temperatura di equilibrio
Due masse uguali di acqua hanno rispettivamente temperatura di 60 oC e di 40 oC, mescolandole senza che ci sia
scambi di calore con l’ambiente, quale sarà la temperatura di equilibrio?
Dati: macqua calda = macqua fredda tacqua fredda = 40 oC tacqua calda = 60 oC
Quando i due corpi hanno la stessa massa e sono formati della stessa sostanza
teq =
tacqua calda + tacqua fredda
2
=
60 oC + 40 oC
2
o
= 50 C
Se le masse dei due corpi sono diverse, si applica la formula teq
mcorpo caldo∙ tcorpo caldo + mcorpo freddo∙ tcorpo ffreddo
=
mcorpo caldo + mcorpo freddo
Prova tu : A quale temperatura arriva un sistema ottenuto mescolando 1000 g di acqua a 20°C con 250 g di acqua
a 80°C?
Se i due corpi sono formati da materiali diversi e hanno masse diverse, si applica la formula
mcorpo caldo x ccorpo caldo x tcorpo caldo + mcorpo freddo x ccorpo freddo x tcorpo freddo
teq =
mcorpo caldo x ccorpo caldo + mcorpo freddo x ccorpo freddo
Prova tu: a quale temperatura arriva un sistema ottenuto mescolando 40 g di acqua a 10°C con un blocchetto di
ferro di 100 g a 60°C? cferro = 0,12 cal/g °C cacqua = 1 cal/g °C
CALORE
Esempi di esercizi con soluzioni: calore latente
Calcola il calore che bisogna fornire a un pezzo di ghiaccio avente massa di 0,300 Kg e che si trova alla
temperatura di 0 oC per fonderlo. Il calore latente di fusione Lf è uguale a 334000 J/Kg
Dati: mghiaccio = 0,300 Kg Lf = 334000 J/Kg
La formula da applicare è: Qf = mxLf
Qf = 0,300Kgx33400
J
= 10020J
Kg
CALORE
Esempi di esercizi con soluzioni: calore latente
Un pezzo di ghiaccio di 0,300 Kg si trova nel freezer a una temperatura di -20°C. Quanto calore è necessario per trasformarlo in
acqua alla temperatura di +20°C? Si consideri che il calore specifico del ghiaccio è uguale a 2220 J / (kg · K), il calore specifico
dell’acqua è uguale a 4186 J / (kg · K) e il calore latente di fusione del ghiaccio Lf è uguale a 334000 J/Kg .
Dati:
mghiaccio = 0,300Kg tiniziale = ‒20 oC = 253 K tfusione = 0 oC = 273 K tfinale = 20 oC = 293 K cghiaccio = 2220 J / (kg · K)
cacqua = 4186 J/(kg · K) Lf = 334000 J/Kg
20 oC
Per risolvere tale problema si tenga presente la curva di riscaldamento dell’acqua
Il ghiaccio deve assorbire il calore Q1 per passare dalla temperatura di ‒20 oC alla temperatura di 0 oC
Il ghiaccio deve assorbire il calore Q2 per fondere e diventare acqua
L’acqua deve assorbire il calore Q3 per passare dalla temperatura di 0 oC alla temperatura di 20 oC
0 oC
Q3
Q1
Q2
‒20 oC
Q1 = mghiaccio x cghiaccio x (tfusione ‒ tiniziale) = 0,300 Kg x 2220 J/(kg · K) x (273 − 253) K = 13320 J
Q2 = mghiaccio x Lf = 0,300 Kg x 334000 J/Kg = 10020 J
Q3 = macqua x cacqua x (tfinale − tfusione) = 0,300 Kg x 4186 J/(kg · K) x (293 − 273) K = 25186 J
Qtotale = Q1 + Q2 + Q3 = (13320 + 10020 + 25186) J = 48526 J









