MALATTIE GENETICHE
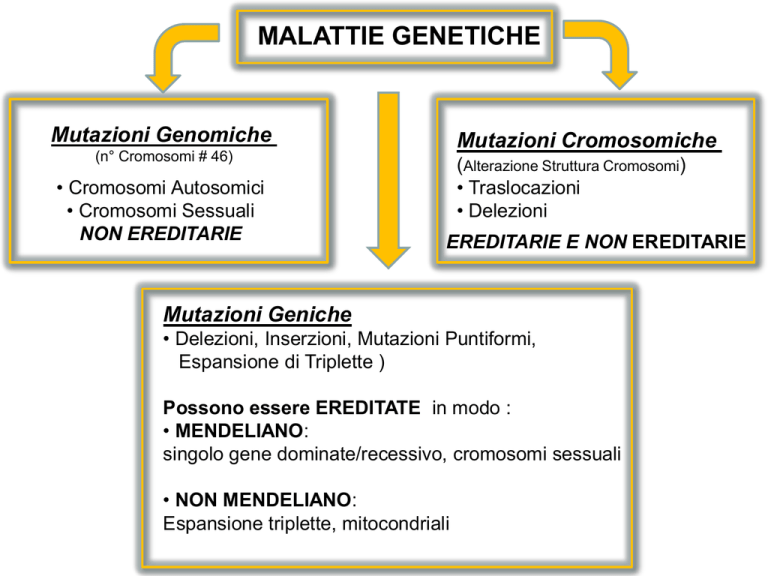
Mutazioni Genomiche
Mutazioni Cromosomiche
(n° Cromosomi # 46)
• Cromosomi Autosomici
• Cromosomi Sessuali
NON EREDITARIE
(Alterazione Struttura Cromosomi)
• Traslocazioni
• Delezioni
EREDITARIE E NON EREDITARIE
Mutazioni Geniche
• Delezioni, Inserzioni, Mutazioni Puntiformi,
Espansione di Triplette )
Possono essere EREDITATE in modo :
• MENDELIANO:
singolo gene dominate/recessivo, cromosomi sessuali
• NON MENDELIANO:
Espansione triplette, mitocondriali
PATOLOGIA GENETICA
Studia i fenomeni patologici che riconoscono come causa
un’alterazione del genoma
Differenza tra:
• Malattie genetiche
• Malattie ereditarie
• Malattie congenite
Malattie genetiche: comprendono tutte quelle condizioni patologiche
a carico del patrimonio genetico (ereditarie e non)
Malattie ereditarie:
Derivano dai genitori, sono trasmesse attraverso le cellule
germinali nelle diverse generazioni e sono quindi familiari
Non tutte le malattie ereditarie si manifestano al momento della
nascita (ex. Corea di Huntington)
Malattie congenite: significa “Nato con”. I sintomi sono riscontrabili
al momento della nascita. Non tutte le malattie congenite sono
ereditarie (ex. Sindrome di Down, raramente lo e’) oppure determinate
geneticamente (ex. Toxoplasmosi).
Derivano da fattori patogeni di natura fisica/chimica/biologica che
agendo durante la vita intrauterina inducono alterazioni organiche
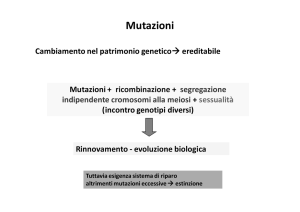
Mutazioni ed Evoluzione
• L’insorgenza di mutazioni é dovuta ad una interazione fra
componenti ambientali (esempio: radiazioni ionizzanti, raggi
UV, composti chimici) e una non perfetta efficienza dei sistemi
di riparazione dei danni al DNA
• Le mutazioni peró possono insorgere anche spontaneamente:
una classe di DNA polimerasi é detta “a bassa fedeltá” proprio
per la sua tendenza ad inserire errori: vi é pressione selettiva
per la riduzione, non per la scomparsa delle mutazioni
NON TUTTE LE MUTAZIONI RISULTANO
ESSERE CAUSA DI MALATTIE…
HIV-1 e DCCR5
Meccanismo di Infezione da HIV-1
Il Recettore CCR5 (CD195)
• Localizzato sul cromosoma 3
• Recettore per le chemiochine RANTES, Mp1alfa e Mip1 beta
• Espresso su linfociti T, Macrofagi, cellule dendritiche e microgliali
• Esiste una mutazione D32 (32 nucleotidi) che produce una proteina
non capace di raggiungere la superficie cellulare
• L’allele D32 è comune nella popolazione Caucasica (frequeunza 10%)
ma quasi assente in Africa e Asia
• I portatori Omozigoti di questa mutazione non hanno CCR5
sulla superficie cellulare
• Sono resistenti all’infezione da HIV-1 (R5)
• Hanno un fenotipo normale
Individui Recanti la Mutazione D32 sono protetti
dall’Infezione HIV-1 (R5)
In 2008, Timothy Ray Brown got what scientist call a sterilizing cure. Brown was
diagnosed with HIV in 1995 and later, in 2006, was also diagnosed with acute myeloid
leukemia. In 2007 and 2008 Mr. Brown received two stem cell transplants from a single
donor with homozygous alleles for the delta-32 mutation. After the initial transplant, Mr
Brown stopped his antretroviral medication treatment, which three months later resulted
in the plummeting of his HIV infection levels and increased the number of CD4 T cells in
his blood. To this day, Mr. Brown is not using antiretroviral drugs and is considered cured
by the scientific community. This has lead other scientists to propose a similar mode of
action though the use of genetically engineered autologous cells to treat HIV by using
gene therapy.
Malattie Genetiche
In funzione dell’estensione della mutazione posso essere suddivise in:
1) Mutazioni genomiche (ANEUPLOIDIA): perdita o acquisto di interi
cromosomi (ex. Sindrome di Down)
2) Mutazioni cromosomiche (riarrangiamento di materiale genomico,
ex. traslocazioni)
Definite anche come: Aberrazioni Cromosomiche
3) Mutazioni Geniche
Aberrazioni Cromosomiche
1) Mutazioni genomiche (Aneuploidia)
2) Mutazioni cromosomiche (ex. Traslocazioni)
Mutazioni genomiche
Trisomia: 2n+1
Monosomia: 2n-1
• A carico dei cromosomi autosomici sono rare
• Più frequenti a livello dei cromosomi sessuali
Mutazioni genomiche
(Cause)
• Alterazione della meiosi durante la gametogenesi
• Alterazioni mitotiche durante le prime fasi dello sviluppo
(MOSAICISMO) (46,XY/47,XY,+21)
In entrambi i casi il fenomeno più frequente è di:
• NON DISGIUNZIONE (meiotica/mitotica)
Raramente SEGREGAZIONE (ritardo nella migrazione del cromosoma)
• NON-DISGIUNZIONE: incapacità dei cromatidi fratelli
appaiati di separarsi la divisione meiotica. I due
cromosomi o cromatidi congiunti migrano ad un polo e
vengono inclusi in una sola cellula figlia, mentre l’altra
avrà materiale genetico in meno
• RITARDO ANAFASICO: ritardata migrazione del
cromosoma durante l’anafase, conseguente perdita del
cromosoma. Mancata incorporazione di un cromosoma
nel nucleo di una delle cellule figlie.
Meiosi: è un processo di divisione mediante il quale una cellula eucariotica
con corredo cromosomico diploide dà origine a quattro cellule con corredo
cromosomico aploide.
Aneuploidia per non disgiunzione Meiotica
Mutazioni genomiche
(Cromosomi Autosomici)
Sindrome di Down: trisomia 21 (incidenza 1/700)
• causata prevalentemente da non disgiunzione meiotica, a carico
dell’ oocita
• aumenta con l’eta’ della madre (over 35 amniocentesi)
1/1550 sotto 20 anni, 1/25 sopra i 45 anni
• Più raramente (3-4% casi) causata da non disgiunzione mitotica in
una fase più o meno precoce dello zigote (Mosaicismo) con fenotipo
più lieve del precedente
• Traslocazione del braccio lungo del cromosoma 21 sul 14 (rara)
(QUESTA E’ EREDITARIA)
Sindrome di Down
Sindrome di Down
La SD si associa sovente a complicanze malformative che
richiedono interventi chirurgici rilevanti nel corso dei primi anni
di vita:
• il 50% presenta malformazioni cardiache,
• il 30% stenosi duodenale,
• l’1% atresia esofagea,
• il 2% malformazioni anorettali.
• La chirurgia oftalmica è richiesta nel 12% dei casi per
problemi di cataratta.
Oltre alle malformazioni congenite descritte, il soggetto con SD
ha la tendenza a sviluppare patologie secondarie per deficit nel
sistema immunitario con particolare predisposizione ad
infezioni batteriche; nell’1% poi dei casi compare leucemia
acuta. Nel corso della vita il soggetto Down tende anche a
sviluppare ipotiroidismo e diabete mellito.
Mutazioni genomiche
(Cromosomi Autosomici)
Edwards Syndrome:
Trisomia 18 (1/6000).
La sindrome ha un tasso molto basso di
sopravvivenza, derivante da anomalie cardiache,
malformazioni renali e
altri problemi negli organi interni.
MANIFESTAZIONI
•Ritardo mentale
•Ipotonia/Ipertonia
•Alterazioni flessioni dita
•Vizi cardiaci
•Anormalita’ piedi
•Occipite prominente
Mutazioni genomiche
(Cromosomi Autosomici)
Patau Syndrome:
trisomia 13 (1/15000)
common abnormalites include:
Nervous system Musculoskeletal
and cutaneous Urogenital
MANIFESTAZIONI
•Ritardo mentale
•Microcefalia microftalmo
•Labbro leporino e palatoschisi
•Vizi cardiaci
•Anormalita’ piedi
•Polidattilia
•Derivano quasi sempre da non disgiunzione meiotica nell’oocita.
• La probabilità Incrementa con l’età della madre
• A causa della severità del fenotipo, in entrambi i casi, la morte
sopraggiunge nel primo anno di età
Mutazioni genomiche
(Cromosomi Sessuali)
Più numerose perchè meglio tollerate:
• inattivazione di tutti i cromosomi X in eccesso tranne uno
• scarsa quantità di informazione genica presente sul cromosoma Y
Tutte le malattie:
• Causano problemi di sviluppo sessuale e fertilità
• Sono normalmente evidenziabili durante la pubertà
• Possono essere associate a ritardo mentale
Mutazioni genomiche
(Cromosomi Sessuali)
Lyonization: (Mary Frances Lyon 1961) solo uno dei due
cromosomi X rimane attivo (in modo casuale paterno/materno),
l’altro viene represso durante le prime fasi dell’embriogenesi e la
repressione persiste nella progenie. Le femmine hanno
mosaicismo derivante da cellule che hanno attivo il cromosoma X
da parte del padre o da parte della madre .
-Evidenziabile dal corpo di Barr nei nuclei in interfase (massa al lato
della membrana nucleare)
- Oggi si sa che non tutti i geni del X inattivo sono veramente inattivi
(ex. Sindrome di Turner femmine con un solo X) hanno severe
anomalie somatiche e sessuali
XIC (X inactivation center) contains four non-translated RNA
genes, Xist, Tsix, Jpx and Ftx,
XIST (X inactive specific transcript), che trascrive un RNA
espresso solo dal cromosoma inattivato e che non codifica alcuna
proteina ricopre, inattivando, il cromosoma dal quale e’ espresso.
XIST non è espresso nel maschio normale (46,XY).
Il cromosoma X differisce dagli autosomi per alcune
caratteristiche:
geni corti, minor numero di geni, bassa densità di geni.
The X-inactive specific transcript (Xist) gene encodes a large non-coding RNA that is
responsible for mediating the specific silencing of the X chromosome from which it is
transcribed. The inactive X chromosome is coated by Xist RNA, whereas the Xa is not .
The Xist gene is the only gene which is expressed from the Xi but not from the Xa.
X chromosomes which lack the Xist gene cannot be inactivated.
Artificially placing and expressing the Xist gene on another chromosome leads to
silencing of that chromosome.
Compared to the Xa, the Xi has high levels of DNA methylation, low levels of histone
acetylation, low levels of histone H3 lysine-4 methylation, and high levels of histone H3
lysine-9 methylation, all of which are associated with gene silencing.
The existence of genes along the inactive X which are not silenced explains the defects
in humans with abnormal numbers of the X chromosome, such as Turner syndrome (X0)
or Klinefelter syndrome (XXY).
X Inactivation
Esempi di malattie causate da anomalie
nel numero dei cromosomi sessuali
• Klinefelter syndrome: 47,XXY (1/1000)
•Turner syndrome: 45,X (1/5000)
• Multi-X Females: 47,XXX; 49,XXXXX
• XYY Sindrome: 47,XYY (1/1000)
Un solo cromosoma Y e’ in grado di determinare il sesso, su di esso
e’ presente il gene SRY (Sex-determining Region Y) che determina la
soppressione dei caratteri primari femminili (utero, tube e ovaio) e promuove
lo sviluppo dei caratteri sessuali maschili
Codifica per un fattore trascrizionale (HMG-box family) che
inizia la determinazione sessuale maschile
Klinefelter syndrome: 47,XXY (1/1000)
Klinefelter syndrome: 47,XXY (1/1000)
• mancato sviluppo dei caratteri sessuali secondari
• microrchidia e aspermatogenesi
• tendenza all'alta statura
• L'analisi dei cromosomi sui linfociti è lo standard
genetico di diagnosi
• deficit di androgeni
• solo il 10% presenta un ritardo mentale.
• ridotto sviluppo del linguaggio, con problemi
di espressività
• sul piano comportamentale si possono riscontrare
immaturità, poca sicurezza, timidezza
Turner syndrome: 45,X (1/5000)
Sintomi della sindrome di Turner sono:
• ipogonadismo con fenotipo femminile
• bassa statura
• torace a scudo (piatto) e capezzoli iperdistanziati;
• attaccatura dei capelli bassa
• orecchie a basso impianto;
• il viso può avere un aspetto da persona anziana
• sterilità dovuta a malformazioni dell'ovaia detta "a stria";
• amenorrea primaria, cioè, l'assenza della mestruazione (in Turner la menopausa
avviene prima del menarca all'età di 2 anni);
Multi-X Females: 47,XXX; 49,XXXXX
Le principali caratteristiche standard sono:
• altezza (maggiore che nella media)
• circonferenza cranica inferiore alla norma (soprattutto alla nascita, poi c’è un ridotto
recupero).
• sviluppo motorio generalmente un po’ ritardato. Inizio della pubertà tendenzialmente
ritardato.
• sviluppo cognitivo. In media di poco inferiore alla norma.
•sviluppo comunicativo e linguistico. Tendenzialmente allo stesso livello o inferiore
rispetto alle prestazioni intellettive generali.
XYY Sindrome: 47,XYY (1/1000)
I maschi XYY non
patologici.
presentano
particolari
fenotipi
Si tratta infatti di persone normali, con sviluppo intellettivo
normale, vita normale e prole normale.
Alcuni vecchi studi, riportano un aumento della statura
media dei maschi XYY.
In una percentuale variabile tra il 25 ed il 50% possono
andare incontro a problemi nella sfera del linguaggio
Mutazioni cromosomiche
(Anomalie strutturali dei cromosomi ex. Traslocazioni/Delezioni)
• (A) acrocentrici : centromero in posizione terminale
• (B) telocentrici: centromero in posizione subterminale
• (C) submetacentrici: centromero in posizione submediana
• (D) metacentrici: centromero in posizione mediana
Mutazioni cromosomiche
Rottura
Perdita di un braccio e duplicazione di quello rimanente
Rottura e fusione delle estremita’
problemi in meiosi/mitosi
LEUCEMIA PROMIELOCITICA ACUTA
TRASLOCAZIONE BILANCIATA t (15;17)
Mutazioni cromosomiche
TRASLOCAZIONE ROBERTSONIANA
Not Viable
La persona portatrice di questa anomalia è perfettamente sana. È da considerare, però,
che un’alta percentuale dei gameti prodotti dalle persone con traslocazioni bilanciate/ robertsoniane
può essere “sbilanciata”.
Di conseguenza, le persone che hanno una traslocazione, nella loro vita riproduttiva,
hanno un rischio superiore, rispetto a quello di chi non è portatore di traslocazioni, di avere figli con
patologia malformativa o di avere gravidanze interrotte da aborti
Malattie da Genomic Imprinting
(Prader-Willi, Angelman)
Genomic imprinting
• Per imprinting genomico si intende una modificazione
“epigenetica” di uno specifico allele nel gamete o nello
zigote, responsabile per l’espressione differenziale dei
due alleli del gene nelle cellule somatiche della progenie
• For the vast majority of autosomal genes, expression
occurs from both alleles simultaneously. In mammals
however, a small proportion (<1%) of genes are imprinted,
meaning that gene expression occurs from only one
allele.The expressed allele is dependent upon its parental
origin. For example, the gene encoding Insulin-like growth
factor 2 (Igf2) is only expressed from the allele inherited
from the father.
EPIGENETICA
• Per modificazione epigenetica, si intende una
modificazione ereditaria genomica, che non é associata
ad un cambio della sequenza di DNA.
Epigenome A Transcriptome A
Epigenome B Transcriptome B
Blood Cells Neural cells
Epigenetics: the bridge between Genotype and Phenotype
Epigenetic modifications modulate genetic information defining
the cellular Transcriptome and therefore Cell identity
40
Epigenetic Mechanisms: DNA Methylation and Histon Modifications
• DNA Methylation of promoter and CpG Islands leads to
transcriptional silencing.
HAT
HDACs
• The N-terminal of the core histone are subjected to several
types of post-translational modifications, including Acetylation,
Methylation, Phosporylation, Ubiquitylation, etc.
41
Imprinting control region
Demetilated maternal region
La delezione di ICR
porta all’espressione
materna di igf2
Malattie da Imprinting
• Prader-Willi syndrome
• Angelman syndrome
Prader-Willi Syndrome
• E’ una malattia genetica rara (colpisce 1 su 15.000-25.000 nati vivi)
caratterizzata dall'alterazione del cromosoma 15
• Ipotonia nell' infanzia, obesità dovuta ad iperfagia, ipogonadismo,
mani e piedi piccoli
• E’ la più comune tra le sindromi di microdelezione cromosomica
• Avviene per due diverse cause accertate, entrambe di tipo genetico:
Delezione sul cromosoma 15 paterno
Disomia uniparentale materna del cromosoma 15
Prader-Willi/Angelman Syndrome
• Nella PWS il gene materno è silenziato perché sotto imprinting,
mentre quello paterno è deleto
• La regione in questione è sul cromosoma 15 (15q11-q13).
• La PWS è strettamente correlata con la Sindrome di Angelman (AS),
che è causata da imprinting paterno e delezione del gene materno
caratterizzata da movimenti ripetitivi, simmetrici, atassici e da una
disposizione all' allegria, al riso frequente
Stage 1
In the first stage, infants with PWS are hypotonic or "floppy", with very low muscle
tone. Weak cry and a poor suck reflex are typical. Babies with PWS usually are unable
to breastfeed and frequently require tube feeding. These infants may suffer from
"failure to thrive" if feeding difficulties are not carefully monitored and treated. As these
children grow older, strength and muscle tone generally improve. Motor milestones are
achieved, but are usually delayed.
Stage 2
An unregulated appetite characterizes the second stage of PWS. This stage most
commonly begins between ages 2 and 6 years old. Individuals with PWS lack normal
hunger and satiety cues. They usually are not able to control their food intake and will
overeat if not closely monitored. Food seeking behaviors are very common. In
addition, the metabolic rate of persons with PWS is lower than normal. Left untreated,
the combination of these problems will lead to morbid obesity and its many
complications
Genomic Imprinting
(Prader-Willi and Angelman Syndromes)
Sono attivi solo:
• Un set di geni Prader-Willi (paterni)
• Un set di geni Angelman (materni)
Delezione banda q12
Cromosoma 15
Uniparental Disomy
Stesso risultato delle
delezione
Sono attivi solo:
• Un set di geni Prader-Willi (paterni)
Sono attivi solo:
•Un set di geni Angelman (materni)
Uniparental Disomy
Perdita del cromosoma
Materno (PWS) o
Paterno (Angelman S)
MUTAZIONI GENICHE EREDITARIE
Tutte quelle malattie derivanti da alterazioni genetiche che:
• possono essere trasmesse per via parentale perché
presenti nelle cellule germinali
Normalmente:
• non alterano la capacità riproduttiva
• sono compatibili con la vita
DEFINIZIONE DI MUTAZIONE
Permanente cambio nella sequenza del DNA
Tutte le mutazioni che avvengo a livello delle cellule germinali possono
essere trasmesse alla progenie e dare luogo a malattie ereditarie
Le mutazioni a carico di cellule somatiche non vengono trasmesse
per via ereditaria ma sono importanti nello sviluppo di
cancro e malattie congenite
Tipi di Mutazioni Geniche (I)
Possono verificarsi nelle regioni:
codificanti, regolatorie (ex promotori) e nei siti di splicing
• Mutazioni puntiformi: sostituzione di aa che causano cambio di
sequenza o stop codon (talassemia)
• Frame shift: delezione o inserzione di nucleotidi (cambio intera
sequenza aa a valle della mutazione)
• Inserzione/delezione di triplette: aggiunta o eliminazione di aa
• Espansione di triplette: caratterizzate dall’essere dinamiche perchè
aumentano durante la gametogenesi (ex.X-Fragile e Corea Huntington)
Mutazioni puntiformi
Introduzione stop
Autosomica recessiva
beta° talasemia
uracil-DNA glicosilasi
Mutazioni “frame-shift”
Autosomico recessivo (esosaminidasi A)
Malattia da accumulo lisosomiale nel cervello
Inserzione di 4 nts e cambio della sequenza aa
a valle della mutazione
Delezioni di triplette
Eliminazione di aa con alterazione della struttura/funzione
della proteina)
Fibrosi cistica autosomica recessiva
Espansione di triplette
Classificazione delle malattie ereditarie
• Mendeliane (mutazione di singoli geni con ampio effetto)
• Multifattoriali (genetici e ambientali)
• Malattie da singolo gene con trasmissione non mendeliana (ex.
espansione da triplette, malattie mitocondriali)
Mendeliane
(mutazione di singoli geni con ampio effetto)
• Autosomiche domaninanti (ex. Ipercolesterolemia Familiare)
• Autosomiche recessive (ex. Fibrosi cistica)
• Sex-Linked (ex. Emofilia A, Distrofia Muscolare)
Autosomiche Dominanti (I)
- Manifeste clinicamente allo stato eterozigote (maschi e femmine
affetti in egual misura)
- Fenotipo influenzato da:
• penetranza (% di individui che, avendo il gene malato, manifesta il
fenotipo)
• espressivitá (livello di fenotipo)
Dovute alla presenza di geni modificanti
Autosomiche Dominanti (II)
-Normalmente coinvolgono DUE TIPI DI MUTAZIONI:
- Mutazione per Perdita di funzione
- Mutazione per Guadagno di funzione
-E DUE CATEGORIE DI PROTEINE
- Proteine regolatorie (ex. LDLr Familial Hypercholesterolemia),
- Proteine strutturali (ex. Collagene in Osteogenisis Imperfecta )
Pedigree di una Malattia
Autosomica Dominante
Autosomiche domaninanti
(ex. Familial Hypercholesterolemia)
E’ una malattia recettoriale causata da una mutazione nel gene
codificante:
Il recettore per Low-density lipoprotein (LDL) coinvolto nel
trasporto e metabolismo del colesterolo che causa un elevato
livello di colesterolo nel plasma (2-3 volte rispetto alla media)
Caratteristiche soggetti affetti (1/500):
- precoci lesioni aterosclerotiche
- infarto e/o ictus cerebrale con insorgenza giovanile
- Xantomi (accumuli di grasso) tendinei e cutanei
Metabolismo delle LDL
2nd
Adipociti e muscoli
Ricche in trigliceridi
1st
Estrazione trigliceridi
(Lipoprotein Lipasi)
4th
Tramite LDLr
70% dal fegato
Restante da
Fibroblasti, linfociti,
muscolatura liscia
5th
3rd
Aumentata nei malati
perche’ IDL non assorbiti
Il metabolismo del colesterolo
3-hydroxy-3-methylglutaryl
coenzyme E reductase
CLASSIFICAZIONE DELLE MUATAZIONI LDLr
BASATE SULLE FUNZIONI DELLE PROTEINE MUTATE
Il gene per LDLr è situato sul cromosoma
19, comprende 18 esoni e 5 domini.
Sono state mappate almeno 150 mutazioni
Che differentemente modificano la proteina
Autosomiche Recessive (I)
• Entrambi i geni devono essere mutati
• L’espressione e’ piu’ uniforme rispetto alle malattie
autosomiche dominanti
• Penetranza completa e’ comune
• In molti casi proteine enzimatiche sono affette da perdita di
funzione
Pedigree di un carattere recessivo
Consanguinei
Autosomiche Recessive (III)
(ex. FIBROSI CISTICA)
• Difetto del trasporto del cloro a livello epiteliale
causato da mutazioni nel gene CFTR (codificante per il canale dello ione cloro)
• Codifica una proteina di 1480 aminoacidi situata sulla membrana cellulare delle cellule
epiteliali, la cui funzione, normalmente, è quella di trasportare il cloro attraverso le
membrane cellulari a livello della membrana apicale delle cellule epiteliali delle cellule
di vie aeree, del pancreas, dell'intestino, delle ghiandole sudoripare, delle
ghiandole salivari e dei vasi defereni
• Insorgenza 1/1500-4000. E’ la piu’ importante delle malattie genetiche infantili
•Rara in popolazione asiatica e africana
CARATTERISTICHE
Negli organi interessati, le secrezioni mucose, essendo anormalmente
viscide, determinano un'ostruzione dei dotti principali, provocando
l'insorgenza di gran parte delle manifestazioni cliniche tipiche della malattia
Coinvolge: ghiandole esocrine, epiteli respiratori, intestinali e riproduttivi
produzione di secrezioni mucose viscose che causano:
Infezioni polmonari
Insufficienza pancreatica
Cirrosi epatica
Infertilità maschile
Occlusioni intestinali
Mal nutrizione
Polmoni:
Il quadro clinico è dominato da un lento processo distruttivo polmonare. Nella
maggior parte dei casi si manifesta nel primo anno di vita con tosse persistente.
L'esame obbiettivo può subito dimostrare segni indiretti di ostruzione bronchiale.
L'infezione bronchiale cronica determina una progressiva distruzione del parenchima
polmonare.
La risposta immunitaria dell'ospite e i fattori propri dei patogeni contribuiscono
quindi insieme ad innescare un processo patogenetico che è alla base del processo
distruttivo polmonare.
Pancreas:
è colpito nell'80% dei casi con un ristagno dei succhi pancreatici nei dotti con
formazione di cisti con una fibrosi che si va a creare attorno a questi (da qui fibrosi
cistica).
La carenza di succhi pancreatici nel canale intestinale porta a malassorbimento di
grassi (con conseguente steatorrea), e di conseguenza delle vitamine liposolubili,
delle proteine e, in minima parte, degli zuccheri. Con il passare del tempo il
pancreas, sempre più colpito, secerne una minor quantità di insulina portando a una
forma di diabete di solito insulino-dipendente.
Pancreas
Esocrino:
I principali enzimi presenti nel succo
pancreatico sono: tripsinogeno,
chimotripsinogeno, elastasi, lipasi
pancreatiche, amilasi pancreatiche,
fosfolipasi pancreatica, nucleasi
pancreatiche.
Endocrino (Isole di Langerhans)
Cellule A (15%): glucagone
Cellule B (80%). Insulina
Cellule D (3-5%): somatostatina
Cellule F (3-5%): polipeptide pancreatico
This higher-power photomicrograph of the
pancreas shows interstitial tissue and the
presence of small cystic spaces (1) within
the acinar lobules. These spaces are filled
with an eosinophilic proteinaceous
material. The islets of Langerhans (2) are
unaffected.
CANALE DEL CLORO
Ex. Acetilcolina
•2 Domini trasmembrana
• 2 NBD
• Regulatory domain
• 550 mutazioni diverse
• La piu’ comune è una
delezione di tripletta
codificante per phe508
(folding non corretto)
FIBROSI CISTICA
ESPRESSIVITA’
• Classe I: non c'è produzione di proteina
• Classe II: si ha produzione di un corto peptide non funzionante
• Classe III: si produce un polipetide non funzionante
• Classe IV: si produce una proteina difettosa ma in minima parte funzionante
• Classe V: si produce una proteina normale ma in minime quantità
• Classe WT: la proteina normale è prodotta nelle giuste quantità (soggetto sano)
Disfunzione Ghiandole Sudoripare
Ridotto assorbimento
Na+ Cl-
• Metodo di Gibson e Cooke - si misura la concentrazione di Cloro in
almeno 75 mg di sudore
• Valori sono superiori alla norma (60mEq/L) il test è sicuramente positivo
• Valori sotto i 30mEq/L è sicuramente negativo
Low salt levels in the body lead to fatigue, weakness, fever, muscle
cramps, stomach pain, vomiting, dehydration, and heatstroke.
Disfunzione Vie Aeree Superiori
Aumento assorbimento
Na+/H2O
Sex-Linked
• Sono tutti X-Linked e per la maggior parte recessivi
• Modalità di trasmissione caratteristica:
- I maschi non trasmettono la malattia ai figli maschi
(ma le figlie femmine sono portatrici)
- Le femmine a causa dell’ inattivazione casuale del
cromosoma x hanno un fenotipo variabile
Distrofia Muscolare
Le distrofie muscolari di Duchenne (Dmd) e di Becker (Dmb) sono due varianti,
rispettivamente più e meno grave, della stessa malattia neuromuscolare caratterizzata
dall’assenza, carenza o alterazione di una proteina chiamata distrofina. Queste
condizioni, definite in generale distrofinopatie, portano a degenerazione del tessuto
muscolare e quindi alla progressiva perdita di forza e riduzione delle abilità motorie.
Nella Dmd la distrofina è del tutto assente e i primi sintomi si manifestano,
generalmente, tra i 2 e i 6 anni. I bambini affetti spesso imparano a camminare in
ritardo, mostrano un’andatura particolare (anserina), tendono a camminare sulle punte,
hanno difficoltà a rialzarsi da terra, a saltare, a fare le scale. Tipicamente è presente un
ingrossamento (ipertrofia) dei polpacci. La malattia progredisce causando grave scoliosi,
perdita della deambulazione entro i 12 anni, quindi perdita della funzione degli arti
superiori. Anche i muscoli respiratori e il cuore sono coinvolti e sono proprio le
complicanze cardiache e respiratorie a ridurre l’aspettativa di vita di questi pazienti. In
alcuni casi ci può essere un deficit cognitivo, di entità molto variabile.
Nella Dmb, la distrofina è ridotta o alterata, ma mai assente. A livello motorio, le
manifestazioni di questa forma ricalcano quelle della Dmd, ma in forma più lieve e con
esordio più tardivo. Le complicazioni cardiache costituiscono il problema principale: se
vengono riconosciute e curate in tempo, l’aspettativa di vita di questi pazienti può essere
del tutto normale.
Duchenne muscular dystrophy
La malattia si trasmette con modalità legata all’X: in genere solo i maschi (che hanno un
solo cromosoma X) presentano i sintomi, mentre le femmine, a parte alcune eccezioni,
risultano essere delle portatrici sane (perché possiedono un altro cromosoma X oltre a
quello mutato, che può quindi compensarne le funzioni).
Dystrophin is a rod-shaped cytoplasmic protein, and a vital part of a protein complex that
connects the cytoskeleton of a muscle fiber to the surrounding extracellular matrix
through the cell membrane
The dystrophin gene is one of the longest human genes known, covering 2.5
megabases (0.08% of the human genome) at locus Xp21. The primary transcript
measures about 2,400 kilobases and takes 16 hours to transcribe; the mature mRNA
measures 14.0 kilobases. The 79 exons code for a protein of over 3500 amino acid
residues
Dystrophin supports muscle fiber strength, and the absence of dystrophin reduces
muscle stiffness, increases sarcolemmal deformability, and compromises the mechanical
stability
Distrofia Muscolare
Normale
Duchenne
• increase in intracellular calcium,
• reactive oxygen species (ROS)
• activation of a protease cascade
Sia per la Dmd sia per la Dmb, la diagnosi si basa innanzitutto sull’osservazione clinica
ed esami di laboratorio mettono in evidenza il danno muscolare. In particolare un valore
importante è quello della creatinchinasi un enzima che viene rilasciato nel circolo
ematico quando esiste un danno muscolare.
La diagnosi viene poi confermata attraverso la biopsia muscolare (per verificare la
quantità di distrofina presente nel muscolo) e l’analisi molecolare del gene della
distrofina. In situazione a rischio (donna portatrice sana di distrofinopatia) si può
effettuare la diagnosi prenatale mediante villocentesi o amniocentesi.
Al momento non esiste una terapia risolutiva per la malattia. La qualità di vita dei
pazienti può notevolmente migliorare con trattamenti sintomatici e pluridisciplinari
(fisioterapia, valutazione della funzionalità cardiaca e respiratoria ecc.) che gestiscano i
vari aspetti della malattia: motorio, respiratorio e cardiaco. La somministrazione di
steroidi può aiutare a stabilizzare le abilità motorie. Attualmente sono in corso di
sperimentazione diversi approcci terapeutici, tra cui la terapia cellulare e la terapia
molecolare con exon-skipping.
Genome engineering using
programmable nucleases
Genome engineering (editing)
Modification of the genome at a precise, predetermined locus.
• Gene disruption (Knock-out): Non Homologous End Joining (NHEJ);
• Gene insertion (Knock-in): Homologous Recombination (HR);
• Gene correction and point mutagenesis: Homologous Recombination (HR);
Programmable nucleases produce site-specific DSBs, which enhance the
efficency of homologous recombination and/or trigger error-prone NHEJ, which
leads to targeted mutagenesis.
*
*indel: insertion/deletion
Three type of nucleases are used for genome editing:
• Zinc Finger Nucleases (ZFNs);
• Transcription Activator-Like Effector Nucleases (TALENs);
• RNA-Guided Engineered Nucleases (RGENs):
CRISPR-Cas9 system
Zinc-Finger Nucleases
Composed of two domains: a DNA-binding zinc-finger protein (ZFP) domain and
the nuclease domain derived from the FokI restriction enzyme.
The sequence specificity of ZFNs is determined by ZFPs, each of which
recognizes a 3-bp DNA sequence.
There is no open-source collection of 64 zinc-fingers that covers all possible
combinations of triplet sites!
Transciption Activator-Like Effector Nucleases
Composed of two domains: a FokI nuclease domain (like ZFNs) and a TALE
DNA-binding domain; TALEs are composed of tandem arrays of 33-35 aa
repeats, each of which recognizes a single base-pair in the major groove
(specificity determined by the Repeat Variable Diresidues).
Easy to design due to the one-to-one correspondence between RVDs and the
4 bases.
Functioning of the CRISPR-Cas9 in bacteria
Phase 1: the CRISPR system stores
the molecular signature of a previous
infection by integrating fragments of
invading phage or plasmid DNA into
the CRISPR locus as 'spacers'.
Phase 2: in the immunity phase, the
bacterium uses this stored information
to defend against invading pathogens
by transcribing the locus and
processing the resulting transcript to
produce CRISPR RNAs (crRNAs) that
guide effector nucleases to locate and
cleave nucleic acids complementary
to the spacer.
•CRISPR:
Clustered regularly-interspaced
short palindromic repeats
•trans-activating crRNA
•CRISPR-Associated Protein 9 (Cas9)
•CRISPR RNAs (crRNAs)
RNA-Guided Engineered Nucleases: CRISPRCas9
In the presence of single
guide RNAs (sgRNAs),
Cas9 is directed to specific
sites in the genome
adjacent to a protospacer
adjacent motif (PAM),
causing a double strand
break (DSB).
Composition:
• Target specific crRNA;
• Invariable target-independent trans-activating crRNA (tracrRNA);
• CRISPR-Associated Protein 9 (Cas9).
crRNA and tracrRNA can be linked to form a single-chain guided RNA
(sgRNA), which simplifies the components of RGENs.
RGENs target sites are limited by the requirment for the PAM sequence, which
is recognized by Cas9.
Thus, the targetable sequences are 5’-X20NGG-3’ (where X20 corresponds to
the 20bp crRNA sequence, called protospacer, and NGG is the Protospacer
Adiacent Motif).
This CRISPR/Cas9 system is derived from S. pyogenes; there are some other
CRISPR/Cas9 system derived from different Bacteria, as N. meningitis or S.
thermophilus, that work in the same way, but with different PAM sequences
(and different efficiencies).
Delivery of programmable nucleases (CRISPRCas9)
Programmable nucleases are delivered into cultured cells, embyos or whole
organisms in various forms:
•
Transient transfection of plasmid DNA through electroporation or liposome
transfection (gold standard for ES and iPS);
•
Protein delivery (or mRNA direct injection);
•
Integrating vectors, such as Lentivirus, have been used for continuos
expression of Cas9 and sgRNAs in mammalian cells.
•
Adeno-Associated Virus (AAV)
Permanent exon skipping in postnatal mdx mice by AAV-mediated
Myoediting
Rescue of dystrophin expression in postnatal mdx mice by retro-orbital
injection of AAV-Cas9/sgRNAs.
Malattie genetiche multifattoriali
• Risultanti dall’interazione fra le condizioni ambientali e un
numero di geni >1 partecipanti alla determinazione del
fenotipo
• Il rischio di presentare un fenotipo “malattia” é proporzionale
al numero di geni mutati ereditato
• Molte delle piú comuni malattie (diabete, ipertensione,
celiachia) hanno origine multifattoriale
type 1 diabetes—an autoimmune disease in which the body's own immune system
attacks the pancreas, rendering it unable to produce insulin
Compartecipazione genetica : frequente familiarita’, associazione aplotipo HLA
DR3/4. Anticorpi e CD8 citotossici
Compartecipazione ambientale: gemelli omozigotici malatta <50% dei casi
Terapia :insulinica (ricombinante umana)
type 2 diabetes—in which a resistance to the effects of insulin or a defect in insulin
secretion may be seen
Rappresenta l’85% di tutte le forme di diabete, esordio tardivo
Compartecipazione genetica : frequente familiarita’, forse recettori insulinici
Compartecipazione ambientale: iperalimentazione/obesita’