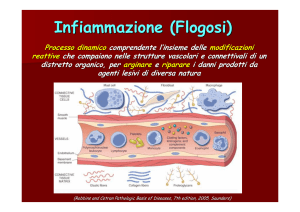
Infiammazione o flogosi
Generalità dell’infiammazione
È un processo che coinvolge più partecipanti e riguarda solo tessuti vivi. È costituito da una serie di eventi che si
sovrappongono a formare un complesso.
È una risposta evocata che richiede uno stimolo e può portare a maggiori danni dello stimolo iniziale; è
fondamentalmente una reazione di difesa che ha fasi definite, indipendentemente dalla causa. La maggioranza dei
componenti reattivi sono nel sangue. È ampiamente ridondante, con una pletora di promotori e regolatori ed è un
fenomeno orientato sulle membrane.
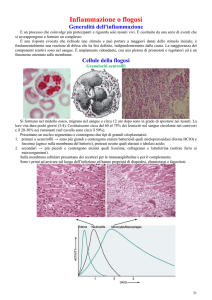
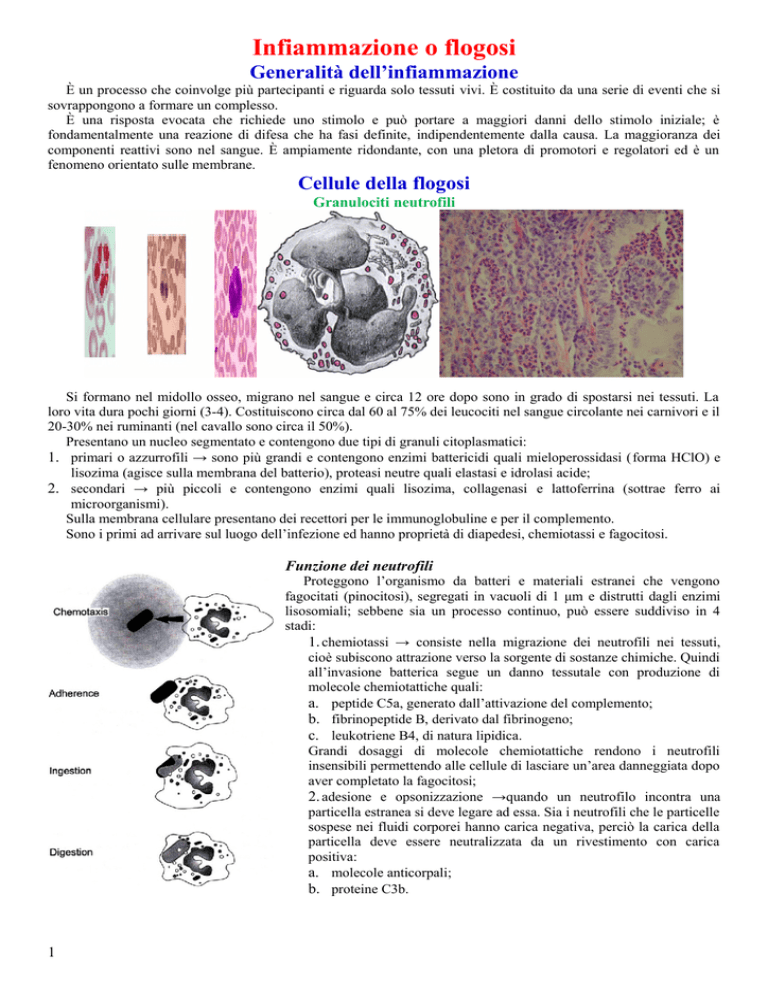
Cellule della flogosi
Granulociti neutrofili
Si formano nel midollo osseo, migrano nel sangue e circa 12 ore dopo sono in grado di spostarsi nei tessuti. La
loro vita dura pochi giorni (3-4). Costituiscono circa dal 60 al 75% dei leucociti nel sangue circolante nei carnivori e il
20-30% nei ruminanti (nel cavallo sono circa il 50%).
Presentano un nucleo segmentato e contengono due tipi di granuli citoplasmatici:
1. primari o azzurrofili → sono più grandi e contengono enzimi battericidi quali mieloperossidasi (forma HClO) e
lisozima (agisce sulla membrana del batterio), proteasi neutre quali elastasi e idrolasi acide;
2. secondari → più piccoli e contengono enzimi quali lisozima, collagenasi e lattoferrina (sottrae ferro ai
microorganismi).
Sulla membrana cellulare presentano dei recettori per le immunoglobuline e per il complemento.
Sono i primi ad arrivare sul luogo dell’infezione ed hanno proprietà di diapedesi, chemiotassi e fagocitosi.
Funzione dei neutrofili
Proteggono l’organismo da batteri e materiali estranei che vengono
fagocitati (pinocitosi), segregati in vacuoli di 1 μm e distrutti dagli enzimi
lisosomiali; sebbene sia un processo continuo, può essere suddiviso in 4
stadi:
1. chemiotassi → consiste nella migrazione dei neutrofili nei tessuti,
cioè subiscono attrazione verso la sorgente di sostanze chimiche. Quindi
all’invasione batterica segue un danno tessutale con produzione di
molecole chemiotattiche quali:
a. peptide C5a, generato dall’attivazione del complemento;
b. fibrinopeptide B, derivato dal fibrinogeno;
c. leukotriene B4, di natura lipidica.
Grandi dosaggi di molecole chemiotattiche rendono i neutrofili
insensibili permettendo alle cellule di lasciare un’area danneggiata dopo
aver completato la fagocitosi;
2. adesione e opsonizzazione →quando un neutrofilo incontra una
particella estranea si deve legare ad essa. Sia i neutrofili che le particelle
sospese nei fluidi corporei hanno carica negativa, perciò la carica della
particella deve essere neutralizzata da un rivestimento con carica
positiva:
a. molecole anticorpali;
b. proteine C3b.
1
I neutrofili hanno specifici recettori per anticorpi e C3b. Le molecole che rivestono le particelle estranee e
promuovono così la fagocitosi sono dette opsonine. Gli anticorpi sono le opsonine di maggior efficacia.
Un altro meccanismo è l’intrappolamento: in un tessuto la particella è intrappolata tra le cellule con impossibilità
di sfuggire alla ingestione da parte del neutrofilo e fagocitosi di superficie;
3. ingestione → un neutrofilo striscia verso una sorgente chemiotattica dapprima uno pseudopodo, poi il resto
della cellula. Una volta legata alla superficie del neutrofilo la particella viene inglobata in un vacuolo nel
citoplasma, il fagosoma;
4. digestione → distruzione tramite:
a. scoppio respiratorio (burst respiratorio) → entro
pochi secondi dal contatto con una particella estranea
i neutrofili aumentano fino a quasi 100 volte il loro
consumo di ossigeno. Tale aumento deriva
dall’attivazione dell’enzima NADPH-ossidasi dal
quale dipendono:
incremento consumo di ossigeno;
incremento produzione di perossido di idrogeno
(H2O2);
formazione anione superossido (radicali liberi).
L’anione superossido non si accumula, al contrario di
H2O2 che viene convertito in un composto battericida
tramite l’azione della mieloperossidasi, il più
significativo enzima dello scoppio respiratorio nei
neutrofili (granuli primari).
L’azione battericida avviene per ossidazione delle
proteine dei batteri e potenziamento delle attività
battericide degli enzimi lisosomiali. Nelle diverse
specie: minori differenze quantitative nella attività dei
neutrofili, che ad es. nelle pecore producono meno
anione superossido dei neutrofili di bovino o
dell’uomo;
b. enzimi lisosomiali → dopo l’unione della particella
estranea alla membrana del neutrofilo, i granuli
primari (o lisosomi) migrano nel citoplasma, si
fondono con il fagosoma e rilasciano i loro enzimi (fagolisosoma).
Dopo aver fagocitato un certo numero di batteri, muoiono liberando i lisozimi ed altri enzimi proteolitici che
continuano a svolgere la loro azione.
I neutrofili disgregati insieme al tessuto alterato e ai microrganismi formano il pus.
Destino dei neutrofili
Hanno una limitata riserva energetica che non può essere ricostituita.
Sono attivi immediatamente dopo essere stati rilasciati dal midollo, ma possono sopportare solo un limitato
numero di eventi fagocitari e sopravvivono solo qualche giorno.
Dato che distruggono tutti i materiali estranei, non sono in grado di processare gli Ag per la presentazione a cellule
Ag-sensibili, Quindi agiscono prontamente, ma sono incapaci di un intervento che si protragga, che necessita così
dell’azione del sistema mononucleati-fagociti.
Lesioni tessutali
Le attività microbicide dei neutrofili vengono dirette anche al tessuto normale presente nei foci infiammatori. I
radicali dell’ossigeno causano lesione diretta tramite la formazione di perossido di idrogeno (H 2O2). Inoltre possono
essere lesivi anche generando fattori chemiotattici aggiuntivi, provocando la depolimerizzazione dei
glicosaminoglicani (soprattutto ialuronato), e anche attivando inibitori della proteasi leucocitaria.
Granulociti eosinofili
2
Originano nel midollo osseo, entrano nel sangue per un breve periodo, poi migrano nei tessuti. Hanno un ciclo
vitale di 8-15 giorni.
Hanno corredo enzimatico analogo ai neutrofili (hanno maggior contenuto di perossidasi che conferisce al tessuto
infiltrato un colore verdognolo), ma con attività battericida e fagocitosi meno spiccate. Sono coinvolti nelle parassitosi
e nelle allergie.
Gli eosinofili stimolati sintetizzano e liberano prostaglandine: aumento della concentrazione di AMPc in mastociti
e basofili e inibizione della liberazione di istamina.
Degradano le proteine estranee (allergeni) che sono state neutralizzate dalle IgE. Vengono richiamati nella zona di
interesse dalla presenza dei complessi Ag-Ab, che inglobano e distruggono. Attaccano anche i parassiti liberando
degli enzimi che ne ledono la parete. Fagocitano anche i granuli liberati dai mastociti.
Gli eosinofili:
1. esplicano la loro azione tossica verso larve parassitarie → uccidono i parassiti degranulandosi sulla loro
superficie. In animali che hanno sviluppato una immunità specifica, i parassiti vengono rivestiti da Ab e
complemento e questo attira gli eosinofili. Gli eosinofili contengono sulla loro superficie specifici recettori per il
complemento e le immunoglobuline; dopo che si sono attaccati al complesso Ab-complemento sulla superficie del
parassita, essi secernono perossidasi. Lesioni focali vengono prodotte nella cute del parassita, che causano la
separazione della cute dal corpo del parassita stesso;
2. compaiono in infezioni allergiche → gli immunocomplessi stimolano l’attivazione del complemento a produrre
fattori di attrazione per gli eosinofili. Fattori chemiotattici specifici per gli eosinofili comprendono l’istamina.
Degranulazione dei mastociti → infiltrazione tessutale di eosinofili → gli eosinofili inattivano
parte dei mediatori chimici derivati dai mastociti
Granulociti basofili
Sono presenti nel sangue in numero così limitato che un aumento è generalmente privo di significato. Sotto
influenze chemiotattiche specifiche essi migrano nei tessuti e si localizzano negli spazi perivascolari dove la loro
degranulazione ha il massimo effetto sulla permeabilità.
I basofili sono coinvolti in fenomeni di ipersensibilità mediata (umorale) e immediata (cellulo-mediata).
Presentano granuli metacromatici sprovvisti di per ossidasi, ma ricchi di eparina (anticoagulante), acido ialuronico,
serotonina e istamina. Queste ultime due (amine vasoattive), quando liberate, provocano vasodilatazione e aumento
della permeabilità capillare nei tessuti danneggiati, favorendo l’arrivo dei granulociti neutrofili. Scarsa attività
fagocitaria.
I basofili sono cellule dell’infiammazione acuta e inoltre sono spesso una componente di lesioni croniche originate
da reazioni immuni. Sono attratti dalle citochine linfocitarie. Essi hanno recettori di superficie per il frammento C3
del complemento, il quale promuove la fagocitosi e aumenta la capacità dei basofili (e dei mastociti) di aderire ai
parassiti che sono stati rivestiti da complemento (analogamente agli eosinofili).
Monociti e macrofagi
3
I monociti (prodotti nel midollo osseo) sono dei fagociti circolanti immaturi. Dopo attivazione, migrano attraverso
la parete dei capillari nelle lesioni infiammatorie e velocemente si trasformano in macrofagi.
I macrofagi maturi si trovano nei tessuti e possono essere fissi (istiociti) o mobili.: cellule di Kupffer, microglia,
macrofagi alveolari, cellule del mesangio, osteoclasti.
Nell’essudato aumentano quando diminuisce l’intervento dei granulociti neutrofili.
Funzioni dei macrofagi
Hanno funzione di fagocitosi simile a quella dei neutrofili. Sono attratti non solo da prodotti batterici ma anche da
prodotti dell’attivazione del complemento (C5a) e molecole rilasciate da cellule danneggiate.
I neutrofili degeneranti rilasciano elastasi e collagenasi che generano fattori chemiotattici per i monociti
Attivazione dei monociti e macrofagi
Vari livelli di attivazione. Il compito principale è quello di eliminare i batteri. Quando il materiale estraneo persiste
si hanno cellule epiteliodi e giganti (infiammazione cronica).
Con l’attivazione dei monociti avviene il rilascio della IL-1 che induce molti aspetti della risposta di fase acuta
dell’infiammazione. IL-1:
1. stimola la circolazione e la degranulazione neutrogranulocitaria per effetto diretto sia sul midollo osseo che sui
neutrofili circolanti;
2. attiva i linfociti B e T;
3. stimola la febbre e la sintesi di PGE2 nell’ipotalamo;
4. aumenta a sintesi di proteine di fase acuta nel fegato;
5. aumenta il catabolismo del muscolo scheletrico per assicurare aminoacidi sufficienti per essere utilizzati dal
fegato.
Nelle ultime fasi dell’infiammazione, IL-1 agisce da fattore di crescita per i fibroblasti.
Linfociti
4
Nella maggior parte dei mammiferi i linfociti costituiscono fino al 20-40% delle cellule ematiche. Sono piccoli,
rotondeggianti, con una limitatissima quantità di citoplasma in cui sono spesso presenti 5-15 granuli azzurrofili densi
e vacuoli, mentre la cromatina nucleare è densa e presente soprattutto alla periferia del nucleo.
Un numero più elevato di linfociti è presente negli
stadi terminali delle infezioni da germi piogeni e in
alcune malattie virali, nelle quali sono plasmociti
immaturi.
I linfociti originano per linfopoiesi dalla corticale
dei linfonodi da dove vengono immessi in circolo
attraverso il dotto toracico e quindi passano attraverso
gli spazi dell’endotelio delle venule post-capillari nelle
regioni paracorticali e rientrano nella circolazione
linfatica (ricircolo).
Linfocitosi → aumento del numero dei linfociti
circolanti; appare transitoriamente in esercizio
muscolare intenso, febbre e altri tipi di stress.
Linfopenia → diminuzione numerica dei linfociti;
si verifica in malattie virali in cui il virus attacca il sistema linfoide (es. cimurro canino, peste suina, diarrea virale del
bovino) e durante trattamento terapeutico con cortisone, radiazioni e farmaci immunosoppressivi.
Si dividono in:
T → maturano nel timo. Quando incontrano l’antigene che sono capaci di riconoscere, si dividono e danno origine
ad una cellula memoria e a due tipi di cellule T effettrici: T helper (T H) e T citotossici (Tc) → immunità cellulomediata. Quindi attacco e distruzione immediata dei microrganismi tramite liberazione di linfochine, attivazione del
complemento, modulazione dei B e dei macrofagi;
B → maturano nel midollo. Quando incontrano l’antigene che sono capaci di riconoscere, si dividono e danno
origine ad una cellula memoria e ad una plasmacellula capace di produrre anticorpi → immunità umorale. Sono
localizzati nei tessuti linfatici.
Plasmacellule
Hanno forma ovale con nucleo eccentrico in cui la cromatina è raccolta in ammassi periferici; il citoplasma è
basofilo. Sintetizzano immunoglobuline e la maturazione richiede 4-5 gg.
Sono presenti in diverse malattie, ad esempio: FIP, Plasmocitoma, Plasmacitoleucosi, malattie immunomediate a
decorso cronico.
Dalle plasmacellule derivano i Corpi di Russel.
Sono elementi terminali: esplicata la funzione anticorpopoietica vanno in lisi.
5
Tipologie di infiammazione
L’infiammazione si distingue in base a:
1. durata;
a. acuta → ha esordio rapido (secondi o minuti) e durata breve fino ad alcuni giorni, edema e granulociti
neutrofili; prevalenza di fenomeni vasali ed essudativi (angioflogosi) su quelli cellulari (istoflogosi);
b. subacuta;
c. cronica → ha maggiore durata con presenza di linfociti e macrofagi, proliferazione di vasi sanguigni, fibrosi e
necrosi tissutale;
2. eziologia:
a. radiazioni;
b. agenti fisici;
c. agenti chimici;
d. agenti fisiologici;
3. sede:
a. essudativa (angioflogosi) → fuoriuscita delle cellule dal vaso; ha generalmente decorso acuto;
b. produttiva (istoflogosi) → proliferazione in situ di cellule infiammatorie (linfociti, macrofagi), e cellule
tessutali (fibroblasti, angioblasti, mastociti). Ha generalmente decorso cronico.
Infiammazione essudativa
Infiammazione sierosa
Accumulo di essudato liquido, limpido, giallognolo, proveniente dalla parte plasmatica del sangue (essudazione
paglierina) e contenente:
1. proteine (> 2-3%) → sono albumine e globuline, non fibrinogeno perché troppo voluminoso;
2. mucopolisaccaridi;
3. poche cellule.
L’essudato si forma per vasodilatazione delle venule a cui consegue un aumento della permeabilità e ristagno
linfatico. È legata alle primissime fasi dell’infiammazione e si manifesta:
1. nella cute → fase successiva dell’infiammazione eritematosa (vasodilatazione). Si può avere in seguito a ustioni,
sostanze vescicanti (vescicole, bolle) con edema infiammatorio intercellulare;
2. nelle cavità sierose → sono generalmente siero-fibrinose (i pori di membrana si allargano tanto da far uscire il
fibrinogeno) e le ritroviamo in pleura, pericardio, peritoneo, meningi, cavità articolari e testicolari. L’eziologia
può essere microbica: FIP, Actinomyces, Nocardia;
3. nei parenchimi di fegato, cuore e rene → imbibizione sierosa dell’interstizio ed infiltrazione cellulare assente
(infiammazione o edema?); si ha durante epatite virale da adenovirus ed epatite da leptospira.
Infiammazione mucosa
Si trova esclusivamente sulle superfici mucose di apparato respiratorio (narici, trachea, bronchi), digerente
(stomaco, intestino, vie biliari) e congiuntiva (lacrimazione quando c’è molto vento); sono tutte dotate di ghiandole
mucipare e cellule caliciformi (appaiono ectasiche e aumentate di volume) e si ha una iper produzione di muco.
L’essudato è viscoso e si accumula sulla superficie della mucosa (non infiltra i tessuti), è debolmente giallastro e
privo di cellule.
Infiammazione catarrale
È l’evoluzione dell’infiammazione sierosa: alla iperproduzione di muco si associano cellule infiammatorie
(soprattutto neutrofili) e cellule desquamate. Dai neutrofili poi si liberano enzimi che demoliscono la parte
polisaccaridica e proteica della mucina con fluidificazione dell’essudato.
Nella sottomucosa si osservano iperemia, edema, essudazione cellulare (granulociti e monociti).
L’essudato catarrale ha funzione:
1. diluizione dell’agente patogeno;
2. distanziamento dell’agente dalla mucosa;
3. facilitazione dell’espulsione;
4. produzione di agenti antibatterici ed antivirali.
Infiammazione purulenta
Essudato prevalentemente cellulare: granulociti neutrofili in disfacimento; è autolitico ed eterolitico
(suppurazione) che porta alla formazione di pus. Il pus può essere viscoso (dipende dall’elevato contenuto in DNA
che deriva dal nucleo dei neutrofili in disfacimento), cremoso, fluido (dipende dalla quantità di essudato liquido),
torbido, giallastro o verdognolo (in funzione dell’agente batterico) o rosato (emorragico).
6
Ascesso o apostema: raccolta circoscritta di pus in cavità neoformata, cioè scavata dal processo suppurativo.
Empiema: raccolta di pus in cavità preformata (naturale) non comunicante con l’esterno (es. piotorace).
Flemmone: il materiale purulento si estende e invade l’interstizio del sottocute, muscolo, fasce, sottomucosa
(concomita regolarmente la necrosi). Tende a fistolizzare.
Fistola: tragitto che si forma quando le raccolte purulente si fanno strada comunicazione con l’esterno per l’azione
erosiva di:
1. germi piogeni: Staphilococcus aureus, Streptococcus pyogenes, Corynebacterium pyogenes, Bacterium
pyocyaneus, Pasteurella multocida, Actinomyces bovis, Actinobacillus ligneresi ecc.
2. agenti chimici piogeni: trementina, olio di croton, Nitrato d’Ag.
Capsula di connettivo denso: è indicativa della lesione, cioè più la capsula è spessa e
più la lesione è pregressa.
Tessuto di granulazione: connettivo giovane e molto vascolarizzato; ha colorito
rosato (per neoangiogenesi), poi diventa grigiastro (connettivo maturo).
Infiammazione gangrenosa
Fenomeni di gangrena umida che derivano spesso da focolai di flogosi inizialmente di altro tipo (di solito
purulenta), laddove i batteri piogeni, quasi tutti fortemente aerobi, consumano l’O 2 tessutale, rendendo l’ambiente
sufficientemente anaerobio per lo sviluppo dei Clostridi. Così avviene per certe polmoniti catarrali o purulente,
soprattutto in bovini e suini, che evolvono in gangrenose; le polmoniti ab ingestische si instaurano quando
l’inalazione del bolo alimentare ostruisce una o più diramazioni bronchiali (a livello di biforcazione tracheale),
provocandovi una flogosi necretico-purulenta che poi diviene gangrenosa. Un tipico esempio di flogosi gangrenosa
che fin dall’inizio si presenta come tale è quello del Carbonchio sintomatico da Clostridium chauvei.
In tutti i casi di cui sopra, i focolai hanno dimensioni variabili, colorito rosso-brunastro o rosso-verdastro, aspetto
colliquativo dei tessuti colpiti, colio di liquidi scuri cosparsi di bolle di gas assai maleodoranti (crepitio al tatto).
Istologicamente: estrema omogeneizzazione delle strutture cellulari e dei tessuti, piccole bolle otticamente vuote e
proliferazione di numerosi grandi batteri bastoncellari, in parte sporificati.
Una forma di gangrena secca fisiologica è quella del cordone ombelicale.
Infiammazione fibrinosa
Vi è un aumento della permeabilità di grado maggiore rispetto alla sierosa, che porta alla fuoriuscita di albumine,
globuline e fibrinogeno, che precipita in forma di fibrina (bianco-giallastra, fibrillare, friabile, acidofila, colorabile
con Weigert).
Questo tipo di infiammazione è tipica delle cavità sierose, dell’interstizio, delle superfici cutanee e mucose.
L’essudato fibrinoso funge da barriera per diminuire la permeabilità dei tessuti e ostacolare il passaggio degli
agenti patogeni.
Nelle cavità sierose inizialmente c’è infiammazione siero-fibrinosa, poi avviene il riassorbimento del liquido e le
sierose rimangono coperte da un panno fibrinoso (sierositi secche). Infine avviene l’organizzazione connettivale
(cronicizzazione), che esitano in saldature permanenti cicatriziali (aderenze, coalescenze, sinechie). Un esempio sono
le aderenze intestinali, che ostacolando la peristalsi determinano il ristagno del bolo nell’ansa con fermentazione dello
stesso e meteorismo.
La fibrina è solitamente traslucida e quando inizia a perdere la sua trasparenza significa che si sta organizzando.
Nelle mucose le pellicole di fibrina sono più o meno aderenti alla mucosa, che spesso è necrotica: formazione di
pseudomembrane. Se l’essudato fibrinoso compenetra l’epitelio necrotizzato e la pseudomembrana si stacca perciò
facilmente: infiammazione fibrinosa crupale per formazione di pseudomembrane crupali; se l’infiammazione è
profonda ed interessa anche la sottomucosa, le pseudomembrane non si staccano facilmente e, quando staccate,
scoprono ulcerazioni sanguinanti: infiammazione fibrinosa difteroide per formazione di pseudomembrane difteroidi.
Polmonite fibrinosa: notevole aumento di consistenza (epatizzazione) e l’essudato ostacola gli scambi respiratori.
Infiammazione emorragica
È difficile che si verifichi da sola, ma è sempre insieme a un’altra (siiero-emorragica). Avviene quando
concomitano gravi alterazioni della permeabilità (alterazioni dell’endotelio), rottura dei vasi o in caso di
ipocoagulabilità.
Infiammazione necrotizzante
Quando concomitano imponenti fenomeni regressivo-necrotici, come nel carbonchio ematico e nella
microvasculite da complessi immuni (es. malrosso, febbre catarrale maligna).
7
Infiammazione acuta
Si può sviluppare in meno di un’ora dal danno tessutale (anche in pochi minuti se pensiamo alla puntura di una
vespa), seguendo un percorso classico:
La reazione dei tessuti danneggiati prevede:
a) dilatazione dei vasi sanguigni:
arrossamento (rubor) → dilatazione del letto vascolare periferico → aumento del flusso ematico
nell’area interessata; è la prima manifestazione dell’attività dell’istamina;
aumento della temperatura locale (calor) → aumento del flusso ematico nel microcircolo;
b) aumento della permeabilità capillare (con accumulo di liquido ricco di proteine nel comparto extravascolare):
dolore (dolor) → stimolazione degli algocettori; è dato dall’istamina che ha azione breve (pochi
minuti);
perdita di funzione (functio lesa) → passaggio degli anticorpi dal sangue nell’area di flogosi;
edema (tumor: turgore); aumento della permeabilità vasale ed accumulo di essudato.
Tutti questi aspetti sono una conseguenza di alterazioni dei piccoli vasi:
1. aumento del flusso ematico;
2. modificazioni strutturali della micro vascolarizzazione;
3. fuoriuscita di leucociti, accumulo e attivazione.
Essudato: fuoriuscita di liquido, proteine e cellule ematiche dal sistema vascolare
nel tessuto interstiziale (PS> 1020).
Trasudato: liquido con basso contenuto proteico e un PS <1012.
Gli stimoli dell’infiammazione acuta sono:
1. infezioni (batteriche, virali, parassitarie) e tossine microbiche;
2. traumi;
3. agenti fisici e chimici;
4. necrosi tissutale;
5. corpi estranei;
6. reazioni immunitarie.
La vasodilatazione è una delle prime manifestazioni dell’infiammazione acuta, è
indotta da mediatori quali l’istamina e ossido nitrico sulla muscolatura liscia dei
vasi. La vasodilatazione è seguita dall’aumento della permeabilità vascolare del
microcircolo, poi si ha la stasi. I leucociti si accumulano lungo l’endotelio vascolare
(marginazione, rotolamento e adesione all’endotelio), dopodiché fuoriescono (diapedesi) e migrano nei tessuti.
Immediatamente dopo il danno si ha:
Evento
Meccanismo
hi sec.)
Origine neurogena
inuti, ore o tempi più lunghi a seconda della quantità/potenza
Rilascio di istamina dai mastociti e generazione di ossido nitrico e P
sere radunate molte cellule infiammatorie)
enza: edema e rigonfiamento)
o alla parte corpuscolare di uscire)
8
Risultato della vasodilatazione
Istamina, leucotrieni, bradichinina causano contrazione delle cellule
fessure nei piccoli vasi. C5a e C3a partecipano indirettamente induc
processo si autogenera)
Causata da vasodilatazione nell’area
La diminuzione del flusso provoca il contatto tra l’endotelio e le WB
numero delle molecole di adesione (caderina, catenina, granzima, s
collante fra una cellula e l’altra). Nei tumori la malignità è tanto più
molecole
Quando la permeabilità vasale è molto aumentatasi ha la migrazion
Esempi di molecole vasoattive prodotte nell’infiammazione acuta
Fonte principale
Funzione
Mastociti, basofili e piastrine
Vasodilatazione, aumento pe
Chininogeno plasmatico e tessuti
Vasodilatazione, aumento pe
i
Acido arachidonico presente nelle membrane plasmatiche
Vasodilatazione, aumento pe
aumento aggregazione piastr
chemiotassi neutrofili
Complemento
Degranulazione mastociti, co
Neutrofili ed eosinofili sono i leucociti del sangue dotati di maggior mobilità e sono i primi ad arrivare nei tessuti
danneggiati. Mentre i neutrofili sono attivati in tutti i focolai (accorrono in infezioni batteriche o a seguito di cause
fisiche come i traumi); gli eosinofili hanno predisposizione per i parassiti e accorrono nelle ipersensibilità di I tipo.
I monociti si spostano più lentamente e sono attratti dalle molecole chemiotattiche nel sito di danno tessutale e di
crescita batterica e fagocitano e distruggono qualsiasi materiale estraneo, trasformandosi in macrofagi infiammatori
attivati.
Con il danno tissutale si ha la degradazione della matrice extracellulare tramite enzimi, per la maggior parte
metalloproteinasi (MMP) prodotti da macrofagi, fibroblasti, mastociti e dalla maggior parte dei leucociti. Vengono
attivate in presenza di zinco:
MMP-1 (collagenasi), 2, 3, 11, 14 in fibroblasti;
MMP-9 in macrofagi;
MMP-9 in neutrofili;
MMP-2, 3,9 in endoteliociti;
MMP-9 in periciti.
Prefissi anatomici Infiammazione
Arter-(arteria)
Arterite
Oste-(osso)
Osteite
Encefal-(encefalo) Encefalite
Tifl-(cieco)
Tiflite
Blefar-(palpebra) Blefarite
ColecistColecistite
(cistifellea)
Epat-(fegato)
Epatite
Stomat-(bocca)
Stomatite
1.
2.
1.
2.
3.
1.
2.
9
Denominazione
Si utilizza il suffisso “-ite” (= infiammazione).
Gli stessi prefissi possono essere usati con suffissi quali:
osi per indicare un insulto non infiammatorio risultante in danno ad un organo o tessuto in cui si rende preminente
la Necrosi
opatia per indicare che esiste un problema o una lesione in un organo o tessuto, ma la causa/patogenesi/natura
della lesione non è del tutto chiara.
La distribuzione delle lesioni può essere:
a focolaio: lesione infiammatoria in una unica area (unica lesione ben delimitata);
multifocale: con più aree di infiammazione di dimensioni variabili, ma tra di loro separate da un tramezzo di
tessuto pressoché normale (tipico della pasteurellosi polmonare);
diffusa: coinvolge tutto l’organo o il tessuto. A diversi stadi (tipiche lesioni virali o da sostanze tossiche).
Determinazione della durata delle lesioni
iperacuta → da ore a 3-5 giorni;
acuta → da 3-5 giorni a 7-14 giorni;
3. subacuta → da molti giorni a settimane;
4. cronica → mesi, anni;
5. cronica attiva → la cui causa non è stata eliminata e mantiene vivo lo stato infiammatorio, con momenti di
ricomparsa dell’infiammazione acuta.
Fase cellulare dell’infiammazione acuta
Ha la finalità:
1. guidare i leucociti nell’essudato infiammatorio che caratterizza il sito di penetrazione, dove è inglobato l’agente
eziologico;
2. internalizzare l’agente mediante fagocitosi;
3. ucciderlo e degradarlo mediante enzimi proteolitici e prodotti reattivi dell’ossigeno.
Cascata dell’adesione leucocitaria
È il complesso di eventi che portano alla fuoriuscita dei leucociti dal lume di capillari e venule postcapillari fino al
tessuto connettivo periva scolare. Inizia durante la fase vascolare ed è mediato da citochine e molecole chemiotattiche
(es. complemento). La vasodilatazione e l’aumento di permeabilità determinano:
1. rallentamento di flusso ematico;
2. cambiamenti di forze emodinamiche;
3. marginazione dei leucociti.
La cascata caratterizzata da:
1. attrazione (cattura) dei leucociti: è dovuta all’instaurarsi di deboli contatti selectine-recettori → temporaneo
legame leucociti-cellule endoteliali → distacco.
Tutto ciò porta a:
a. rallentamento movimento leucocitario;
b. contrazione di un legame più stretto leucociti-cellule endoteliali.
La fase di cattura è mediata da:
a. L-selectina, espressa da tutti i leucociti, si lega al recettore sialyl-Lewis X posto sulle cellule endoteliali;
b. P-selectina, espressa dalle cellule endoteliali, riconosce il ligando glicoproteico della selectina P (PSGL-1)
presente su neutrofili, eosinofili, monociti e linfociti;
2. rotolamento → i leucociti rotolano sull’endotelio (costituirsi/rilasciarsi del legame mediato dalle selectine) spinti
dalle forze emodinamiche del flusso, che via via rallentano fino all’adesione stabile;
3. attivazione, a cui segue l’adesione stabile che è il risultato della interazione di integrine;
4. trasmigrazione dei leucociti verso lo stimolo chemiotattico → se nell’essudato extracellulare è presente un fattore
chemiotattico esogeno i leucociti così stabilmente adesi al rivestimento endoteliale ne attraversano la parete
(trasmigrazione).
Sono mediati dall’interazione di ligandi sulla superficie di neutrofili, monociti e linfociti, con i rispettivi recettori
posti sulla membrana luminale delle cellule endoteliali
attivate. Diverse citochine e chemochine modulano l’affinità
di tali molecole di adesione:
1. selectine (selectina E, P, L);
2. integrine → presenti sulla superficie dei leucociti
marginati;
3. famiglia delle citoadesine → sulle cellule endoteliali;
4. superfamiglia delle immunoglobuline → molecole di
adesione intercellulare (ICAM) e vascolare (VCAM).
Deficit di adesione leucocitaria (LAD tipo 1)
Ci sono malattie che comportano difetti alla migrazione dei leucociti nella sede di infiammazione e colpiscono
cane e bovino.
10
La LAD tipo 1 consiste nella manc anza di integrine β2 funzionanti. La conseguenza è la mancanza di
attraversamento delle pareti vasali da parte dei leucociti. Sono colpite prevalentemente mucose e polmoni e la
tipica lesione istologica è la carenza di neutrofili nei tessuti ulcerati o negli alveoli.
Mediatori chimici dell’infiammazione acuta
Sono sostanze che mediano e modulano il processo infiammatorio.
Istamina
È contenuta in cellule tissutali quali i mastociti, o elementi circolanti, quali i basofili e, nel coniglio, le piastrine. È
anche presente nelle cellule parietali dello stomaco.
La liberazione di istamina è per lo più di tipo secretorio (degranulazione dei mastociti). Se localizzato, il rilascio di
istamina causa, a livello cutaneo, eritema ed edema; a livello bronchiale, broncocostrizione. Se generalizzato, si
manifestano imponenti fenomeni a carico del sistema cardiovascolare che possono sfociare nello shock anafilattico.
Agisce molto rapidamente, ma altrettanto rapidamente viene degradata per azione enzimatica e, inoltre, le cellule
diventano resistenti alla sua azione, per cui il suo ruolo è limitato alla vasodilatazione iniziale.
Una volta liberata, l’istamina viene captata da due tipi di recettori specifici:
1. H1: presenti nelle fibrocellule muscolari lisce della parete vasale determinando l’allargamento delle giunzioni
interendoteliali;
2. H2: mediano la comparsa di effetti antinfiammatori, pur partecipando ai fenomeni di vasodilatazione.
Serotonina
È anche detta 5-idrossitriptamina (5-HT) Localizzata nel SNC (come mediatore sinaptico), nelle cellule cromaffini
del tratto gastrointestinale e nei granuli densi delle piastrine. Ha effetto edemigeno, per aumento della permeabilità
delle venule postcapillari indotto, similmente all’istamina, per contrazione degli endoteliociti ed aumento dello spazio
giunzionale interendoteliale.
Enzimi lisosomiali
Sono liberati nel focolaio infiammatorio dai fagociti professionali (granulociti e monociti) che li tengono
sequestrati nei granuli lisosomiali o lisosomi (così chiamati perché gli enzimi qui contenuti provocano la lisi di molti
costituenti dell’organismo stesso) in forma inattiva.
Si distinguono 3 tipi di granuli, detti lisosomi primari, secondari e terziari, ognuno contenente enzimi diversi.
Lisosomi primari
Lisosomi secondari
Lisosomi terziari
Catepsina
Elastasi
Fosfolipasi A2
Idrolasi acide
Lisozima
Mieloperossidasi
Collagenasi
Fosfolipasi alcalina
Fosfolipasi A2
Lattoferrina
Lisozima
Attivatore del plasminogeno
Catepsine
Gelatinasi
Citochine
Prodotte da cellule endoteliali, insieme all’ossido nitrico sono le molecole più efficaci per l’innesco e per la
modulazione del processo infiammatorio.
Si distinguono in citochine di:
1. I tipo (THI) → sono molecole fornite di attività chemiotattica (chemochine) che richiamano nel focolaio flogistico
cellule NK, linfociti T CD4+ e CD8+ e macrofagi e condizionano la formazione dell’essudato linfomonocitario.
Sono anche responsabili di insorgenza ipersensibilità ritardata (DHT);
2. II tipo (THII) → attive sui granulociti e linfociti B; presiedono alla risposta flogistica acuta e alla risposta
immunitaria mediata da anticorpi compresa quella di tipo allergico.
Citochine
Principali azioni
Favorenti ipersensibilità ritardata
Tipo I (TH1): IFN-γ, IL-2, TNF-β
Favorenti la flogosi cronica
Favorenti la risposta umorale e
Tipo II (TH2): IL-4/5/6/9/10/13 l’immunità mucosale
Favorenti la flogosi acuta
Eicosanoidi
Sono degli idrossiacidi grassi insaturi derivati dall’ac. arachidonico, componente dei fosfolipidi di membrana.
Pervenuto nel citoplasma, l’ac. arachidonico viene metabolizzato ad opera di due sistemi enzimatici: il complesso
delle lipossigenasi e la ciclossigenasi.
Principali metaboliti dell’acido arachidonico e loro effetti nell’infiammazione
Via
Derivati
Effetti indotti
Ciclo-ossigenasica
Lipo-ossigenasica
11
PGE2 e PGG2
Vasodilatazione, aumento permeabilità e genesi dolore
Trombossano A2
Vasocostrizione, bronco-costrizione, aggregazione piastrinica
Leucotrieni C4, D4 e E4 Costrizione bronchiale
Leucotrieni B4
Chemiotassi dei neutrofili e degli eosinofili
I leucotrieni C4, D4 e E4 costituiscono la c.d. SRS-A, dotato di proprietà vasopermeabilizzante. Il B4 ha un
potente potenziale chemiotattico sui leucociti.
Le prostaglandine hanno effetto edemigeno, pirogeno e dolorifico; stimolano l’aggregazione e la degranulazione
dei neutrofili. L’aspirina inibisce la biosintesi delle PG bloccando la cicloossigenasi. I corticosteroidi inibirebbero la
loro liberazione dalle cellule, presumibilmente ostacolando il trasporto o il rifornimento del substrato.
Nell’infiammazione vengono liberate soprattutto dai macrofagi: dopo attivazione convertono rapidamente l’acido
arachidonico in PGE. Sia la produzione che l’effetto delle PG sono in funzione del contenuto enzimatico dei tessuti.
Ad es. le piastrine producono soprattutto trombossano A2, mentre le cellule muscolari lisce formano prostaclina
(PGI2).
Ossido nitrico (NO)
Molecola gassosa prodotta da endoteliociti, astrociti, monociti/macrofagi, a partire dall’aminoacido L-arginina per
opera dell’ossido nitrico sintetasi(NOS), presente nell’organismo in tre isoforme: costitutiva (cNOS), inducibile
(iNOS) e cerebrale (nNOS; NO si comporta da neurotrasmettitore del SNC).
Ruolo del NO nell’infiammazione:
1. partecipa alla vasodilatazione venulare e all’adesività dei leucociti agli endoteli vascolari promosse da molteplici
mediatori;
2. partecipa alla distruzione di cellule batteriche, fungine, protozoarie presenti nel focolaio flogistico.
Proteine di fase acuta
Non sono normalmente presenti nel plasma o lo sono in piccola quantità, ma aumentano immediatamente dopo
uno stimolo flogogeno. Sono sintetizzate per la maggior parte nel fegato e sono:
1. fibrinogeno → interviene nella coagulazione e nella formazione di polimeri della fibrina;
2. C3 → porta alla lisi delle cellule batteriche.
Possono aumentare la permeabilità vasale e attrarre i leucociti (chemiotassi):
1. fattori della vasopermeabilità → mantengono la permeabilità capillare iniziata dall’istamina e dai leucotrieni;
operano aprendo le giunzioni fra le cellule endoteliali e inducendo la contrazione dei filamenti actomiosinici delle
stesse;
2. fattori chemiotattici → agiscono principalmente sui neutrofili e ne promuovono la migrazione, l’aggregazione e
aumentano la loro glicolisi.
Mediatori chimici di fase fluida
Sistema del complemento → agisce come un meccanismo ausiliario di espressione e moltiplicazione delle
conseguenze biologiche delle reazioni antigene-anticorpo e in questa funzione partecipa a certe forme di reazioni
immunologiche acute ed ai processi infiammatori. Si compone di varie proteine (fattori o componenti del
complemento), che si trovano nel siero fresco normale, in forma di precursori inattivi. I bersagli principali del
complemento attivato sono le membrane biologiche:
1. citolisi per danneggiamento delle membrane;
2. liberazione di istamina dai mastociti;
3. aumento della permeabilità vasale;
4. contrazione delle fibrocellule muscolari lisce;
5. attrazione chemiotattica dei fagociti;
6. aumento della fagocitosi;
7. degranulazione dei neutrofili e la conseguente liberazione di enzimi lisosomiali capaci di degradare il tessuto.
Il complesso del complemento può essere attivato mediante due vie:
1. classica → attivabile da certi complessi Ag-Ab e anche da fattori non immunologici (plasmina/tripsina).
L’attivazione dà inizio all’interazione in successione di 9 proteine indicate nell’ordine in cui entrano in funzione
(C1, C4, C2, C3, C5, C6, C7, C8, C9);
2. alternativa o properdinica → attivabile da certi complessi Ag-Ab, vari lipopolissaridi batterici (endotossine) e dal
veleno di cobra. In origine venne considerata un meccanismo di difesa immunitaria non specifico e probabilmente
predominante negli stadi iniziali delle infezioni, prima della sintesi di anticorpi fissanti il complemento.
In entrambe le vie è un punto cruciale l’attivazione del C3, che dà luogo all’attivazione delle componenti terminali
del complemento. I peptidi C3a e C5a sono anafilotossine (interagiscono con i recettori specifici sui mastociti e
basofili provocando la degranulazione con liberazione di istamina e aumento della permeabilità vasale). L’iniezione
intradermica di minime quantità di anifilotossina produce eritema ed edma, che hanno minor entità se si inietta
contemporaneamente un antistaminico.
12
Sistema delle chinine: è costituito da peptidi che inducono vasodilatazione e contrazione della muscolatura liscia.
Sono state finora isolate la bradichinina, la lisil-bradichinina o callidina e la metionil-lisil-bradichinina o metilcallidina. Inducono ipotensione, aumento della permeabilità vasale, broncocostrizione e dolore. La bradichinina ha
rivelato nel ratto la stessa capacità dell’istamina di produrre permeabilizzazione vasale, mentre nel coniglio questa
azione si è dimostrata c.a. 10 volte superiore. Hanno anche effetto algogeno. Entrano in gioco per un breve periodo al
termine della fase istaminica.
Lisozima
Catalizza l’idrolisi del legame dell’ac. N-acetil-muramico e N-acetilglucosamina, che abbondano nelle pareti
batteriche. È presente in vari liquidi corporei: latte, saliva, lacrime e secrezioni genitali. Si trova nei granulociti,
monociti e macrofagi ed è anche prodotto da cellule epiteliali della mucosa e delle ghiandole dei tratti respiratorio e
intestinale. Lo si trova anche in pneumociti, corpuscoli timici e cellule intestinali di Paneth.
Interferone
La sua azione è quella non di inattivare i virus ma quella di bloccare la replicazione virale endocellulare mediante
l’induzione di una proteina antivirale che inibisce la produzione ribosomiale delle proteine. Sebbene siano speciespecifici la > parte degli interferoni non sono specifici nella loro attività (contrasto con Ab). È uno dei primi
meccanismi di difesa verso un’infezione virale: si diffonde alle cellule vicine e entra in quelle presentanti recettori per
l’interferone sulla superficie, cosicché i virus incontrano una barriera intracellulare alla loro diffusione. In circolo
appaiono considerevoli quantità di interferone e rapidamente scompaiono.
Infiammazione cronica: la cronicizzazione
La cronicizzazione avviene quando si ha:
1. progressione della risposta tessutale flogistica;
2. incapacità di risoluzione dell’infezione;
3. infiammazione di durata prolungata (settimane o mesi) in cui sono simultanei:
a. distruzione tessutale;
b. reclutamento di cellule infiammatorie;
c. processi di riparazione.
Le cause di cronicizzazione sono:
1. persistenza degli agenti flogogeni;
a. irritazioni meccanico-traumatiche prolungate (sella del cavallo);
b. corpi estranei (resta graminacee);
c. persistenza di agenti biologici per inefficacia dei meccanismi distruttivi (Mycobacterium tuberculosis,
Actinomyces bovis, miceti); a volte permangono attivi all’interno dei macrofagi;
d. equilibrio fra resistenza dell’organismo e virulenza dell’agente;
e. ipersensibilità immunitaria prolungata e protratta (TBC, dermatiti da contatto);
f. difetti ereditari (ipoplasia ereditaria timo dei bovini) o acquisiti (nefrosi, ipoproteinemie da diarrea protratta)
dei meccanismi di difesa;
g. localizzazione dell’agente in siti inaccessibili ai meccanismi difensivi (granulomi TBC, actinogranulomi,
ascessi);
2. resistenza fisica alla distruzione enzimatica:
a. urati nella gotta;
b. calcoli;
c. silice nella silicosi polmonare dei minatori;
3. accumulo persistente di materiali necrotici ed essudativi:
a. irritazione;
b. pabulum per i germi;
c. ambiente protetto;
d. scarsa efficacia della terapia antibiotica (importanza del drenaggio);
4. meccanismi immunologici:
a. deposito o continua produzione di immunocomplessi ad eliminazione più lenta: Ag-Ab si depositano nei
glomeruli renali, nelle sinovie, nei microvasi cutanei con attivazione del complemento e microvasculite. Se
l’Ag viene continuamente reimmesso in circolo (ad es. da una tonsillite) si hanno lesioni infiammatorie
croniche;
b. autoimmunità → Lupus eritematoso sistemico (autoanticorpi anti-DNA), tiroiditi autoimmuni (autoanticorpi
anti-tireoglobulina), artrite reumatoide (autoanticorpi anti-IgG).
13
Tipi di infiammazione cronica
Infiammazioni essudative croniche:
1. purulente croniche: ascessi, pielonefriti, empiemi;
2. fibrinose croniche: pericardite fibrinosa da c.e., pleurite sierofibrinosa del suino.
Infiammazione follicolare cronica: per l’iperplasia del tessuto linfatico pre-esistente, cronicamente stimolato, si
osservano nodulini sporgenti sotto la mucosa, soprattutto in stomaco, intestino, congiuntiva e laringe.
Endoarterite obliterante: nel corso di un’infiammazione cronica, può manifestarsi l’occlusione del lume delle
arterie presenti nel focolaio per proliferazione progressiva dell’intima.
Istoflogosi: granulomi.
Infiammazioni interstiziali: epatite parassitaria del suino, nefrite interstiziale del bovino, enterite cronica linfoplasmocitaria, polmonite interstiziale dell’ovino. Sono processi caratterizzati dalla presenza di linfociti, plasmacellule,
mastociti e fibroblasti.
Infiammazioni iperplastiche: rigenerazione epiteliale eccessiva(anche con formazione di polipi) a fronte di
fenomeni regressivi (es. endometrite e gastrite iperplastica cronica).
Possibili evoluzioni di un’infiammazione cronica:
1. stenosi: restringimento di lumi e orifizi per la retrazione del connettivo;
2. atrofia: avviene a carico dei parenchimi nelle infiammazioni interstiziali;
3. emorragia del tessuto di granulazione;
4. necrosi: granulomi tbc: necrosi caseosa.
Infiammazione cronica granulomatosa
Infiammazione produttiva con organizzazione tipicamente nodulare (con un’unica eccezione, il morbo di Johne o
paratubercolosi di bovini e ovini che ne colpisce l’intestino). Componente cellulare principale: macrofagi e cellule da
essi derivate (cellule epiteliodi e cellule giganti).
Gli agenti granulomatogeni possiedono proprietà fondamentali, cioè sono in grado di:
1. attivare il sistema dei monociti-macrofagi (differenziazione);
2. resistere alla degradazione fagocitaria (sono difficilmente metabolizzabili).
Possono essere agenti:
1. biologici → macroparassiti, parassiti intracellulari;
2. agenti fisico-chimici → corpi estranei in piccole particelle (talco nei guanti), sostanze oleose (adjuvanti nei
vaccini, olio di paraffina).
Fasi di sviluppo del granuloma:
1. essudazione di monociti (formazione di un infiltrato);
2. aggregazione dei monociti in noduli e maturazione a macrofagi;
3. trasformazione dei macrofagi in cellule epiteliodi e/o giganti. Ad attivare i macrofagi e a promuoverne la
trasformazione in cellule epitelioidi sono le citochine (interleuchina-2, TNF- α e β).
Cellule epitelioidi
Morfologicamente più simili a cellule epiteliali che a macrofagi, in quanto vagamente batiprismatiche. Sono
generalmente mononucleate, con abbondante citoplasma e delle microvillosità uniscono cellule contigue. Circondano
la cellula gigante e alla periferia vi sono linfociti e connettivo per isolarle. Il ciclo vitale è di 1-4 settimane; quando
giovani possono dividersi se c’è lo stimolo dell’agente patogeno. Hanno scarsa attività fagocitaria, ma notevole
attività secretiva: lisozima, catepsina acida, fosfatasi acida.Sono considerate espressione di una ipermaturazione
differenziativa dei macrofagi. I fattori che possono concorrere a questa trasformazione sono:
1. linfochine, ipersensibilità ritardata;
2. sostanze ad elevato peso molecolare, complessi Ag-Ac insolubili;
3. presenza di macrofagi in numero superiore al necessario.
Cellule giganti
Voluminose cellule multinucleate (ampie masse citoplasmatiche provviste di 10-100 nuclei). Hanno origine
sinciziale: fusione di cellule epitelioidi e/o macrofagi
1. tipo Langhans: con nuclei disposti a corona o a ferro di cavallo, tipico di agenti viventi che riescono a
moltiplicarsi (TBC);
2. tipo Müller o da corpo estraneo: nuclei al centro, disposti irregolarmente, tipico di agenti viventi.
Hanno scarso potere fagocitario, sopravvivenza di pochi giorni e assenza di divisione. Possono solo “inglobare”
nuovi elementi cellulari. La fusione dei macacrofagi è stimolata dalla linfochina MFF (Macrophage Fusion Factor).
14
Altri aspetti presenti nei granulomi
Necrosi soprattutto caseosa (in funzione del batterio causale) per:
1. ischemia delle parti centrali che sono sempre relativamente povere di vasi sanguigni;
2. fattori immunologici di ipersensibilità che inducono la liberazione da parte di linfociti di fattori citotossici (TNF,
linfotossina).
Granulociti neutrofili: la loro presenza può segnalare episodi di riacutizzazione e actinogranulomi (mastiti, lingua
di legno nei bovini).
Linfociti: compaiono quando è coinvolta l’ipersensibilità ritardata (reazione alla tibercolina).
Granulociti eosinofili: presenza di linfociti T (fattore eosinofilotattico attivato dai complessi Ag-Ab). Nei
granulomi parassitari gli eosinofili esplicano la loro azione tossica verso larve parassitarie e compaiono in infezioni
allergiche (degranulano sulla superficie dei parassiti). In animali che hanno già sviluppato un’immunità specifica, i
parassiti vengono rivestiti di Ab e complemento, con attivazione degli eosinofili; questi presentano dei rettori specifici
e dopo essersi legati al complesso Ab-complemento sulla superficie del parassita secernono perossidasi che determina
lesioni focali sulla cute del germe e la sua separazione dal corpo.
Fibroblasti: tendono a circoscrivere e a riparare la lesione per evitare che sostanze tossiche possano andare in
circolo. Sono stimolati da citochine liberate dai macrofagi.
Cinetica del processo granulomatoso:
1. granulomi a ridotto rinnovamento cellulare → provocati da sostanze inerti non metabolizzabili, ma atossiche (c.e.,
particelle di talco). Sia l’immigrazione di nuovi macrofagi che la proliferazione di quelli già in loco sono molto
ridotte: la longevità della lesione è dovuta alla massima longevità delle cellule macrofagiche (8 settimane);
2. granulomi ad elevato rinnovamento cellulare → vivace immigrazione e proliferazione dei macrofagi, che hanno
un ciclo vitale relativamente rapido (alcuni giorni). Quasi tutti i granulomi batterici o da sostanze irritanti sono di
questo tipo.
Classificazione dei granulomi
Possono essere granulomi:
1. da corpo estraneo:
a. sostanze endogene → sono metaboliti normali, ma presenti in quantità eccessiva o sottoforma inconsueta
nelle cellule e nei tessuti (si comportano da corpo estraneo):
colesteatosi granulomatosa → il colesterolo, quando assume forma di cristalli solidi, produce celle
reazioni granulomatose. Inizialmente l’accumulo avviene allo stato liquido sottoforma di goccioline
intracellulari nei macrofagi (cellule xantomatose, cellule schiumose che quando si rompono o cadono in
necrosi determinano la solidificazione del colesterolo in cristalli che diviene inriassorbibile e persiste nel
tessuto come corpo estraneo);
colesteatosi dei plessi corioidei → frequente nei cavalli anziani, si presenta con neoformazioni nodulari
(colesteatomi) che possono raggiungere il volume di un uovo causando idrocefalo o lesioni compressive;
granulomi lipofagici nella steatonecrosi → avviene la scissione dei trigliceridi contenuti negli adipocidi
con formazione di acidi grassi e glicerina. La glicerina viene riassorbita, mentre gli acidi grassi in parte si
dissolvono (se prevalgono danno un aumento dell’acidità locale e flogosi essudativa) e in parte
cristallizzano comportandosi da corpi estranei avviando la reazione macrofagica. Nel tessuto
infiammatorio si notano grandi macrofagi e numerose cellule giganti che inglobano materiale lipidico;
tesaurosi puriniche (ac. Urico, tofi gottosi) → l’acido urico forma cristalli che vengono isolati in un
granuloma;
sostanza amiloide → quando l’amiloidosi assume la forma circoscritta, nei noduli amiloidi si trova una
reazione infiammatoria, con cellule giganti da corpi estranei attorno a blocchi di della sostanza patologica
(amiloide);
enfisema mesenteriale → avviene attorno ai vasi linfatici dilatati da prodotti gassosi della fermentazione
microbica del chilo;
cheratina → in tumori che hanno origine da epiteli malpighiani; sono masse di cellule cheratinizzate che
possono rimanere isolate nel connettivo dove si sviluppa, attorno ad esse, una reazione di cellule giganti;
15
calcinosis circumscripta (o calcinogranuloma o calcinosi cutanea del cane) → si manifesta in giovani
b.
2.
a.
b.
c.
d.
e.
f.
16
cani, soprattutto agli arti, con una formazione nodosa sottocutanea sottocutanea rilevata e nella parete
delle arterie (anelasticità della parete e predisposizione a trombi, emorragie e emboli); la lesione potrebbe
essere dovuta alla precipitazione di sali di calcio per un processo distrofico locale per elevate
mobilizzazione dalle ossa o per un dismetabolismo del calcio; attorno ai depositi si ha una reazione di
macrofagi e cellule giganti che incapsulano il calcio;
sostanze esogene
corpi estranei → materiali chirurgici (fili di seta, talco), schegge di vario materiale;
oli medicamentosi (paraffina, vasellina);
pneumoconiosi → inalazione prolungata di polveri insolubili (silice, asbeto, berillio);
granulomi vaccinali (adiuvanti densi);
da micro parassiti:
tubercolosi: l’agente eziologico è un batterio acido-resistente per la presenza di gruppi carbossilici ed
idrossilici in lipidi insaturi della parete:
Mycobacterium tuberculosis var. hominis → uomo, scimmia, bovino, suino, cane;
Mycobacterium bovis → bovino, uomo, suino, cavallo, cane, gatto, pecora;
Mycobacterium avium → uccelli, bovino, suino, cavallo, pecora;
Mycobacterium marinum → pesci, mammiferi marini.
Sono infezioni che iniziano come croniche granulomatose, per la resistenza del micobatterio alla fagocitosi.
Sono infezioni latenti, per la capacità di sopravvivere a lungo dell’agente in focolai necrotici, immersi in
connettivo fibroso o in focolai calcifici. Sono infiammazioni granulomatose, ma a seconda di: specie
dell’ospite, stato immunitario dell’ospite (se sensibilizzato o no), tipo di micobatterio, quantità di micobatteri,
virulenza dei micobatteri. Si possono sovrapporre caratteristiche essudative quali sierofibrinose o purulente.
La lesione elementare si denomina tubercolo che macroscopicamente si presenta come un nodulo grigiobiancastro vitreo, di circa 1 mm; microscopicamente è costituito da cellule epiteliodi, 1-2 cellule giganti e in
periferia linfociti e plasmacellule. Poi compare la necrosi coagulativa della parte centrale, con cariopicnosi e
carioressi, sostanza necrotica astrutturata, i tubercoli tendono a conglomerare e si forma la necrosi caseosa
(tipica della TBC). caratteristiche della necrosi caseosa
lunga persistenza
aspetto di “formaggio molle”
viene circondata da tessuto fibroso
a seconda della specie animale e del tipo di micobatterio, può calcificare
fattore granulomatogeno: cera D (lipolisaccaride) della parete dei micobatteri
azione tossica necrosante: reazione di ipersensibilità ritardata (IV tipo) verso tubercoloproteine (che
inducono necrosi caseosa se iniettate in animale sensibilizzato)
Il Mycobacterium bovis induce nelle varie specie le seguenti lesioni:
bovino: forte tendenza alla necrosi caseosa e alla calcificazione
suino: granulomi con una certa tendenza alla necrosi e alla calcificazione
cavallo: granulomi senzatendenza alla necrosi caseosa
carnivori: necrosi colliquativa, essudato lattiginoso simile a pus
Pseudotbc dei ruminanti (linfoadenite caseosa): causata dal Corynebacterium ovis, colpisce linfonodi
(mediastinici e bronchiali) e polmoni con necrosi caseosa e calcificazione circondate da tessuto fibroso.
L’invasione dei capillari da parte degli agenti con successiva apposizione di necrosi, calcificazione e nuova
reazione fibrosa accerchiante provoca il tipico aspetto “a cipolla” della lesione.
Pseudo TBC dei roditori: da Yersinia pseudotuberculosis che provoca lesioni granulomatose nodulari con
centro caseoso in milza e intestino
Para TBC dei ruminanti: da Mycobacterium johnei si distingue dalle tipiche lesioni granulomatose perché i
macrofagi e le cellule epiteliodi infiltrano diffusamente la mucosa intestinale, che assume aspetto cerebroide.
Inoltre sono molti i micobatteri fagocitati dai macrofagi, al contrario della tubercolosi dove sono rari
Piogranulomi: Actinomyces bovis e Actinobacillus ligneresisono responsabili dei c.d. actinogranulomi. Il
primo si localizza nella mammella e nella mandibola di bovino; il secondo nella cute, lingua, polmone e
linfonodi.
Tra i piogranulomi si annoverano anche quelli da Staphilococcus pyogenes aureus, causa di mastite nella
bovina e del granuloma botriococcico del cavallo e il Rhodococcus equi responsabile di polmonite nel
puledro. La denominazione è dovuta alla presenza nel granuloma di pus.
Salmonellosi → dà lesioni granulomatose, piccoli nodi da macrofagi e cellule epitelioidi senza pus; ha
localizzazione splenica soprattutto nei vitelli;
g. Tularemia → nei roditori selvatici (necrosi caseosa);
h. Brucellosi → provoca febbri ondulanti (si può prendere anche da alimenti a base lattea). Cronicizza
facilmente, localizzandosi in miocardi e pericardio; se si localizza nella placenta, il feto avrà lesioni nella
maggior parte degli organi;
i. Listeriosi → causa aborto in bovino e ovino. Gli animali la assumono con gli insilati;
3. da macroparassiti → dove le larve migranti di:
a. Ascaridi → danno granulomi nel rene dei cuccioli;
b. Strongili → le larve danno granulomi nel polmone di suino e bovino;
c. Dictyocaulus spp. → le larve danno granulomi nel polmone di ovino che vanno incontro a calcificazione (al
macello deve essere eliminato l’intero organo); la larva (sovente calcifica) è al centro della lesione
nell’organo non di elezione dove il suo sviluppo si interrompe;
4. da miceti:
a. Aspergilli;
b. Mucor;
c. Penicilli.
Sovente sono causa di granulomi attornianti colonie fungine di aspetto clavato nei polmoni e nei linfonodi
broncopolmonari.
Evoluzione dei processi infiammatorie guarigione
Il processo di guarigione presenta tre fasi:
1. infiammazione acuta e cronica (distruzione tessuto);
17
2. proliferazione (granulazione) e riepitelizzazione (connettivo giovane e vascolarizzato);
3. contrazione della ferita, deposizione di matrice extracellulare, rimodellamento della porzione di tessuto.
Le principali cause per le quali si può verificare la perdita o la distruzione di un tessuto sono:
escissione fisica (traumatica, accidentale, chirurgica);
azione necrosante di agenti patogeni (fisici, chimici e biologici);
azione necrosante dell’ischemia;
azione necrosante dei processi infiammatori (compressione dell’essudato, azione proteolitica dell’essudato,
ipersensibilità).
Il processo ripartivo (guarigione) può avvenire in due modi:
1. rigenerazione → ricostruzione del tessuto perduto mediante sostituzione con tessuto identico per proliferazione
delle cellule rimaste indenni alla periferia della lesione (membrana basale): iperplasia rigenerativa. Tipica dei
tessuti labili e stabili;
2. riparazione → sostituzione del tessuto perduto con tessuto connettivale, attraverso la formazione di tessuto di
granulazione che evolve in tessuto cicatrizziale, quando le cellule limitrofe non hanno la capacità di proliferare.
Tipica dei tessuti permanenti. Avviene quando si ha la necessità di isolare/incapsulare ematomi, ascessi, raccolte
di essudati: organizzazione.
1.
2.
3.
4.
Cellule “labili”
Sono le cellule di vari tessuti e organi che in condizioni fisiologiche normali si replicano rapidamente:
midollo osseo;
epiteli di superficie (cute, mucose buccali e di parte dell’apparato riproduttore);
epiteli respiratori e gastro-intestinali;
epiteli del tratto biliare e dotti escretori delle salivari e del pancreas;
epiteli delle tube di falloppio e dell’utero;
epitelio transizionale della vescica.
In questi siti, si osserva una maturazione continua di cellule riserva che si trovano negli strati più profondi. Gli
epiteli sulle superfici cercano di rigenerare anche sopra lesioni cavitate (ulcere), ma in questi casi si ha una
combinazione di proliferazione di connettivo e di rigenerazione, in cui la cavità riempita dal connettivo, viene
ricoperta dall’epitelio.
1.
2.
3.
4.
5.
6.
Cellule “stabili”
Sono cellule che normalmente hanno una limitata capacità di replicarsi:
1. acini pancreatici;
2. ghiandole salivari;
3. epitelio dei tubuli renali;
4. epatociti;
5. numerose cellule di origine mesenchimale: cellule endoteliali, osteo-condroblasti e cellule muscolari lisce.
In caso di lesione, conservano la capacità di dividersi rapidamente e proliferare.
Le cellule stabili sono in grado di rigenerarsi, sempreché la membrana basale sia preservata e l’architettura della
parte sia mantenuta.
Molti tipi di cellule epiteliali ed endoteliali sono in grado di sintetizzare i componenti della membrana basale su
cui crescere, ma senza l’architettura propria del tessuto si ottiene una crescita disordinata (cheloidi: cicatrici
esuberanti facilmente ledibili, possono riprendere a sanguinare in seguito a trauma).
Cellule “permanenti”
Sono quelle che non si replicano o si replicano molto limitatamente: neuroni e cellule muscolari cardiache.
18
Tessuto di granulazione nel processo di cicatrizzazione
Il tessuto di granulazione è un connettivo giovane ricco di vasi che matura formando tessuto cicatriziale.
Rappresenta l’evoluzione in senso proliferativo della flogosi destinata a guarigione attraverso il processo cicatriziale.
Per l’abbondanza dei vasellini neoformati, il tessuto di granulazione si presenta in un primo momento di colore rosso
vivo, che poi sbiadisce con l’evoluzione del processo che porta all’atrofia dei vasi.
I fenomeni proliferativi che edificano questo tessuto flogistico si compendiano:
1. neoformazione di capillari sanguigni e linfatici per gemmazione di quelli preesistenti;
2. proliferazione di fibroblasti e deposizione di fibre collagene;
3. proliferazione di macrofagi ematici e tissutali e dei mastociti;
4. infiltrazione di linfociti e plasmacellule.
Si ha poi un progressivo aumento delle fibrille collagene (da fibre reticolari argento file si passa a un tessuto
fibroso denso) e una contemporanea riduzione delle componenti cellulari del tessuto di granulazione con atrofia dei
vasellini neoformati. Gradualmente il tessuto di granulazione si trasforma in tessuto cicatriziale (ossia in connettivo
fibroso, compatto, povero di cellule e ricco di fasci e fibrille collagene che ha proprietà di ritrarsi progressivamente:
tendenza all’atrofia dei tessuti).
La guarigione può avvenire per:
1. prima intenzione: è della ferita di tipo chirurgico, cioè
a. netta,
b. asettica
c. con bordi ravvicinati
avvengono con ripristino completo della struttura/forma del tessuto;
2. seconda intenzione:
a. ferita complicata da piogeni
b. ferita aperta, con perdita di sostanza, a margini non ben avvicinati
c. ustioni di terzo grado
d. ascessi
Tempi:
1. dopo 24 ore: proliferazione e migrazione di cellule epiteliali formanti un punto di unione (sotto l’escara, se
presente)
2. dopo 48 ore: proliferazione delle cellule connettivali ed endoteliali e migrazione dell’epitelio all’interno della
ferita
3. dopo circa 3 giorni:
a. -migrazione di fibroblasti nella rete di fibrina del coagulo
b. -gemmazione di capillari
19
c. -formazione di ponti vasculo-connettivali (tessuto di granulazione) che unisce i margini e se necessario colma
la perdita di tessuto
d. -formazione di uno sperone epiteliale in corrispondenza della ferita
4. dopo 4-5 giorni: comparsa di fibre collagene in forma di fibre reticolari argirofile
5. da 7-8 giorni in poi:
a. -maturazione del collageno in fibre connettivali dense completamente polimerizzate e con legami crociati
b. -atrofia dei vasi neoformati (devascolarizzazione)
c. -tessuto cicatriziale
d. -degenerazione dello sperone dell’epitelio rigenerante
e. -retrazione del tessuto fibroso
f. -maturazione dei fibroblasti a fibrociti
g. -cicatrice
6. dopo settimane o mesi
a. -riassorbimento parziale del connettivo fibroso in eccesso
b. -rigenerazione delle fibre elastiche
20