Termodinamica (1).
Sul libro: cap.12.
Equilibrio termodinamico:
• pressione e temperatura costanti in tutto il fluido
• equilibrio meccanico (non ci sono variazioni di volume)
In un gas perfetto le variabili termodinamiche (pressione, volume, temperatura) sono collegate dall’equazione di stato
P ⋅V = n ⋅ R ⋅ T .
Trasformazioni quasi-statiche: trasformazione ottenuta attraverso una serie di stati di equilibrio. E’ una trasformazione
ideale, ci si avvicina quando fluidi reali si trasformano lentamente attraverso piccole variazioni delle grandezze
termodinamiche (P,V,T).
Per descrivere le trasformazioni termodinamiche quasi-statiche si fa ricorso al diagramma pressione-volume.
Quando non sarà specificato diversamente, ci occuperemo sempre di trasformazioni quasi-statiche, che sono però
soltanto un’approssimazione di quello che succede in realtà.
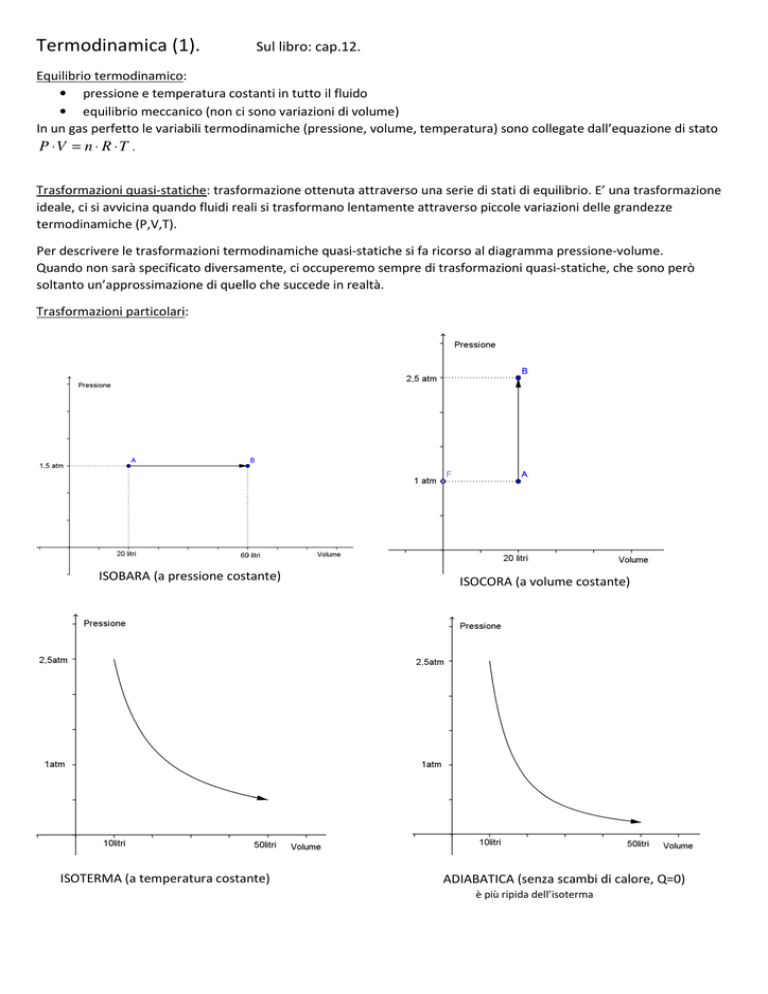
Trasformazioni particolari:
ISOBARA (a pressione costante)
ISOTERMA (a temperatura costante)
ISOCORA (a volume costante)
ADIABATICA (senza scambi di calore, Q=0)
è più ripida dell’isoterma
Calore: trasferimento di energia “disordinato”, causato da una differenza di temperatura.
Lavoro: trasferimento di energia “ordinato”, causato da una forza macroscopica.
Possono avere effetti indistinguibili:
Non si può sapere se l’energia interna del gas è
aumentata perché il gas è stato compresso (lavoro)
o è stato scaldato (calore).
Lavoro effettuato (o subito) da un gas:
Pensiamo ad una trasformazione isobarica in un contenitore con
un pistone mobile.
Il gas effettua un lavoro espandendosi e spostando il pistone.
Questo lavoro sarà uguale al prodotto tra la forza sul pistone e lo
spostamento del pistone (indicato in figura con d).
Risulta (dettagli in classe…) che L = P ⋅ ∆V .
Nel piano P-V questo lavoro equivale
all’area del rettangolo compreso tra
l’asse V e il segmento che indica la
trasformazione
In generale, per trasformazioni generiche, il
lavoro è l’area sotto alla curva nel
diagramma P-V (pag.433)
Ricordare però che il lavoro fatto dal gas è positivo quando il gas si espande, è negativo quando il gas si si comprime.
Primo principio della termodinamica:
∆U = Q − L
Q: + quando è assorbito, - quando è ceduto
L: + quando è fatto dal sistema (ad esempio, gas che si espande), - quando è subito dal sistema (ad esempio, gas che viene
compresso).
Esempio di primo principio della termodinamica:
Trasformazioni cicliche
∆U = Q − L + energia cibo
Esercizi………
In quale caso la freccia “Q” ha direzione opposta?
Ricordare che U è una funzione di stato, mentre Q ed L non lo sono.
Per un gas perfetto, trascurando l’energia potenziale, l’energia interna sarà essenzialmente energia cinetica.
3
Abbiamo già visto che l’energia cinetica media di traslazione di una particella è E K − media = kT . Conteggiando tutte le
2
particelle e considerando anche la rotazione delle particelle su se stesse si trova che l’energia interna è:
U=
3
nRT per gas monoatomico
2
U=
5
nRT per gas biatomico
2
Trasformazioni cicliche:
Lavoro:
positivo se la figura è percorsa in senso orario
negativo se la figura è percorsa in senso antiorario
∆U in un ciclo è 0, essendo l’energia interna una funzione di stato (ha sempre lo stesso valore ogni volta che si torna
nello stesso punto del diagramma P-V).
Esercizi: 12 pag.447; 5-6-10 pag.449-450; 24-27 pag. 453; 3-7 pag.457.
Negli esercizi sulle trasformazioni termodinamiche ricordare che:
→ vale il primo principio della termodinamica ∆U = Q − L
in tutte le trasformazioni
→
trasformazioni cicliche
L è l’area sotto alla curva nel piano P-V, con segno + in caso di espansione
→ ∆U in un ciclo è 0
→
L è l’area dentro alla figura, con segno + se percorsa in senso orario
trasformazioni isoterme → se il gas è un gas perfetto,
trasformazioni isocore
→
trasformazioni adiabatiche
L=0
→
Q=0
∆U = 0 (poiché U dipende solo dalla temperatura)